微量肌肉组织蛋白提取及Western blot在肌营养不良诊断中的应用
2016-01-29吴冬燕赵燕环任海涛关鸿志魏妍平郭玉璞崔丽英焦劲松
吴冬燕,陈 琳,赵燕环,任海涛,关鸿志,魏妍平,刘 智,钱 敏,郭玉璞,崔丽英,焦劲松
1中日友好医院神经内科,北京 100029
2中国医学科学院 北京协和医学院 北京协和医院神经内科,北京 100730
微量肌肉组织蛋白提取及Western blot在肌营养不良诊断中的应用
吴冬燕1,陈琳2,赵燕环2,任海涛2,关鸿志2,魏妍平2,刘智2,钱敏2,郭玉璞2,崔丽英2,焦劲松1
1中日友好医院神经内科,北京 100029
2中国医学科学院北京协和医学院北京协和医院神经内科,北京 100730
摘要:目的通过改进肌肉组织蛋白的提取方法,利用微量组织进行Western blot(WB)方法诊断肌营养不良。方法比较不同的样品缓冲液和处理方式对鼠骨骼肌蛋白提取量的影响,采用筛选出的最佳方法对待检病例的微量肌肉组织进行蛋白提取和蛋白分析。结果将筛选出的样品缓冲液加入冰冻切片肌肉组织,通过振荡溶解,提取蛋白量多且损失小。从62例疑似肌营养不良病例的肌肉组织中提取足量蛋白,WB结果显示所检蛋白带清晰,部分病例存在蛋白带的异常。免疫组织化学染色显示Dys-R、Dys-C、Dys-N均重度表达异常的标本中,WB检测均未发现相应的目标蛋白带。免疫组织化学显示Dys轻度表达异常的标本中,WB检测显示目标蛋白带位置异常、带浅或正常。结论应用改进的蛋白提取方法可以节省组织标本用量,并进行蛋白分析诊断肌营养不良。临床高度疑诊疑似抗肌萎缩蛋白病的病例,免疫组织化学染色显示轻度缺失或正常,需要进一步行WB检测抗肌萎缩蛋白。
关键词:免疫印迹;肌营养不良;微量肌肉组织
ActaAcadMedSin,2015,37(6):705-710
肌营养不良是一组以骨骼肌受累为主的遗传性疾病,随着分子生物学的发展,数10种肌营养不良的致病基因及相关蛋白被发现,并用于肌营养不良的类型诊断。肌肉组织中相关蛋白的表达情况可作为肌营养不良类型的筛查和基因突变致病性的证据,目前用于临床的有免疫组织化学方法(immunohistochemistry,IHC)和免疫印迹(Western blot,WB)方法。由于患者的肌肉活检作为一项有创检查,取材标本量有限且难以重复,因此,改进方法、节省组织用量、进行更多的诊断学研究非常重要。2003年Cooper等[1]将WB方法进行改进,用微量标本提取肌肉组织蛋白,进行肌营养不良蛋白分析。本研究在既往文献报道的基础上,尽量减少组织蛋白提取过程中的蛋白损失量,从而利用微量肌肉组织进行肌营养不良的诊断。
材料和方法
材料雄性Wistar大鼠肌肉购自维通利华实验动物技术有限公司。北京协和医院神经病理实验室肌肉活检标本,待检患者均在知情同意情况下行肌肉活检。根据患者的临床特点和肌肉病理改变,筛选疑似抗肌萎缩蛋白病病例和疑似肢带型肌营养不良病例的肌肉标本。一抗:抗肌萎缩蛋白抗体(NCL-DYS1、NCL-DYS2、NCL-DYS3)、抗质膜修复蛋白抗体(NCL- Hamlet)、抗钙蛋白酶- 3抗体 (NCL-CALP- 2C4)、抗α-肌聚多糖抗体(NCL-a-SARC)、抗β-肌聚多糖抗体 (NCL-b-SARC) (Novocastra Laboratories,Newcastle,UK)、抗小窝蛋白-3抗体(Santa Cruz),二抗辣根过氧化物酶抗小鼠IgG(北京中杉金桥生物技术有限公司)。电泳仪、转移槽(北京市六一仪器厂)。
样品缓冲液缓冲液1:1% TritonX- 100,10 mmol/L Tris(pH 7.6),150 mmol/L NaCl,0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS),最终将 pH 调整至 8.0,蛋白酶抑制剂;缓冲液2:4% SDS,125 mmol/L Tris(pH 8.8),蛋白酶抑制剂;缓冲液3:4% SDS,125 mmol/L Tris(pH 8.8),0.5 mmol/L苯甲基磺酰氟,蛋白酶抑制剂;缓冲液4:4% SDS,125 mmol/L Tris(pH 8.8),0.5 mmol/L苯甲基磺酰氟,100 mmol/L二硫苏糖醇,蛋白酶抑制剂。
肌肉组织蛋白提取方法的筛选大鼠肌肉经过液氮冷冻处理后,将同一块肌肉组织块剪碎或冷冻切片后,加入同一种样品缓冲液,进行不同方式处理:超声(频率为50 Hz,10 s/次,间歇20 s,共3次);匀浆(匀浆器直径7 mm,匀浆时间为1 min/次,间歇1 min,共3次);超声+匀浆。之后,进行蛋白含量测定。将冷冻切片加入不同的样品缓冲液,振荡仪震荡后,测定蛋白含量,选取最佳的组织提取方法。
蛋白测定方法采用BCA方法测定蛋白。
肌肉组织的蛋白提取采用筛选出的肌肉组织蛋白的提取方法,用于疑似患者肌肉组织提取。首先,待检肌肉组织冷冻切片,HE染色,光镜下观察。之后,根据待检标本中肌纤维病变和结缔组织增生的程度决定WB所需要的肌肉组织标本量。切片厚度10 μm,根据所切肌肉组织直径不同,切20~30片,加入样品缓冲液。利用机械振荡让肌肉切片在样品缓冲液中充分溶解,沸水浴5 min,离心6 000×g,10 min,分离上清液。在上清液中加入5×上样缓冲液[50%(体积分数)甘油和普鲁士兰混合液]。
Western blot在10%的SDS-聚丙烯酰胺凝胶上配制6%的凝胶,加标本5 μl,电泳90 min。转膜到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(相对分子质量大于130 000的PVDF膜需要150 min;相对分子质量在40 000~130 000的膜需要90 min;相对分子质量在40 000以下的膜需要45~60 min),5%(质量浓度)脱脂乳封闭1 h。将相对分子质量在40 000~130 000膜切割为相对分子质量在75 000~130 000和40 000~75 000两块膜。1∶1 000稀释抗肌萎缩蛋白抗体,1∶800稀释抗质膜修复蛋白抗体,1∶50稀释抗钙蛋白酶- 3抗体,1∶100稀释抗α-肌聚多糖抗体,1∶200稀释抗小窝蛋白- 3抗体,1∶1 000稀释抗GAPDH抗体。4 ℃过夜,磷酸盐吐温缓冲液洗膜3次,每次10 min,再在封闭液中加入二抗(1∶5 000~10 000辣根过氧化物酶标记的抗鼠抗体),室温2.5 h。磷酸盐吐温缓冲液洗膜3次,每次10 min。化学发光试剂显色。每份标本均重复两次。
结果
不同的样品缓冲液及肌肉组织处理方式结果评价在应用同一种样品缓冲液的情况下,同一块肌肉组织相继经过超声和匀浆处理,提取的蛋白量较多,但是超声仪和匀浆器上粘有组织液,损耗量亦最大。随后,将微量肌肉组织进行冷冻薄切(冷冻组织切片横截面9 mm2×厚度10 μm×20片),组织切片分别加入不同的样品缓冲液100 μl。对不同种类的样品缓冲液进行比较显示,肌肉组织切片在样品缓冲液4中溶解完全,离心后未见明显沉淀;而在其他样品缓冲液1、2、3中溶解不完全,离心后仍有少许沉淀,以样品缓冲液1中沉淀最多。4种样品缓冲液提取的总蛋白浓度分别为623.17、1 012.66、4 078、6 672 mg/dl。蛋白含量测定结果显示样品缓冲液4提取蛋白量最大。
肌肉组织Western blot蛋白分析情况共从62例患者的活检肌肉组织中提取了蛋白,36例同时检测了肌萎缩蛋白、质膜修复蛋白和GAPDH,26例同时检测了肌萎缩蛋白、质膜修复蛋白、钙蛋白酶- 3、α-肌聚多糖、小窝蛋白- 3及GAPDH。此部分组织块的横截面为6~12 mm2,组织中的结缔组织含量分别从较少至中度增多,冷冻切片厚度10 μm,连续切取10~30枚,提取到足量蛋白,并进行WB分析蛋白量,得到满意的蛋白带。另有5例患者因组织块中肌纤维严重萎缩伴结缔组织增生或组织块过小,未能提取到足量蛋白或未得到理想的蛋白带。
应用微量肌肉组织提取蛋白,通过WB方法,在非肌营养不良患者标本中可显示多条所检测的目标蛋白带(图1)。36例临床和免疫组织化学疑诊抗肌萎缩蛋白相关肌病的患者标本(图2),WB检测结果显示31例发现抗肌萎缩蛋白带异常(图3),5例未见抗肌萎缩蛋白带异常。与免疫组织化学染色标记结果比较,6例免疫组织化学显示Dys-R、Dys-C、Dys-N均重度表达异常的标本中,WB检测均未发现相应的目标蛋白带。2例免疫组织化学显示仅Dys-R无表达的标本,WB检测显示Dys-R蛋白带缺失伴Dys-C和Dys-N蛋白带位置异常。1例免疫组织化学显示仅Dys-N无表达的标本,WB检测显示Dys-N缺失伴Dys-C和Dys-N的蛋白带都浅。1例女性患者免疫组织化学显示Dys呈斑片不表达,WB检测显示正常和异常2个蛋白带。26例免疫组织化学显示Dys轻度表达异常的标本中,WB检测显示10例目标蛋白带位置异常、11例目标蛋白带浅、5例正常。62例中13例WB检测显示同时有2个及以上蛋白带减弱,其中6例肌肉组织保存时间相对较长。
26例临床疑诊肢带型肌营养不良患者肌肉标本免疫组织化学检测肌萎缩蛋白、α-肌聚多糖、β-肌聚多糖、小窝蛋白- 3均无异常,WB检测肌萎缩蛋白、质膜修复蛋白、钙蛋白酶- 3、α-肌聚多糖、小窝蛋白- 3及GAPDH,结果显示11例所有目标蛋白带均正常;8例质膜修复蛋白带缺失(图4),1例减弱;2例钙蛋白酶- 3蛋白带缺失;2例肌萎缩蛋白带减弱或呈2个蛋白带;1例肌萎缩蛋白带、质膜修复蛋白带均减弱;1例肌萎缩蛋白带、α-肌聚多糖蛋白带强度减弱。

Mr:相对分子质量;肌萎缩蛋白带(棒状区)为Dys-R蛋白带
Mr:relative molecular mass;dystrophin(rod) band is Dys-R band
图 1从非肌营养不良患者骨骼肌中提取微量组织蛋白,应用免疫印迹方法通过不同抗体对相应的蛋白标记显示的多条带
Fig 1Western blot analysis of human muscle biopsy tissue,the bands of different molecular weight proteins in sample were showed using this protocol

A. HE染色显示肌纤维普遍圆钝、大小不等,可见变性肌纤维(×40);B.免疫组织化学染色可见肌纤维膜Dys-R普遍着色浅,大多数肌纤维膜清楚着色,局部肌纤维膜着色淡且不连续(×40);C.正常对照的免疫组织化学染色(×400)
A. HE staining:the muscle fibers are round blunt in shape,with varied sizes,the degeneration of muscle fiber is visible (×40);B. immunohistochemical staining:the muscle fiber membrane Dys-R is generally light-colored,most of the muscle fiber membranes are clearly stained,whereas part of the muscle fiber membranes are lightly stained and non-continuous (×40);C. immunohistochemical staining in the normal control group (×400)
图 2抗肌萎缩蛋白病患者肌肉病理组织化学与免疫组织化学病理改变
Fig 2Histopathological and immunohistochemical changes in patient with dystrophinopathy
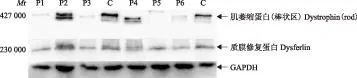
P:患者;C:正常对照;P1、P6:肌萎缩蛋白带强度较正常对照减低;P2:肌萎缩蛋白带出现双带;P3、P4:肌萎缩蛋白带位置较正常对照降低;P5:肌萎缩蛋白带位置较正常对照升高;这6例患者质膜修复蛋白带正常,肌萎缩蛋白带(棒状区)为Dys-R蛋白带
P:the patient;C:the normal control;P1,P6:the intensity of dystrophin protein bands was lower than normal;P2:the dystrophin protein band was a double band;P3,P4:the position of dystrophin protein bands was lower than the normal;P5:the position of dystrophin protein band was higher than the normal;the dysferlin protein band in six patients were normal,dystrophin (rod) band is Dys-R band
图 3肌萎缩蛋白带的异常
Fig 3Abnormal dystrophin protein bands
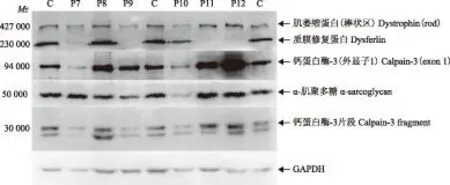
C:正常对照;P:患者;P7:质膜修复蛋白强度较正常对照减弱,钙蛋白酶- 3外显子1和片段蛋白带均正常;P8、P10:蛋白带无异常;P9、P11、P12:质膜修复蛋白无表达,肌萎缩蛋白、钙蛋白酶- 3外显子1和片段蛋白、α-肌聚多糖蛋白带正常;肌萎缩蛋白带(棒状区)为Dys-R蛋白带
C:the normal control;P:the patient;P7:the intensity of dysferlin protein band was lower than the normal,but the calpain-3 exon 1 and fragment protein band were normal;P8,P10:no detect the abnormal protein band;P9,P11,P12:the dysferlin protein band had not been shown,but the bands of dystrophin protein,calpain-3 exon 1 and fragments of protein,α-sarcoglycan protein were normal;dystrophin(rod) band is Dys-R band
图 4质膜修复蛋白带的异常
Fig 4Abnormal bands of dysferlin protein
讨论
在应用WB方法分析多条肌营养不良蛋白的研究中,关于提取蛋白的方法是有差异的。Cooper等[1]将厚度8 μm,面积为10 mm2的1枚肌肉组织放入样品缓冲液(4% SDS,125 mm Tris pH 8.8,40% 甘油,0.5 mm PMSF,100 mm DTT,普鲁士兰),随后在样品处理时加用超声,电泳时加用10 mm 2-巯基乙醇;胡静和樋口逸郎[2]取10~20枚厚度10 μm的肌肉标本(视标本大小而定)放入1% TritonX-100样品缓冲液(10 mm Tris-Hcl,2 mm EDTA,pH=7.6),随后4 ℃匀浆;罗苏珊等[3]和Luo等[4]将肌肉组织块直接加入缓冲液中匀浆;耿娜等[5]将肌肉组织块直接处理进行WB分析。本研究在选择样品缓冲液时,参考文献[1- 5]的缓冲液配比方案并进行对比,从中选择最适合本研究的样品缓冲液。本研究在评定样品缓冲液裂解组织的效果时,不仅应用BCA测定法,还通过肉眼分辨提取蛋白后的残存组织量进行评定,结果显示样品缓冲液4裂解肌肉组织能力较其他缓冲液强,推测可能与该缓冲液中加入的DTT有关。DTT阻止蛋白质中半胱氨酸之间形成的蛋白质分子内或分子间二硫键,使蛋白组织裂解更完全。本研究超声加4 ℃匀浆的方法在肌肉组织处理过程相同的情况下,提取的蛋白量最大。但是在提取过程中使用超声仪和匀浆器,将损失较多的样品缓冲液(其中已溶解了肌肉组织蛋白),所以会相应损失较多已经提取了的蛋白。本研究显示若直接对肌肉组织块提取蛋白,则加入缓冲液后,为了使其与缓冲液接触更充分,还需要将组织块处理的细碎。在此操作过程中,组织块容易粘在器械上,也将造成肌肉组织的损失,将肌肉组织冷冻薄切则可以避免此类损失。本研究采用将肌肉组织薄切成10 μm小片,加入样品缓冲液,通过振荡使组织与缓冲液接触充分,不需要超声和匀浆,组织即可溶解,减少了肌肉组织在接触其他仪器、器械过程中的损失。最终,发现将4% SDS,125 mm Tris(pH 8.8),蛋白酶抑制剂,0.5 mm PMSF,100 mm DTT的样品缓冲液加入肌肉组织,在未应用超声加4 ℃匀浆处理情况下,溶解最完全。随后的WB实验结果也证实蛋白提取是成功的。
有研究提到将多种一抗混合在一起,同时孵育载有目标蛋白的PVDF膜,这样在同一张PVDF膜上可以同时检测出多条蛋白带,比较节省实验时间[1,6]。但是,笔者在实际操作中发现有欠妥之处:(1)多种蛋白一抗同时孵育,当某种蛋白由于相对分子质量改变而发生移位到另一种目标蛋白位置上,造成两者重叠,干扰结果判读,如肌萎缩蛋白带(相对分子质量427 000)易出现截短,相对分子质量较正常减小,甚至出现在质膜修复蛋白带(相对分子质量230 000)的位置。当PVDF膜仅在质膜修复蛋白带的位置上显示一条条带,很难确定此蛋白带是位置异常的肌萎缩蛋白带/质膜修复蛋白带缺失;还是正常的肌萎缩蛋白带/肌萎缩蛋白带未显色;还是位置异常的肌萎缩蛋白带和正常的质膜修复蛋白带重叠。(2)由于抗体的液体量是依据膜的面积而定,因而整张膜多种抗体同时孵育,每种目标蛋白抗体的用量较大,比较浪费抗体。而采用单个膜孵育可以避免上述不足,得到比较理想的结果[7]。但是单个膜孵育也需要注意:单个膜孵育需要在孵育相应一抗前,根据蛋白Marker位置切割PVDF膜,若电泳及转移时蛋白带位置不整齐,所需要的两条蛋白带位置很近,容易将其中一条蛋白带切割出去。同时,为了保证结果的真实性,每一份标本均需重复两次,从而减少实验结果的误差。
本研究在提取患者的肌肉标本时,5例患者未提取出足量的蛋白。考虑原因如下:(1)组织块较大,但是标本中结缔组织含量显著增多,仅有少量严重萎缩肌纤维残留;(2)组织块相对较小,标本中结缔组织含量增多,部分萎缩肌纤维残留。Groen等[8]提出,在免疫印迹前对于待检组织进行HE染色,对于形态和脂肪含量评估。每次在提取肌肉标本之前需要进行HE染色,判断标本中结缔组织含量,从而确定切片的数量,并对WB结果判定提供参考。
本研究显示保存相对较长时间的标本容易出现多条蛋白带强度减弱,这些标本肌肉组织HE染色显示肌纤维形态明显皱缩,虽然BCA检测显示提取的总蛋白含量充分,转膜后的凝胶行考马斯亮蓝染色也可见肌球蛋白重链,WB也可检测出GAPDH,但是所检测的多个目标蛋白带强度减弱。因此,笔者分析可能由于肌纤维蛋白的降解,使含量低的蛋白不能被检测出来,但是此情况尚需进一步研究证实。
WB方法与IHC相比,可以半定量蛋白,同时看到蛋白带位置是否出现改变。但是WB方法较IHC费时费力、成本更高、需要的组织标本量更多。本研究通过IHC与WB检测蛋白结果进行对比,发现:(1)IHC显示DYS严重缺失或单一抗DYS抗体缺失的病例,WB与IHC结果具有一致性,提示此类病例可单做IHC。(2)IHC显示轻度缺失或斑片样缺失的病例,需要进一步行WB检测肌萎缩蛋白带,确定蛋白的异常。IHC显示染色斑片状缺失的1例女性患者,WB显示肌萎缩蛋白存在正常和异常位置的两条蛋白带,提示DMD携带者或女性DMD患者。赵娟等[9]提到此类患者IHC染色可以有相同的改变。(3)对于临床高度疑诊而IHC显示正常的病例,需要进一步行WB检测肌萎缩蛋白。IHC显示肌纤维膜上肌萎缩蛋白清晰表达的1例患者,WB显示肌萎缩蛋白带位置较正常升高(图3),最终DMD基因发现外显子45~67重复。
综上,本研究证实改进的蛋白提取方法可节省组织标本用量,并进行蛋白分析诊断肌营养不良。
参考文献
[1]Cooper ST,Lo HP,North KN. Single section Western blot:improving the molecular diagnosis of the muscular dystrophies[J]. Neurology,2003,61 (1):93- 97.
[2]胡静,樋口逸郎.微量标本Western blot在诊断肢带型肌营养不良2A型中的应用[J]. 中华神经科杂志,2008,41(4):250- 253.
[3]罗苏珊,奚剑英,朱雯华,等.Calpain蛋白病的临床表型和基因型分析(附一家系报道)[J].中国临床神经科学,2012,20(2):169- 175.
[4]Luo SS,Xi JY,Lu JH,et a1.Clinical and pathological features in 15 Chinese patients with calpainopathy[J].Muscle Nerve,2011,43(3):402- 409.
[5]耿娜,李伟,李鸿皓,等.分子病理确诊的肢带型肌营养不良2A型患者五例临床及病理特点[J].中华神经科杂志,2010,43(5):317- 321.
[6]Anderson LV,Davison K. Multiplex Western blotting system for the analysis of muscular dystrophy proteins[J]. Am J Pathol,1999,154(4):1017- 1022.
[7]吴冬燕,陈琳,赵燕环,等.免疫组织化学和免疫印迹法诊断dystrophin相关的临床表现良性肌病[J]. 中华神经科杂志,2010,43(1):45- 50.
[8]Groen EJ,Charlton R,Barresi R,et al. Analysis of the UK diagnostic strategy for limb girdle muscular dystrophy 2A[J]. Brain,2007,130(Pt 12):3237- 3249.
[9]赵娟,宋书娟,王朝霞,等.症状性女性迪谢内肌营养不良基因携带者五例临床、病理和基因特点[J].中华神经科杂志,2014,47(1):12- 15.
·论著·
Effects of Rapamycin and Rapamycin-loaded Poly(lactic-co-glycolic)Acid Nanoparticles on Apoptosis and Expression of bcl- 2 and p27kip1Proteins of Human Umbilical Arterial Vascular Smooth Muscle Cell Diagnosis of Muscular Dystrophy Using Western Blot with Micro-sample of Muscle
WU Dong-yan1,CHEN Lin2,ZHAO Yan-huan2,REN Hai-tao2,GUAN Hong-zhi2,WEI Yan-ping2,LIU Zhi2,QIAN Min2,GUO Yu-pu2,CUI Li-ying2,JIAO Jin-song1
1Department of Neurology,China-Japan Friendship Hospital,Beijing 100029,China
2Department of Neurology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
Corresponding author:CHEN LinTel:010- 65196377,E-mail:chenlinpumch@live.cn
ABSTRACT:ObjectiveTo diagnose muscular dystrophy using Western blot (WB) by improving the method of the protein extraction. MethodFirstly,we compared the effect of different sample buffer solutions and processing methods on the extraction of muscle protein in rats,then selected the appropriate extracting method and the process of the muscular protein. ResultsWe put the selected sample buffer into the micro-sample,then mixed. The concentration of the extracting protein was much more,and the loss during the process was much less. We extracted enough protein in 62 cases. The protein bands were showed clearly by WB,and the abnormal protein bands were shown in some patients. Compared with the results of immunohistochemical staining detected the severe abnormal expressions of Dys-R,Dys-C,and Dys-N in the specimens,we did not detect the corresponding target band in WB. We detected the target protein band of the specimens were abnormal position,light or normal staining in WB,while Dys were mildly expressed in immunohistochemical staining. ConclusionsThe improved protein extraction method can save the muscle tissue,and the protein bands can be used for diagnosing the muscular dystrophy. For clinically suspected patients with dystrophinopathy,if normal or mild deficiency is shown by immunohistochemistry,WB should be applied to detect the dystrophin protein band.
Key words:Western blot;muscular dystrophy;micro-sample of muscle
收稿日期:(2015- 04- 15)
DOI:10.3881/j.issn.1000- 503X.2015.06.011
中图分类号:R746.2
文献标志码:A
文章编号:1000- 503X(2015)06- 0705- 06
通信作者:陈琳电话:010- 65196377,电子邮件:chenlinpumch@live.cn
