肾脏局部生物钟系统与水盐排泄昼夜节律的时相关系
2016-01-29张瑞雨牟利军李雪梅李学旺
张瑞雨,牟利军,李雪梅,李学旺,秦 岩
中国医学科学院 北京协和医学院 北京协和医院肾内科,北京 100730
肾脏局部生物钟系统与水盐排泄昼夜节律的时相关系
张瑞雨,牟利军,李雪梅,李学旺,秦岩
中国医学科学院北京协和医学院北京协和医院肾内科,北京 100730
摘要:目的观察大鼠水盐排泄昼夜节律以及肾脏局部生物钟系统的钟基因及下游与水盐转运相关的钟控基因的昼夜节律表达的关系。方法饲养正常成年SD雄性大鼠,分别于授时时间(ZT)00∶00-ZT12∶00(开灯后,即日间)及ZT12∶00-24∶00(关灯后,即夜间)留取尿液,比较日夜间尿量及尿钠、尿钾、尿氯的排泄率,然后分别于ZT2∶00、6∶00、10∶00、14∶00、18∶00及22∶00处死大鼠并取肾脏组织,应用实时定量PCR方法检测6个钟基因CLOCK、BMAL1、Per1、Per2、Cry1和Cry2及6个钟控基因NHE3、αENaC、NCC、Ptges、V1aR 和V2R 的mRNA表达。应用部分傅里叶分析合并逐步回归的分析方法对基因表达进行节律分析。结果正常大鼠尿量及尿钾排泄率呈夜高日低的昼夜节律(P<0.05),而尿钠及尿氯排泄率也表现为夜间高于日间的趋势,但差异无统计学意义。与其同步的肾脏组织内6个钟基因CLOCK、BMAL1、Per1、Per2、Cry1、Cry2(P均<0.05)及6个钟控基因NHE3、αENaC、NCC、Ptges、V1aR、V2R(P均<0.05)均表现昼夜节律,其峰值均处于大鼠夜间活动期。结论大鼠水钠排泄节律与肾脏局部生物钟系统的钟基因及钟控基因表达的昼夜节律具有时相协同性。
关键词:肾脏;昼夜节律;钟基因;钟控基因;水盐排泄
ActaAcadMedSin,2015,37(6):698-704
地球上生物的生命活动大多数呈现昼夜节律,这是由生物体内强大的生物钟系统调控的。哺乳动物的各种生理活动如血压、心率、呼吸及睡眠等呈现昼夜节律,是由遍布于全身各组织器官甚至细胞的生物钟系统运行产生的[1]。生物钟系统中枢器官位于下丘脑前部的视交叉视上核,即中枢振荡器,能够同步化调控外周各组织器官内的生物钟系统,使全身的生理生命活动协调一致[2]。各个组织器官的生物钟系统都具有类似的分子机制,包括钟基因及受其调控的下游钟控基因。目前研究较多的钟基因包括CLOCK、BMAL1、Per1、Per2、Cry1、Cry2,CLOCK与BMAL1的基因产物形成二聚体Clock/Bmal1,与Per1、Per2、Cry1、Cry2基因相结合,促进基因产物Per1- 2/Cry1- 2的表达。而Per1- 2/Cry1- 2反过来抑制Clock/Bmal1的表达,从而抑制自身表达。这些钟基因相互抑制、相互促进、此消彼长,并调控下游的钟控基因,构成了生物钟系统运行的分子机制[2]。目前研究发现外周组织器官的生物钟系统不仅受中枢的协同调控,自身也具有独立完整的节律自控能力,这可能与疾病的发生、发展有一定的关系,遂成为各领域研究的热点[2]。
肾脏作为外周器官,具有生物钟系统,参与调控血压及水盐排泄等生理昼夜节律的形成,这对维持肾脏的正常生理功能具有重要意义。有研究表明SD大鼠胚胎期20 d就发现肾脏局部钟基因系统表达形成,并随着幼鼠的发育成熟逐渐完善,因此肾脏局部生物钟系统在胚胎发育早期即发挥维持肾脏功能运行的重要作用[2]。当出现肾脏疾病时,如慢性肾功能不全患者表现出多种节律紊乱如夜尿增多、血压节律紊乱、睡眠节律紊乱、不宁腿综合征等[2],虽其发生机制并不明确,但这些节律紊乱往往在肾移植术后得到改善[3]。研究表明小鼠肾脏钟基因CLOCK、BMAL1、Per1、Per2、Cry1、Cry2的表达均具有昼夜节律[4]。而参与肾脏水盐代谢的功能基因中,NHE3及αENaC是目前研究较多、较明确的钟控基因。NHE3是最早明确的肾脏内钟控基因,其基因产物是位于肾脏近曲小管的Na-H交换体,主要参与调控钠离子代谢及酸碱平衡[3,5]。αENaC的基因产物是位于肾脏集合管及远段小管的上皮钠通道,受醛固酮的调控以调节钠的代谢[6]。Zuber等[7]应用基因芯片技术发现小鼠肾脏远曲小管、连接管及皮质集合管均有钟控基因NHE3、αENaC、V1aR、V2R mRNA的表达呈昼夜节律。虽然已有研究者开始关注肾脏钟基因及钟控基因的节律表达,但把肾脏钟基因及钟控基因的节律表达与肾脏水盐代谢的生理节律相联系的研究相对较少。本研究拟观察正常成年大鼠肾脏钟基因及钟控基因的节律表达情况与大鼠尿钠、尿钾、尿量排泄的昼夜节律是否具有时相的一致性。
材料和方法
动物饲养及试剂健康清洁级雄性SD大鼠18只,所有大鼠为7~8周龄,购自北京华阜康生物科技股份有限公司。所有大鼠均在北京协和医院实验动物中心清洁级动物房饲养。适应性饲养2周,规律进食、进水。定时开关灯,早8∶00开灯,记为授时时间ZT00∶00,晚20∶00关灯,记为ZT12∶00。RNA稳定液购自美国GIBCO公司,Trizol试剂盒、cDNA反转录试剂盒(型号DRR036A)及RT-PCR试剂盒(型号DRR082A)均购自日本TAKARA公司。
大鼠尿标本留取及检测将大鼠放入代谢笼内,禁食不禁水,饮水规律不变。自ZT00∶00~ZT12∶00留取日间尿液,ZT12∶00~24∶00留取夜间尿液。收集到的新鲜尿液立即3 000 r/min,离心5 min后去除沉渣。北京协和医院检验科Olympus AU2700自动生化分析仪分别测尿钠(间接离子选择电极法)、尿钾(间接离子选择电极法)、尿氯(间接离子选择电极法)的浓度,并分别计算日夜间尿量及尿钠、尿钾、尿氯的排泄率。
肾组织留取分别于ZT2∶00、6∶00、10∶00、14∶00、18∶00及22∶00各处死3只SD大鼠。3%苯巴比妥钠(30 mg/kg)腹腔注射麻醉。用碘伏消毒胸腹部皮肤后,打开腹腔,暴露肾脏;打开胸腔,在心尖处注入无菌冰生理盐水,同时剪开右心耳,冲出大鼠体内的血,直到肾脏发白为止。取下双侧肾脏置于冰生理盐水中,去除肾脏表面筋膜。用眼科剪将肾脏组织均匀剪成黄豆粒大小,置于冻存管内的RNA稳定液中。置于-80℃冰箱保存。
实时定量PCR检测目的基因表达应用Trizol试剂盒提取肾组织中的RNA,然后应用cDNA反转录试剂盒将RNA逆转录成为cDNA,进一步应用实时定量PCR试剂盒检测钟基因CLOCK、BMAL1、Per1、Per2、Cry1、Cry2及钟控基因NHE3、αENaC、NCC、Ptges、V1aR、V2R mRNA的表达,得到目的基因mRNA/GAPDH mRNA的表达比值。每个步骤均参照试剂盒说明书。内参基因GAPDH及目的基因的引物序列见表1。
统计学处理所得数据均应用Chronos-fit1.06软件进行昼夜节律分析。该软件的分析方法为部分傅里叶分析合并逐步回归分析,部分傅里叶分析公式为f(t)=中位数+Σ[振幅i×cos(t-峰值ZT时间i)×2π/pi],该函数表现为余弦曲线,中位数为所有数据的中位数,峰值ZT时间为余弦曲线高峰值对应的ZT时间。若所有数据经上述函数分析后得到的曲线与拟合的余弦曲线模型相符合,那么所得曲线上的每个数值都符合余弦曲线,即经F检验具有统计学意义。
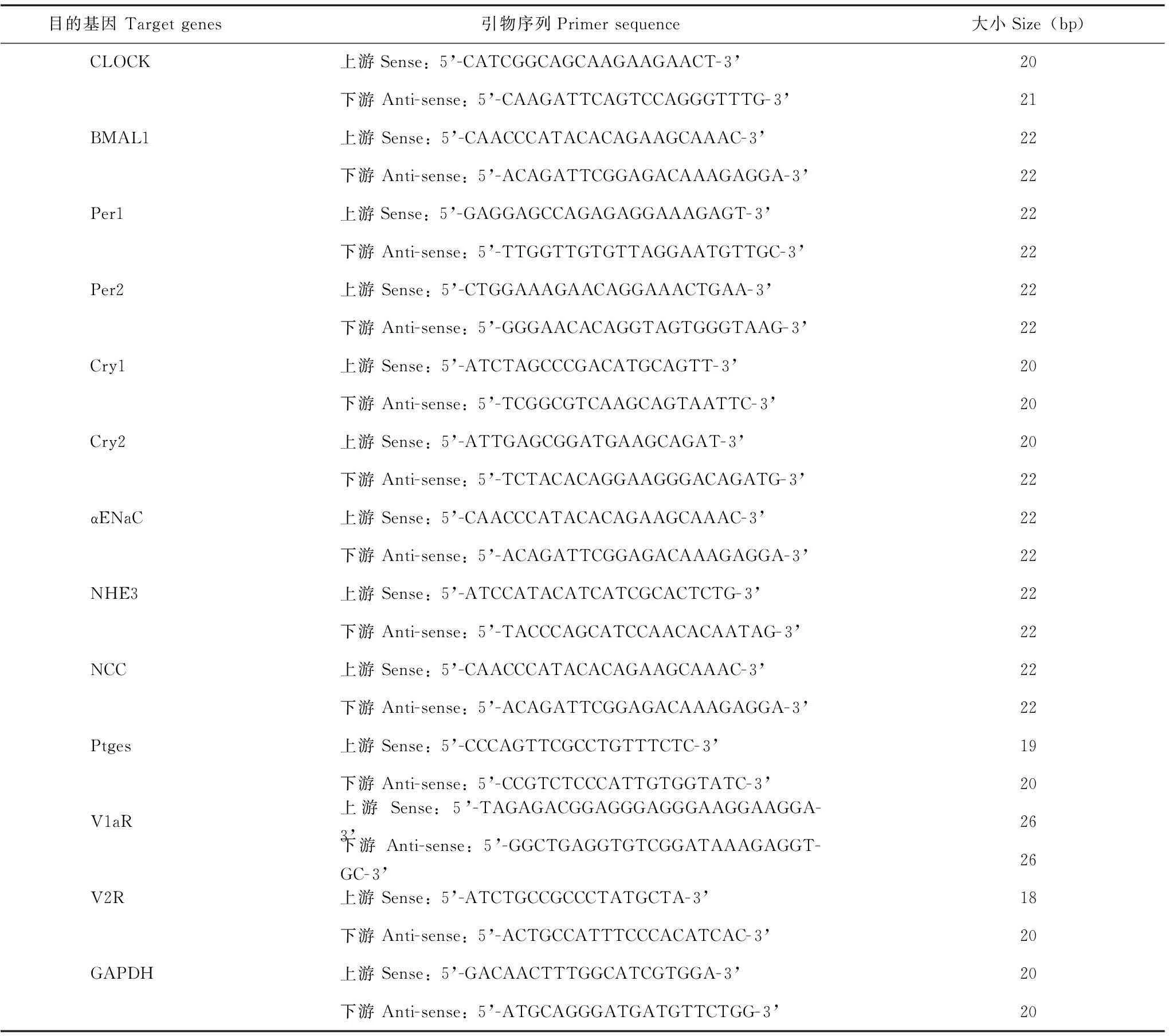
表 1 实时定量PCR的引物序列
若上述函数分析所得的F值大于F-to-enter值,相当于P<0.05,即有统计学意义。若所得的F值小于或等于F-to-enter值,则无统计学意义。F-to-enter为软件自行给出的固定值。日夜间尿量及尿钠、尿钾、尿氯的浓度及排泄率数据应用配对t检验,应用SPSS 18.0软件进行统计学分析,数据以均数±标准差表示。P<0.05为差异有统计学意义。
结果
大鼠尿量、尿钾排泄节律与夜间尿量(18.5±9.74) ml相比,SD大鼠日间尿量(8.78±3.94) ml明显减少(P<0.05)。而尿钾排泄率夜间(92.85±23.87)μmol/h显著高于日间(24.82±5.75)μmol/h(P<0.05)。而尿钠、尿氯排泄率夜间分别为(39.49±22.44)μmol/h、(70.81±20.90)μmol/h,日间分别为(31.54±8.46)μmol/h、(50.77±10.73)μmol/h,夜间排泄率虽有高于日间的趋势,但差异无统计学意义(P>0.05)。
大鼠肾脏钟基因CLOCK、BMAL1、Per1、Per2、Cry1、Cry2 mRNA的表达节律钟基因CLOCK、BMAL1、Per1、Per2、Cry1、Cry2 mRNA节律表达曲线F值分别为28.26、4.52、3.7、5.79、5.26、26.36>F-to-enter,即P<0.05,具有明显的昼夜节律。其峰值时间分别位于ZT23∶21、ZT 22∶45、ZT13∶11、ZT14∶24、ZT15∶06、ZT17∶53,均处于大鼠夜间活动期(图1)。
大鼠钟控基因NHE3、αENaC、NCC、Ptges、V1aR、V2R mRNA的表达节律钟控基因NHE3 mRNA节律表达的相对应F值为14.28>F-to-enter,即P<0.05,其峰值时间位于ZT14∶05。钟控基因αENaC mRNA节律表达的相对应F值为28.22>F-to-enter,即P<0.05,其峰值时间位于ZT14∶18。钟控基因NCC、Ptges mRNA节律表达的相对应的F值分别为14.81、13.52,P均<0.05,其峰值时间分别为ZT13∶53、ZT13∶53,而钟控基因V1aR、V2R mRNA节律表达的相对应的F值分别为8.77、5.08,P均<0.05,其峰值时间分别为ZT23∶34、ZT20∶37(图2)。
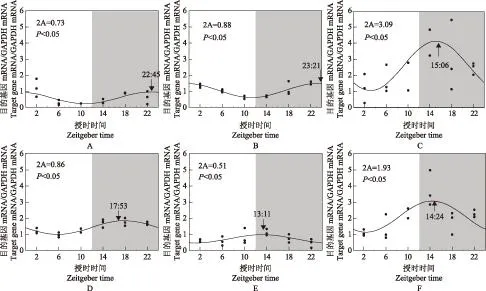
箭头:节律高峰值对应的授时时间;2A:两倍的振幅;图中曲线为节律分析后各钟基因的拟合曲线,经F检验,P均<0.05
black arrow in every figure directs Zeitgeber time related to the peak value of the fitted curve (acrophase);2A:double amplitude;the curve in the chart is the fitted one induced by circadian analysis of all clock genes,which is checked significantly byF-test,the correspondingP<0.05
图 1肾脏钟基因BMAL1(A)、CLOCK(B)、Cry1(C)、Cry2(D)、Per1(E)、Per2(F)mRNA的昼夜节律表达
Fig 1Expression of clock genes including BMAL1(A)、CLOCK(B)、Cry1(C)、Cry2(D)、Per1(E)、Per2(F) exhibit circadian pattern in kidney
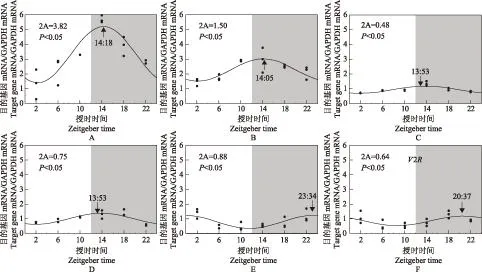
箭头:节律高峰值对应的授时时间;2A:两倍的振幅;图中曲线为节律分析后各钟基因的拟合曲线,经F检验,P均<0.05
black arrow in every figure directs Zeitgeber time related to the peak value of the fitted curve (acrophase);2A:double amplitude;the curve in the chart is the fitted one induced by circadian analysis of all clock genes,which is checked significantly byF-test,the correspondingP<0.05
图 2肾脏钟控基因αENaC(A)、NHE3(B)、NCC(C)、Ptges(D)、V1aR(E)、V2R(F) mRNA昼夜节律表达
Fig 2Expression of clock-controlled genes including αENaC(A)、NHE3(B)、NCC(C)、Ptges(D)、V1aR(E)、V2R(F) exhibit circadian pattern in kidney
讨论
早在19世纪50年代,Goldman[8]观察到正常人的水及电解质钠、钾的排泄表现为日高夜低的昼夜节律。随后Minors[9]也观察到正常人水、电解质如钠、氯、钾、尿酸、钙及磷的排泄表现出日高夜低的昼夜节律。也有研究显示大鼠或小鼠等夜间活动的啮齿类动物中水及电解质钠、钾、氯等排泄呈日低夜高的昼夜节律[10]。本研究显示大鼠尿量及尿钾的排泄呈日低夜高的昼夜节律,而尿钠与尿氯的排泄虽有日低夜高的趋势,但差异无统计学意义,这可能与本研究样本量小有关。综上,对于人类和啮齿类动物研究表明水盐排泄的峰值处于动物的活动期。
本研究显示肾脏组织局部钟基因CLOCK、BMAL1、Per1、Per2、Cry1、Cry2及其下游的与肾脏功能相关的钟控基因NHE3、αENaC、NCC、Ptges、V1aR、V2R的mRNA表达均呈明确的昼夜节律,且所有基因节律高峰集中在大鼠的活动期(夜间),这与其他研究者在小鼠上的研究结果[4]具有一致性。因此,本研究表明大鼠肾脏水盐排泄与肾脏局部的钟基因及钟控基因的表达三者的节律具有时相一致性,峰值均位于活动期,谷值均位于睡眠休息期。该一致性表明夜间大鼠活动频繁时肾脏代谢功能活跃,肾脏钟基因、钟基因下游的肾脏水盐排泄功能基因表达增加,水盐排泄增加;而日间大鼠休息时,上述钟基因、钟控基因表达减少,水盐排泄减少,证实了肾脏生理功能的节律性与其内部生物钟系统基因的节律性具有时相的协同性,这种协同性是维持肾脏功能正常运行的重要分子机制之一。
破坏这种协同性可导致肾脏或全身疾病的发生。Zuber等[7]研究显示CLOCK基因敲除小鼠肾脏局部的钟控基因V2R、AQP2、AQP4及αENaC的表达节律紊乱,并伴有部分性尿崩症、钠排泄节律紊乱及显著低血压。有研究表明Cry1/Cry2基因表达缺失的小鼠肾脏局部的钟控基因NHE3表达节律紊乱[11],并表现盐敏性高血压[12]。Gumz等[6]研究显示Per1基因表达缺失的小鼠肾脏局部的钟控基因αENaC的节律表达改变,并伴尿钠排泄增多,Per1基因敲除小鼠表现为低血压、尿钠排泄节律紊乱[13]。上述研究表明,当作为肾脏局部生物钟系统重要组成部分的钟基因表达缺失或减少时,与肾脏功能相关的钟控基因的表达出现节律紊乱,而肾脏功能也表现节律紊乱,即三者之间形成的时相一致性遭到破坏而导致肾脏疾病的发生。另有研究表明钟基因BMAL1、Per2基因敲除小鼠均表现非杓型血压节律[13- 14]。这些研究从反向验证了肾脏局部生物钟系统对维持肾脏功能正常运行的重要性。临床研究显示有生物钟节律紊乱的人群如夜班工作者较日间工作人群罹患糖尿病、高血压、肿瘤等疾病的概率明显增加[15]。
本研究显示与肾脏功能相关的NHE3、αENaC、NCC、Ptges、V1aR、V2R mRNA的表达也呈昼夜节律,这些基因均是位于钟基因下游的受钟基因调控的钟控基因。这些功能基因既受到上游钟基因的调控,又直接参与调控肾脏水盐排泄功能。钟控基因NHE3、αENaC是肾小管内参与水钠调控的重要通道或转运体。有研究通过体内或体外分子水平实验,直接证明醛固酮促进钟基因Per1与盐皮质激素受体共同结合于钟控基因αENaC的启动子序列,从而促进产物αENaC的表达[16]。另外人们还发现小鼠肾脏中Clock/Bmal1二聚体与NHE3 mRNA启动子的E-box序列相结合,从而促进产物NHE3的产生[5,11]。这项研究证明钟基因Clock、Bmal1对钟控基因NHE3的直接调控作用。上述两种转运体或通道均在醛固酮的调控下,参与水钠代谢及血压的调控[17]。
另有钟控基因NCC的产物是Na-Cl同向转运体,主要位于远曲小管、连接管及皮质集合管,也参与水钠代谢的调控[18]。钟控基因Ptges的产物是前列腺素E合成酶,位于远曲小管及连接管,主要参与前列腺素E的合成。钟控基因V1aR、V2R的产物分别是血管加压素受体V1a及V2,位于远曲小管、连接管及皮质集合管,主要与血管加压素结合,调控水的代谢[3]。上述基因产物作为肾脏的功能基因,接受上游钟基因的调控,其表达的节律性与肾脏水盐排泄的节律具有时相一致性,对维持肾脏水钠代谢正常运行具有重要作用。这些肾脏特有的具有生理功能的钟控基因作为连接肾脏局部生物钟系统与肾脏生理功能的重要纽带,是研究生物钟系统运行机制及肾脏功能调控机制的重要突破点。
正常大鼠肾脏局部生物钟系统的昼夜节律与肾脏生理功能具有时相的协同性。那么在肾脏疾病状态下,这种协同性是否受到破坏?临床观察证实慢性肾脏病患者存在尿钠排泄及血压节律的紊乱[19],那么肾脏局部的生物钟分子表达是否发生改变,这些改变与肾脏病理生理的改变孰因孰果?这些都是进一步研究的方向。
参考文献
[1]Okamura H,Yamaguchi S,Yagita K. Molecular machinery of the circadian clock in mammals[J]. Cell Tissue Res,2002,309(1):47- 56.
[2]Koch BC,Nagtegaal JE,Kerkhof GA,et al.Circadian sleep-wake rhythm disturbances in end-stage renal disease[J]. Nat Rev Nephrol,2009,5(7):407- 416.
[3]Stow LR,Gumz ML. The circadian clock in the kidney[J]. JASN,2011,22(4):598- 604.
[4]Yamamoto T,Nakahata Y,Soma H,et al. Transcriptional oscillation of canonical clock genes in mouse peripheral tissues[J]. BMC,2004,5 (18):1- 9.
[5]Nishinaga H,Komatsu R. Circadian expression of the NaH exchanger NHE3 in the mouse renal medulla[J]. Biomed Res,2009,30(2):87- 93.
[6]Gumz ML,Stow LR,Lynch IJ,et al. The circadian clock protein period 1 regulates expression of the renal epithelial sodium channel in mice[J]. J Clin Invest,2009,119(8):2423- 2434.
[7]Zuber AM,Centeno G,Pradervand S,et al. Molecular clock is involved in predictive circadian adjustment of renal function[J]. Proc Natl Acad Sci U S A,2009,106(38):16523- 16528.
[8]Goldman R. Studies in diurnal variation of water and electrolyte excretion;nocturnal diuresis of water and sodium in congestive cardiac failure and cirrhosis of the liver [J]. J Clin Invest,1951,30(11):1191- 1199.
[9]Minors DS.Circadian rhythms of urinary excretion the relationship between the amount excreted and the circadian changes[J]. J Physiol,1982,327(pp):39- 51.
[10]Noh JY,Han DH,Yoon JA,et al. Circadian rhythms in urinary functions:possible roles of circadian clocks? [J] .Int Neurourol J,2011,15(2):64- 73.
[11]Rohman MS,Emoto N. Circadian clock genes directly regulate expression of the Na H exchanger NHE3 in the kidney[J]. Kidney Int,2005,67(pp):1410- 1419.
[12]Doi M,Takahashi Y,Komatsu R,et al. Salt-sensitive hypertension in circadian clock-deficient cry-null mice involves dysregulated adrenal Hsd3b6[J]. Nat Med,2010,16(1):67- 74.
[13]Stow LR,Richards J,Cheng KY,et al. The circadian protein period 1 contributes to blood pressure control and coordinately regulates renal sodium transport genes[J]. Hypertension,2012,59(6):1151- 1156.
[14]Bonny O,Vinciguerra M,Gumz ML,et al. Molecular bases of circadian rhythmicity in renal physiology and pathology[J]. Nephrol Dial Transplant,2013,28(10):2421- 2431.
[15]Takahashi JS,Hong HK,Ko CH,et al. The genetics of mammalian circadian order and disorder:implications for physiology and disease[J]. Nat Rev Genet,2008,9(10):764- 775.
[16]Richards J,Jeffers LA,All SC,et al. Role of Per1 and the mineralocorticoid receptor in the coordinate regulation of alpha ENaC in renal cortical collecting duct cells[J]. Front Physiol,2013,4(253):1- 6.
[17]Seva Pessoa B,van der Lubbe N,Verdonk K,et al. Key developments in renin-angiotensin-aldosterone system inhibition[J]. Nat Rev Nephrol,2013,9(1):26- 36.
[18]Susa K,Sohara E,Isobe K,et al.WNK-OSR1/SPAK-NCC signal cascade has circadian rhythm dependent on aldosterone[J]. Biochem Biophys Res Commun,2012,427(4):743- 747.
[19]Fukuda M,Munemura M. Nocturnal blood pressure is elevated with natriuresis and proteinuria as renal function deteriorates in nephropathy[J]. Kidney Int,2004,65(pp):621- 625.
·论著·
Effects of Rapamycin and Rapamycin-loaded Poly(lactic-co-glycolic)Acid Nanoparticles on Apoptosis and Expression of bcl- 2 and p27kip1Proteins of Human Umbilical Arterial Vascular Smooth Muscle Cell Temporally Relationship between Renal Local Clock System and Circadian Rhythm of the Water Electrolyte Excretion
ZHANG Rui-yu,MOU Li-jun,LI Xue-mei,LI Xue-wang,QIN Yan
Department of Nephrology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
Corresponding author:Qin YanTel:010- 69155058,E-mail:qinyanbeijing@126.com
ABSTRACT:ObjectiveTo investigate the relationship of the circadian rhythm of the urine volume and urine electrolytes excretion rate and the daily expression pattern of the clock genes and clock-controlled genes with the water electrolyte transportation circadian pattern in rat kidneys. MethodsMale adult SD rats were exposed to in a light∶dark (12∶12) cycles. We collected two period urine from zeitgeber time (ZT)00∶00-ZT12∶00 (light time,rest period) and ZT12∶00-24∶00 (dark time,activity period) and then compared the urinary excretion rates of volume,sodium,potassium,and chloride at light time with those at dark time. Rats were sacrificed every 4 hours throughout a 24-hour day-night cycle. Circadian clock gene CLOCK,BMAL1,Per1,Per2,Cry1,Cry2 and kidney specific clock-controlled gene NHE3,αENaC、NCC,Ptges,V1aR,V2R expression were profiled by real-time quantitative polymerase chain reaction. Data were analysed by a partial Fourier analysis and a stepwise regression technique. ResultsUrine volume and urine potassium excretion rate displayed high level at dark time and low at light time in SD rats (P<0.05),and urine sodium and chloride excretion rate also showed the trend(P>0.05).Clock gene CLOCK,BMAL1,Per1,Per2,Cry1,Cry2(P<0.05)and kidney specific clock-controlled gene NHE3,αENaC,NCC,Ptges,V1aR,V2R (P<0.05)mRNA expression showed circadian pattern,and the peak times of the genes were in the dark time. ConclusionUrine volume and urine electrolyte excretion rate which displayed circadian pattern were temporally coupled with the rhythm of expression of clock and clock-controlled genes associated with water electrolyte transportation in rats kidney.
Key words:kidney;circadian rhythm;clock gene;clock-controlled gene;water electrolyte excretion
收稿日期:(2015- 01- 04)
DOI:10.3881/j.issn.1000- 503X.2015.06.010
中图分类号:R589.4
文献标志码:A
文章编号:1000- 503X(2015)06- 0698- 07
通信作者:秦岩电话:010- 69155058,电子邮件:qinyanbeijing@126.com
基金项目:国家自然科学基金(81100545)Supported by the National Natural Sciences Fundation of China(81100545)
