英夫利昔单抗对高脂饲养大鼠肠黏膜屏障及胰岛素抵抗的影响
2016-01-28杨高中夏扣平张小春
杨 峰 杨高中 夏扣平 张小春
(九江市第三人民医院消化内科,江西 九江 332000)
英夫利昔单抗对高脂饲养大鼠肠黏膜屏障及胰岛素抵抗的影响
杨峰杨高中夏扣平1张小春
(九江市第三人民医院消化内科,江西九江332000)
摘要〔〕目的探讨英夫利昔单抗对高脂饲养大鼠肠黏膜功能及胰岛素抵抗(IR)的影响。方法30只大鼠随机分为3组:正常组,模型组,英夫利昔单抗组。通过高脂饲料喂养大鼠造模,6 w后IR大鼠造模成功。模型组继续高脂饲料喂养6 w,治疗组在高脂饲料喂养基础上分别于0,2,4 w给予英夫利昔单抗肌注(3 mg/kg)1次。于6 w处死大鼠,颈总动脉取血并取小肠标本。全自动生化分析仪检测血清空腹血糖(FPG)、空腹胰岛素(FINS)并计算胰岛素敏感指数;ELISA法检测大鼠血清肿瘤坏死因子(TNF)-α及白细胞介素(IL)-10含量;比色法检测血清二胺氧化酶(DAO)、D-乳酸含量;HE染色检测大鼠肠黏膜形态;Western印迹检测大鼠小肠组织核因子(NF)-κB p65、pp65、IκBα、p-IκBα、闭合蛋白(ZO-1)、咬合蛋白的表达。结果与正常组比较,模型组IR大鼠血清中FPG、FINS水平显著上升,胰岛素敏感指数(ISI)下降,大鼠小肠黏膜损害程度较深,炎症细胞浸润较多,血清中DAO、D-乳酸及TNF-α含量上升,IL-10含量下降,NF-κB p65及IκBα磷酸化水平升高,ZO-1及咬合蛋白表达量下降;英夫利昔单抗可显著抑制此变化。结论英夫利昔单抗可以通过NF-κB信号通路来调节TNF-α等相关炎症因子含量,并间接影响TNF-α诱导的紧密连接蛋白的表达,从而改善大鼠肠黏膜功能,治疗大鼠IR。
关键词〔〕英夫利昔单抗;胰岛素抵抗;肠黏膜屏障;肿瘤坏死因子-α;核因子-κB;信号通路
1江西省永修县人民医院内3科
第一作者:杨峰(1974-),男,主治医师,硕士,主要从事消化系统疾病临床研究。
胰岛素抵抗(IR)是多种代谢性疾病的始动因素和致病基础。随着现代生活方式的改变,各种与IR相关的代谢性疾病,如肥胖、糖尿病、高血压及类风湿关节炎等发病率逐年上升〔1~3〕。IR是一个慢性非特异性炎症持续过程〔4〕。其病理过程为:长期高脂饮食,引起肠道菌群结构发生改变,增加了肠道的通透性,导致肠道屏障功能受损,肠道细菌所产生的内毒素(LPS)大量进入门静脉系统,形成代谢性内毒素血症;从而刺激核因子(NF)-κB信号通路〔5〕释放炎性因子如肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1、IL-6〔6〕等,导致IR;而炎性因子进一步抑制肠道上皮紧密连接蛋白的表达〔7〕,加重肠道屏障功能损伤。说明肠道屏障功能障碍为发生IR的启动因素,其中TNF-α高度表达是发生IR的中心环节。英夫利昔单抗目前广泛应用于炎症性肠病、类风湿关节炎、强直性脊柱炎、银屑病及银屑病关节炎等疾病的治疗,并已取得良好的疗效〔8~11〕,作为一种新型生物制剂,与体内多种形式的TNF-α有较强结合能力,降低TNF-α生物活性,从而阻断炎症反应〔12〕,并抑制TNF-α诱导的肠上皮细胞紧密连接蛋白表达的降低〔13〕,降低肠上皮通透性,从而保护肠黏膜屏障功能〔14〕。高脂饲养Swiss小鼠,可产生IR及糖耐受,短期给予英夫利昔单抗可改善症状〔15〕。英夫利昔单抗可改善强直性脊柱炎病人IR〔11〕。自发性高血压大鼠主动脉中胰岛素活性下降,TNF-α活性提高,给予一定剂量英夫利昔,可抑制Iκβ磷酸化,改善此性状〔16〕。基于以上理论背景,我们得出假设,英夫利昔单抗可以通过NF-κB信号通路降低体内TNF-α水平及生物活性,改善高脂大鼠肠黏膜障碍从而治疗IR,并对此进行探讨。
1材料和方法
1.1动物5~6周龄,160~180 g的健康成年SD 雄性大鼠30只,购于南昌大学动物部,室内温度控制在(23±2)℃,大鼠自由饮食和摄水。
1.2药物及饲料英夫利昔单抗(西安杨森制药有限公司);普通饲料(100 g):豆粕25 g、黄豆5 g、玉米30 g、酵母2.5 g、鼓子10 g、鱼粉10 g、骨粉2.5 g、高粱5 g、标准粉8.5 g、豆油1 g、盐0.5 g。高脂饲料(100 g):基础饲料44 g、鸡蛋20 g、奶粉15 g、猪油15 g、鲜黄豆芽5 g、鱼肝油1 g。
1.3试剂 大鼠血清TNF-α检测试剂盒(Bender MedSystems公司);BCA法蛋白定量试剂盒(碧云天生物技术研究所);β-actin(碧云天生物技术研究所);闭合蛋白(ZO-1)蛋白抗体(武汉博士德生物工程有限公司);NF-κB p65,pp65,IκBα,p-IκBα蛋白抗体(Epitmics公司);咬合蛋白抗体(Occludin,Abcam公司);二胺氧化酶(DAO)、D-乳酸检测试剂盒(南京建成生物工程研究所)。
1.4仪器全自动生化分析仪(德国 ROCHE MODULAR SWA 公司 );LDZ5-2 型台式低速离心机(北京医用离心厂);ZT-12P 生物组织自动脱水机(湖北孝感亚光医用电子技术有限公司);电泳仪,转印电泳仪,ChemiDocTM XRS凝胶成像系统(美国Bio-Rad公司);酶标仪(瑞士TECAN集团公司);-80℃冰箱(美国Thermo公司)。
1.5大鼠IR模型的建立大鼠适应性喂养1 w后,给予高脂饲料喂养。饲养6 w后,尾静脉取血测空腹血糖(FPG)及胰岛素(FINS),并计算胰岛素敏感指数(ISI),ISI<-4.11±0.32即IR大鼠造模成功。
1.6动物分组及干预方法正常组:一直给予普通饲料喂养;将造模成功的20只大鼠随机分为:模型组:继续高脂饲料喂养6 w;英夫利昔单抗组:在高脂饲料喂养基础上分别于0,2,4 w给予英夫利昔单抗肌注(3 mg/kg)1次。
1.7标本采集各组大鼠禁食12 h,麻醉,经颈总动脉采血,并处死大鼠,取小肠标本,标本皆放于-80℃冰箱保存待测。
1.8血清葡萄糖、胰岛素及ISI的测定血清葡萄糖、胰岛素由我院检验科生化研究室采用全自动生化分析仪检测,并计算ISI。
1.9血清TNF-α及IL-10含量的测定采用双抗夹心ELISA法。分别按试剂盒说明书步骤进行操作。
1.10血清DAO及D-乳酸含量的测定采用改良分光光度法测定。分别按试剂盒说明书步骤进行操作。
1.11HE染色小肠组织标本经10%中性甲醛浸泡,石蜡包埋,切片,烘干。二甲苯脱蜡,无水、95%、80%乙醇脱水,流水冲洗,苏木素浸泡,盐酸酒精浸泡,流水冲洗至返蓝,伊红复染,流水冲洗,梯度乙醇脱水,二甲苯透明,吹干后中性树胶封片,后镜检。
1.12Western印迹取适量小肠组织标本,加入RIPA裂解液,裂解,离心,收获蛋白。根据BCA试剂盒对蛋白浓度进行测定。蛋白上样,跑SDS凝胶电泳,湿法砖膜。一抗孵育,4℃过夜;漂洗后,二抗室温孵育1~2 h。漂洗,滴加ECL曝光液,在凝胶成像系统中曝光。用“Quantity one”软件对各抗体条带灰度值进行统计。
1.13统计学方法采用SPSS17.0软件进行t检验、One-Way ANOVA。
2结果
2.1英夫利昔单抗对高脂饲养大鼠FPG,FINS及ISI的影响与正常组比较,模型组中大鼠FINS,FINS水平上升,ISI下降(P<0.01);与模型组比较,英夫利昔单抗组能降低IR大鼠FPG、FINS水平,并提高ISI(P<0.05)。见表1。

表1 英夫利昔单抗对高脂饲养大鼠FPG、
与正常组比较:1)P<0.01;与模型组比较:2)P<0.01,下表同
2.2HE染色检测英夫利昔单抗对高脂饲养大鼠肠黏膜形态的影响正常组小肠黏膜各层结构完整连续,极少炎症细胞浸润;模型组中黏膜糜烂,大量淋巴细胞浸润;英夫利昔单抗治疗组小肠黏膜损害程度较轻,炎症细胞浸润较少,各层细胞结构较为清楚。见图1。

图1 英夫利昔单抗对高脂饲养大鼠肠黏膜形态的影响(×400)
2.3英夫利昔单抗对高脂饲养大鼠血清TNF-α及IL-10水平的影响与正常组比较,模型组大鼠血清中TNF-α水平上升,IL-10水平下降(P<0.01);与模型组比较,英夫利昔单抗能降低IR大鼠血清中TNF-α含量并提高IL-10水平(P<0.05)。见表2。
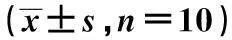
表2 英夫利昔单抗对高脂饲养大鼠血清TNF-α、
2.4英夫利昔单抗对高脂饲养大鼠肠黏膜通透性的影响与正常组比较,模型组中大鼠血清DAO及D-乳酸水平上升(P<0.01);与模型组比较,英夫利昔单抗能降低IR大鼠血清中DAO及D-乳酸水平(P<0.05)。见表3。
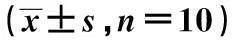
表3 英夫利昔单抗对高脂饲养
2.5英夫利昔对高脂饲养大鼠肠上皮紧密连接蛋白含量的影响与正常组比较,模型组IR大鼠小肠组织中ZO-1和Occludin表达量显著下降(P<0.01);与模型组比较,英夫利昔单抗能提高IR大鼠小肠组织中ZO-1和Occludin表达(P<0.05)。见图2,表4。

图2 英夫利昔单拉对高脂饲养大鼠肠上皮紧密连接蛋白含量的影响

组别ZO-1/GADPHOccludin/GADPH正常组2.38±0.191.27±0.05模型组0.19±0.001)0.31±0.041)英夫利昔单抗组1.16±0.172)1.07±0.102)
2.6英夫利昔对高脂饲养大鼠NF-κB信号通路的影响与正常组比较,模型组IR大鼠小肠组织NF-κB p65和IκBα磷酸化水平上升(P<0.01);与模型组比较,英夫利昔单抗能抑制IR大鼠小肠组织中NF-κB p65和IκBα磷酸化水平(P<0.05)。见图3,表5。

图3 英夫利昔单抗对高脂饲养大鼠NF-κB信号通路的影响

组别p-IκBα/IκBαpp65/p65正常组0.35±0.020.26±0.05模型组1.38±0.151)0.89±0.031)英夫利昔单抗组0.79±0.082)0.45±0.052)
3讨论
IR是指外周围靶器官对胰岛素敏感度及反应性下降的一种病理状态,主要表现为糖脂代谢异常等〔2,3〕。我们实验室用高脂饲料喂养大鼠在6 w出现了FPG、FINS上升症状,胰岛素敏感指数降低,显示了IR症状,与El等〔17〕的观点肥胖导致人体产生IR一致。英夫利昔单抗可改善强直性脊柱炎病人IR〔11〕。而本实验也发现英夫利昔单抗能降低IR。
TNF-α主要由活化的单核细胞和巨噬细胞产生,可促进炎症部位白细胞的聚集和活化,多种炎症介质。TNF-α在肥胖病人和风湿性关节炎动物模型的肠道组织中含量上升并与胰岛素敏感性下降有关〔18,19〕。TNF-α高度表达是发生IR的中心环节,因此,抑制TNF-α的显著表达可治疗IR。抗TNF-α可通过胰岛素信号通路治疗高IR类风湿关节炎患者〔20〕。高脂饲养的Wistar大鼠给予英夫利昔10 d,可抑制肝组织中促炎因子TNF-α、IL-1β含量〔12〕。Olsen等〔21,22〕利用英夫利昔单抗治疗溃疡性结肠炎患者,结果显示治疗后肠黏膜中TNF-α水平显著降低。本实验结果也发现IR抵抗的大鼠,血清中TNF-α含量显著上升,给予英夫利昔单抗后,可显著降低TNF-α含量。IL-10是Tp细胞分泌产生的抗炎细胞因子,可直接抑制Th1细胞,减少促炎因子的产生。Menassa等〔23〕的研究显示,实验性结肠炎小鼠肠黏膜中IL-10水平显著低于正常组,同时小鼠IL-10基因沉默也可诱发实验性结肠炎的产生,经治疗后,肠道炎症较模型组有所缓解。本实验结果也发现IR大鼠,血清中IL-10含量显著下降,给予英夫利昔单抗后,可提高IL-10含量。
高脂饲养大鼠,会使大鼠肠道功能受损,肠道屏障通透性升高,使肠道内有害物质如细菌或毒素通过肠黏膜进入体内,产生炎症,导致肠源性内毒素血症,影响胰岛素信号通路,产生IR。英夫利昔单抗可抑制克罗恩病人血清中TNF-α表达及炎症细胞浸润〔9〕并恢复肠黏膜形态〔8,10〕。英夫利昔单抗可抑制缺血再灌注诱导的大鼠黏膜损伤〔24〕。本实验发现模型组大鼠肠黏膜糜烂,黏膜下层水肿,淋巴细胞浸润淋巴细胞及中性粒细胞浸润。英夫利昔能改善此症状。
DAO主要位于小肠黏膜,在血浆中含量极低,当肠黏膜通透性增加时,DAO进入肠细胞间使血液中DAO水平升高,故能反映肠黏膜通透性变化。D-乳酸是肠道固有细菌的代谢终产物,生理状态下血中D-乳酸含量很低,当各种因素诱导肠黏膜损伤,肠上皮细胞间隙连接破坏,肠道屏障通透性增高,肠腔内的D-乳酸通过受损肠黏膜进入血循环,导致其含量上升,故D-乳酸水平也可反映肠黏膜损害程度和通透性变化。本实验结果也发现IR抵抗的大鼠,血清中DAO和D-乳酸水平显著上升,给予英夫利昔单抗后,可显著降低DAO和D-乳酸含量。
肠黏膜上皮屏障是由完整的肠上皮细胞和相邻肠上皮细胞之间的连接构成。上皮细胞间通过形成紧密连接蛋白网络复合物,防止肠道内有害物质对肠腔外组织器官侵犯。其中紧密连接(TJ)是决定肠黏膜通透性最重要的连接方式,研究发现当紧密连接断裂或紧密连接蛋白减少,会使肠上皮细胞间隙增大,肠黏膜通透性增加〔25,26〕。ZO-1蛋白属于膜结合鸟苷酸激酶家族,为跨膜蛋白,起中介作用,并且还可与其他紧密连接蛋白相连。TNF-α与结肠癌上皮细胞株(CaCo-2细胞株)共同培养,发现肠道屏障功能降低,ZO-1 mRNA和蛋白表达皆下降〔27〕。咬合蛋白也是构成紧密连接成分之一,能使细胞以拉链式紧密结合,并参与紧密连接形成的信号调节。缺乏完整结构的咬合蛋白片段转入缺乏TJ的L-成纤维细胞未能改善细胞屏障功能,当转入咬合蛋白完整片段后,相邻细胞之间可以形成TJ样结构〔28〕。Costantini等〔29〕,分别在烧伤引起的肠黏膜屏障损害及感染性肠病中观察到咬合蛋白和ZO-1的表达显著降低。TNFR-1(-/-)小鼠或英夫利昔治疗组小鼠可改善小鼠的肠黏膜障碍功能,是通过提高肠上皮细胞紧密连接蛋白表达来实现的〔13〕。本实验结果也发现IR抵抗的大鼠肠黏膜形态受损,咬合蛋白和ZO-1表达下降,给予英夫利昔后,可显著提高咬合蛋白和ZO-1的表达量。
NF-κB通路是体内主要的炎症信号转导通路,与IR的发生有密切的联系,已成为研究改善IR的新靶点〔5,31〕。在细胞中最常见的作用形式为 p65 及 p50 组成的二聚体,未受刺激时与 IκB 结合,当受到刺激时,IκB被降解,磷酸化,从而释放NF-κB p65,使之恢复转录活性并从细胞质转移到细胞核内,调节炎症相关基因的表达。Vona-Davis〔32〕等发现NF-κB的拮抗剂可以显著抑制组织病理损伤及大量炎症因子的产生。IR/糖尿病小鼠暴露于PM2.5空气中4~5 w,脑注射IKKβ抑制剂IMD-0354可改善小鼠胰岛素敏感度,抑制TNFα含量〔33〕。英夫利昔单抗治疗12个克罗恩病人,发现肠黏膜中炎症细胞数目减少,TNF-α含量降低,是通过NF-κB活性实现的〔14〕。本实验也发现IR大鼠肠组织中NF-κB p65及IκBα磷酸化程度上升,英夫利昔单抗可显著抑制NF-κB信号通路的活化。Al-Sadi等〔34〕使用NF-κB抑制剂或NF-κB p65 siRNA基因沉默技术降低炎症因子引起的紧密连接破坏。说明英夫利昔单抗可以通过NF-κB信号通路来调节TNF-α相关炎症因子含量,并间接影响TNF-α诱导的紧密连接蛋白的表达,从而改善大鼠肠黏膜功能进而治疗IR大鼠。
虽然本实验得到英夫利昔单抗可通过NF-κB信号通路调节TNF-α相关炎症因子含量,并间接影响TNF-α诱导的紧密连接蛋白的表达,并改善大鼠肠黏膜功能从而治疗大鼠IR。但是实验设计还是有所不足。首先是本实验是从蛋白水平探讨英夫利昔单抗对于NF-κB信号通路的影响,没有涉及基因水平,mRNA的合成和蛋白质的合成可能不在同一个水平上,会产生误差,影响实验结果。且本实验缺少NF-κB信号通路抑制剂给药组,来进一步更加精确的得到结论。
参考文献4
1Ursini F,Naty S,Grembiale RD.Infliximab and insulin resistance 〔J〕.Autoimmun Rev,2010;9(8):536-9.
2Hernandez AV,Guarnizo M,Miranda Y,etal.Association between insulin resistance and breast carcinoma:a systematic review and meta-analysis 〔J〕.PLoS One,2014;9(6):e99317.
3Gougeon R.Insulin resistance of protein metabolism in type 2 diabetes and impact on dietary needs:a review 〔J〕.Can J Diabet,2013;37(2):115-20.
4Wellen KE,Hotamisligil GS.Inflammation,stress,and diabetes 〔J〕.J Clin Invest,2005;115(5):1111-9.
5Yang SJ,Choi JM,Park SE,etal.Preventive effects of bitter melon (Momordica charantia)against insulin resistance and diabetes are associated with the inhibition of NF-kappaB and JNK pathways in high-fat-fed OLETF rats 〔J〕.J Nutr Biochem,2015;26(3):234-40.
6Mohd-Radzman NH,Ismail WI,Adam Z,etal.Potential roles of stevia rebaudiana bertoni in abrogating insulin resistance and diabetes:a review 〔J〕.Evid Based Complement Alternat Med,2013;2013:718049.
7Hallam MC,Reimer RA.Postnatal prebiotic fiber intake in offspring exposed to gestational protein restriction has sex-specific effects on insulin resistance and intestinal permeability in rats 〔J〕.J Nutr,2014;144(10):1556-63.
8Sloan S,Maxwell P,Salto-Tellez M,etal.FOXP3+ regulatory T-cell counts correlate with histological response in Crohn's colitis treated with infliximab 〔J〕.Pathol Int,2014;64(12):624-7.
9Liu C,Xia X,Wu W,etal.Anti-tumour necrosis factor therapy enhances mucosal healing through down-regulation of interleukin-21 expression and T helper type 17 cell infiltration in Crohn's disease 〔J〕.Clin Exp Immunol,2013;173(1):102-11.
10Meijer MJ,Mieremet-Ooms MA,van Duijn W,etal.Effect of the anti-tumor necrosis factor-alpha antibody infliximab on the ex vivo mucosal matrix metalloproteinase-proteolytic phenotype in inflammatory bowel disease 〔J〕.Inflamm Bowel Dis,2007;13(2):200-10.
11Genre F,Lopez-Mejias R,Miranda-Filloy JA,etal.Correlation between insulin resistance and serum ghrelin in non-diabetic ankylosing spondylitis patients undergoing anti-TNF-alpha therapy 〔J〕.Clin Exp Rheumatol,2013;31(6):913-8.
12Barbuio R,Milanski M,Bertolo MB,etal.Infliximab reverses steatosis and improves insulin signal transduction in liver of rats fed a high-fat diet 〔J〕.J Endocrinol,2007;194(3):539-50.
13Fries W,Muja C,Crisafulli C,etal.Dynamics of enterocyte tight junctions:effect of experimental colitis and two different anti-TNF strategies 〔J〕.Am J Physiol Gastrointest Liver Physiol,2008;294(4):G938-G947.
14Guidi L,Costanzo M,Ciarniello M,etal.Increased levels of NF-kappaB inhibitors (IkappaBalpha and IkappaBgamma)in the intestinal mucosa of Crohn's disease patients during infliximab treatment 〔J〕.Int J Immunopathol Pharmacol,2005;18(1):155-64.
15Araujo EP,De Souza CT,Ueno M,etal.Infliximab restores glucose homeostasis in an animal model of diet-induced obesity and diabetes 〔J〕.Endocrinology,2007;148(12):5991-7.
16Filho AG,Kinote A,Pereira DJ,etal.Infliximab prevents increased systolic blood pressure and upregulates the AKT/eNOS pathway in the aorta of spontaneously hypertensive rats 〔J〕.Eur J Pharmacol,2013;700(1-3):201-9.
17El AM,Ruiz DAJ,Angulo J,etal.Preserved endothelial function in human obesity in the absence of insulin resistance 〔J〕.J Transl Med,2013;11(2):263.
18Wang N,Wang H,Yao H,etal.Expression and activity of the TLR4/NF-kappaB signaling pathway in mouse intestine following administration of a short-term high-fat diet 〔J〕.Exp Ther Med,2013;6(3):635-40.
19Shinoki A,Hara H.Dietary fructo-oligosaccharides improve insulin sensitivity along with the suppression of adipocytokine secretion from mesenteric fat cells in rats 〔J〕.Br J Nutr,2011;106(8):1190-7.
20Stagakis I,Bertsias G,Karvounaris S,etal.Anti-tumor necrosis factor therapy improves insulin resistance,beta cell function and insulin signaling in active rheumatoid arthritis patients with high insulin resistance 〔J〕.Arthritis Res Ther,2012;14(3):R141.
21Olsen T,Cui G,Goll R,etal.Infliximab therapy decreases the levels of TNF-alpha and IFN-gamma mRNA in colonic mucosa of ulcerative colitis 〔J〕.Scand J Gastroenterol,2009;44(6):727-35.
22Olsen T,Goll R,Cui G,etal.TNF-alpha gene expression in colorectal mucosa as a predictor of remission after induction therapy with infliximab in ulcerative colitis 〔J〕.Cytokine,2009;46(2):222-7.
23Menassa R,Du C,Yin ZQ,etal.Therapeutic effectiveness of orally administered transgenic low-alkaloid tobacco expressing human interleukin-10 in a mouse model of colitis 〔J〕.Plant Biotechnol J,2007;5(1):50-9.
24Yang Q,Zheng FP,Zhan YS,etal.Tumor necrosis factor-alpha mediates JNK activation response to intestinal ischemia-reperfusion injury 〔J〕.World J Gastroenterol,2013;19(30):4925-34.
25Yang S,Yu M,Sun L,etal.Interferon-gamma-induced intestinal epithelial barrier dysfunction by NF-kappaB/HIF-1alpha pathway 〔J〕.J Interferon Cytokine Res,2014;34(3):195-203.
26Wang Y,Tong J,Chang B,etal.Effects of alcohol on intestinal epithelial barrier permeability and expression of tight junction-associated proteins 〔J〕.Mol Med Rep,2014;9(6):2352-6.
27Costantini TW,Deree J,Loomis W,etal.Phosphodiesterase inhibition attenuates alterations to the tight junction proteins occludin and ZO-1 in immunostimulated Caco-2 intestinal monolayers 〔J〕.Life Sci,2009;84(1-2):18-22.
28Kubota K,Furuse M,Sasaki H,etal.Ca(2+)-independent cell-adhesion activity of claudins,a family of integral membrane proteins localized at tight junctions 〔J〕.Curr Biol,1999;9(18):1035-8.
29Costantini TW,Loomis WH,Putnam JG,etal.Burn-induced gut barrier injury is attenuated by phosphodiesterase inhibition:effects on tight junction structural proteins 〔J〕.Shock,2009;31(4):416-22.
30Vivinus-Nebot M,Frin-Mathy G,Bzioueche H,etal.Functional bowel symptoms in quiescent inflammatory bowel diseases:role of epithelial barrier disruption and low-grade inflammation 〔J〕.Gut,2014;63(5):744-52.
31Elshazly SM.Ameliorative effect of nicorandil on high fat diet induced non-alcoholic fatty liver disease in rats 〔J〕.Eur J Pharmacol,2015;748:123-32.
32Vona-Davis L,Yu A,Magabo K,etal.Peptide YY attenuates transcription factor activity in tumor necrosis factor-alpha-induced pancreatitis 〔J〕.J Am Coll Surg,2004;199(1):87-95.
33Liu C,Fonken LK,Wang A,etal.Central IKKbeta inhibition prevents air pollution mediated peripheral inflammation and exaggeration of type II diabetes 〔J〕.Part Fibre Toxicol,2014;11:53.
34Al-Sadi R,Ye D,Said HM,etal.IL-1beta-induced increase in intestinal epithelial tight junction permeability is mediated by MEKK-1 activation of canonical NF-kappaB pathway 〔J〕.Am J Pathol,2010;177(5):2310-22.
〔2014-09-16修回〕
(编辑安冉冉/曹梦园)
基金项目:江西省卫生计生委科技计划项目(20141725)
中图分类号〔〕R589〔
文献标识码〕A〔
文章编号〕1005-9202(2015)21-6045-05;doi:10.3969/j.issn.1005-9202.2015.21.018
