离子色谱/直接电导法测定利格列汀药物中三氟乙酸残留
2016-01-27周长朋王东武郑文凤徐利娜
周长朋,王东武,郑文凤,许 洁,徐利娜
(迪沙药业集团国家认定企业技术中心质量研究院,山东 威海 264205)
离子色谱/直接电导法测定利格列汀药物中三氟乙酸残留
周长朋*,王东武,郑文凤,许洁,徐利娜
(迪沙药业集团国家认定企业技术中心质量研究院,山东威海264205)
利格列汀(Linagliptin),又名利拉列汀,化学名8-[(3R)-3-氨基-1-哌啶基]-7-(2-丁炔-1-基)-3,7-二氢-3-甲基-1-[(4-甲基-2-喹唑啉基)甲基]-1H-嘌呤-2,6-二酮,由8-溴-3,7-二氢-3-甲基-1H-嘌呤-2,6-二酮经3次取代反应和水解反应制成[1-2],其合成路线见图1。利格列汀属于二肽基肽酶-Ⅳ抑制剂,能够有效提高肠促胰素水平,刺激胰岛素释放,改善患者的血糖水平,但很少引起低血糖,不会导致体重增加[3]。利格列汀不仅可单药用于经生活方式干预不能控制血糖、不能服用或不耐受二甲双胍的2型糖尿病患者,也可与其他降糖药或基础胰岛素联合使用,可明显改善2型糖尿病患者的糖化血红蛋白、空腹和餐后2 h的血糖,且其主要由胆汁经肠道排出体外,对于肝肾功能不全者无需调整剂量,是治疗2型糖尿病患者的新途径[4-5]。

图1 利格列汀的合成路线图Fig.1 Graphical synthetic routes of linagliptin
三氟乙酸(TFA)作为一种酸性有机溶剂,属于四类溶剂,临床使用存在毒性。利格列汀在合成过程中以三氟乙酸作为催化剂,必须严格控制其残留量。目前,国内检测三氟乙酸的方法主要有液相色谱法[6-7]、气相色谱-串联质谱法[8-9]和离子色谱法[10-15]。液相色谱法的灵敏度较低,且对色谱柱损害极大;气相色谱法需衍生后气化,样品处理方法复杂;而离子色谱在检测阴离子时具有灵敏度高、重复性好、方便快捷等优势,现已广泛应于环境监测、生命科学、医学、电子化工等领域[16-18]。离子色谱在药物领域内已得到广泛应用,主要用于检测合成反应中残留的无机酸[10-11,15]、各类阴离子[19]和阳离子残留[20],但国内却未见采用离子色谱法测定利格列汀药物中三氟乙酸残留的报道。本文建立了离子色谱/直接电导法测定利格列汀药物中三氟乙酸残留的方法,并且采用液-液萃取法配制供试品溶液。该方法简单、快速,回收率好、灵敏度高,能够对低浓度的三氟乙酸进行定性与定量分析,填补了利格列汀药物中三氟乙酸残留检测研究的空白,有利于实现利格列汀合成反应过程中三氟乙酸残留的有效监测。
1实验部分
1.1仪器与试剂
ICS-2000离子色谱仪(美国TheromFisher公司):配有ASRS-ULTRA 4 mm阴离子抑制器和电导检测器; CR22GⅡ落地式高速冷冻离心机(日本Hitachi公司);超声波清洗机(昆山超声仪器有限公司);DV215CD精密分析天平(日本OHAUS公司);Milli-Q超纯水仪(美国Millipore公司);0.45 μm水系滤膜(上海津腾公司)。
三氟乙酸(纯度≥99%,阿拉丁公司);甲醇、乙腈(色谱级,德国Merck公司);二氯甲烷(优级纯,天津大茂化学试剂厂);实验用水为Milli-Q超纯水(电阻率为18.2 MΩ·cm);利格列汀药品(自制)。
1.2溶液的制备
对照品溶液:准确称取三氟乙酸10.0 mg于10 mL容量瓶中,用水定容至刻度,混匀后配成1.0 g/L的标准储备液,于4 ℃密封保存。取适量标准储备液,用水配成4.0 μg/mL的标准中间液,即为三氟乙酸对照品溶液。
供试品溶液:准确称取利格列汀药品100 mg于15 mL具塞玻璃离心管中,加少量二氯甲烷溶解后再加水混合后超声,4 000 r/min离心5 min,取上层水相置于10 mL玻璃容量瓶内,加水定容至刻度。
系统适用性溶液:取三氟乙酸、利格列汀适量,按供试品溶液配制方法配成含三氟乙酸4 μg/mL、利格列汀10 mg/mL的溶液,此溶液作为系统适用性溶液。以上溶液均需过0.45 μm水系滤膜后进行色谱分析。
1.3色谱条件
色谱柱:Ionpac AS11-HC(4 mm×25 cm)阴离子交换色谱柱及相应的Ionpac AG11-HC(4 mm×5 cm)保护柱;流动相:20 mmol/L氢氧化钾溶液(EGⅢ在线生成);流速:1.2 mL/min;检测器:ASRS 500-4 mm阴离子抑制器,抑制电流60 mA;电导检测器;柱温30 ℃;电导池温度35 ℃;进样体积25 μL。
2结果与讨论
2.1溶剂的选择
利格列汀易溶于甲醇、乙腈、二氯甲烷等有机溶剂,几乎不溶于水。实验尝试在水中分别加入10%甲醇和10%乙腈进行配制,利格列汀均能完全溶解,但在进入色谱仪后发现大量有机物分别在4.0 min和5.5 min出峰,且峰形较宽,影响三氟乙酸的峰形及信噪比。本文借鉴食品中药物残留检测的液液萃取方法[21],将利格列汀溶于二氯甲烷后再用水萃取三氟乙酸,利格列汀及其他有机物仍留在二氯甲烷层,进色谱仪后背景较为干净,无任何有机物峰,且三氟乙酸峰形良好。10%甲醇、10%乙腈及二氯甲烷-水萃取配制供试品溶液的色谱图见图2。

图2 10%甲醇(A)、10%乙腈(B)及二氯甲烷-水(C)配制三氟乙酸系统适用性溶液的色谱图Fig.2 Chromatograms of trifluoroacetic acid(TFA) in 20% methanol(A),20%acetonitrile(B) and dichloromethane-water(C)
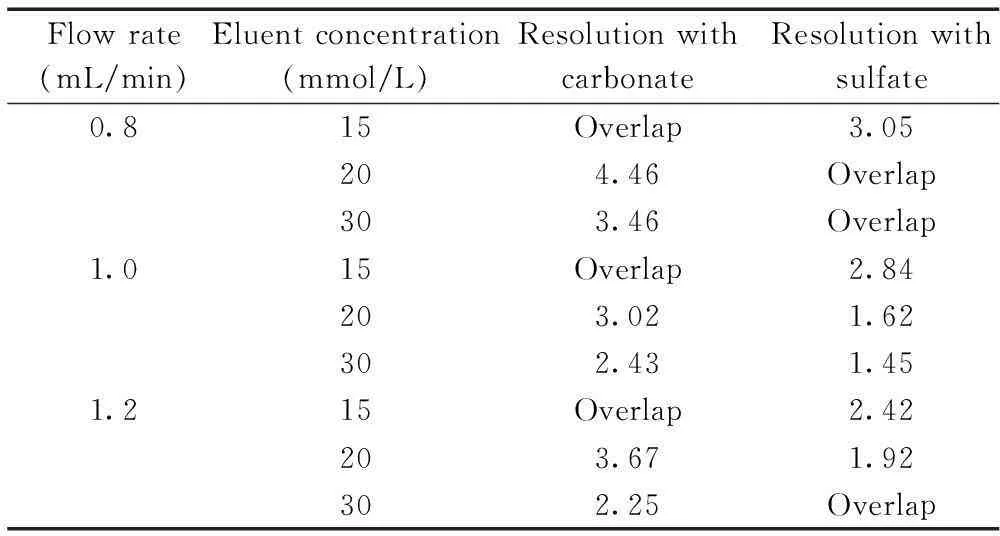
表1 不同流速和不同淋洗液浓度的筛选结果
2.2色谱条件的选择
采用的Ionpac AS11-HC阴离子交换柱为高容量阴离子柱,匹配NaOH或KOH淋洗液可用于无机阴离子和有机酸的阴离子分析,适合大体积进样测定痕量阴离子。文献[10]采用1.3 mL/min、30 mmol/L的KOH作为淋洗液,虽然三氟乙酸出峰较快、峰形较好,但与硫酸根的分离度差。而文献[15]采用0.8 mL/min、15 mmol/L的KOH作为淋洗液,三氟乙酸与氯离子可获得较好的分离度,但与碳酸根峰重叠,且硝酸根与硫酸根在20 min内均不能出峰。本文尝试分别以0.8,1.0,1.2 mL/min的流速和15,20,30 mmol/L KOH淋洗液浓度匹配筛选后发现,以1.2 mL/min流速、20 mmol/L KOH淋洗液作为色谱条件时,三氟乙酸与碳酸根和硫酸根离子的分离度最好(见表1)。
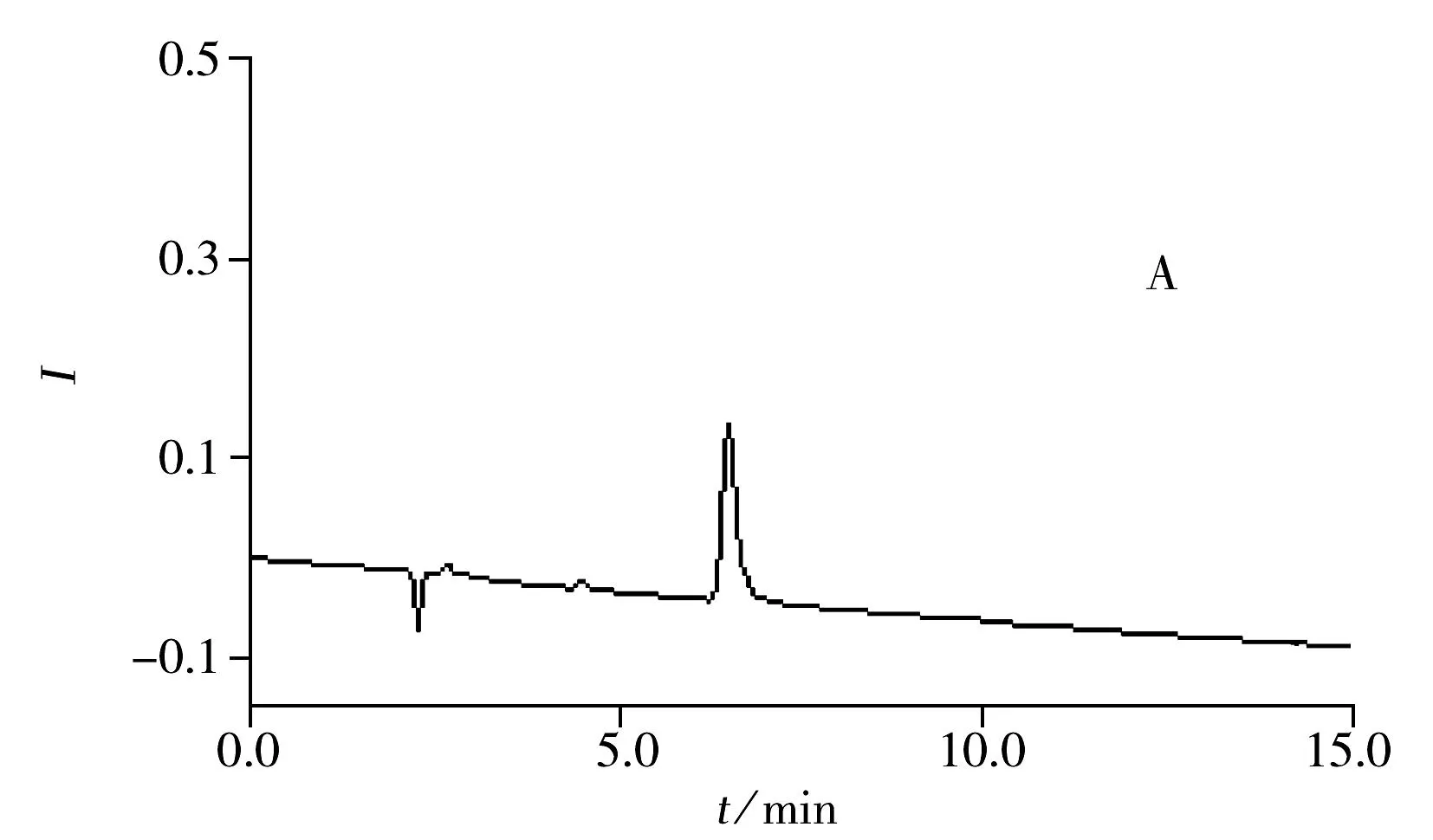
2.3系统适用性实验
分别取空白溶液和系统适用性溶液,按照“1.3”方法注入离子色谱仪,记录色谱图。从图3可观察到,三氟乙酸的保留时间约为7.7 min,与碳酸根离子及其他峰均能实现有效分离。
2.4检出限、定量下限与精密度
取三氟乙酸31.80 mg,加水稀释成0.031 8 μg/mL的溶液,按照“1.3”方法注入离子色谱仪,记录色谱图,以信噪比S/N=3计算得到三氟乙酸的检出限为0.031 8 μg/mL,以S/N=10计算得到三氟乙酸的定量下限为0.106 μg/mL。取三氟乙酸对照品溶液,进行离子色谱分析,重复进样6次,三氟乙酸保留时间和峰面积的相对标准偏差(RSD)分别为0.2%和4.4%。

图4 利格列汀空白溶液(a)及添加4.0 μg/mL三氟乙酸后(b)的色谱图Fig.4 Chromatograms of linagliptin blank(a) and linagliptin blank spiked with 4.0 μg/mL TFA(b)
2.5线性范围与回收率
在杂质限度150%范围内,分别配制定量下限(0.106 μg/mL)、20%限度(0.848 μg/mL)、50%限度(2.12 μg/mL)、100%限度(4.24 μg/mL)、150%限度(6.36 μg/mL)6个浓度的系列溶液,按照本方法进行离子色谱分析,以峰面积(Y)对质量浓度(X,μg/mL)作曲线,得线性回归方程为Y=0.072 5X-0.016 1,相关系数r=0.999 4。
采用不含三氟乙酸的利格列汀药品为空白基质,添加80%限度、100%限度、120%限度浓度的三氟乙酸对照品进行回收率实验,平均回收率为91.5%~97.8%,RSD为0.27%~0.65%(表2)。利格列汀空白溶液及添加三氟乙酸后的色谱图见图4。

表2 利格列汀中三氟乙酸的加标回收率
2.6实际应用
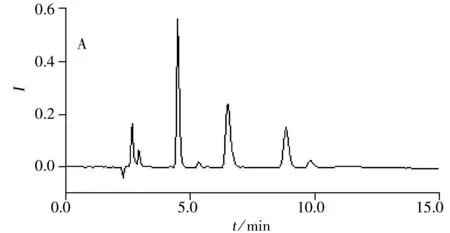
采用所建方法对合成的利格列汀药物小试3批、中试3批及工艺验证3批共27份样品进行检测,结果检出1批样品中含有三氟乙酸残留(图5),其他样品均未检出。
3结论
本文建立了离子色谱/直接电导法测定利格列汀药物中三氟乙酸残留的分析方法,并采用液-液萃取方法配制供试品溶液,该方法快捷、有效、灵敏,回收率、精密度及定量下限均能满足要求,是检测利格列汀药物中三氟乙酸残留的有效方法。将所建方法用于检测利格列汀药物小试3批、中试3批及工艺验证3批共27份样品,检出1批样品含有三氟乙酸残留。方法有效地指导了利格列汀合成反应的进行,对项目研发过程起到了良好的监督作用。
参考文献:
[1]Ouyang L H,Peng L B,Zeng X H,Wang S Y.Chin.J.NewDrugsClin.Remed.(欧阳丽辉,彭六保,曾小慧,王思颖.中国新药与临床杂志),2013,32(2):92-97.
[2]Wang Y,Guo H,Cen J D.Chin.J.Pharm.(王悦,郭珩,岑均达.中国医药工业杂志),2014,45(11):1093-1096.
[3]Wu W J,Chen X,Shen F X,Xiang S Y,Lin D N,Gu X M.Chin.J.NewDrugsClin.Remed.(吴文俊,陈雄,沈飞霞,项松英,林迪妮,谷雪梅.中国新药与临床杂志),2014,33(4):263-266.
[4]Huang W P.J.NanchangUniv.:Med.Sci.Ed.(黄伟萍.南昌大学学报:医学版),2013,53(12):98-101.
[5]Yang W Y.Chin.J.DiabetesMellitus(杨文英.中华糖尿病杂志),2013,5(9):580-582.
[6]Yang X M,Zhao D M,Du Q J,Li Y R.Chin.J.Biochem.Pharm.(杨小明,赵冬梅,杜秋江,李语如.中国生化药物杂志),2010,31(2):126-127.
[7]Yu W,Juan H L,Wang W,Shi H X.Chin.J.Pract.Med.(于伟,隽海龙,王伟,史红霞.中国实用医药),2013,36(8):13-14.
[8]Wang Q Y,Ding X,Li D J,Wang X M.Chin.J.Anal.Lab.(王巧云,丁翔,李德军,王新明.分析试验室),2009,28(5):68-71.
[9]Xiang X W,Shen Z Q,Zheng G,Wu P.Phys.Test.Chem.Anal.:Chem.Anal.(项徐伟,沈志群,郑刚,吴鹏.理化检验:化学分册),2010,46(3):241-243.
[10]Feng S Q,Li Y H,Li X Y,Huang Z L.Chin.J.Pharm.Anal.(冯顺卿,李咏华,李晓燕,黄仲立.药物分析杂志),2013,33(2):289-291.
[11]Zhou C J,Song Y P,Li Y S,Wei C F.Chin.J.Pharm.Res.(周传静,宋玉平,李玉双,魏长峰.药学研究),2014,33(11):635-639.
[12]Li S W,Zhang X D,Yu H.Chin.J.Chromatogr.(李偲文,张小东,于泓.色谱),2010,28(7):708-711.
[13]Li D,Zhang X,Yu H.Chin.J.Inorg.Anal.(李丹,张欣,于泓.中国无机分析化学),2012,2(3):35-37.
[14]Liu Y Z,Yu H,Zhang R Q.Chin.J.Chromatogr.(刘玉珍,于泓,张仁庆.色谱),2012,30(4):384-390.
[15]Guo X H,Huang Y L,Wang Q W,Zheng Z D.Chin.J.Pharm.Anal.(郭兴辉,黄永丽,王倩雯,郑子栋.药物分析杂志),2014,34(6):1077-1079.
[16]Yang L,Hou Y,Wang B X,Yang S H,Zou Y,Yang Y,Yang Y,Liu J.J.Instrum.Anal.(杨蕾,侯英,王保兴,杨式华,邹悦,杨燕,杨勇,刘静.分析测试学报),2010,29(2):164-170.
[17]Zhang S F,Lin Z Z,Chen X Z,Zhang D L,Wang L S.J.Instrum.Anal.(张水锋,林珍珍,陈小珍,张东雷,王立世.分析测试学报),2012,31(1):85-89.
[18]Zeng X L,Ye M L,Chen Y X,Zhu Y.J.Instrum.Anal.(曾雪灵,叶明立,陈永欣,朱岩.分析测试学报),2006,25(3):92-94.
[19]Li J,Li X,Luo J,Xu C G,Liu H J.Chin.J.Pharm.(李继,李霞,罗晶,徐长根,刘海静.中国医药工业杂志),2015,46(2):197-199.
[20]Huang Q Q,Zhong N F,Hong G Y.Chin.J.HealthLab.Technol.(黄巧巧,钟乃飞,洪高云.中国卫生检验杂志),2014,24(4):505-507.
[21]GB/T 21311-2007.Determination of Residues of Nitrofuran Metabolites in Foodstuffs of Animal Origin-HPLC-MS/MS.National Standards of the People’s Republic of China(动物源性食品中硝基呋喃类药物代谢物残留量检测方法 高效液相色谱/串联质谱法.中华人民共和国国家标准).

实验技术
摘要:建立了离子色谱/直接电导法测定利格列汀药物中三氟乙酸残留的方法。利格列汀药物经二氯甲烷溶解后加水进行萃取,水相过滤膜后直接进样。采用EGⅢ在线发生20 mmol/L氢氧化钾溶液为淋洗液,以Ionpac AS11-HC(4 mm×25 cm)色谱柱及Ionpac AG11-HC(4 mm×5 cm)保护柱进行分离,流速为1.2 mL/min,ASRS 500-4 mm阴离子抑制器和电导检测器抑制并直接检测,抑制电流60 mA,柱温30 ℃,进样体积25 μL。结果表明,三氟乙酸与碳酸根离子及其他成分的分离度良好,三氟乙酸在0.848~6.46 μg/mL范围内线性关系良好(r=0.999 4),检出限(LOD)为0.031 8 μg/mL,定量下限(LOQ)为0.106 μg/mL。该方法操作简单、灵敏度高、重现性好,可用于利格列汀药物中三氟乙酸残留的检测。
关键词:离子色谱-直接电导法;三氟乙酸;利格列汀
Determination of Trifluoroacetic Acid(TFA) Residues in Linagliptin Drugs by Ion Chromatography with Direct ConductanceZHOU Chang-peng*,WANG Dong-wu,ZHENG Wen-feng,XU Jie,XU Li-na
(Quality Research Institute of National Enterprise Technology Center of Disha Pharmaceutical Group,Weihai264205,China)
Abstract:An ion chromatographic method was developed for the determination of trifluoroacetic acid(TFA) residues in linagliptin drugs.After dissolved with dichlomethane and extracted with water,the samples were loaded onto the instument.The determination was performed on an Ionpac AS11-HC(4 mm×25 cm) column with an IonpacAG11-HC(4 mm×5 cm) guard column.The eluent was 20 mmol/L potassium hydroxide solution produced on-line with EGⅢ KOH at a flow rate of 1.2 mL/min.TFA was detected by suppressed conductivity with an ASRS 500-4 mm suppressor at a current of 60 mA.The column temperature was set at 30 ℃ and the injection volume was 25 μL.There was a good resolution between trifluoroacetic acid and other components.The calibration curve showed a good linearity(r=0.999 4) in the range of 0.848-6.46 μg/mL.The limit of detection(LOD) was 0.031 8 μg/mL and the limit of quantitation(LOQ) was 0.106 μg/mL.The method has the advantages of simple operation,high sensitivity and good reproducibility,and could be used for the detection of trifluoroacetic acid(TFA) residues in linagliptin drugs.
Key words:ion chromatography with direct conductance;trifluoroacetic acid(TFA);linagliptin
中图分类号:O657.75;TQ460.72
文献标识码:A
文章编号:1004-4957(2015)12-1425-05
doi:10.3969/j.issn.1004-4957.2015.12.017
通讯作者:*周长朋,工程师,研究方向:理化检测及药物分析,Tel:0631-3857373,E-mail:20019568@qq.com
收稿日期:2015-06-11;修回日期:2015-06-29
