老芒麦染色体组型分析
2016-01-27郑慧敏毛培胜黄莺
郑慧敏,毛培胜,黄莺
(中国农业大学动物科技学院草业科学系,草业科学北京市重点实验室,北京 100193)
老芒麦染色体组型分析
郑慧敏,毛培胜*,黄莺
(中国农业大学动物科技学院草业科学系,草业科学北京市重点实验室,北京 100193)
摘要:以老芒麦种子为材料,利用酶解-火焰干燥法来分析有丝分裂中期染色体核型,为老芒麦系统分类及育种工作提供科学依据。研究结果表明,老芒麦染色体数目为28条,13号染色体上有1对随体,臂比值大于2的染色体占7.14%,最长染色体与最短染色体比值为2.04,核型公式是2n=4x=28=24m+4sm(2SAT),不对称类型为2B。细胞有丝分裂呈现出间期、前期、前中期、中期、后期5个不同的时期。在分裂间期,细胞核染色均匀;到分裂前期时可以看到纤细状的网状染色体;进入分裂前中期,可辨别单个染色体;到分裂中期,染色体高度浓缩,姊妹染色单体及着丝点都清晰可辨;在分裂后期,姊妹染色单体分离。
关键词:老芒麦;核型;有丝分裂
DOI:10.11686/cyxb2014371http://cyxb.lzu.edu.cn
郑慧敏,毛培胜,黄莺. 老芒麦染色体组型分析. 草业学报, 2015, 24(8): 225-230.
Zheng H M, Mao P S, Huang Y. Karyotype analysis and mitotic observation ofElymussibiricus. Acta Prataculturae Sinica, 2015, 24(8): 225-230.
收稿日期:2014-09-02;改回日期:2014-10-27
基金项目:十二·五科技支撑课题(2011BAD17B01-02)和草业科学北京市重点实验室共建项目资助。
作者简介:郑慧敏(1991-),女,山东菏泽人,在读硕士。E-mail: zhenghuimin5210@163.com
通讯作者*Corresponding author. E-mail: maops@cau.edu.cn
Karyotype analysis and mitotic observation ofElymussibiricus
ZHENG Hui-Min, MAO Pei-Sheng*, HUANG Ying
DepartmentofGrasslandScience,CollegeofAnimalScienceandTechnology,ChinaAgriculturalUniversity;BeijingKeyLaboratoryofGrasslandScience,Beijing100193,China
Abstract:A study has been undertaken to determine the karyotype of Elymus sibiricus. The results showed that the chromosome number of E. sibiricus was 28, with a pair of satellites on the short arms of the 13thchromosomes. Its karyotype figure is 2n=4x=24m+4sm (2SAT). The percentage of chromosomes with arm ratios over 2 was 7.14%, and the ratio of the longest to the shortest was 2.04. Its karyotype asymmetry is 2B. There were five phases (Interphase, Prophase, Prometaphase, Metaphase and Anaphase) in the process of mitosis. At interphase the nuclei were dyed homogeneously. During prophase the shape of the slender chromosomes was visible. The individual chromosome could be identified clearly in the prometaphase. At metaphase the chromosomes highly concentrated and the chromatids and centromeres were distinctly visible. During anaphase the chromatids separated and moved to the opposite poles.
Key words:Elymus sibiricus; karyotype; mitosis
老芒麦(Elymussibiricus)属于小麦族禾本科披碱草属多年生疏丛型草本植物,具有抗旱、抗寒、耐盐碱及分蘖能力强等特点,大面积应用于天然草地的恢复和人工草地的建植中[1-2]。老芒麦营养物质丰富、适口性好、产量高,是一种适合家畜食用的优良禾草[3]。
部分老芒麦具有抗小麦花叶病和抗大麦锈病等一些优良基因,可以通过杂交和转基因工程将这些基因转入小麦族近缘种中,进而增强被转入基因物种的抗病虫害特性[4]。云锦凤等[5]通过分析杂交后代染色体,探讨了亲本的同源性及杂种优势的利用。李景环等[6]通过比较亲本与子代的染色体组型及子代花粉母细胞减数分裂行为,鉴定了老芒麦与加拿大披碱草(Elymuscanadensis)杂交后代F1的真伪性和不育机理。对老芒麦与近缘种染色体同源性关系的深入研究,可以为育种工作提供大量的有用信息[7]。有丝分裂前期染色质细长,DNA伸展性较好,暴露的碱基对较多,该时期有利于引物原位杂交新技术探测基因位点[8]。因此,对老芒麦进行核型分析及有丝分裂的观察可以为遗传学、染色体工程及细胞分类学等技术应用提供科学依据。
我国学者已在老芒麦品种选育、抗性、生产性能、生理特征等方面开展了相关的研究[9-12]。但是,对于老芒麦的细胞学研究报道较少,并且结果不统一,争议性较大。陈仕勇等[13]研究提出老芒麦的核型公式为2n=4x=28=22m+6sm(2SAT),核型对称性类型为2A。王琴等[14]报道的老芒麦核型公式为2n=4x=28=24m(2SAT)+4sm,核型对称性类型为2B。因此,对老芒麦染色体组型的确定有待进一步研究。
我国老芒麦野生资源丰富,广泛分布于内蒙古、青海、甘肃等地,但是对该资源的搜集及育种工作都较为滞后,到2014年我国仅有8个国家审定品种。针对老芒麦进行核型分析,可以加速该资源的鉴定、保存及利用,为育种工作提供理论基础。故本实验以老芒麦为研究对象,利用酶解-火焰干燥法进行染色体制片,分析核型并观察有丝分裂过程,为老芒麦在披碱草属中的进化分类学地位、杂交育种研究等方面提供细胞学依据。
1材料与方法
1.1 材料
实验材料为老芒麦种子,种子于2013年采集于河北省承德市鱼儿山牧场,由中国农业大学牧草种子实验室提供。
1.2 染色体制片
按照牧草种子检验规程GT/T2930.4-2001的规定,设置老芒麦的生根环境[15]。待根尖长到0.5~2.0 cm时,于培养箱中光照2~3 h后取材,选择生长良好的种子,剪取粗壮正常的根尖0.5 cm左右。将根尖放入2 mmol/L的8-羟基喹啉中,20~25℃条件下预处理4 h,期间更换一次处理液。而后进行固定,先用蒸馏水清洗处理过的根尖至少3次,再置入卡诺固定液(无水乙醇∶冰乙酸=3∶1)中,4℃条件下固定20~21 h。再将根尖放在0.075 mol/L KCl溶液中,前低渗处理30 min。用蒸馏水充分洗净根尖3次,置于有混合酶液(2.5%纤维素酶+1.25%果胶酶)的小培养皿内,20~25℃下酶解2 h 15 min,酶解过程中最好轻轻摇动小培养皿几次,促使酶解反应更加充分。用蒸馏水慢慢冲洗根尖3次,注意完全去除酶解液,再放入蒸馏水中浸泡15 min,完成后低渗过程。进行火焰干燥,清洁载玻片上放上3~5个乳白色根尖,加一滴固定液,迅速用镊子将材料捣碎,将载玻片一端抬起轻轻吹气,使细胞分散成薄薄的一层,将制片在酒精灯上干燥。1%的吉姆萨染液滴在制片上2 h,之后用蒸馏水清洗3遍,晾干。最后镜检,制好的临时玻片在生物显微镜(OLYMPUS BX53,日本株式会社)下观察并拍照。
1.3 核型分析
参考李懋学和陈瑞阳[16]提出的标准,选取102个染色体分散良好的有丝分裂细胞,统计细胞的染色体数目。选取5个清晰的有丝分裂中期细胞,计算核型的各个参数指标,即:
染色体相对长度(%)=染色体个体长度/染色体组总长度×100
臂比=长臂/短臂
染色体长度系数=染色体个体长度/全组染色体平均长度
染色体长度比=最长染色体长度/最短染色体长度
利用SPOT Isight 4.0软件分别测量染色体的长臂与短臂,利用Excel计算出染色体的相对长度、臂比以及染色体长度系数等一系列核型参数。参考Stebbins[17]的核型分类原则,根据染色体长度比和臂比确定核型的不对称性程度。选取具有代表性照片一张,根据核型分析结果,利用VideoTesT-Karyo3.1核型分析软件剪贴染色体,配对制成核型图。绘制出便于观察分析的核型模式图。
1.4 有丝分裂过程观察
根据高等植物有丝分裂各个时期的特点[18-20],观察老芒麦染色体有丝分裂不同时期的细胞,利用生物显微镜(OLYMPUS BX53,日本株式会社)拍照分析。
2结果与分析
2.1 老芒麦根尖染色体数目的确定
根据根尖细胞染色体观察结果,染色体数目在14~56间(表1)。78.43%的细胞染色体数目为28条,染色体数目变化范围在24~29之间,并有少量单倍体和多倍体变异细胞的出现。据此认为老芒麦的染色体数目为28,即2n=28。在染色体数目为28的80个细胞中,发现具有1对随体的细胞77个,所占比例为96%,因此确定老芒麦染色体组含有1对随体染色体。
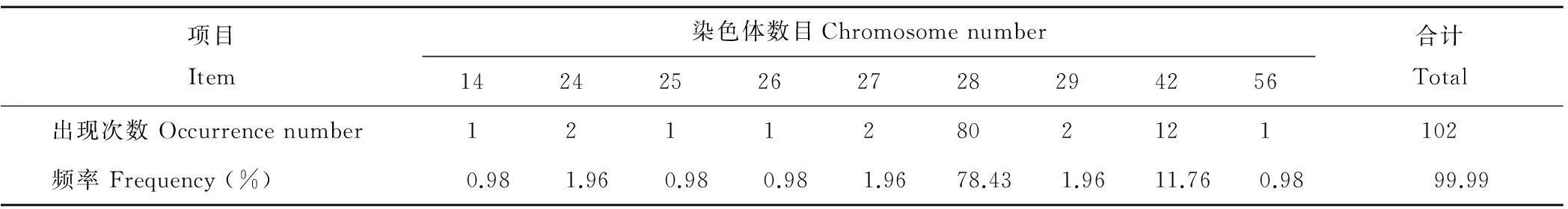
表1 老芒麦根尖细胞染色体数目
2.2 核型分析
老芒麦根尖细胞染色体核型分析结果表明(图1、表2),染色体相对长度变化范围是4.78%~9.73%,由12对中部着丝点区(m)和2对亚中部着丝点区(sm)染色体组成,具有1对随体,位于第13号染色体的短臂上,除第5对和第13对染色体为亚中部着丝点区(sm),其余均为中部着丝点区(m)染色体,其核型公式为2n=4x=24m+4sm(2SAT)。臂比大于2的染色体占染色体总数的7.14%,染色体长度比为2.04。根据Stebbins[17]的核型分类标准,老芒麦的染色体核型类型为2B,属于较为对称型品种(图2)。
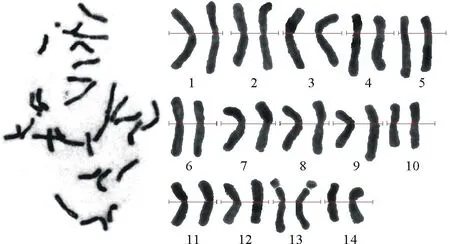
图1 老芒麦染色体组型Fig.1 Karyotype of E. sibiricus
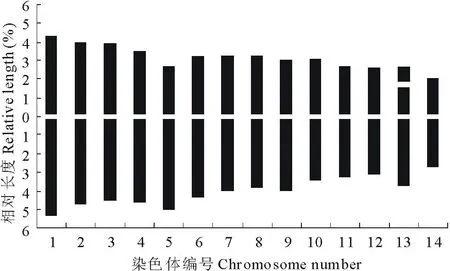
图2 老芒麦核型模式Fig.2 Idiogram of E. sibiricus
2.3 染色体的有丝分裂过程
根据老芒麦根尖细胞染色体有丝分裂观察结果,染色体有丝分裂包括间期、前期、前中期、中期和后期(图3)。间期细胞核染色较为均匀,看不到染色质丝(图3a)。前期隐约可见松散的染色体(图3b)。进入前中期后,染色体进一步缩短变粗,并且单个染色体逐渐变得清晰,但是无法清晰辨别着丝点和姊妹染色单体(图3c)。
在有丝分裂中期,染色体高度螺旋化,着丝点和姊妹染色单体都清晰可见(图3d)。细胞有丝分裂中期染色体本应排列于赤道板中,但是本实验观察到的染色体都凌乱地分布在一个小的区域中,这是由于8-羟基喹啉的作用,妨碍了纺锤丝的形成,使染色体无法正常移动到赤道板上。细胞分裂后期,姊妹染色单体分离,但是实验观察到的染色体没有明显的移向两极的趋势(图3e),可能是试剂处理影响了纺锤丝的作用。
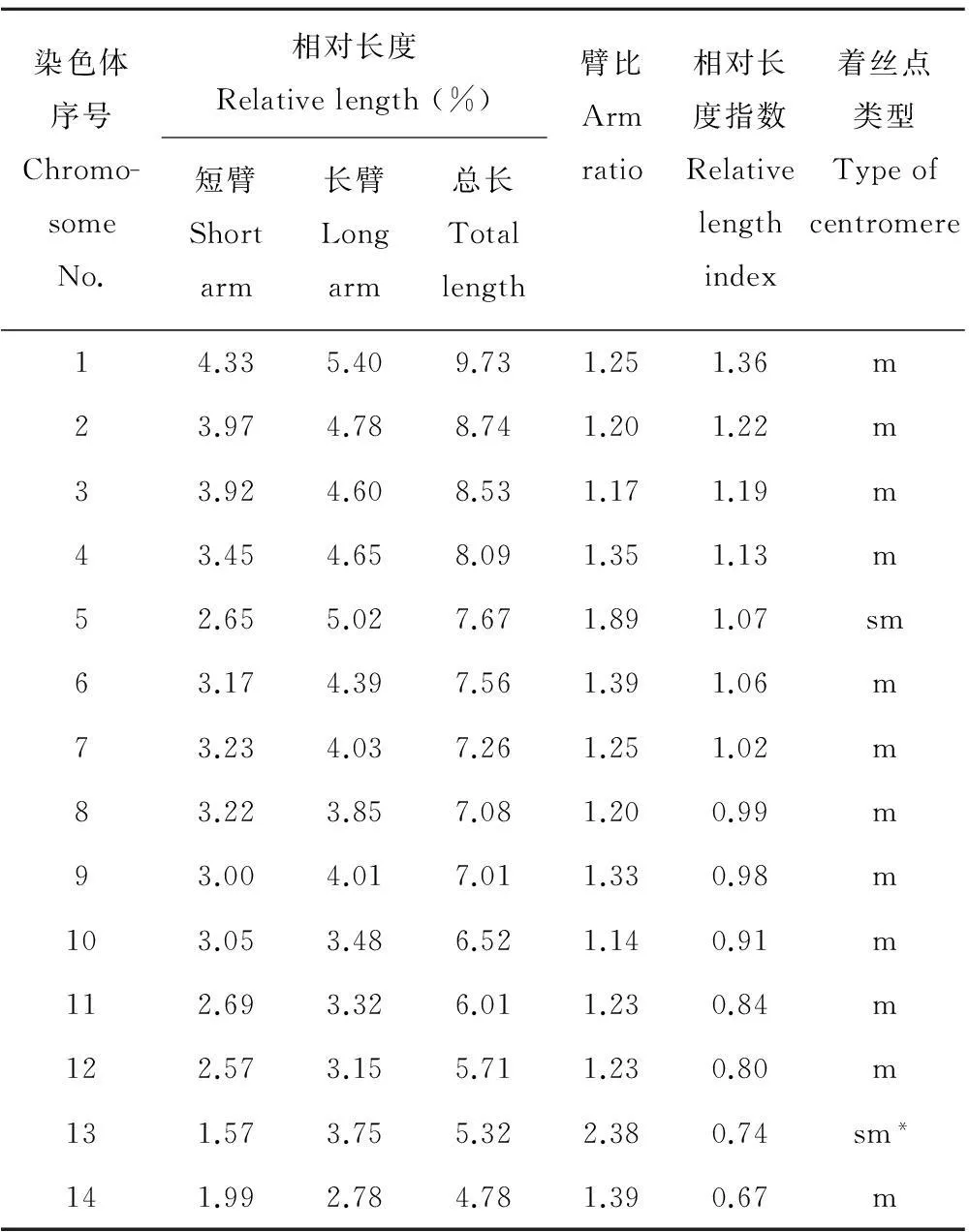
表2 老芒麦核型分析参数
m:中部着丝点区Median region;sm:近中部着丝点区Submedian region;* 带有随体的染色体,随体不计入臂长Chromosome has satellite and satellite were not summed up to the arm length.
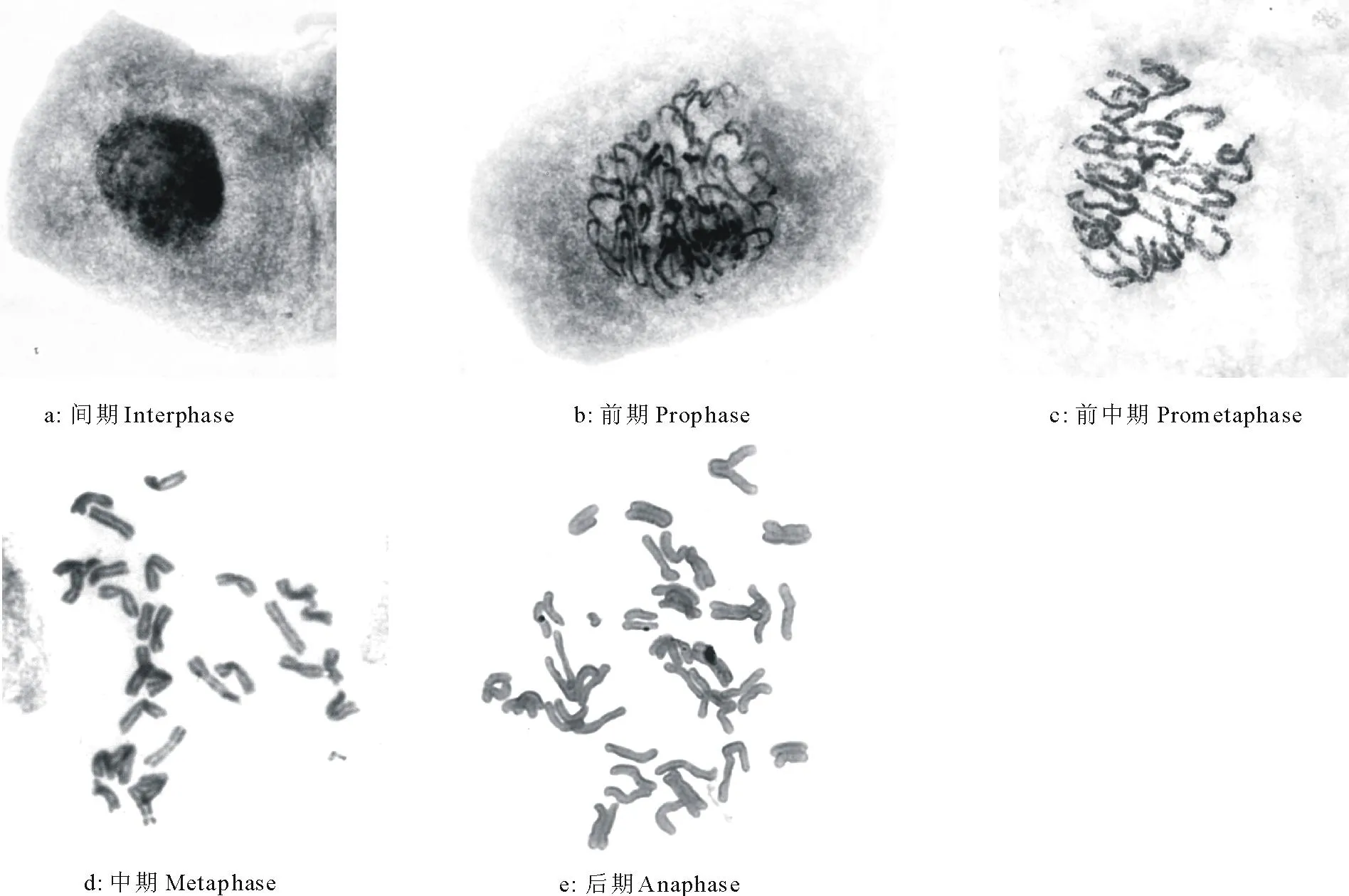
图3 老芒麦有丝分裂过程
3讨论
3.1 染色体数目
本实验中老芒麦染色体数目存在多个变量。在24~26之间的变化可能包含两个原因,一方面是制片时酶解作用使细胞膜崩溃,导致少数染色体丢失;另一方面是老芒麦在生长期间发生了染色体数目的变异,该变异也可能引起染色体数目的增多,即出现染色体数目为29的现象。对于二倍(2n=2x=14)体的出现,有待于进一步研究。据刘玉红[21]报道我国除老芒麦外,其他多数披碱草属植物属于六倍体。本实验中,六倍体(2n=6x=42)细胞出现的情况较多,所占比例达到11.7%,可能是提供的材料不纯,混杂有其他六倍体的披碱草属植物。八倍体(2n=8x=56)细胞的存在也可能有两种原因,一是预处理液有类似于秋水仙素的作用,阻碍了纺锤丝的运动[22];二是细胞膜崩溃的细胞没法给纺锤丝提供发挥作用的环境,进而使细胞的染色体加倍。由于8-羟基喹啉预处理对纺锤丝的作用机理还没有较为权威的报道[23], 因此,对于本实验中多倍体出现的具体原因还需要进一步探索。
老芒麦核型分析中,染色体数目为28的细胞所占比例最高,也符合前人的研究结果,因此,本实验中确定老芒麦的染色体数目为28[24]。
3.2 染色体组型
我国学者从20世纪80年代就开始了对老芒麦核型的分析,刘玉红[21]提出老芒麦核型公式为2n=4x=28=24m+4sm(2SAT),一对随体位于第7号染色体,核型类别为1A。王琴等[14]提出的老芒麦核型公式为2n=4x=28=24m(2SAT)+4sm,核型对称性类型为2B。两者随体位置和对称性类型不同。孙义凯等[25]研究认为老芒麦核型公式为2n=4x=28=20m+8sm(4SAT),两对随体分别位于7和14号染色体上,核型类别为2A。陈仕勇等[13]研究提出老芒麦的核型公式为2n=4x=28=22m+6sm(2SAT),核型对称性类型为2A。多年来各学者针对老芒麦核型分析提出的结果都有较大差异。本实验中老芒麦的核型公式为2n=4x=28=24m+4sm(2SAT),和刘玉红[21]提出的核型公式相同,但是核型对称性有差别。
老芒麦核型结果之间的差异性,可能与实验方法有关,也可能与测量染色体长度时存在的误差有关。严学兵等[26]利用微卫星分子标记技术研究提出,老芒麦的遗传特点和环境因素(经纬度、海拔等)有着密切的关系。鄢家俊等[27]利用RAPD分子标记技术提出,老芒麦的遗传分化和生态地理环境具有一定的相关性。张晓燕等[28]对3份不同来源偃麦草(Elytrigriarepens)种子的核型分析中总结认为,3份材料之间核型都存在一定的差异性,但是染色体数目和着丝点位置的分布比较稳定。因此,老芒麦核型多样性还可能与材料采集地点有关,核型结果在一定的范围内是允许存在差异性的。
References:
[1]Wang X C, Zhang H M, Zhang S L,etal. Analysis of main climatic factors affecting the yield ofElymussibiricuscv. Tongde. Qinghai Prataculture, 2005, 14(3): 13-15.
[2]Li Y H. Region trial report onElymussibiricuscv. Tongde. Qinghai Prataculture, 2007, 16(4): 9-13, 28.
[3]Liu J F, Wang X C, Liu W H,etal. Production performance evaluation of four materials ofElymusin Tongde region. Chinese Journal of Grassland, 2010, 32(6): 81-85.
[4]Yan J J, Bai S Q, Ma X,etal. Genetic diversity ofElymussibiricusand its breeding in China. Chinese Bulletin of Botany, 2007, 24(2): 226-231.
[5]Yun J F, Wang Z L, Du J C. Interspecific hybridization and its cytology ofElymuscanaddensisxE.sibiricus. Grassland of China, 1997, (1): 32-35, 48.
[6]Li J H, Yun J F, Du R S H L,etal. Genetic analysis on chromosome of hybrid F1betweenElymuscanaddensisandElymussibiricus. Agricultural Science and Technology, 2009, 10(5): 67-71.
[7]Lu B R, Liu J H. Genome analysis and biosystematics of the wheat tribe (Triticeae dumort). Chinese Bulletin of Botany, 1992, 9(1): 26-31.
[8]Wu H, Deji B Z, Shang P,etal. Mitosis observation and chromosome karyotype analysis of Tibet chicken. Chinese Journal of Veterinary Medicine, 2014, 41(1): 174-177.
[9]Long X F, Li T Q, Jiang Z R,etal. Research on key technology ofElymussibiricusKangba seed breeding. Prataculture and Animal Husbandry, 2014, (1): 5-12.
[10]Bai S Q, Yan J J, Zhang Y,etal. Comprehensive evaluation on drought-resistance of 9Elymussibiricusnative germplasms resources. Prataculture and Animal Husbandry, 2013, (2): 1-5, 9.
[11]Ji Y J, Wang X C. Effect of balanced fertilizer application on yield of perennial grasses. Chinese Qinghai Journal of Veterinary Sciences, 2011, 41(3): 20-22.
[12]Lu G X, Li X L, Qiao Y M,etal. Effects of seed pelleting on seed germination and physiological indexes of forages. Acta Agrestia Sinca, 2011, 19(3): 451-457.
[13]Chen S Y, Ma X, Zhang X Q,etal. Karyotypes of 10 tetraploid species inElymus(Poaceae: Triticeae). Journal of Systematic and Evolution, 2008, 46(6): 886-890.
[14]Wang Q, Tai L H, Ha S B G,etal. Study on the karyotype analysis and genetic relationship of seven species ofElymusL. Journal of Inner Mongolia Normal University(Natural Science Edition), 2013, 42(2): 192-200.
[15]State Bureau of Quality Technical Supervision. National Standard of the People’s Republic of China, Rules of Forage Seed Testing(GB/T2930.4-2001) [M]. Beijing: Standards Press of China, 2001.
[16]Li M X, Chen R Y. A suggestion on the standardization of karyotype analysis in plants. Journal of Wuhan Botanical Research, 1985, 3(4): 297-302.
[17]Stebbins G L. Chromosomal Evolution in Higher Plants[M]. London: Edward Arnold, 1971: 85-104.
[18]Sun Y, Zhou H, Shi D K. Mitotic division and karyotype analysis of Russian wildrye grass. Acta Agrestia Sinca, 2000, 8(3): 193-197.
[19]Huan J Q, Zhu Y L, Zhang N. Karyotype analysis and mitotic division ofRobiniapseudonacacia. Northern Horticulture, 2009, (9): 83-84.
[20]Lin S. Mitosis observation and comparision of four species. Middle School Biology, 2014, 30(1): 41-42.
[21]Liu Y H. Study on the karyotype of 11 species of fromElymusChina. Journal of Wuhan Botanical Research, 1985, 3(4): 325-330.
[22]Peng J H, Zhang L B, Peng X Y. Research progress of colchicine in ploidy breeding of plant. Hunan Forestry Science and Technology, 2004, 31(5): 22-25.
[23]Li A H, Lu K C. Studies on comparison of four conventional factors for pretreatment. Laboratory Research and Exploration, 2002, 21(5): 94-96.
[24]Dewey D R. Cytogenetics ofElymussibiricusand its hybrids withAgropyrontauri,ElymuscanadensisandAgropyroncaninum. Botanical Gazette, 1974, 135(1): 80-87.
[25]Sun Y K, Zhao Y T, Dong Y C,etal. Karyotypes of eleven species of Triticeae in northern China. Acta Phytotaxonomica Sinica, 1992, 30(4): 342-345.
[26]Yan X B, Guo Y X, Zhou H,etal. Analysis of geographical conditions affected on genetic variation and relationship among population ofElymus. Journal of Plant Resources and Environment, 2006, 15(4): 17-24.
[27]Yan J J, Bai S Q, Zhang X Q,etal. Genetic diversity of wildElymussibiricusgermplasm from the Qinghai-Tibetan Plateau in China detected by SRAP markers. Acta Prataculturae Sinica, 2010, 19(1): 173-183.
[28]Zhang X Y, Mao P S, Meng L,etal. Analysis of chromosome karyotype on three germplasm ofElymusrepens. Acta Prataculturae Sinica, 2011, 20(4): 194-201.
参考文献:
[1]汪新川, 张海梅, 张生莲, 等. 影响同德老芒麦产草量的关键气候因子分析. 青海草业, 2005, 14(3): 13-15.
[2]李永红. 同德短芒披碱草区域试验报告. 青海草业, 2007, 16(4): 9-13, 28.
[3]刘军芳, 汪新川, 刘文辉, 等. 四份披碱草属牧草在同德地区生产性能评价. 中国草地学报, 2010, 32(6): 81-85.
[4]鄢家俊, 白史且, 马啸, 等. 老芒麦遗传多样性及育种研究进展. 植物学通报, 2007, 24(2): 226-231.
[5]云锦凤, 王照兰, 杜建才. 加拿大披碱草与老芒麦种间杂交及F1代细胞学分析. 中国草地, 1997, (1): 32-35, 48.
[6]李景环, 云锦凤, 都日斯哈拉, 等. 加拿大披碱草与老芒麦种间杂种F1的染色体遗传分析. 农业科学与技术, 2009, 10(5): 67-71.
[7]卢宝荣, 刘继红. 染色体组分析及小麦族的系统学. 植物学通报, 1992, 9(1): 26-31.
[8]吴洪, 德吉巴卓, 商鹏, 等. 藏鸡的有丝分裂观察及染色体核型分析. 中国畜牧兽医, 2014, 41(1): 174-177.
[9]龙兴发, 李太强, 蒋忠荣, 等. 康巴老芒麦种子繁育关键技术研究. 草业与畜牧, 2014, (1): 5-12.
[10]白史且, 鄢家俊, 曾怡, 等. 9份野生老芒麦种质资源抗旱性综合评价. 草业与畜牧, 2013, (2): 1-5, 9.
[11]纪亚君, 汪新川. 平衡施肥对多年生禾本科牧草产量的影响. 青海畜牧兽医杂志, 2011, 41(3): 20-22.
[12]芦光新, 李希来, 乔有明, 等. 丸粒化处理对几种牧草种子萌发及生理特性的影响. 草地学报, 2011, 19(3): 451-457.
[13]陈仕勇, 马啸, 张新全, 等. 10个四倍体披碱草属物种的核型. 植物分类学报, 2008, 46(6): 886-890.
[14]王琴, 邰丽华, 哈斯巴根, 等. 披碱草属七种植物核型及其亲缘关系的研究. 内蒙古师范大学学报(自然科学汉文版), 2013, 42(2): 192-200.
[15]国家质量技术监督局. 中华人民共和国国家标准牧草种子检验规程(GB/T2930.4-2001)[M]. 北京: 中国标准出版社, 2001.
[16]李懋学, 陈瑞阳. 关于植物核型分析的标准化问题. 武汉植物学研究, 1985, 3(4): 297-302.
[18]孙彦, 周禾, 史德宽. 新麦草有丝分裂及核型分析. 草地学报, 2000, 8(3): 193-197.
[19]黄健全, 朱延林, 张娜. 二乔刺槐染色体核型分析及有丝分裂过程观察. 北方园艺, 2009, (9): 83-84.
[20]林松. 四种植物细胞有丝分裂的观察与比较. 中学生物学, 2014, 30(1): 41-42.
[21]刘玉红. 我国11种披碱草的核型分析. 武汉植物学研究, 1985, 3(4): 325-330.
[22]彭尽晖, 张良波, 彭晓英. 秋水仙素在植物倍性育种中的应用进展. 湖南林业科技, 2004, 31(5): 22-25.
[23]李爱华, 鲁坤存. 实验室常用预处理因素的比较研究. 实验室研究与探索, 2002, 21(5): 94-96.
[25]孙义凯, 赵毓棠, 董玉琛, 等. 东北地区小麦族11种植物的核型报道. 植物分类学报, 1992, 30(4): 342-345.
[26]严学兵, 郭玉霞, 周禾, 等. 影响披碱草属植物遗传分化和亲缘关系的地理因素分析. 植物资源与环境学报, 2006, 15(4): 17-24.
[27]鄢家俊, 白史且, 张新全, 等. 青藏高原老芒麦种质基于SRAP标记的遗传多样性研究. 草业学报, 2010, 19(1): 173-183.
[28]张晓燕, 毛培春, 孟林, 等. 三份偃麦草种质的染色体核型分析. 草业学报, 2011, 20(4): 194-201.
