不同放牧强度下垂穗披碱草遗传多样性分析
2016-01-27陈钊梁新平侯扶江田苗苗张红瑞余莹管永卓王成章严学兵
陈钊,梁新平,侯扶江,田苗苗,张红瑞,余莹,管永卓,王成章,严学兵*
(1.河南农业大学牧医工程学院,河南 郑州 450002; 2.兰州大学草地农业科技学院,草地农业生态系统国家重点实验室,甘肃 兰州 730020)
不同放牧强度下垂穗披碱草遗传多样性分析
陈钊1,梁新平1,侯扶江2,田苗苗1,张红瑞1,余莹1,管永卓1,王成章1,严学兵1*
(1.河南农业大学牧医工程学院,河南 郑州 450002; 2.兰州大学草地农业科技学院,草地农业生态系统国家重点实验室,甘肃 兰州 730020)
摘要:放牧对草地植物种群遗传与进化产生重要影响,本研究利用SSR分子标记对4个不同放牧强度下垂穗披碱草种群遗传多样性进行研究,试验地选择在甘肃省甘南自治州玛曲县的阿孜试验站,利用8对多态性强的SSR引物对不同放牧压力下4个居群的800个个体基因组进行检测,每个位点的有效等位基因数在1.2267~1.9976之间。利用popgene分析发现不放牧垂穗披碱草种群遗传多样性最高,在3种不同放牧地,中等放牧强度的遗传多样性指数较高,其次为重牧,最后为轻度放牧。在不同放牧干扰下的4个垂穗披碱草种群的遗传分化系数为0.5168,基因流Nm=0.2337,说明4个种群的遗传变异主要发生在种群之间。从种质资源保护角度来讲,不放牧对于垂穗披碱草种质资源的保护是有利的;从草地利用角度,中等放牧强度比较合理。
关键词:遗传多样性;基因流;放牧强度;SSR;披碱草
DOI:10.11686/cyxb2014355http://cyxb.lzu.edu.cn
陈钊,梁新平,侯扶江,田苗苗,张红瑞,余莹,管永卓,王成章,严学兵. 不同放牧强度下垂穗披碱草遗传多样性分析. 草业学报, 2015, 24(8): 159-165.
Chen Z, Liang X P, Hou F J, Tian M M, Zhang H R, Yu Y, Guan Y Z, Wang C Z, Yan X B. Genetic diversity ofElymusnutansunder different grazing intensities. Acta Prataculturae Sinica, 2015, 24(8): 159-165.
收稿日期:2014-08-21;改回日期:2014-12-01
基金项目:国家自然科学基金项目(30901051,31172249)资助。
作者简介:陈钊(1990-),男,河南滑县人,硕士。E-mail:740515547@qq.com
通讯作者*Corresponding author. E-mail:yxbbjzz@163.com
Genetic diversity ofElymusnutansunder different grazing intensities
CHEN Zhao1, LIANG Xin-Ping1, HOU Fu-Jiang2, TIAN Miao-Miao1, ZHANG Hong-Rui1, YU Ying1, GUAN Yong-Zhuo1, WANG Cheng-Zhang1, YAN Xue-Bing1*
1.CollegeofAnimal&VeterinaryScience,HenanAgriculturalUniversity,Zhengzhou450002,China; 2.CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,StateKeyLaboratoryofGrasslandAgro-ecosystems,Lanzhou730020,China
Abstract:Grazing can influence the population genetics and evolution of grassland plant species. To study the relationship between grazing and the potential for evolutionary differentiation and gene flow, we used SSR markers to study the genetic diversity of Elymus nutans. The experiment station investigated is based at Azi, in Maqu County in the Gannan region of Gansu Province. The grazing lands were divided into four levels according to different grazing intensities. Eight pairs of SSR primers were used to detect genetic diversity among 800 individual plants from the four populations under different grazing pressures. The effective number of alleles per locus ranged from 1.2267 to 1.9976. We found that materials under moderate grazing intensity had the highest genetic diversity index, followed by the heavy and then light grazing levels. The genetic differentiation coefficient under different grazing levels is 0.5168. This suggests that genetic variation of the four populations exists mainly among populations. In conclusion, no grazing or enclosure is effective for the conservation of E. nutans genetic resources. For grassland utilization, however, moderate grazing is relatively optimal.
Key words:genetic diversity; gene flow; grazing intensity; SSR; Elymus
草地生态系统是我国最大的绿色屏障,是生态环境的基础,草地对于维护生态平衡,改善生态环境,以及保护人类生存和发展都起着至关重要的作用[1]。我国草地面积占国土总面积的42%,达到4亿hm2。其中可利用的大约为3亿hm2,占国土总面积的1/3。但是近年来由于人们对草原不合理的开发和利用,导致我国草原已经出现了不同程度的退化。其中,不合理的放牧是导致草原退化的主要原因[2]。在相同的气候条件下,放牧干扰因子对草原植物的影响可以超越不同地段其他环境条件的影响,成为影响草原植物群落关系主要影响因子[3]。在放牧过程中,家畜可以通过选择性采食,直接影响某些甚至是某一类植物的种群结构,从而影响或者改变群落结构[4]。放牧强度还会影响到牧区土壤理化性质和土壤热量的流动[5]。改变草地群落组成,草地初级生产力并非随着放牧强度的增加而线性下降[6]。适当的放牧会对草地造成正面的干扰可促进草地物种多样性,加强草地的生产力和群落的稳定性[7]。物种多样性是地球上生物赖以生存的基础,是生物可以适应不同的环境,不断进化和繁衍的物质基础。种群的遗传多样性与种群的进化潜力和对环境的适应性有着密切的联系。遗传多样性是地球上物种多样性的核心和物质基础,也是生物多样性的重要组成部分,更是地球生态系统中各种群落之间可以不断进行物质循环和能量流动的核心。现有的研究多集中在个体和种群水平上的种群动态和物种功能特征,以及在群落水平上的结构及系统功能的影响[8-9]。研究物种的遗传多样性可以从分子角度对物种的种群变化进行深入的探讨。
遗传多样性的研究伴随着分子化学、分子遗传学等学科的迅速发展,科学家可以从不同的层次、不同的角度用不同的技术对物种的遗传信息和生物性状进行研究和推测。近年来分子标记是较为常见的一种方法。SSR(simple sequence repeat,简单序列重复)标记以其多态性高,操作方便,数量丰富和稳定性强等众多优点成为一种较为理想的分子标记方法。SSR在基因组中较为均匀地分布,容易检测,在实验操作过程中进行PCR(polymerase chain reaction,聚合酶链式反应)扩增时对模板DNA的要求不高,只要有少量的DNA模板就能进行高通量的分析[10]。目前,国内外学者已经将DNA分子标记技术应用在了多花黑麦草等牧草育种工作中[11]。可以用来揭示居群之间、品种之间或是个体之间遗传的多样性,重复性较好,近年来逐渐取代了RFLP(restriction fragment length polymorphism,限制性内切酶片段长度多态性),ISSR(inter-simple sequence repeat,简单重复序列区间扩增多态)等分子标记[12]。
垂穗披碱草 (Elymusnutans)主要分布于我国宁夏,甘肃,新疆,内蒙古等省区,抗寒性强,粗蛋白含量较高,属于多年生疏丛型优质牧草[13-14],是草地群落系统的重要组成部分,有着重要的经济价值和生态意义。本实验主要利用分子标记的手段通过对不同放牧强度下垂穗披碱草种群遗传多样性的研究来深入了解放牧与种群进化潜力,分化程度及基因流动的关系。为确定合理有效的放牧方式及治理高寒草地的退化提供一定的依据。
1材料与方法
1.1 试验地概况及设计
本试验是在甘肃省甘南自治州玛曲县的阿孜试验站进行。玛曲县位于黄河上游,甘肃、四川和青海三省的结合部,在青藏高原的东北缘。并位于33°06′30″-34°30′15″ N,100°45′45″—102°29′00″ E,海拔3500 m左右。是黄河中下游地区的天然自然屏障[15],年降水量约为620 mm,全年的平均日照时数为2580 h,1月温度最低是-8.7℃,7月温度达到最高是11.3℃。年均温仅为1.2℃,≥10℃积温持续时期仅有2个月多,此地属于典型高原大陆性气候。植被属于高寒草原类型,全县的草地类型为高寒草甸草地和山地草甸草地[16]。根据放牧强度的不同,4个草场进行不同强度放牧处理已达3年,把放牧地分为4种强度的放牧地:封育草地不进行放牧作为对照(control,CK),放牧强度为4只羊/hm2是轻度放牧(light grazing,LG),放牧强度为8只羊/hm2是中度放牧(medium grazing,MG),放牧强度为16只羊/hm2是重度放牧(high grazing,HG),轮牧周期是45 d,放牧期是7 d左右。在每一个放牧小区随机采收成熟的种子穗80个(实验种植40株),单株的植物距离不小于5 m(防止采集到同一植株不同个体即克隆单株),每一个种子穗放入一个信封中标记,在烘箱中50℃烘干(防止部分种子过潮不利于携带)带回实验室。
1.2 实验方法
将垂穗披碱草种子在烘箱中50~55℃的温度处理,大约5~6 d的时间以打破种子的休眠作用。然后将种子种在一次性花盆中,浇水,在未发芽前以光照25℃18 h,黑暗20℃6 h用光照培养箱培养,种子发芽后以光照26℃12 h,黑暗20℃12 h进行培养。幼苗在1个月左右时即可长至两叶一心,此时的幼苗就可以用于DNA的提取。

表1 本研究中所用SSR引物序列
本实验提取垂穗披碱草的基因组用的是经过改进后的CTAB(cetyltriethy lammoniurn bromide,十六烷基三甲基溴化铵)法[17],通过分光光度计和琼脂糖跑胶来鉴别提取基因组的纯度。将提取的基因组进行PCR反映,PCR体系为20 μL体系。模板为1 μL,引物各1 μL,ddH2O为7 μL,mix为10 μL[10 mmol/L Tris-HCl(pH=8.3),50 mmol/L KCl,1.5 mmol/L MgCl2,250 μmol/L DNTP,0.05 U/μL Polymerase]。PCR反应程序为94℃预变性4 min,94℃变性30 s,退火温度在50~55℃之间40 s,72℃延伸30 s,72℃延伸10 min,循环数为36。本实验引物具体信息如表1和表2。将PCR扩增产物首先用1%琼脂糖凝胶电泳,确定PCR扩增产物存在,然后再用6%聚丙烯酰胺凝胶进行电泳。
1.3 数据分析
经过银染后的聚丙烯酰胺胶可以直接在观片灯下读取,SSR是共显性标记,可以根据条带的类型直接读出基因型为杂合或者是纯合,基因类型用AA,BB,AB来标记,形成原始数据,每一对等位基因视为一个多态性位点(图1)。遗传多样性指数(有效等位基因[18]、Shannon’s信息指数[19]、有效种群大小、Nei’s指数)及基因流[Nm=Gene flow estimated from Fst=0.25(1-Fst)/Fst]采用Popgene V.1.32进行分析。
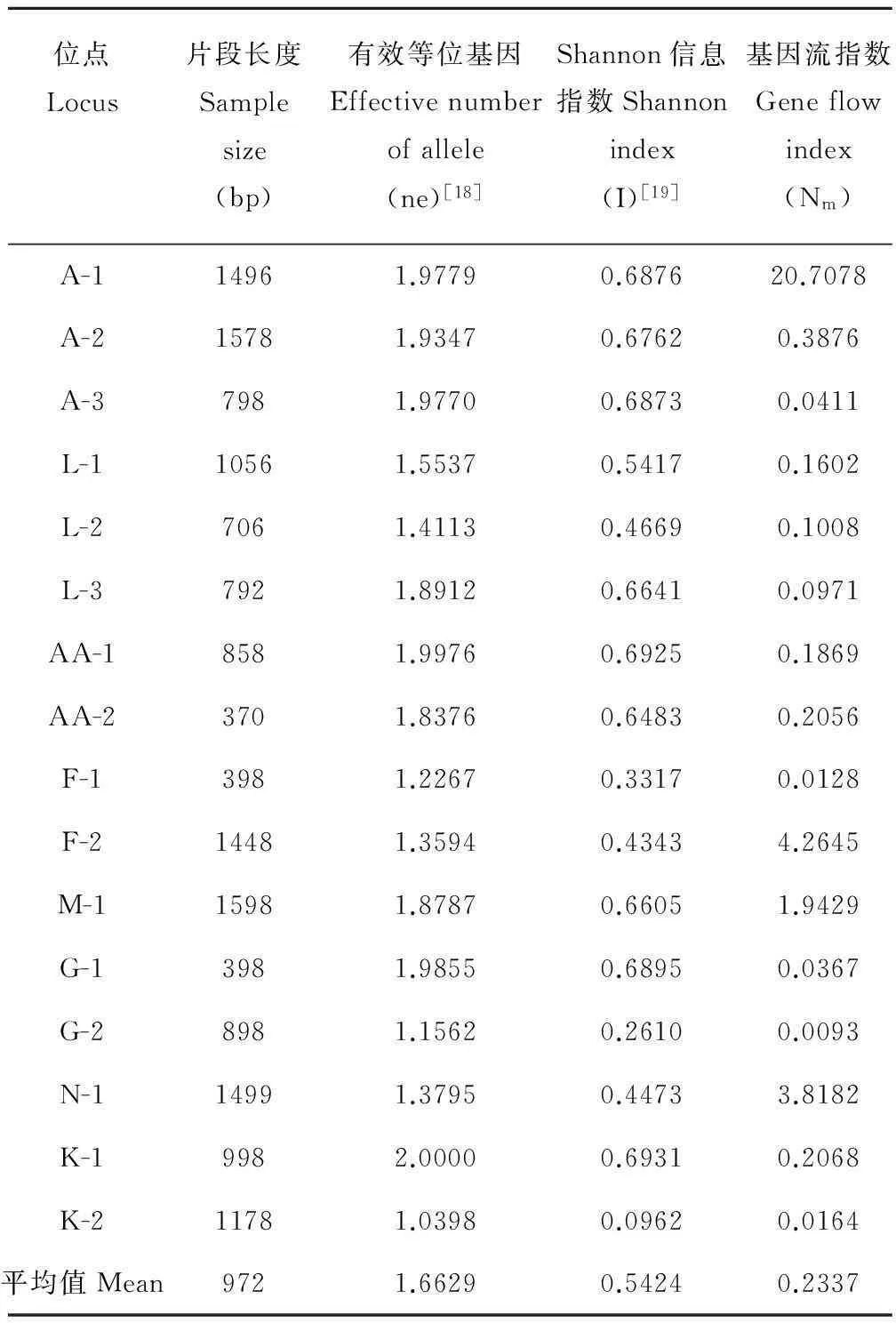
表2 SSR-PCR位点遗传多态性

图1 部分垂穗披碱草LG组SSR-PCR扩增结果Fig.1 PACG gel with results of SSR-PCR bands from LG in different Elymus populations
2结果与分析
2.1 SSR-PCR扩增位点遗传多样性分析
种群遗传多样性的研究,通常是以Shannon信息指数,有效等位基因数等来衡量其水平。本研究通过SSR-PCR的引物筛选试验,挑选出的8对引物共扩增出16个位点,引物ECGT36对应A-1到A-3,EAGA104对应L-1到L-3,ECGA114对应AA-1和AA-2,ECGA22对应F-1和F-2,EAGA101对应M-1,EAGA13对应G-1和G-2,EAGA103对应N-1,EAGA104对应K-1和K-2。每对引物检测出的位点数不同,其中引物ECGT36,EAGA104扩增出的位点最多,检测到3个位点;EAGA101和EAGA103扩增出的位点最少,检测到1个位点(图1)。所有位点的多态性均为100%,说明实验材料的遗传多态性较为丰富。扩增片段的长度在370~1598 bp之间,位点EAGA101的M-1扩增片段最大为1598 bp,AA-2(ECGA114)扩增片段最小为370 bp。利用8对SSR引物对不同放牧压力下4个居群的800个个体遗传多样性进行检测,每个位点的有效等位基因数在1.2267~1.9976之间,其中位点AA-1的有效等位基因数最高是2.0000,最低的是K-2,为1.0398(表2)。
2.2 遗传多样性分析
在不同放牧压力下的4个垂穗披碱草居群通过SSR-PCR扩增出条带的多态性随着放牧压力的增大呈下降的趋势,对照组的多态性最高为100%,在重度放牧干扰下的垂穗披碱草的位点多态性比率为43.75%,是4个居群中最低的一组。有效等位基因数(Ne),Nei’s遗传多样性(H)和Shannon信息指数(I)表现出一致性,在不放牧条件下均表现出最高的趋势,Ne是1.7100,H是0.3919,I是0.5702。在放牧条件下,中度放牧干扰下垂穗披碱草的Shannon信息指数及有效等位基因数最高,即在中度放牧条件干扰下的垂穗披碱草种群的进化潜力及基因的多样性都是最高。轻度放牧的有效等位基因数和Shannon信息指数是最低的(表3)。与对照组相比,LG组,MG组和HG组的Nei’s遗传多样性(H)和Shannon信息指数(I)分别降低了42.3%,22.0%,23.8%,37.7%,18.6% 和19.4%。在放牧地中,中等放牧强度的遗传多样性指数较高,其次为重牧,最后为轻度放牧。这说明放牧干扰会明显地影响到垂穗披碱草的遗传多样性,对于垂穗披碱草的进化和生存有着较大的干扰作用。不放牧条件下有利于垂穗披碱草遗传多样性的维持,在草地放牧条件下,中度放牧对于维持垂穗披碱草的遗传多样性是最有利的。
2.3 遗传相似性和遗传距离的分析
不同居群间的遗传距离和遗传相似性可以反映出各居群间的亲缘关系以及遗传背景的差异性,遗传距离和遗传相似性呈负相关性,遗传距离越大,说明居群间的亲缘关系越远,遗传相似性也就越低,反之亦然。由表4可以看出,中度放牧区和轻度放牧区的遗传相似度最大,为0.7901,重度放牧和中度放牧的遗传相似性最小,为0.5244。轻度放牧和对照组的遗传相似度是0.7446,重度放牧和对照组的遗传相似度是0.6913,重度放牧和轻度放牧的遗传相似系数是0.5965。重度放牧和对照组的遗传相似度是0.5544。
在不同放牧强度干扰下的垂穗披碱草,重度放牧和中度放牧的遗传距离最大,为0.6456,轻度放牧和中度放牧的遗传距离最小,为0.2356,对照组与轻度放牧的遗传距离是0.2949,对照组与中度放牧的遗传距离是0.3691,对照组与重度放牧组的遗传距离是0.5899,轻度放牧组与重度放牧组的遗传距离是0.5166。
根据遗传距离,对不同放牧压力下的垂穗披碱草材料的SSR数据进行聚类分析,构建了垂穗披碱草的UPGMA系统树(图2)。从聚类分析图上可以看出,轻度放牧和中度放牧先聚为一类,然后与对照组聚为一类,最后与重度放牧聚为一类。
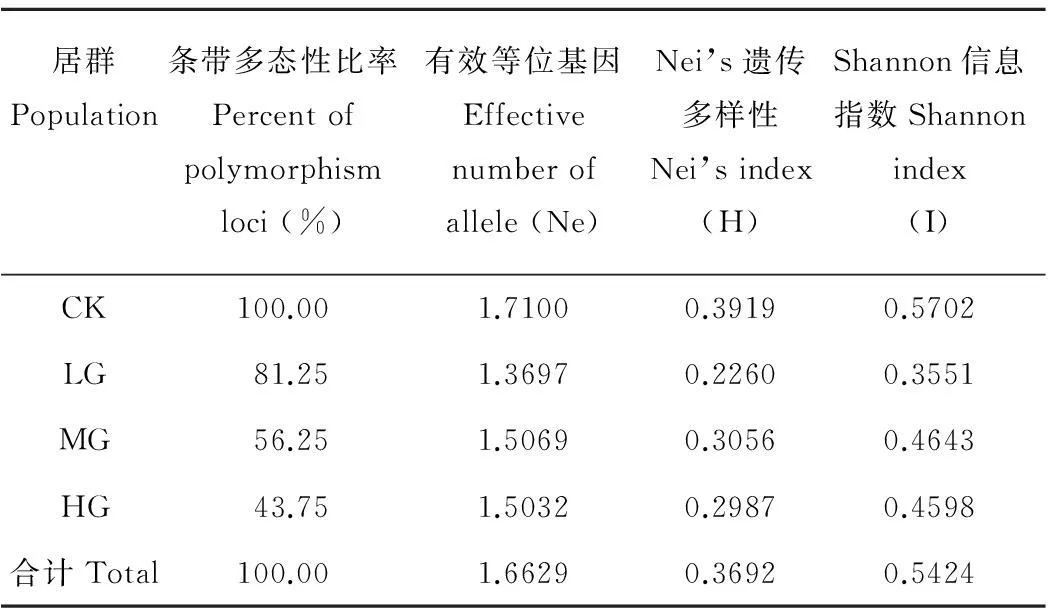
表3 不同放牧条件下垂穗披碱草的遗传多样性指数
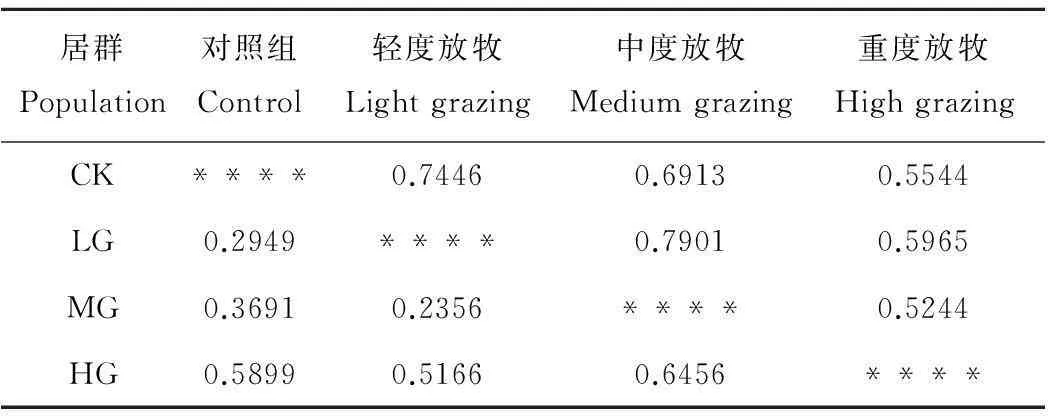
表4 不同放牧强度干扰下垂穗披碱草种群
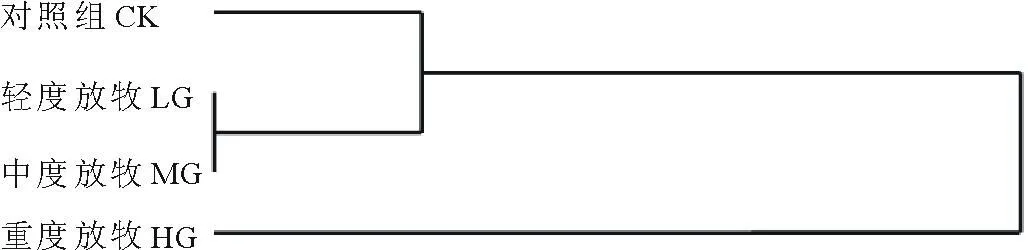
图2 不同放牧条件种群的聚类分析Fig.2 Clustering of populations under different grazing intensity
上三角为Nei’s遗传相似性,下三角为Nei’s遗传距离。Nei’s genetic identity (above diagonal) and genetic distance(below diagonal). 2.4遗传分化系数和基因流分析
不同放牧压力下的4个垂穗披碱草种群间的遗传分化系数Fst为51.68%,不同居群总的遗传分化系数为0.4018,种群间的基因流为0.2337(表5)。说明种群间的基因流较小,即种群间的遗传变异较大。不同居群的遗传分化有51.68%发生在种群之间,本实验的结果符合垂穗披碱草是自花授粉植物的特质。Nei[20]认为:自花授粉的植物种群间的基因流Nm<1。
3讨论
不同放牧强度下垂穗披碱草种群的遗传多样性结果表明,在放牧条件下,中度放牧干扰下种群遗传多样性最高,其次是重度放牧,轻度放牧条件下种群的遗传多样性最低。物种遗传多样性的高低可以反映该物种或种群对环境的适应能力以及本身的进化
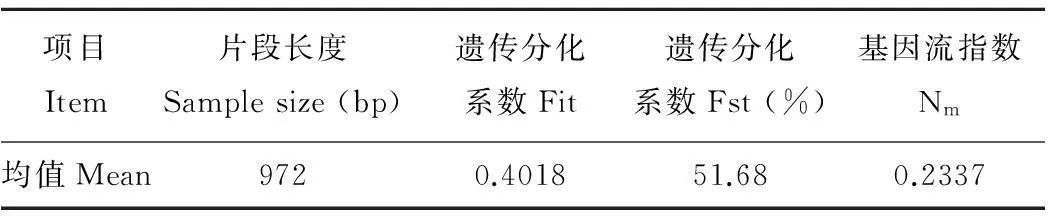
表5 处理组间的遗传分化系数与基因流
潜力和该种群的稳定性。物种的遗传多样性越高,其对环境变化的适应性就越强[21]。这一结果与前人的研究结果较为相似[22-23],蒙旭辉等[22]的研究表明在中度放牧条件下放牧群落的多样性指数要显著地高于其他放牧干扰群落,中度放牧强度最为适宜草地群落类型。殷国梅等[24]的研究表明在不同的放牧强度干扰下,适度放牧可以使群落保持较高的密度和盖度,群落较为稳定,既可保证草地有一定的载畜量,又可以保持草地群落的稳定性。本实验结果说明放牧干扰对种群的遗传多样性有着明显的影响并且在中度放牧条件下有利于维持物种的进化潜力和稳定性。这一结果也符合“中度干扰理论”[24-25]。原因可能是由于在重度放牧条件下,家畜的反复啃食会严重影响垂穗披碱草植株的正常生长,植物本身不能进行正常的开花,结果,导致植物个体间及种群内的基因流动较小。放牧强度的差异进而导致群落中优势种群的地位发生逐渐的变化[26]。而在轻度放牧条件下,由于牲畜的选择性采食可能会降低垂穗披碱草在群落中的地位,群落中不同物种的竞争压力影响到垂穗披碱草本身的遗传多样性。轻牧条件下,家畜携带种子造成的基因流动较小,导致轻度放牧的遗传多样性最低。对照组的遗传多样性最高这一结果可能与试验地本身的封育时间有关。适宜的放牧强度能够维持较高的地上生物量。不同强度的放牧干扰对物种多样性的影响不同,适度放牧可以增加群落的多样性, 而长期的过度放牧或者完全不放牧都将导致群落多样性降低[27]。
本研究的4个在不同放牧强度干扰条件下的垂穗披碱草种群的遗传分化系数为51.68%,基因流Nm=0.2337,说明4个种群的遗传变异主要发生在种群之间。基因流较小,说明4个种群间很少发生基因流动,这一方面可能与垂穗披碱草本身是自花授粉有关。种群之间很难通过花粉传播发生基因流动。另一方面也说明放牧干扰可以明显地影响到植物种群的遗传变化,基因流是影响自然植物种群间遗传变异的关键因素。种群间高的基因流可以降低物种的遗传分化并保持其完整性。在植物种群中,基因流一般通过种子或花粉进行传播,适量基因流可以有效地促进居群地方性适应以及多样化[28]。本实验中的基因流较低, 低水平的基因流可以促进居群对环境的适应性,进而造成种群之间的遗传分化。高水平的基因流可以防止居群的分化。
References:
[1]Wang Q, Yang J P. Degeneration and index system of ecological safety of Chinese grassland. Journal of Soil and Water, 2008, (6):27-31.
[2]Wu G L, Du G Z. Discussion on ecological construction and sustainable development of degraded alpine grassland ecosystem of Qinghai-Tibetan Plateau. Chinese Journal of Nature, 2007, 29(3):159-164.
[3]Li J H, Li Z Q. The effects of grazing on grassland plants. Acta Prataculturae Sinica, 2002, 11(1):4-11.
[4]Diaz S, Lavorel S, Mclntyre S U E,etal. Plant trait responses to grazing-a global synthesis. Global Change Biology, 2007, 13(2): 313-341.
[5]Gan L, Peng X, Peth S,etal. Effects of grazing intensity on soil thermal properties and heat flux underLeymuschinensisandStipagrandisvegetation in Inner Mongolia, China. Soil and Tillage Research, 2012, 118: 147-158.
[6]Yang S J, Li T, Gan Y M,etal. Impact of different use patterns and degrees of grassland use on vegetation carbon storage in the Aba grassland pastoral area. Acta Prataculturae Sinica, 2014, 23(3):325-332.
[7]Yuan J L, Jiang X L, Huang W B,etal. Effects of grazing intensity and grazing season on plant species diversity in alpine meadow. Acta Prataculturae Sinica, 2004, 13(3):16-21.
[8]Grime J P. Control of species diversity in herbaceous vegetation. Journal of Environmental Management, 2005, 40(1): 124-138.
[9]Sternberg M, Gutman M, Perevolotsky A,etal. Vegetation response to grazing management in a Mediterranean herbaceous community: a functional group approach. Journal of Applied Ecology, 2000, 37(2): 224-237.
[10]Qian X J. Development of Chromosome-specific SSR Markers fromBrassicarapa[D]. Wuhan: Huazhong Agricultural University, 2009.
[11]Wang S F, Huang L K, Zhang X Q,etal. The genetic variation revealed by SSR market in crossbreeding groups of annual ryegrass after continuous mass selection. Acta Prataculturae Sinica, 2014, 23(5):345-351.
[12]Fang X Y, Wu W R, Tang J L,etal. DNA Mark Assisted Breeding for Crop[M]. Beijing: Science Press, 2001.
[13]Yuan C G. The high quality forage on Tibetan Plateau-E.nutans. Prataculturae & Animal Husbandry, 2005, 10: 62.
[14]Zhou Y H, Zheng Y L, Yang J L,etal. Phylogenetic relationships among tenElymusspecies based on random amplified polymorphic DNA. Acta Phytotaxonmica Sinica, 1999, 37(5):425-432.
[15]Li W L, Xue Z Z, Guo S M,etal. Vegetation coverage changes and analysis of the driving forces in Maqu country based on 3S technology. Journal of Lanzhou University (Natural Sciences), 2010, (1):85-90.
[16]Dong G S. Study on integrated methods to control rodents in grassland in Maqu country. Qinghai Prataculturae, 2004, (2):11-13.
[17]Liu Q L. The Study of Molecular Phylogeny and Evolution forElymusL[D]. Shanghai: Fudan University, 2005.
[18]Kimura M, Crow J F. The number of alleles that can be maintained in a finite population. Genetics, 1964, 49(4): 725.
[19]Lewontin R C. The problem of genetic diversity. Harvey Lectures, 1973, 70: 1-20.
[20]Nei M. Analysis of gene diversity in subdivided populations. Proceedings of the National Academy of Sciences, 1973, 70(12): 3321-3323.
[21]Ji W Z, Su B. The Principle and Method of the Study of Genetic Diversity[M]. Hangzhou: Zhejiang Science & Technology Press, 1999.
[22]Meng X H, Li X L, Xin X P,etal. Study on community characteristics and diversity under different grazing intensity onLeymuschinensisTzvel. meadow steppe of Hulunbeier. Acta Prataculturae Sinica, 1996, 5(3):28-33.
[23]Wang D L, Lu X L, Luo W D. Analysis to effects of different grazing density on characteristics of rangeland vegetation. Acta Prataculturae Sinica, 1996, 5(3):28-33.
[24]Yin G M, Liu Y Z, A L T,etal. The study about biological characteristics ofAgmpyronGaerth. Inner Mongolia Prataculturae, 2006, 18(1):1-5.
[25]Foster B L, Gross K L. Species richness in a successional grassland: effects of nitrogen enrichment and plant litter. Ecology, 1998, 79(8): 2593-2602.
[26]Noy-Meir I. Compensating growth of grazed plants and its relevance to the use of rangelands. Ecological Applications, 1993, 3(1): 32-34.
[27]Liu T, Gan Y M, Zhang H X. A study on the appropriate stocking capacity under group-household management on the Hong yuan grasslands in north-western Sichuan. Acta Prataculturae Sinica, 2014, 23(3):197-204.
[28]Qu R Z, Hou L, Lv H L,etal. The gene flow of population genetic structure. Hereditas, 2004, 26(3):380-382.
参考文献:
[1]王强, 杨京平. 我国草地退化及其生态安全评价指标体系的探索. 水土保持学报, 2008, (6): 27-31.
[2]武高林, 杜国祯. 青藏高原退化高寒草地生态系统恢复和可持续发展探讨. 自然杂志, 2007, 29(3): 159-164.
[3]李金花, 李镇清. 放牧对草原植物的影响. 草业学报, 2002, 11(1): 4-11.
[6]杨树晶, 李涛, 干友民, 等. 阿坝牧区草地不同利用方式与程度对植被碳含量的影响. 草业学报, 2014, 23(3): 325-332.
[7]袁建立, 江小蕾, 黄文冰, 等. 放牧季节及放牧强度对高寒草地植物多样性的影响. 草业学报, 2004, 13(3): 16-21.
[10]钱晓菊. 白菜染色体特异性 SSR 分子标记的开发[D]. 武汉: 华中农业大学, 2009.
[11]王绍飞, 黄琳凯, 张新全, 等. 连续混合选择下多花黑麦草杂交群体的SSR多样性变化. 草业学报, 2014, 23(5): 345-351.
[12]方宣钧, 吴为人, 唐纪良, 等. 作物 DNA 标记辅助育种[M]. 北京: 科学出版社, 2001.
[13]袁春光. 青藏高原野生优质牧草: 垂穗披碱草. 草业与畜牧, 2005, (10):62.
[14]周永红, 郑有良, 杨俊良, 等. 10种披碱草属植物的RAPD分析及其系统学意义. 植物分类学报, 1999,37(5):425-432.
[15]李文龙, 薛中正, 郭述茂, 等. 基于3S技术的玛曲县草地植被覆盖度变化及其驱动力. 兰州大学学报: 自然科学版, 2010,(1): 85-90.
[16]董高生.玛曲县鼠害草地综合治理途径的研究.青海草业,2004,(2):11-13.
[17]刘全兰. 小麦族披碱草属(ElymusL.)的分子系统发育与进化研究[D]. 上海: 复旦大学, 2005.
[21]季维智, 宿兵.遗传多样性研究的原理与方法[M]. 杭州: 浙江科学技术出版社, 1999.
[22]蒙旭辉, 李向林, 辛晓平, 等. 不同放牧强度下羊草草甸草原群落特征及多样性分析. 草地学报, 2009, 17(2): 239-244.
[23]王德利, 吕新龙, 罗卫东. 不同放牧密度对草原植被特征的影响分析. 草业学报, 1996,5(3): 28-33.
[24]殷国梅, 刘永志, 阿拉塔, 等. “蒙农杂种” 冰草的生物学特性初探. 内蒙古草业, 2006, 18(1): 1-5.
[27]刘焘, 干友民, 张洪轩. 川西北红原草地在联户经营下的适宜载畜量研究. 草业学报, 2014,23(3): 197-204.
[28]曲若竹, 侯林, 吕红丽, 等. 群体遗传结构中的基因流. 遗传, 2004, 26(3): 380-382.
