不同水分环境下小麦粒重QTL定位及遗传分析
2016-01-27胡亮亮叶亚琼吕婷婷栗孟飞刘媛常磊柴守玺杨德龙
胡亮亮,叶亚琼,吕婷婷,栗孟飞,刘媛,常磊,柴守玺,杨德龙*
(1.甘肃省干旱生境作物学重点实验室,甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃农业大学农学院,甘肃 兰州730070)
不同水分环境下小麦粒重QTL定位及遗传分析
胡亮亮1,叶亚琼1,吕婷婷1,栗孟飞1,刘媛1,常磊2,柴守玺2,杨德龙1*
(1.甘肃省干旱生境作物学重点实验室,甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃农业大学农学院,甘肃 兰州730070)
摘要:为探讨小麦千粒重(TGW)分子数量性状遗传,及QTL与水分环境互作关系,本文以抗旱性强的冬小麦品种陇鉴19与水地高产品种Q9086杂交创建的重组近交系(recombinant inbred lines,RIL)群体120个株系为供试材料,采用条件复合区间作图法对3个环境不同水分条件下TGW进行QTL定位和遗传分析。结果表明,小麦RIL群体TGW对水分环境反应敏感,群体中各株系呈现广泛变异和超亲分离,属于微效多基因控制的复杂数量性状,易受水分环境影响。共检测到19个和38对控制TGW的加性QTL(A-QTL)和上位性QTL(AA-QTL),分布在除1A、3B、4D和6A以外的其他17条染色体上。这些A-QTL和AA-QTL表达通过正向或负向调控影响TGW表型变异,贡献率分别在1.24%~10.94%和0.38%~2.89%。发现了3个多环境均能稳定表达的A-QTL(Qtgw.acs-1B.1,Qtgw.acs-2A.1和Qtgw.acs-4A.1),以及4个A-QTL热点区域 [Xmag2064-Xbarc181(1B),Xwmc522-Xgwn122(2A),Xwmc446-Xgwm610(4A)和Xwmc603-Xbarc195(7A)]。所检测到的A-QTL和AA-QTL与干旱胁迫环境互作普遍负向调控TGW表型。加性效应和加性与环境的互作效应是决定小麦TGW的主要遗传因子。在干旱胁迫条件下,这种遗传主效应均不同程度降低TGW表型。本研究结果可为小麦抗旱遗传改良和分子标记辅助选择育种奠定理论基础。
关键词:小麦;干旱胁迫;千粒重;QTL定位;环境互作
DOI:10.11686/cyxb2015071http://cyxb.lzu.edu.cn
胡亮亮,叶亚琼,吕婷婷,栗孟飞,刘媛,常磊,柴守玺,杨德龙. 不同水分环境下小麦粒重QTL定位及遗传分析. 草业学报, 2015, 24(8): 118-129.
Hu L L, Ye Y Q, Lv T T, Li M F, Liu Y, Chang L, Chai S X, Yang D L. QTL mapping and genetic analysis for grain weight in wheat (Triticumaestivum) under different water environments. Acta Prataculturae Sinica, 2015, 24(8): 118-129.
收稿日期:2015-02-05;改回日期:2015-04-20
基金项目:国家自然科学基金项目(31460348,30960195),陇原青年创新人才扶持计划,甘肃农业大学“伏羲人才”计划(FXRC20130102),公益性行业(农业)科研专项(201303104)和甘肃省干旱生境作物学重点实验室开放基金项目(GSCS-2010-04)资助。
作者简介:胡亮亮(1990-),男,河南安阳人,在读硕士。E-mail:hu931629850@163.com
通讯作者*Corresponding author. E-mail: yangdl@gsau.edu.cn
QTL mapping and genetic analysis for grain weight in wheat (Triticumaestivum) under different water environments
HU Liang-Liang1, YE Ya-Qiong1, LV Ting-Ting1, LI Meng-Fei1, LIU Yuan1, CHANG Lei2, CHAI Shou-Xi2, YANG De-Long1*
1.GansuProvincialKeyLabofAridlandCropScience,CollegeofLifeScienceandTechnology,GansuAgriculturalUniversity,Lanzhou730070,China; 2.CollegeofAgronomy,GansuAgriculturalUniversity,Lanzhou730070,China
Abstract:To better understand the molecular quantitative genetic and QTL patterns affecting thousand-grain weight (TGW) in wheat (Triticum aestivum) in different water environments, QTL mapping and genetic analysis were performed for TGW using a mixed linear model approach. TGW was evaluated for recombinant inbred lines (RIL) with 120 progenies from a cross between Longjian 19 (drought tolerant) and Q9086 (drought sensitive) under different water regimes in three environments. Phenotypic expression of TGW in the RILs was highly sensitive to water status and showed wide variation and transgressive segregation. TGW was found to be subject to complex quantitative genetic regulation by minor-effect polygenes, which were easily affected by water environments. A total of 19 additive QTL (A-QTL) and 38 pairs of epistatic QTL (AA-QTLs) were detected for TGW in wheat, distributed on all chromosomes including 1A, 3B, 4D and 6A. Expression of these QTLs influenced the phenotypic variation of TGW resulting in both up- and down-regulation. The magnitude of these effects on TGW ranged from 1.24%-10.94% and 0.38%-2.89%, respectively. Three A-QTLs, Qtgw.acs-1B.1, Qtgw.acs-2A.1 and Qtgw.acs-4A.1, were detected in multiple environments. In addition, four A-QTL hot-spot regions for TGW were also found at some specific locations, e.g., Xmag2064-Xbarc181 on chromosome 1B, Xwmc522-Xgwn122 on chromosome 2A, Xwmc446-Xgwm610 on chromosome 4A and Xwmc603-Xbarc195 on chromosome 7A. Most of the interaction effects of A-QTLs and AA-QTLs associated with drought-stressed environments were linked to down-regulation of the TGW variations. The additive and the additive×environment interaction effects may be the main genetic factors in TGW inheritance, and if so their expression would decrease TGW. The findings of this study should be useful for the genetic improvement of drought tolerance using molecular marker-assisted selection in wheat.
Key words:wheat (Triticum aestivum); drought stress; thousand-grain weight; QTL mapping; environmental interaction
小麦(Triticumaestivum)产量主要由单位面积穗数、穗粒数和粒重直接决定,且各要素与产量的关系比较复杂。小麦穗粒数的增加是建立在穗数减少的基础上的,而粒重的增加则是相对独立的[1];在穗数和穗粒数一定的条件下,粒重对小麦产量提高有着至关重要的作用[1-2]。尤其在高水肥条件下,粒重表型具有较高稳定性和遗传力(0.59~0.80)[3-4],表现出与产量显著的正相关性,是小麦高产育种的重要选择指标[3-5]。然而,在干旱胁迫条件下,小麦自身通过不同程度地降低粒重等产量相关因子,来缓解干旱胁迫对植株体的伤害,最大限度地维系生存和繁殖后代,表现出对水分环境显著的弹性适应和较低的遗传力(0.35~0.63)[6-8]。这为小麦粒重抗旱常规选择育种带来较大的困难。因此,研究小麦粒重抗旱遗传特性,对提高小麦粒重遗传改良效率和精确性具有重要的意义。
现代分子数量遗传学研究表明,小麦粒重属于典型的微效多基因控制的数量性状,易受环境影响[4-9]。据前人研究,小麦粒重主要受加性效应控制[3],其加性QTL(A-QTL)在小麦21条染色体上均有分布,这些位点依据不同作图群体和环境,可解释粒重表型变异的1.70%~44.15%[4-6,8-23],普遍与控制籽粒大小和产量相关农艺性状QTL重叠或共享相近的染色体区间[8,11,13-15,21-22]。此外,在1A[4,12-13]、1B[9,23]、2A[9,23]、2B[4,11,13]、2D[13,19]、3B[9]、3D[12]、4B[12]、5B[11,13,16]和7A[4,11]上检测到多环境均能稳定表达的A-QTL,这些主效QTL位点表达对控制粒重表型遗传变异具有重要作用。通过遗传互作分析发现,控制粒重的QTL存在显著的上位性效应,及其与环境互作效应[6,8,10,21-22],一些QTL的互作效应显著大于加性效应[6,8,10,22],这些非加性遗传效应在控制小麦粒重遗传中不容忽视。由此看出,小麦粒重遗传基础非常复杂,已有的研究普遍存在不同遗传背景群体和不同的环境检测出控制小麦粒重的QTL数目、染色体区域和效应大小有较大差异。而且,目前有关针对小麦粒重抗旱QTL定位和遗传剖析方面的研究甚少。因此,利用不同遗传背景材料,设置多样的试验环境条件,有利于对已定位的粒重位点进行验证和发掘新的QTL位点[9]。
为此,本研究利用抗旱性强的冬小麦品种陇鉴19 与水地高产品种Q9086 杂交,通过杂交创建的F8重组近交系群体(recombinant inbred lines,RIL)120个株系为供试材料,设置不同水分环境,对小麦千粒重(thousand-grain weight,TGW)进行QTL定位和分子数量遗传剖析,旨为小麦粒重抗旱遗传改良和分子标记辅助选择育种奠定理论基础。
1材料与方法
1.1 实验材料
利用抗旱性强的冬小麦品种“陇鉴19”与水地高产品种“Q9086”杂交创建的F8重组近交系群体(RIL)120个株系为供试材料。群体两个亲本在抗旱性、株高、TGW等重要农艺性状上表型差异较大[7,24-26]。其中,陇鉴19是以济南2号×秦麦4号有性杂交多年选育而成的新品种,是甘肃省第一个大面积应用的抗旱北移冬小麦新品种,抗旱性强,耐瘠薄,对水肥反应不敏感。Q9086是从西北农林科技大学引进的品系,对水肥反应敏感,尤其是灌浆期对水分反应敏感[7]。
1.2 田间试验与性状测定
试验于2011年10月-2012年6月和2012年10月-2013年6月在甘肃省兰州市安宁小麦试验点(36°04′ N,103°51′ E,平均海拔1520 m,平均气温8.9℃,年降水量350 mm,年蒸发量1664 mm,无霜期171 d)和2013年10月-2014年6月在甘肃省榆中金家营小麦试验点(35°51′ N,104°07′ E,平均海拔1900 m,平均气温6.6℃,年降雨量450 mm,年蒸发量1450 mm,无霜期140 d)进行。3个环境依次记为E1、E2和E3。在每个环境中,小麦播前基肥施用量均为N 180 kg/hm2,P2O5120 kg/hm2,K2O 75 kg/hm2,在整个生育期内均不再施肥。试验为随机区组设计,每处理3次重复,均为稀条播,行长2 m,行距0.2 m,每行点播120粒,12行区。田间试验水分管理分为雨养,即干旱胁迫(drought stress,DS)和灌溉(well-watered,WW)2个处理。各试验点播前均统一灌底墒水(900 m3/hm2)。灌溉处理在拔节期,抽穗期和开花期补充灌水,每次灌水量为750 m3/hm2;干旱胁迫处理仅在拔节期灌水750 m3/hm2,其后完全依靠自然降水。各试验点(E1~E3)小麦全生育期降水量分别为116,110和128 mm。按照不同试验处理,在小麦完熟收获后,每个株系随机选取完全风干的300粒籽粒进行称重(g),3次重复,求平均值,测定籽粒TGW。
1.3 分子标记连锁图谱
小麦RIL群体图谱是在前期构建图谱[26]的基础上进行加密的图谱,该图谱连锁定位524个SSR位点,所有标记(Xgwm、Xgdm、Xwmc、Xbarc、Xcfa、Xcfd、Xpsp、Xksum和Xmag)引物序列和PCR扩增条件均参考Xue等[27]、Yu等[28]的报道和http://wheat.pw.usda.gov公布的信息。该图谱共形成21个连锁群组成,覆盖小麦所有染色体,全长2266.7 cM,平均两标记间的遗传距离是4.3 cM。A基因组有211个SSR标记,全长871.6 cM;B基因组有203个SSR标记,全长912.1 cM;D 基因组有110个SSR标记,全长483.1 cM。单个连锁群平均长度为107.9 cM,7B连锁群最长149.9 cM,6D连锁群最短为33.6 cM。每个连锁群包括4(6D)~36(1A和7A)个SSR标记,平均为24.9个SSR标记。
1.4 数据统计与QTL定位分析

采用基于混合线性模型复合区间作图的QTLMapper 1.6软件[30]检测干旱胁迫和灌溉条件下TGW的A-QTL和上位性QTL(AA-QTL),扫描步长为2.0 cM。以最大似然对数优势比值(logarithms of odds ratio,LOD)>3.0作为阈值判断QTL存在与否,QTL加性效应(additive effect,A)、加性×环境互作效应(interaction effect of the additive with environment,AE)、上位性互作效应(epistatic effect,AA)和上位性×环境互作效应(interaction effect of the epistatic with environment,AAE)分析以P≤0.005为显著性水平,采用“QTL+性状+研究单位+染色体”命名法对检测到的QTL位点命名。利用各位点的A、AE、AA和AAE,以及各遗传因子对TGW表型变异的贡献率[H2(A)、H2(AE)、H2(AA)和H2(AAE)]的环境平均累加值分析小麦TGW的整体遗传效应和数量遗传特征。
2结果与分析
2.1 千粒重表型分析

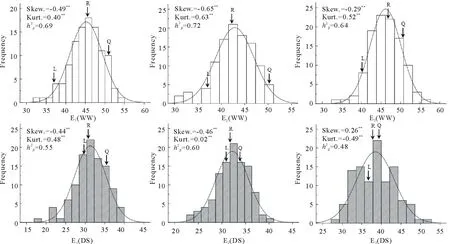
图1 不同环境条件下小麦RIL群体千粒重表型频率和遗传参数Fig.1 Phenotypic frequency and genetic parameters for the thousand-grain weight of the RIL population in wheat under different environments E1~E3分别表示2012、2013年兰州安宁试验点和2014年榆中金家营试验点,每个环境均设干旱胁迫(DS,条纹柱表示)和正常灌溉(WW,空心柱表示)处理;Frequency、Skew.、Kurt.和分别表示表型频率、偏度、峰度和广义遗传力。*P≤0.05,**P≤0.01。下同。E1-E3 represent experimental environments at Anning, Lanzhou in 2012 and 2013, and at Jingjiaying, Yuzhong in 2014, respectively. Each environment includes the drought-stressed (DS, as diagonal stripe histograms) and the well-watered (WW, as open histograms) conditions. Frequency, Skew., Kurt. and indicate phenotypic frequency, skewness, kurtosis and broad-sense heritability of the thousand-grain weight of the RIL population. *P≤0.05, **P≤0.01.The same below.
从表1看出,TGW表型变异受水分环境(F=940.80**)、基因型(F=8.02**),及其二者互作(F=4.35**)的显著影响,其中,水分环境对TGW影响最大,其均方占据总均方的98.60%。通过相关分析发现,小麦RIL群体TGW表型不同环境间均呈极显著正相关,相关系数在0.64**~0.89**(表2)。其中,灌溉条件下不同环境间TGW表型相关系数(0.82**~0.89**)高于干旱胁迫条件下的(0.68**~0.71**)。不同环境两种水分条件下的TGW表型相关系数在0.64**~0.76**。说明,水分环境对TGW表型有显著影响,干旱胁迫导致小麦RIL群体各基因型TGW表型变异增大,相关性降低。
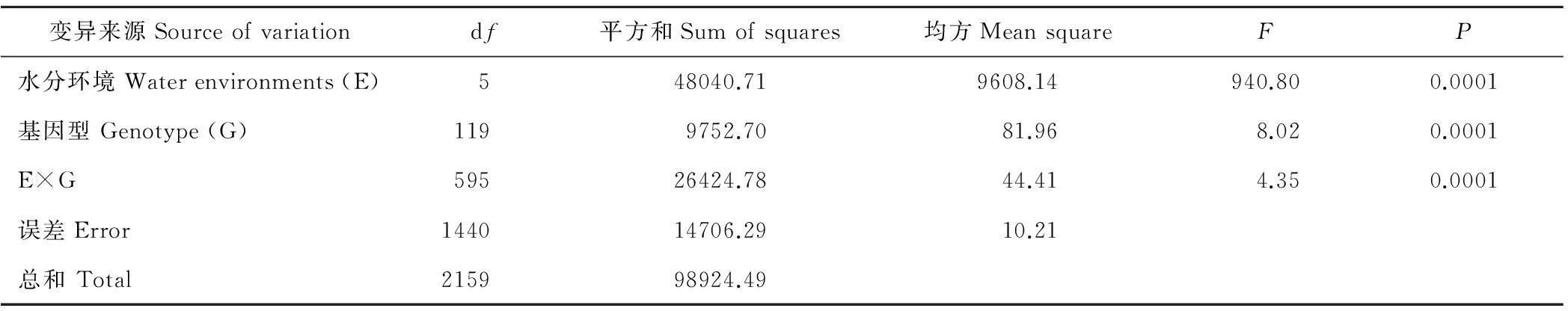
表1 小麦RIL群体千粒重方差分析

表2 不同环境条件下小麦RIL群体千粒重的相关性
2.2 千粒重QTL加性效应及其与水分环境互作
在不同环境条件下,小麦RIL群体共检测到19个控制TGW的显著A-QTL,主要分布在1B、2A、3D、4A、5B、6B和7A染色体上(表3,图2)。其中,E1~E3环境分别检测到6,5和8个A-QTL。有13个A-QTL位点的加性效应(A)来自于高值亲本Q9086,具有增加TGW的效应,A在1.17~1.93 g之间,H2(A)在2.57%~7.33%;其余6个A-QTL加性效应来自于低值亲本陇鉴19,具有降低TGW的效应,A在1.23~2.03g,H2(A)在1.24%~10.94%。此外,有12个A-QTL检测出与水分环境发生显著互作,其中Qtgw.acs-3D.1与干旱胁迫环境互作效应(AE)可增加TGW 1.29 g,H2(AE)为3.56%;其余11个加性位点与干旱胁迫环境的AE效应均可降低TGW1.28~1.86g,H2(AE)在3.65%~12.69%。在1B、2A和4A染色体上发现3个在2个以上环境均能稳定表达的A-QTL位点,如Qtgw.acs-1B.1(E1~E3),Qtgw.acs-2A.1(E1和E3)和Qtgw.acs-4A.1(E1和E2),但这些位点因环境条件的不同,导致其加性效应来源对TGW表型变异的贡献率以及环境互作效应均表现出显著差异。说明,这些重要位点尽管在多环境中能稳定表达,但其表达形式和强度仍存在对环境较强的可塑性。
从图2看出,小麦RIL群体不同环境条件下控制TGW的A-QTL在不同染色体间和同一染色体内的不同区段上呈现出显著的不均匀分布,其中在1B、2A、4A和7A上分布最多,达3~6个。这些A-QTL在相应的染色体标记区间内或相邻区间聚集分布,形成了QTL热点区域,如1B染色体Xmag2064-Xbarc181,2A染色体Xwmc522-Xgwn122,4A染色体Xwmc446-Xgwm610和7A染色体Xwmc603-Xbarc195。说明,在这些重要染色体区间可能携带大量控制小麦TGW的基因。

图2 小麦RIL群体千粒重QTL图谱Fig.2 QTL map for the thousand-grain weight of the RIL population in wheat ▲,■和●分别表示E1、E2和E3环境下检测到的控制小麦千粒重的A-QTL。▲, ■ and ● indicate QTL for the thousand-grain weight of wheat in E1, E2 and E3.
2.3 千粒重QTL上位性效应及其与水分环境互作
在不同环境条件下,小麦RIL群体共检测到38对控制TGW的显著AA-QTL,这些AA-QTL主要分布在除1A、3B、4D和6A以外的其他17条染色体上(表4)。其中,E1~E3环境分别检测到11,12和15对AA-QTL,未检测到多环境能稳定表达的AA-QTL。说明,AA-QTL比A-QTL表达更易受到环境影响。其中,20对AA-QTL的上位性效应(AA)均对TGW表型变异起负向调控作用,即重组型上位性效应大于亲本型上位性效应,单对互作QTL的AA效应可降低TGW 0.42~1.19 g,H2(AA)在0.48%~2.17%;其余18对AA-QTL的AA效应均对TGW表型变异起正向调控作用,即亲本型上位性效应大于重组型上位性效应,单对互作QTL的AA效应可增加TGW0.40~1.40g,H2(AA)在0.38%~2.89%。此外,有16对AA-QTL检测到显著的上位性×水分环境互作,其中8对AA-QTL与干旱胁迫环境互作效应(AAE)可降低TGW 0.57~0.90 g,H2(AAE)在1.53%~4.30%;其余8对AA-QTL与干旱胁迫环境的AAE效应可提高TGW0.47~0.79g,H2(AAE)在1.05%~3.88%。

表3 不同环境条件下小麦RIL群体千粒重QTL加性效应及其与水分环境互作
1)遗传距离(cM)表示距左标记的距离;2)A代表加性效应,正值表示增效等位基因来自于Q9086,负值表示增效等位基因来自于陇鉴19,H2(A)表示由加性效应所解释的表型变异;*P<0.05,**P<0.01;3)E1表示干旱胁迫条件,AE1表示加性QTL与干旱胁迫环境互作效应,干旱胁迫与正常灌溉中AE1绝对值相同,但效应方向相反,H2(AE1)表示由加性QTL与环境互作所解释的表型变异。1)Genetics distance (cM) between the most likely position of putative QTL and the left flanking marker in marker interval.2)Arepresents the additive effect. Positive value indicates the Q9086 allele having positive effect on the trait, and negative value represents Longjian 19 allele having positive effect;H2(A)indicatesthephenotypicvarianceexplainedbyadditiveQTL; *P<0.05,**P<0.01;3)E1representsthedroughtstress; AE1representstheeffectofadditiveQTL×environmentinteractioninthedroughtstress;theabsolutevalueofeffectofQTL×environmentinteractioninthewell-wateredissameasinthedroughtstress,buttheeffectdirectionisreverse; H2(AE1) indicates the phenotypic variance explained by additive QTL×environment.
以上参与AA-QTL形成的位点中,只有4个A-QTL(Qtgw.acs-1B.3、Qtgw.acs-2A.1、Qtgw.acs-3D.1和Qtgw.acs-4A.1)为具有显著加性效应(表3),其余均为非显著加性效应的位点间的互作;且多以单个A-QTL两次或两次以上的互作组成网络系统。其中,最大的互作网络由21个A-QTL组成,互作形成26对AA-QTL,占整个AA-QTL的68.4%(图3)。4个具有显著加性效应A-QTL(Qtgw.acs-1B.3、Qtgw.acs-2A.1、Qtgw.acs-3D.1和Qtgw.acs-4A.1)在该互作网络中发挥中心枢纽的作用,单个位点发生4次以上的互作,其余单位点多发生两次互作。在此网络系统中,除Qtgw.acs-1D.1、Qtgw.acs-2A.4、Qtgw.acs-7B.3、Qtgw.acs-7B.4和Qtgw.acs-7B.5与其他位点互作通过正向调控TGW表型外,其余位点间互作均通过正向或负向调控TGW表型。

图3 小麦RIL群体上位性QTL的互作网络Fig.3 Epistatic QTL network for thousand-grain weight of wheat RIL population 灰色和白色椭圆圈分别表示显著加性效应和非显著加性效应的QTL;实线和虚线分别表示 QTL 上位互作遗传效应值为正值和负值。Gray and white ellipses represent significant and non-significant additive-effect QTL, respectively; Solid and dashed lines indicate positive and negative values for epistatic effect of QTL, respectively.
2.4 千粒重QTL整体遗传效应
从不同环境条件下控制小麦RIL群体TGW的A、AE、AA、AAE遗传效应均值来分析,TGW的A效应主要来自于高值亲本Q9086,平均每个环境所有位点A效应可累积增加TGW 3.74 g。而AE、AA和AAE效应均表现为降低TGW的作用,其中AE效应最强,平均每个环境所有位点AE效应可累积降低TGW 5.01 g;相比较AA和AAE效应的作用较低,分别仅为0.26 和0.15 g(图4)。对TGW表型变异的贡献率在各遗传组分之间有显著差异,其中A和AE效应对TGW表型变异的贡献率较高,分别为25.63%和22.49%;AA和AAE效应的贡献率较低,分别为15.01%和12.29%(图5)。由此看出,决定小麦TGW的主要遗传因子为A和AE效应。在干旱胁迫条件下,这种遗传主效应均对TGW表型具有负向调控作用。

图4 小麦千粒重QTL遗传组分效应差异Fig.4 Difference in genetic effects of all identified QTL for the thousand-grain weight of the RIL population in wheat

图5 小麦千粒重QTL遗传贡献率差异Fig.5 Difference in genetic contribution rate of all identified QTL for the thousand-grain weight of the RIL population in wheat

表4 不同环境条件下小麦RIL群体千粒重QTL上位性效应及其与水分环境互作
1)QTLi和QTLj是QTL二维搜索检测;2)遗传距离(cM)表示距左标记的距离;3)AA代表上位性效应,正值表示亲本型效应大于重组型,负值反之,H2(AA)表示由上位性效应所解释的表型变异;*P<0.05,**P<0.01;4)E1表示干旱胁迫条件,AAE1表示上位性QTL与干旱胁迫互作效应,干旱胁迫与正常中AAE1绝对值相同,但效应方向相反,H2(AAE1) 表示由上位性QTL与环境互作所解释的表型变异。1)QTLiand QTLjare a pair of QTL detected by two-dimensional searching;2)Genetics distance (cM) between the most likely position of putative QTL and the left flanking marker in marker interval; *P<0.05,**P<0.01;3)AArepresents epistatic effect at its direction: the positive value means parent-type effect is more than recombinant-type effect, and the negative value means parent-type effect is less than recombinant-type effect;H2(AA)indicatesthevarianceexplainedbyepistasisQTL.4)E1representsthedroughtstress; AAE1representstheeffectofepistaticQTL×environmentinteractioninthedroughtstress;theabsolutevalueofeffectofQTL×environmentinteractioninthewell-wateredissameasinthedroughtstress,buttheeffectdirectionisreverse; H2(AAE1) indicates the phenotypic variance explained by epistatic QTL×environment.
3讨论
3.1 小麦粒重响应水分环境的复杂性
粒重是决定小麦产量的重要影响因子[1-2]。在正常生长条件下,粒重表型具有较高稳定性和遗传力(0.59~0.80)[3-4]。然而,干旱胁迫条件下,小麦随着胁迫程度增加和持续时间的延长,粒重表现出不同程度的降低,表型变异增大,遗传力显著下降(hB2=0.35~0.63),表现出显著的与水分互作效应[7-8,10]。本研究通过设置不同的水分环境条件也进一步证实这一现象,与灌溉条件(对照)相比,干旱胁迫导致小麦RIL群体TGW表型平均下降7.42 g,遗传力平均降低0.14,变异系数平均增高2.13%,不同环境间TGW相关性显著降低;并且以上这些特征值在不同地点(年份)环境变幅较大(图1,表1和2)。此外,Yang等[6]还发现小麦不同发育时期的TGW对干旱胁迫响应不同,灌浆中期的TGW抗旱性普遍高于成熟期的。Li等[10]发现,在不同的水分环境,以及同一水分环境不同的发育阶段,小麦TGW表型对水分环境和发育阶段表现显著不同。由此说明了小麦TGW对水分反应的复杂性,显著的基因型差异性,生育期水分响应的特异性和易与环境互作性,从而佐证其典型数量性状特点。同时也暗示出,控制小麦TGW的基因可能以一定的时空方式表达,不同的环境具有不同的表达模式,从而导致其丰富的表型差异。
3.2 小麦粒重QTL遗传定位特征与热点区域比较
据前人研究,小麦TGW主要受加性效应控制[3],其A-QTL在小麦21条染色体上均有分布,不同遗传背景材料和不同的环境这些A-QTL表达的数目、位置、遗传效应不同[4-6,8-23]。但在1A[4,12-13]、1B[9,23]、2A[9,23]、2B[4,11,13]、2D[13,19]、3B[9]、3D[12]、4B[12]、5B[11,13,16]和7A[4,11]上检测到多环境均能稳定表达的A-QTL。在本研究中,小麦RIL群体共检测到19个控制TGW的A-QTL,不同环境这些位点表达形式有显著差异,主要分布在1B、2A、3D、4A、5B、6B和7A染色体上;其中,在1B、2A、4A和7A染色体上一些重要标记区段,形成了4个QTL的热点区域(表2,图2)。在1B染色体上Xmag2064-Xbarc181区间内,发现了6个A-QTL,尤其在该区域内Xwmc156或相邻标记附近,王瑞霞等[9,23]定位了7个控制TGW的A-QTL,H2(A)在6.23%~13.96%;Li等[10]定位了1个A-QTL,H2(A)为7.13%;根据Somers等[31]的遗传图谱作为参考图谱比对,Huang等[18]检测到1个A-QTL与Xwmc156相邻,H2(A)为12.60%。在2A染色体上Xwmc522-Xgwn122区间内本研究发现了4个控制TGW的A-QTL,王瑞霞等[9,23]在该区域发现8个控制TGW的A-QTL,H2(A)在4.99%~16.80%。3D染色体上检测到的Qtgw.acs-3D.1与廖祥政等[12]检测到控制TGW的A-QTL位于相邻区间。以上不同遗传背景群体间稳定表达的控制TGW的A-QTL及其热点区域,普遍与控制籽粒大小和产量相关农艺性状QTL重叠或共享相近的染色体区间[8,11,13-15,21-22]。说明,这些重要位点的表达不仅具有一定的稳定性,同时在遗传上存在 “一因多效”现象,可利用这些正向连锁实现籽粒产量及其产量相关因子的同步提高,用于分子标记辅助育种和聚合育种[22]。此外,本研究中在4A、5B、6B和7A发现的控制TGW的A-QTL均未与前人研究报道的位点重合或相近,属于新发掘的QTL位点。因此,由于小麦巨大的基因组特性[15],以及小麦粒重遗传的复杂性[4,9-11,21-23],开展多环境条件下,小麦不同遗传背景群体TGW的QTL定位,将有利于发掘TGW更多的遗传信息和功能分子标记,提高小麦TGW遗传改良的效率。
3.3 小麦粒重数量遗传基础
小麦粒重属于典型的微效多基因控制的复杂数量性状,易受环境影响[4-9]。前期的研究表明,小麦粒重遗传符合加性-显性模型,显性效应为主,A效应也起一定的作用[32]。也有研究者认为,小麦粒重主要受A效应控制[3],AA、AE和AAE效应也对粒重起到重要作用[6,8,10,21-22]。本研究发现,小麦TGW遗传受到A、AE、AA和AAE效应的显著影响,其中A和AE效应是决定小麦TGW的主要遗传因子。在干旱胁迫条件下,这种遗传主效应均对TGW表型具有负向调控作用(图4,图5)。并且检测到的一些控制TGW的显著加性效应的QTL,不仅单独表达显著影响TGW表型变异,而且与其他位点互作形成复杂的QTL网络,发挥中心枢纽的作用对TGW表型起正向或负向调控(图3)。
4结论
小麦RIL群体千粒重对水分环境反应敏感,群体中各株系呈现广泛变异和超亲分离,属于微效多基因控制的复杂数量性状,易受水分环境影响。
共检测到19个和38对控制千粒重的A-QTL和AA-QTL。这些QTL表达通过正向或负向调控,对千粒重表型变异起重要作用。发现了3个多环境均能稳定表达的A-QTL,如Qtgw.acs-1B.1,Qtgw.acs-2A.1和Qtgw.acs-4A.1,以及4个A-QTL热点区域,如Xmag2064-Xbarc181(1B),Xwmc522-Xgwn122(2A),Xwmc446-Xgwm610(4A)和Xwmc603-Xbarc195(7A)。所检测到的A-QTL和AA-QTL与干旱胁迫环境互作普遍具有降低千粒重的效应。
加性效应和加性与环境的互作效应是决定小麦千粒重的主要遗传因子,在干旱胁迫条件下,这种遗传主效应均对千粒重表型具有负向调控作用。
References:
[1]Wang R X. QTL Analysis of Grain Filling Rate and Related Traits in Wheat (TriticumaestivumL.) under Different Ecological Environments[D]. Beijing: Chinese Academy of Agricultural Science, 2008.
[2]Lu Q L, Chai S X, Zhang L J,etal. Contribution of winter wheat leaf and non-leaf organs to grain weight. Acta Prataculturae Sinica, 2013, 22(5): 165-174.
[3]Zhuang Q S. Chinese Wheat Improvement and Pedigree Analysis[M]. Beijing: Chinese Agricultural Press, 2003: 502.
[4]Kumar N, Kulwal P, Gaur A,etal. QTL analysis for grain weight in common wheat. Euphytica, 2006, 151: 135-144.
[5]Varshney R K, Prasad M, Roy J K,etal. Identification of eight chromosomes and a microsatellite marker on 1AS associated with QTL for grain weight in bread wheat. Theoretical and Applied Genetics, 2000, 100: 1290-1294.
[6]Yang D, Jing R, Chang X,etal. Identification of quantitative trait loci and environmental interactions for accumulation and remobilization of water-soluble carbohydrates in wheat (TriticumaestivumL.) stems. Genetics, 2007, 176: 571-584.
[7]Yang D L, Zhang G H, Li X M,etal. Genetic characteristics associated with drought tolerance of plant height and thousand-grain mass of recombinant inbred lines of wheat. Chinese Journal of Applied Ecology, 2012, 23(6): 1569-1576.
[8]Wu X, Chang X, Jing R. Genetic insight into yield-associated traits of wheat grown in multiple rain-fed environments. PLoS ONE, 2012, 7(2): e31249.
[9]Wang R X, Zhang X Y, Wu K,etal. The stability of QTL mapping for thousand grain weight in multiple environments. Journal of Triticeae Crops, 2012, 32(1): 1-6.
[10]Li S, Wang C, Chang X,etal. Genetic dissection of developmental behavior of grain weight in wheat under diverse temperature and water regimes. Genetica, 2012, 140: 393-405.
[11]Groos C, Robert N, Bervas E,etal. Genetic analysis of grain protein content, grain yield and thousand-kernel weight in bread wheat. Theoretical and Applied Genetics, 2003, 106: 1032-1040.
[12]Liao X Z, Wang J, Zhou R H,etal. Mining favorable alleles of QTLs conferring 1000-grain weight from synthetic wheat. Acta Agronomica Sinica, 2008, 34(11): 1877-1884.
[13]Ramya P, Chaubal A, Kulkarni K,etal. QTL mapping of 1000-kernel weight, kernel length, and kernel width in bread wheat (TriticumaestivumL.). Journal of Applied Genetics, 2010, 51: 421-429.
[14]Campbell K G, Bergman C J, Gualberto D G,etal. Quantitative trait loci associated with kernel traits in a soft×hard wheat cross. Crop Science, 1999, 39: 1184-1195.
[15]Quarrie S A, Steed A, Calestani C,etal. A high-density genetic map of hexaploid wheat (TriticumaestivumL.) from the cross Chinese Spring×SQ1 and its use to compare QTLs for grain yield across a range of environments. Theoretical and Applied Genetics, 2005, 110: 865-880.
[16]Liu S B, Zhou R H, Dong Y C,etal. Development, utilization of introgression lines using a synthetic wheat as donor. Theoretical and Applied Genetics, 2006, 112: 1360-1373.
[17]Li S H, Jia J Z, Wei X Y,etal. A intervarietal genetic map and QTL analysis for yield traits in wheat. Molecular Breeding, 2007, 20: 167-178.
[18]Huang X Q, Kempf H, Ganal M W,etal. Advanced backcross QTL analysis in progenies derived from a cross between a German elite winter wheat variety and a synthetic wheat (TriticumaestivumL.). Theoretical and Applied Genetics, 2004, 109: 933-943.
[19]Börner A, Schumann E, Fürste A,etal. Mapping of quantitative trait loci determining agronomic important characters in hexaploid wheat (TriticumaestivumL.). Theoretical and Applied Genetics, 2002, 105: 921-936.
[20]Röder M S, Huang X Q, Börner A. Fine mapping of the region on wheat chromosome 7D controlling grain weight. Functional & Integrative Genomics, 2008, 8: 79-86.
[21]Li W F, Liu B, Peng T,etal. Detection of QTL for kernel weight, grain size, and grain hardness in wheat using DH and immortalized F2 population. Scientia Agricultura Sinica, 2012, 45(17): 3453-3462.
[22]Zhang K P, Xu X B, Tian J C. QTL mapping for grain yield and spike related traits in common wheat. Acta Agronomica Sinica, 2009, 35(2): 270-278.
[23]Wang R X, Zhang X Y, Wu L,etal. QTL analysis of grain size and related traits in winter wheat under different ecological environments. Scientia Agricultura Sinica, 2009, 42(2): 398-407.
[24]Li L, Yang D L, Li M F,etal. Effects of source-sink regulation on WSC in vegetative organs and thousand-grain mass of wheat under different water conditions. Chinese Journal of Applied Ecology, 2013, 24(7): 1879-1888.
[25]Ma Z P, Li M F, Yang D L,etal. Relationship between grain filling and accumulation and remobilization of water soluble carbohydrates in leaf and stem of winter wheat during the grain filling in different water conditions. Acta Prataculturae Sinica, 2014, 23(4): 68-78.
[26]Zhang G H, Yang D L, Li M F,etal. Genetic analysis of QTL mapping for developmental behaviors of plant height and QTL×water regimes interactions in wheat. Journal of Agricultural Biotechnology, 2012, 20(9): 996-1008.
[27]Xue S, Zhang Z, Lin F,etal. A high-density intervarietal map of the wheat genome enriched with markers derived from expressed sequence tags. Theoretical and Applied Genetics, 2008, 117: 181-189.
[28]Yu J K, Dake T M, Singh S,etal. Development and mapping of EST-derived simple sequence repeat markers for hexaploid wheat. Genome, 2004, 47: 805-818.
[29]Toker C. Estimates of broad-sense heritability for seed yield and yield criteria in faba bean (ViciafabaL.). Hereditas, 2004, 140: 222-225.
[30]Wang D L, Zhu J, Li Z K,etal. Mapping QTLs with epistatic effects and QTL×environment interaction by mixed linear model approaches. Theoretical and Applied Genetics, 1999, 99: 1255-1264.
[31]Somers D J, Isaac P, Edwards K. A high-density wheat microsatellite consensus map for bread wheat (TriticumaestivumL.). Theoretical and Applied Genetics, 2004, 109: 1105-1114.
[32]Zhang L H, Xu M F. An analysis of genetic effects on harvest index and several other agronomic characteristics of wheat. Acta Agriculturae Nuleatae Sinica, 1997, 11(3): 135-140.
参考文献:
[1]王瑞霞. 不同生态环境下小麦籽粒灌浆速率及有关性状的QTL定位分析[D]. 北京: 中国农业科学院, 2008.
[2]鲁清林, 柴守玺, 张礼军, 等. 冬小麦叶片和非叶器官对粒重的贡献. 草业学报, 2013, 22(5): 165-174.
[3]庄巧生. 中国小麦品种改良及系谱分析[M]. 北京: 中国农业出版社, 2003: 502.
[7]杨德龙, 张国宏, 李兴茂, 等. 小麦重组近交系群体株高和千粒重的抗旱遗传特性. 应用生态学报, 2012, 23(6): 1569-1576.
[9]王瑞霞, 张秀英, 吴科, 等. 多个环境下小麦千粒重QTL定位的稳定性分析. 麦类作物学报, 2012, 32(1): 1-6.
[12]廖祥政, 王瑾, 周荣华, 等. 发掘人工合成小麦中千粒重QTL 的有利等位基因. 作物学报, 2008, 34(11): 1877-1884.
[21]李文福, 刘宾, 彭涛, 等. 利用DH 和IF2两个群体进行小麦粒重、粒型和硬度的QTL分析. 中国农业科学, 2012, 45(17): 3453-3462.
[22]张坤普, 徐宪斌, 田纪春. 小麦籽粒产量及穗部相关性状的QTL定位. 作物学报, 2009, 35(2): 270-278.
[23]王瑞霞, 张秀英, 伍玲, 等. 不同生态环境下冬小麦籽粒大小相关性状的QTL分析. 中国农业科学, 2009, 42(2): 398-407.
[24]李丽, 杨德龙, 栗孟飞, 等. 不同水分条件下源库调节对小麦营养器官WSC及籽粒千粒重的影响. 应用生态学报, 2013, 24(7): 1879-1888.
[25]马召朋, 栗孟飞, 杨德龙, 等. 不同水分条件下冬小麦灌浆期茎叶可溶性碳水化合物积累转运与籽粒灌浆的关系. 草业学报, 2014, 23(4): 68-78.
[26]张国宏, 杨德龙, 栗孟飞,等. 小麦株高发育动态QTL定位及其与水分环境互作遗传分析. 农业生物技术学报, 2012, 20(9): 996-1008.
[32]张利华, 许梅芬. 小麦收获指数和其它几个农艺性状的基因效应分析. 核农学报, 1997, 11(3): 135-140.
