甘肃省高寒草原牧草孢囊线虫的鉴定
2016-01-27李惠霞彭焕彭德良朱锐东徐鹏刚李建荣
李惠霞,彭焕,彭德良,朱锐东,徐鹏刚,李建荣
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;
2.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
甘肃省高寒草原牧草孢囊线虫的鉴定
李惠霞1,彭焕2,彭德良2,朱锐东1,徐鹏刚1,李建荣1
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;
2.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
摘要:2013年8月下旬,对甘肃天祝高寒草甸草原孢囊线虫发生情况进行调查,从嵩草和矮嵩草根部和根际土样中分离得到孢囊线虫。通过对孢囊和孢囊阴门锥的形态观察,初步鉴定为禾谷孢囊线虫(Heterodera avenae)。其特征为孢囊浅褐色,阔柠檬形,阴门锥双膜孔,未见阴门下桥,泡状突明显。利用通用引物AB28和TW81对其群体rDNA-ITS区进行PCR扩增和序列测定,得到ITS区序列长度为1045 bp。将所测得序列在Genbank和Blast上比对,结果显示,此禾谷孢囊线虫群体与H. avenae群体相似度达99%~100%。进一步证实寄生于甘肃天祝高寒草甸草原嵩草和矮嵩草的孢囊线虫均为H. avenae,这是首次报道莎草科嵩草和矮嵩草也是禾谷孢囊线虫的寄主。
关键词:高寒草甸草原;禾谷孢囊线虫;嵩草;矮嵩草
DOI:10.11686/cyxb2014372http://cyxb.lzu.edu.cn
李惠霞,彭焕,彭德良,朱锐东,徐鹏刚,李建荣. 甘肃省高寒草原牧草孢囊线虫的鉴定. 草业学报, 2015, 24(8): 174-180.
Li H X, Peng H, Peng D L, Zhu R D, Xu P G, Li J R. Identification of cyst nematode in alpine meadow steppe, Gansu. Acta Prataculturae Sinica, 2015, 24(8): 174-180.
收稿日期:2014-09-02;改回日期:2014-12-25
基金项目:国家自然科学基金(31460463)和草业生态系统教育部重点实验室(甘肃农业大学)开放课题基金(CYZS-2011010)资助。
作者简介:李惠霞(1972-),女,甘肃天水人,副教授。E-mail:lihx@gsau.edu.cnIdentification of cyst nematode in alpine meadow steppe, Gansu
LI Hui-Xia1, PENG Huan2, PENG De-Liang2, ZHU Rui-Dong1, XU Peng-Gang1, LI Jian-Rong1
1.CollegeofPrataculturae,GansuAgriculturalUniversity,KeyLaboratoryofGrasslandEcosystem,MinistryofEducation,Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China; 2.StateKeyLaboratoryforBiologyofPlantDiseasesandInsectPest,InstituteofPlantProtection,ChineseAcademyofAgriculturalSciences,Beijing100193,China
Abstract:A survey of grass cyst nematodes in Tianzhu alpine meadow steppe, Gansu Province was conducted in August, 2013. Cyst nematodes were isolated from the roots and root rhizosphere of Kobresia sp. and Kobresia humilis. The nematodes were initially identified as Heterodera avenae based on cyst characteristics, particularly the cyst vulva cones. The cysts were light brown, large lenmon-shaped and contained vulva cones with bifenestrate and obvious bullae and without a vulva under-bridge. The 1045 bp sequence fragment of ITS region was amplified using PCR with general primers AB28 and TW81. The similarities between these groups and H. avena were 99%-100%. Molecular analysis confirmed that the cyst nematodes isolated from Kobresia sp. and Kobresia humilis growing in Tianzhu alpine meadow steppe were H. avenae. This is the first report identifying Kobresia sp. and Kobresia humilis as hosts of H. avenae.
Key words:alpine meadow steppe; cereal cyst nematode; Kobresia sp.; Kobresia humilis
禾谷孢囊线虫(Heterodera)是一类危害小麦(Triticumaestivum)、大麦(Hordeumvulgare)、燕麦(Avenasativa)等禾谷类作物的世界性重要病原线虫。属于复合种群组,包括12 个有效种,其中禾谷孢囊线虫(Heroderaavenae),菲利普孢囊线虫(H.filipjevi)和麦类孢囊线虫(H.latipons)是最为常见且最具经济重要性的种[1-3]。H.avenae是温带地区禾谷类植物上最重要的,也是世界上分布最广的种[1,4]。目前,H.avenae在我国湖北、河南、河北、山东、山西、青海、内蒙古、北京、安徽、陕西、甘肃、江苏、宁夏、天津、新疆和西藏等16个省市自治区分布报道的小麦禾谷孢囊线虫主要为该种[5-12]。H.filipjevi分布在欧洲、美洲和中亚[2,8],彭德良等[13]在河南省临颍、许昌、卫辉和延津发现H.filipjevi。H.latipons主要分布在地中海地区[2,14-15],我国尚未见报道。
禾谷孢囊线虫除危害小麦、大麦和燕麦,齐淑华等[16]报道禾谷孢囊线虫可危害青稞(Hordeumvulgarevar.nudum)。王明祖等[17]的研究表明除小麦、裸大麦(Hordeumsativumvar.hexastichon)、米大麦(Hordeumvulgare)、家燕麦(Avenasativa)、野燕麦(Avenafatura)外,黑麦草(Loliumperenne)、鹅观草(Roegneriakanoji)、苇状羊茅(Festucaelatiorvar.arundinucea)、球茎草芦(Phalaristuberosa)和鸭茅(Dactylisglomerata)等禾本科植物也是该线虫的良好寄主。这些多年生的禾本科植物作为禾谷孢囊线虫的中间寄主或桥梁寄主存在于麦类作物田间。西北农牧交错带分布最广,面积最大的,是以各种针茅为主的丛生禾草高寒草原,以紫花针茅(Stipapurpurea)和坐花针茅(S.subssesiliflora)为主的典型草原,还有以戈壁针茅(S.gobica)和沙生针茅(S.glareosa)为主的荒漠草原,以嵩草属(Kobresiasp.)为建群种的草甸草原,其建群的群系主要为禾草和莎草,而这些牧草很可能也是禾谷孢囊线虫的寄主。但对于农牧交错带禾谷孢囊线虫对牧草的寄生情况了解甚少,因此,针对寄生于牧草的孢囊线虫的种类、交叉侵染、生态分布多样性进行研究,显得尤为重要。
rDNA-ITS序列是一个多用途的遗传标记,常用 ITS-RFLP(internal transcript space-restriction fragment length polymorphism)分析线虫不同群体的差异及多态性。Subbotin等[18]研究了70个H.avenae复合种群的ITS-RFLP 图谱,揭示出H.avenae是一个并系分类群, 中国禾谷孢囊线虫不同于其他的H.avenae群体。彭德良等[19]对7个国内种群与摩洛哥种群做RFLP分析,发现我国部分群体属于“B ”型。欧师琪等[20]用6种限制性内切酶酶切发现,陕西禾谷孢囊线虫群体和青海群体、河南群体不完全一致,呈现丰富的多样性。上述国内外的研究充分说明我国不同地域H.avenae群体间rDNA-ITS具有丰富的多样性。
综上所述,近年来,麦类作物孢囊线虫的研究得到广泛重视,但对于农牧交错带禾谷孢囊线虫对麦类和牧草的寄生情况了解甚少,因此,针对寄生于牧草的孢囊线虫的种类多样性进行研究,显得尤为重要。本文利用形态学和分子生物学手段相结合的方法对天祝高寒草甸草原的针茅(Stipacapillata)、披碱草(Elymusdahuricus)、嵩草和矮嵩草(Kobresiahumilis)孢囊线虫进行鉴定,以期明确天祝草原孢囊线虫的种类。
1材料与方法
1.1 线虫的采集
于2013年8月牧草生长季在甘肃省天祝高寒草甸草原不同地点进行采样。采用“Z”字形法采集受害牧草根及根际土壤,每点采取5~20 cm深处的土样500~1000 g,充分混匀,取其中的500~1000 g作为一个标样,带回实验室进行线虫分离。具体采样信息见表1。
1.2 线虫的分离方法
采用简易漂浮法进行孢囊的分离,取200 g土样用强水流冲洗,搅动,沉淀片刻,将混合物通过20目(850 μm) 和60目(250 μm)的样品筛,重复以上步骤3次。再用小水流轻轻清洗60目(250 μm)筛上残余物,将其淋洗入三角瓶中,用滤纸过滤收集,4℃冷藏备用。
1.3 孢囊线虫标本的制作
1.3.1二龄幼虫标本的制作将二龄幼虫置于60℃水浴2 min,进行热杀死,用三乙醇胺-福尔马林液(TAF)固定过夜。用吸管汲取一滴浮载剂滴于洁净载玻片中央。在体视显微镜下用挑针将固定好的二龄幼虫挑至载玻片中央的浮载剂中。选取与线虫虫体直径相似的3根5 mm左右的支撑物,均匀置于浮载剂边缘,将烤热的盖玻片盖于浮载剂上,应避免产生气泡。在体视显微镜下用裁成小条的滤纸吸取多余的浮载剂。然后用封片剂封片。待封片剂干后,贴上标签,即可用于短时间形态的观察、拍照并测量。
1.3.2孢囊阴门锥标本的制作用细毛笔挑取饱满孢囊置于载玻片的水滴中,在体视显微镜下用锋利的解剖刀切下孢囊阴门锥部分。用毛针或竹针仔细清除阴门锥内附着物,用刀适当修正阴门锥边缘,最好使阴门锥的高度不超过阴门窗区域宽度的10~15倍。将切下的阴门锥用40%双氧水处理数分钟。将阴门锥移至载玻片的水滴中,用凡士林封片制成临时玻片。在光学显微镜下进行形态的观察、拍照、测量及参照王明祖等[17]的方法鉴定。
1.4 孢囊线虫DNA的提取
从检出孢囊的样品中,挑取饱满的孢囊,参考彭德良等[11]的方法提取孢囊线虫的DNA,将单个孢囊放入Eppendorf管中,加入10 μL灭菌重蒸水、7 μL的10×PCR-buffer(含Mg2+)、3 μL蛋白酶K(600 μg/mL),在液氮中速冻1 min,取出后用75%乙醇消毒的玻璃棒研磨1~2 min后,置于-20℃冷冻至少2 h。之后,将Eppendorf管置于65℃下温育1.5 h,95℃10 min,4℃至少5 min。最后,12000 r/min离心1 min。取DNA上清液于-20℃保存备用。
1.5 rDNA-ITS的PCR扩增
反应采用50 μL体系,10×PCR-buffer(含Mg2+)5.0 μL,dNTPs 4 μL,引物TW81 (GTTTCCGTAG GTGAACCTGC)1 μL,引物AB28 (ATATGCTTAAGTTCAGCGGGT)1 μL,ExTaq DNA Polymerase(5 U/μL)1 μL,模板DNA 3.0 μL,灭菌双蒸水补足到50 μL,同时设置无DNA模板的阴性对照。在Eppendorf PCR仪上进行扩增,扩增反应条件为94℃预变性5 min,94℃ 30 s,55℃ 45 s,72℃ 1.5 min,循环35次,72℃延伸10 min,4℃ 5 min,最后-20℃保存。取10 μL扩增产物加2 μL 6×Loading buffer在1.5%琼脂糖凝胶上电泳,用0.5×TAE电泳缓冲液,120 V电泳40 min,EB染色,在BIO-RAD成像仪紫外光灯下观测并照相。
1.6 rDNA-ITS区域PCR产物的回收纯化、克隆、测序和序列分析
将上述电泳后的目的条带切下,用普通琼脂糖凝胶DNA回收试剂盒(TIANGEN)按步骤进行回收纯化。取4 μL纯化后的产物与6 μL pMD18-T vector在16℃连接4 h,然后将10 μL连接产物转入感受态细胞DH5α中,用热击法进行转化后均匀涂在含有Ampicillin (100 mg/L)、IPTG(24 mg/L)和X-gal(200 mg/L)的LB(Luria-Bertani)培养基平板上,之后倒置在37℃培养箱中12~16 h,进行蓝白斑筛选。挑取单个白斑于含有Ampicillin(100 mg/L)的液体LB中置于37℃ 200 r/min振荡培养6 h,经菌液PCR鉴定后,将含有正确片段的菌液进行测序。所得序列用Chromas、DNAMAN分析比对,在GenBank注册,并在NCBI下载已知近缘种序列,用MEGA 5.2中的UPGMA法构建禾谷孢囊线虫群体的系统发育树,进行亲缘关系分析。
2结果与分析
2.1 孢囊线虫发生情况
采集到不同地点禾本科牧草的20份根部和根际土样,其中嵩草和矮嵩草根部观察到寄生于根部的白色雌虫(图1),并从其根际土样中分离得到2个浅褐色孢囊群体,每100 g土样中孢囊数分别为36个和54个。孢囊密度较高,表明嵩草和矮嵩草是其良好寄主。但在针茅和披碱草根部均未观察到白雌虫,根际土样也未分离到孢囊(表1)。
2.2 孢囊线虫的形态鉴定
对收集自嵩草和矮嵩草的2个孢囊线虫群体进行形态学观察(图1),孢囊柠檬形,颈部明显,呈浅褐色,孢囊长(584.1±63.2) μm(472~691 μm);孢囊宽(451.9±56.9) μm(264~519 μm)。阴门锥膜孔为双膜孔,无下桥,阴门裂清晰可见。形态测量值分别为:阴门膜孔长(29.2±2.4) μm(25~32 μm);膜孔宽(14.3±1.5) μm(12~17 μm);阴门裂长(8.9±1.6) μm(7~11 μm),且阴门锥下方有较多泡状突。二龄幼虫都为线形,唇区圆,与身体连接处缢缩明显,口针强壮,中食道球发达。尾部呈锥形,有较长的透明区,其相关形态测量值为:线虫体长(382.4±28.9) μm(314.1~421.9 μm);线虫体宽(22.7±2.1) μm(19.5~26.9 μm);体长/虫体最宽处体宽(17.0±1.9) μm(14.1~20.0 μm); 体长/尾长(10.4±1.6) μm(7.0~11.6 μm);尾长(37.3±5.8) μm(28.7~58.6 μm);透明尾长(27.3±5.7) μm(19.1~36.6 μm)。受精卵长(108.4±6.5) μm(97.1~121.1 μm);受精卵宽(48.2±5.0) μm(40.2~55.9 μm);卵量(粒/孢囊) (231.5±36.9) (196~311)。根据上述形态观察和测量值,参考文献[21-23],将分离自甘肃天祝嵩草和矮嵩草的孢囊群体鉴定为禾谷孢囊线虫(H.avenae)。
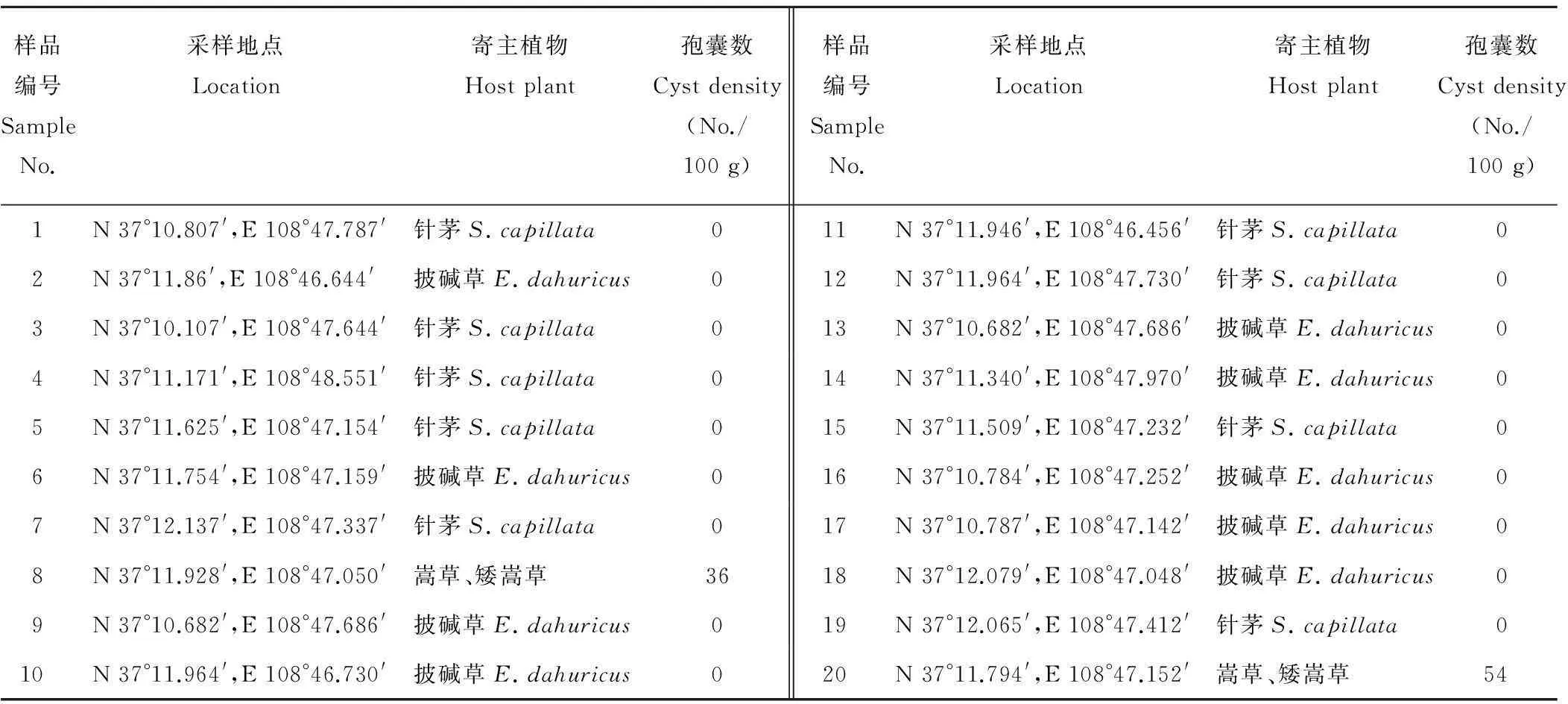
表1 甘肃省天祝高寒草甸牧草孢囊线虫发生情况
嵩草Kobresiasp., 矮嵩草K.humilis.

图1 孢囊线虫形态特征Fig.1 Illustration of cereal cyst nematode A.浅褐色孢囊Cyst;B.受精卵Eggs;C,D.阴门膜孔Fenestra area;E,F.泡状突Ballae;G.二龄幼虫头部Head of second-stage juvenile;H.二龄幼虫尾部Tail of second-stage juvenile;I.矮嵩草K. humilis.
2.3 rDNA-ITS区序列分析
将采集自嵩草和矮嵩草的2个孢囊线虫群体编号为群体Ⅰ和群体Ⅱ,从群体Ⅰ随机挑选10个饱满的孢囊,编号依次为GS1~GS10,从群体Ⅱ随机挑选10个饱满的孢囊,编号依次为GS11~GS20。以AB28和TW81为引物,对上述2个孢囊线虫群体rDNA-ITS进行扩增,得到所有片段长多约为1000 bp,阴性对照无扩增条带出现(图2,图3)。

图2 甘肃天祝嵩草和矮嵩草孢囊线虫群体Ⅰ的rDNA-ITS序列PCR扩增产物Fig.2 PCR products of rDNA-ITS of cyst nematodes population Ⅰfrom Kobresia sp., K. humilis in Tianzhu of Gansu M:Maker(DL2000);N:阴性对照Negative control; 1~10: GS1, GS2, GS3, GS4, GS5, GS6, GS7, GS8, GS9, GS10.
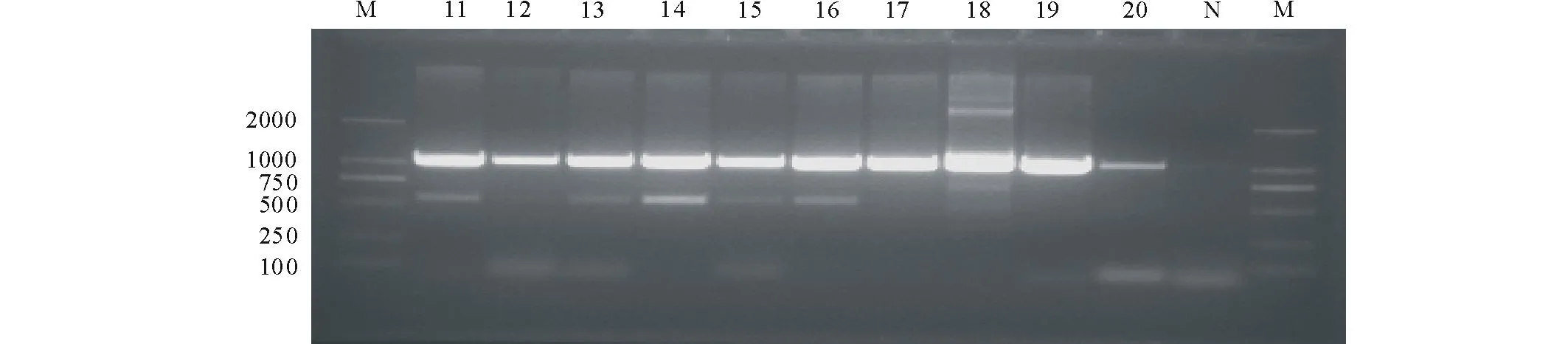
图3 甘肃天祝嵩草和矮嵩草孢囊线虫群体ⅡrDNA-ITS序列PCR扩增产物Fig.3 PCR products of rDNA-ITS of cyst nematodes population Ⅱfrom Kobresia sp., K. humilis in Tianzhu of Gansu M:Maker(DL2000); N: 阴性对照Negative control; 11~20: GS11, GS12, GS13, GS14, GS15, GS16, GS17, GS18, GS19, GS20.
将PCR产物经回收,纯化,克隆和测序,最终得到长度均为1045 bp的ITS序列,将序列提交Genbank并与NCBI下载的ITS序列进行Blast比对,这些序列分别包括Avenae组的有效种(澳大利亚的H.australis,中国、法国、德国、以色列、印度的H.avenae,德国的H.mani,美国的H.filipjevi,英国的H.arenaria)、Schachtii组(伊朗的H.glycines、比利时的H.schachtii)、Goettingiana组(德国的H.goettingiana、荷兰的H.cruciferae、意大利的H.carotae)和比利时H.urticae。用MEGA5.2的UPGMA方法构建ITS区的系统发育树(图4)。

图4 UPGMA法构建的甘肃天祝高寒草甸
H.avenae,禾谷孢囊线虫;H.mani,稀少孢囊线虫;H.filipjevi,菲利普孢囊线虫;H.arenaria,蚤缀孢囊线虫;H.glycines,大豆孢囊线虫;H.schachtii,甜菜孢囊线虫;H.goettingiana,豌豆孢囊线虫;H.urticae,荨麻孢囊线虫;H.cruciferae,十字花科孢囊线虫;H.carotae,胡萝卜孢囊线虫.横线上数字为置信度。Numbers on the line indicate degree of confidence.聚类分析结果表明,所有的序列聚为3个大的分支,其中本研究中的9个禾谷孢囊线虫群体与上述Avenae组的10个群体聚为一个大的分支,H.glycines和H.schachtii聚为一分支,其置信度为100。Goettingiana组3个群体和H.urticae为一类。在Avenae组的分支中,本研究线虫群体与中国的禾谷孢囊线虫和澳大利亚的H.australis群体聚为一个小的分支,其他国家的H.avenae聚在另外一个小的分支中。
3讨论
孢囊线虫病在我国的分布逐年扩大,已成为小麦的重要病害,严重威胁我国粮食的安全生产。农牧交错带农业种植区与草原畜牧区相连接的生态过渡地带,又称半农半牧区或生态脆弱带。在过渡带内,种植业和草地畜牧业在空间上交错分布,具有生态多样性和复杂性。西北农牧交错带是遏制西北荒漠化、沙化东移和南下的生态屏障。处于甘肃中部的天祝高寒草甸草原(东经102°01′-103°40′,北纬36°45′-37°54′)是半农半牧区,麦类作物及禾草种类多样。本研究采集高寒草甸牧草(针茅、披碱草和矮嵩草)根部及根际土壤,观察根部并分离样品中的孢囊。其结果显示,采自嵩草和矮嵩草根际土样中分离到孢囊,在其根部发现白色雌虫。这表明,莎草科嵩草和矮嵩草可以作为禾谷孢囊线虫的寄主。该结果首次表明H.avenae的寄主不局限于禾本科植物,还包括莎草科植物。
禾谷孢囊线虫种群的鉴定目前主要采用形态特征和分子生物学相结合的方法。形态特征鉴定主要包括对孢囊、阴门锥及二龄幼虫形态的观察以及相关体值的测定,但是仅根据形态学和形态测量值区别这12个种比较困难,需要许多专业知识和技巧,用单个个体经常不能鉴定到种的水平。本研究对采集自甘肃天祝高寒草甸草原嵩草和矮嵩草的根际土样中孢囊进行了形态观察和形态体值的测量,形态特征与陈品三等[21]、Zafar[22]和王明祖[23]禾谷孢囊线虫的描述基本一致,但形态测量值略微偏小。形态测量值的略微偏差,可能是生态环境、地域差异造成,不同的寄主也可能对群体分化存在一定的影响。孢囊线虫rDNA-ITS的多种内切酶的RFLP 图谱可用来分析禾谷孢囊线虫种内ITS多态性,彭德良等[19]用11 种限制性内切酶酶切禾谷孢囊线虫ITS 扩增产物,成功地将采集到的禾谷孢囊线虫ITS与摩洛哥群体ITS 分开,分别属于“B 型”和“A型”。欧师琪等[20]用6种限制性内切酶酶切发现,陕西禾谷孢囊线虫群体和青海群体、河南群体不完全一致,呈现丰富的多样性。分子生物学鉴定是通过rDNA-ITS区序列的分子特征分析,结合以形态学鉴定提高了禾谷孢囊线虫种类鉴定的准确性。ITS构建的系统发育树表明,本研究线虫群体与中国的禾谷孢囊线虫、德国的H.pratensis和澳大利亚的H.australis群体聚为一个小的分支,揭示了它们之间具有更高的亲缘关系。
4结论
本研究对寄生于甘肃中部天祝高寒草甸草原牧草(嵩草和矮嵩草)的孢囊线虫群体进行形态学鉴定和rDNA-ITS区序列的分子特征分析。结果显示,该群体均为禾谷孢囊线虫,这是首次报道莎草科嵩草和矮嵩草也是禾谷孢囊线虫的寄主植物。
References:
[1]Rivoal R, Cook R. Nematode pests of cereals. In: Evans K, Trudgill D L, Webster J M. Plant Parasitic Nematodes in Temperate Agriculture[M]. Wallingford, UK: CAB International, 1993: 259-303.
[2]Nicol J, Rivoal R, Vallette S,etal. The frequency and diversity of the cyst and lesion nematode on wheat in the Turkish Central Anatolian Plateau. Nematology, 2002, 4: 272.
[3]Roland N P, Maurice M. Plant Nematology[M]. London: CABI Publishing, 2006.
[4]Fisher J M, Hancock T W. Population dynamics ofHeteroderaavenaeWoll. in South Australia. Australian Journal Agricultural Research, 1991, 42: 53-68.
[5]Chen P S, Wang M Z, Peng D L. A study of cereal cyst-nematode (HeteroderaavenaeWollenweber) in China. Acta Phytopathologic Sinica, 1992, 22(4): 339-342.
[6]Zhang D S, Peng D L, Qi S H. Factors influencing hatching of the cereal cyst nematode from the Northern Part of Huabei plain. Acta Phytopathologic Sinica, 1996, 26(2): 158.
[7]Nicol J, Rivoal R, Taylor S,etal. Global importance of cyst (Heteroderaspp.) and lesion nematode (Pratylenchusspp.) on cereal: distribution, yield loss, use of host resistance and integration of molecular tools. Nematology Monographs, Perspectives, 2003, 2: 12-19.
[8]Yan G P, Smile R W. DistinguishingHeteroderafilipjeviandH.avenaeusing polymerase chain reaction-restriction fragment length polymorphism and cyst morphology. Phytopathology, 2010, 100(3): 216-224.
[9]Yang C G, Wu H P, Tan G J,etal. Investigations on the distribution and damages caused by cereal cyst nematode in Anhui. Plant Protection, 2008, 34(2): 107-110.
[10]Chen X, Zhou H Y, Ma X. Distribution ofHeteroderaavenaein the middle and west regions of Inner Mongolia, China. Plant Protection, 2009, 35(5): 114-117.
[11]Peng D L, Huang W K, Sun J H,etal. First report of cereal cycst nematode (Heteroderaavenae) in Tianjin, China. Nematology Research in China Vol. 4[M]. Beijing: Chinese Agricultural Science and Technology Press,2012.
[12]Li H X, Liu Y E, Wei Z,etal. The detection ofHeteroderaavenaefrom the cereal field in Autonomous regions of Tibet and Xinjiang. Nematology Research in China Vol.4[M]. Beijing: Chinese Agricultural Science and Technology Press, 2012.
[13]Peng D L, Ye W X, Gu X C,etal. First record of the cyst-forming nematodeHeteroderafilipjevion wheat in China. Nematology Research in China Vol.3[M]. Beijing: Chinese Agricultural Science and Technology Press, 2010.
[14]Subbotin S A, Waeyenberge L, Moens M. Identification of cyst forming nematodes of the genus Heterodera (Nematoda: Heteroderidae) based on the ribosomal DNA-RFLPs. Nematology, 2000, 2(2): 153-164.
[15]Scholz U, Sikora A R A. Hatching behavior and life cycle ofHeteroderalatiponsFranklin under Syrian agro-ecological conditions. Nematology, 2004, 6(2): 245-256.
[16]Qi S H, Peng D L, Zhang D S. Preliminary report of host and distribution area of cereal cyst nematode (Heteroderaavenae) in China. Plant Protection, 1994, 20(4): 52.
[17]Wang M Z, Lei Z F, Xiao Y N. Host range of wheat cereal cyst nematode to some important plant. Plant Protection, 1996, 23(1): 2-4.
[18]Subbotin S A, Waeyenberge L, Molokanova I A,etal. Identification ofHeteroderaavenaegroup species by morphometrics and rDNA-RFLPs. Nematology, 1999, 1(3): 195-207.
[19]Peng D L, Subbotin S, Moens M. rDNA restriction fragment length polymorphism ofHeteroderaavenaein China. Acta Phytopathologic Sinica, 2003, 33(4): 323-329.
[20]Ou S Q, Peng D L, Li Y. rDNA-ITS restriction fragment length polymorphism of Qinghai, Shanxi and Henan province China. Acta Phytopathologic Sinica, 2011, 41(4): 411-420.
[21]Chen P S, Wang M Z, Peng D L. Preliminary report of identification on cereal cyst nematode of wheat in China. Scientia Agricultura Sinica, 1991, 24(5): 89-91.
[22]Zafar A H. Key and compendium to species of theHeteroderaavenaegroup (Nematoda: Heteroderidae). Journal of Nematology, 2002, 34(3): 250-262.
[23]Wang M Z. Studies on a cyst nematode wheat disease I. identification of pathogen. Journal of Huazhong Agricultural University, 1991, 10(4): 352-356.
参考文献:
[5]陈品三, 王明祖, 彭德良.我国小麦禾谷孢囊线虫HeteroderaavenaeWollenweber鉴定研究.植物病理学报, 1992, 22(4): 339-342.
[6]张东升, 彭德良, 齐淑华. 华北平原北部禾谷孢囊线虫的孵化特点. 植物病理学报, 1996, 26(2): 158.
[9]杨传广, 吴慧平, 檀根甲, 等. 安徽省小麦孢囊线虫田问分布及危害调查.植物保护, 2008, 34(2): 107-110.
[10]陈新, 周洪友, 马玺. 内蒙古中西部地区小麦禾谷孢囊线虫的发生分布. 植物保护, 2009, 35(5): 114-117.
[11]彭德良, 黄文坤, 孙建华, 等. 我国天津发现小麦禾谷孢囊线虫. 植物线虫学研究(第四卷)[M]. 北京: 中国农业科学技术出版社, 2012.
[12]李惠霞, 柳永娥, 魏庄, 等. 新疆和西藏发现禾谷孢囊线虫的分布. 植物线虫学研究(第四卷)[M]. 北京: 中国农业科学技术出版社, 2012.
[13]彭德良, 叶文兴, 顾晓川, 等. 我国发现菲利普孢囊线虫(Heteroderafilipjevi)危害小麦.中国植物线虫学研究(第三卷)[M]. 北京: 中国农业科学技术出版社, 2010.
[16]齐淑华, 彭德良, 张东升. 禾谷孢囊线虫在我国的新寄主及新分布区初报.植物保护, 1994, 20(4): 52.
[17]王明祖, 雷智峰, 肖炎农. 小麦禾谷包囊线虫寄主范围研究. 植物保护, 1996, 23(1): 2-4.
[19]彭德良, Subbotin S, Moens M. 小麦禾谷孢嚢线虫(Heteroderaavenae)的核糖体基因(rDNA) 限制性片段长度多态性研究.植物病理学报, 2003, 33(4): 323-329.
[20]欧师琪, 彭德良, 李玉. 青海、陕西部分地区禾谷孢囊线虫rDNA-ITS-RFLP的特征分析.植物病理学报,2011, 41(4): 411-420.
[21]陈品三, 王明祖, 彭德良. 我国小麦禾谷孢囊线虫(HeteroderaavenaeWollenweber)的发现与鉴定初报.中国农业科学, 1991, 24(5): 89-91.
[23]王明祖.小麦孢囊线虫病的研究I:病原鉴定. 华中农业大学学报, 1991, 10(4): 352-356.
