GA3和CEPA对香水百合开花期光合生理和抗氧化酶活性的影响及其花期响应研究
2016-01-27孙位潘远智覃琳岚
孙位,潘远智,2*,覃琳岚
(1.四川农业大学风景园林学院,四川 成都 611130;2.四川农业大学园林研究所,四川 成都 611130)
GA3和CEPA对香水百合开花期光合生理和抗氧化酶活性的影响及其花期响应研究
孙位1,潘远智1,2*,覃琳岚1
(1.四川农业大学风景园林学院,四川 成都 611130;2.四川农业大学园林研究所,四川 成都 611130)
摘要:以香水百合为材料,采用盆栽试验,研究了在不同浓度赤霉素(GA3)、乙烯利(CEPA)的处理影响下,香水百合的花期(现蕾期、初花期、盛花期和末花期)变化、光合生理和抗氧化酶活性的变化及其花期响应。结果表明,1)在香水百合开花期,GA3和CEPA处理均不同程度地提高了香水百合株高、茎粗、蕾长和花径,并提前了初花期,延长了开花时间。GA3与株高、茎粗和蕾长呈显著正相关,对开花前中期影响显著,而CEPA与茎粗、蕾长和花径呈显著正相关,与末花天数呈显著负相关;2)GA3和CEPA处理提高了各时期光合色素含量,并有效缓解了末花期叶绿素的下降趋势,延长了光合作用时间;3)GA3和CEPA处理显著提高了香水百合开花期Pn、Gs、Tr和Ls,而Ci和LUE与其他参数呈负相关关系,分析表明,GA3和CEPA处理增强了花期叶片细胞的活性,提高了叶片的光合作用强度;4)GA3和CEPA处理的百合叶片MDA含量在开花各时期显著低于对照,抗氧化酶SOD、CAT活性上升,同时,处理减缓了开花中后期SOD下降趋势,有效缓解了衰老进程,达到延长香水百合花期的目的。综合分析表明,GA3和CEPA提高了香水百合开花各时期的光合特性,并增强了抗氧化酶活性,进而对香水百合开花品质和开花花期有显著影响。其中,GA3200 mg/L+CEPA 30 mg/L协同处理对提前花期和延长开花持续天数的调节效果最佳,其次为单水平GA3200 mg/L处理和单水平CEPA 60 mg/L处理,高浓度GA3200 mg/L+CEPA 60 mg/L和GA3300 mg/L+CEPA 30 mg/L的调节作用下降。
关键词:赤霉素;乙烯利;花期;光合特性;抗氧化酶
DOI:10.11686/cyxb2015041http://cyxb.lzu.edu.cn
孙位, 潘远智, 覃琳岚. GA3和CEPA对香水百合开花期光合生理和抗氧化酶活性的影响及其花期响应研究. 草业学报, 2015, 24(8): 73-84.
Sun W, Pan Y Z, Qin L L. Effects of GA3and CEPA on photosynthetic characteristics and antioxidant enzymes in the flowering phase and the flowering response ofLiliumcasablanca. Acta Prataculturae Sinica, 2015, 24(8): 73-84.
收稿日期:2015-01-21;改回日期:2015-04-08
基金项目:四川农业大学学科建设双支计划项目资助。
作者简介:孙位(1989-),男,四川成都人,在读硕士。E-mail: 1003102365@qq.com
通讯作者*Corresponding author. E-mail: scpyzls@163.com
Effects of GA3and CEPA on photosynthetic characteristics and antioxidant enzymes in the flowering phase and the flowering response ofLiliumcasablanca
SUN Wei1, PAN Yuan-Zhi1,2*, QIN Lin-Lan1
1.CollegeofLandscapeArchitecture,SichuanAgriculturalUniversity,Chengdu611130,China; 2.InstituteofLandscapeArchitectureofSichuanAgriculturalUniversity,Chengdu611130,China
Abstract:The process changes of flowering phase(the squaring stage, the early flowering stage, blooming stage, ending flowering) and the changes of photosynthetic characteristics, antioxidant enzymes, the flowering response of Lilium casa blanca were studied using the bulbs of L. casa blanca as pot experimental material under the coordination treatment of gibberellin (GA3) and ethrel (CEPA).The results showed that, 1) It increased the plant height, thick stems, bud length and flower diameter,advanced the blooming stage and extended the days of blossom of L. casa blanca under the treatment of GA3and CEPA during the flowering phase. There were significantly positive correlation between GA3and plant height, stem diameter and bud length, while there were a significantly positive correlation between CEPA and stem diameter, bud length and flower diameter. GA3made a significant influence in earlier and middle flowering in L. casa blanca. However, CEPA made a significantly negative correlation with ending flowering; 2) The treatment of GA3and CEPA both advanced the photosynthetic pigment in leaves of L. casa blanca, and alleviated the downward trend of chlorophyll at the ending flowering time effectively, also it prolonged the photosynthesis time in leaves; 3) The treatment of GA3and CEPA both significantly promoted photosynthetic rate (Pn), conductance to H2O (Gs), transpiration rate (Tr) and stomatal limitation value (Ls), But there were a significantly negative correlation between intercellular CO2concentration (Ci), transient energy utilization efficiency (LUE) and others. Analysis showed that, the treatment of GA3and CEPA enhanced the activity of leaf cells, increased the intensity of photosynthesis in leaf; 4) MDA content in leaves is lower than CK significantly under the treatment of GA3and CEPA during the flowering phase, and the activity of SOD and CAT increased. At the same time, the treatment of GA3and CEPA slowed down the downward trend of SOD activity in the middle and ending flowering time, relieved the ageing process of L. casa blanca, and it reached the purpose of extending the time of blossom of L. casa blanca. Comprehensive analysis shows that, the treatment of GA3and CEPA advanced the photosynthetic characteristics and antioxidant enzymes of L. casa blanca, It made a significant influence in the blossom quality and flowering phase. Among them, the coordination treatment GA3200 mg/L+CEPA 30 mg/L is the best in regulation on advancing flowering time and extending the days of blossom in L. casa blanca, followed by the single treatment CEPA 60 mg/L and GA3200 mg/L. However, the adjust action decreased in high concentrations coordination treatment GA3200 mg/L+CEPA 60 mg/L and GA3300 mg/L+CEPA 30 mg/L.
Key words:gibberellin (GA3); ethrel (CEPA); flowering phase; photosynthetic characteristics; antioxidant enzymes
百合(Liliumspp.)是单子叶植物亚纲百合科(Liliaceae)百合属(Lilium)的所有种类的总称,属多年生鳞茎草本植物[1-3]。香水百合(Liliumcasablanca)是东方百合的一个杂交变种,属温带球根花卉,其叶片青翠娟秀,花色艳丽,花朵有特殊香气,是点缀花园、庭院的名贵花卉,国内外香水百合鲜切花消费需求量巨大。
随着花卉产业的快速发展,植物生长调节剂越来越多地应用于促进花卉开花和提高花卉品质。其中,赤霉素(gibberellin, GA3)和乙烯利(ethrel, CEPA)是两种不同性质的植物生长调节剂,对植物开花有不同的作用机理。作为花期调控的重要手段,Blankenship等[4],Sodi等[5]研究发现,高浓度CEPA可促进新铁炮百合开花。Elgar等[6]也认为,一定浓度的CEPA处理可将百合花蕾半数开放的时间减少到2~3 d。陈诗林和黄敏玲[7]研究表明,低浓度GA3处理可以提早百合花期,使花期集中。而赵莉等[8]研究认为,低浓度GA3要配合施用一定浓度IBA和6-BA才能提前花期,并增加蕾长和花径。目前,在植物花期调控中,有关植物生长调节剂对光合作用和抗氧化作用影响的报道较少。任艳芳等[9]发现,在脐橙(Citrussinesiscv. Newhall)开花进程中,MDA含量逐渐上升,SOD、CAT和GPX活性呈先升高后降低的趋势,APX活性则是逐渐降低,在开花后期MDA积累量过大,花朵开始衰败。李永华等[10]表明,非洲菊(Gerberahybridvar.diablo)在开花前、中和后期净光合速率变化不显著,在开花后仍然维持较高的水平,这可能与非洲菊连续开花的特性有关。大量研究认为[11-15],在植物开花期,需要较多的能量供应,这时光合作用强度提高,同时,随着开花与衰老的进程,抗氧化酶活性也表现出相应的变化规律,通过植物开花期光合作用和抗氧化酶活性变化可以反应花期进程[8,16],为植物花期调控提供理论依据。因此,本试验采用香水百合材料,研究赤霉素、乙烯利两种植物生长调节剂的不同浓度处理影响下,香水百合开花进程,光合生理和抗氧化酶活性的变化以及光合生理和抗氧化酶活性对花期的响应,进一步探讨外源激素对香水百合花期的调节机制。
1材料与方法
1.1 试验材料
试验于2012年11月至2013年8月在四川农业大学农场4号试验基地进行。供试土壤由腐叶土,园土,细沙按3∶1∶1的比例配成。将园土碾碎、自然风干、剔除杂物,再与腐叶土按比例混匀后过5 mm钢筛。土壤pH=7.15,碱解氮(N)210.32 mg/kg,速效磷(P)100.25 mg/kg,速效钾(K)88.5 mg/kg,有机质含量为10.3 mg/kg。供试香水百合选择荷兰进口香水百合品种“天霸”,周径为14~16 cm。并采用口径35 cm、高20 cm的塑料盆为栽培容器。
1.2 试验设计
本研究共进行8个水平盆栽处理(表1),分别用不同浓度的GA3和CEPA混合液浸泡百合种球40 min,1号处理采用蒸馏水浸球,作为对照(CK)。将处理后的种球晾干后定植于塑料盆中,每个处理15个种球,随机排列,3次重复。

表1 试验因素与水平
1.3 测定指标与方法
参考彭桂群和王力华[17]、赵家昱等[18]花期划分,80%植株现蕾为现蕾期;5%的花蕾已经形成完整的花,80%的花蕾已经露瓣的时期为初花期;80%的花蕾已经形成完整花的时期为盛花期;80%的花已经开始凋谢、枯萎的时期为末花期。从初花期开始到衰败期开始的开花总天数为开花持续天数。
蕾长:花蕾与花梗连接处与花蕾顶点之间的距离;花径:花朵开放第1天花的直径;茎粗:茎干基部的直径(用游标卡尺测量)。株高:地表至花梗基部垂直于地面的植株长度(用卷尺测量)。
光合参数测定:于2013年6月16日(无风晴天),随机选取各处理5株供试植株,从上至下第5~6片叶片,利用光合测定仪Li-6400(Li-Cor,Lincoln,Nebraska,USA)测定净光合速率(photosynthetic rate,Pn)、气孔导度(conductance to H2O,Gs)、胞间二氧化碳浓度(intercellular CO2concentration,Ci)、蒸腾速率(transpiration rate,Tr)、瞬时光能利用效率(transient energy utilization efficiency, LUE)和气孔限制值(stomatal limitation value,Ls)。
于现蕾期、初花期、盛花期和末花期分别取样,从上往下数取供试植株第7~8片叶,去中脉剪碎后进行充分混合、称量,测定光合色素和抗氧化酶活性指标,每次测定重复3次。
光合色素测定:参照高俊凤[19]的方法,称取0.5 g百合叶片,剪碎,然后装入锥形瓶中。加入15 mL 80%的丙酮,当叶片完全变白时,倾出浸提液,在分光光度计663,645,470 nm下测其光密度,并计算光合色素含量。
抗氧化酶测定:参照熊庆娥[20]的方法,略作改进,采用氮蓝四唑法测定超氧化物歧化酶(SOD)活性和硫代巴比妥酸法测定丙二醛(MDA)。参照李合生[21]紫外分光光度法测定过氧化氢酶(CAT)活性。
1.4 数据处理
采用SPSS 18.0软件对不同水平处理进行单因素方差分析(one-way ANOVA),并用最小显著差异法(LSD)检验数据差异性(α=0.05),Duncan’s进行多重比较、相关性和线性回归分析。数据经Origin 9.0整理制图。
2结果与分析
2.1 GA3和CEPA对香水百合开花品质和花期的影响
2.1.1GA3和CEPA对香水百合开花品质的影响由表2可知,香水百合的株高、茎粗、蕾长和花径在GA3和CEPA条件下,均高于对照。其中,单水平GA3处理(2号、3号)株高和蕾长增长显著(P<0.05),分别比对照增加了15.89%和15.93%,13.73%和15.19%。单水平CEPA处理(4号、5号)显著促进茎粗、蕾长和花径的增长。协同处理中,6号处理的株高、茎粗、蕾长均最高,分别比对照增长了16.09%,25.44%和22.49%,差异显著。高浓度CEPA和高浓度GA3协同处理(7号、8号)对香水百合的形态增长的促进作用下降,与对照没有显著差异(P>0.05)。由表3可知,GA3处理对香水百合的株高、茎粗和蕾长的影响呈显著正相关,其中对蕾长的影响达到了极显著水平(P<0.01),而对花径的影响不显著。CEPA处理对香水百合的茎粗、蕾长和花径影响均达到极显著正相关水平,而对株高影响不显著。同时,协同处理中,低浓度GA3和CEPA对开花品质效果最好,高浓度则出现抑制作用。

表2 GA3和CEPA对香水百合开花品质的影响
注:同列不同小写字母表示在不同处理之间差异显著(P<0.05),下同。
Note: Different small letters in the same column indicate significant difference among the different treatments atP<0.05. The same below.
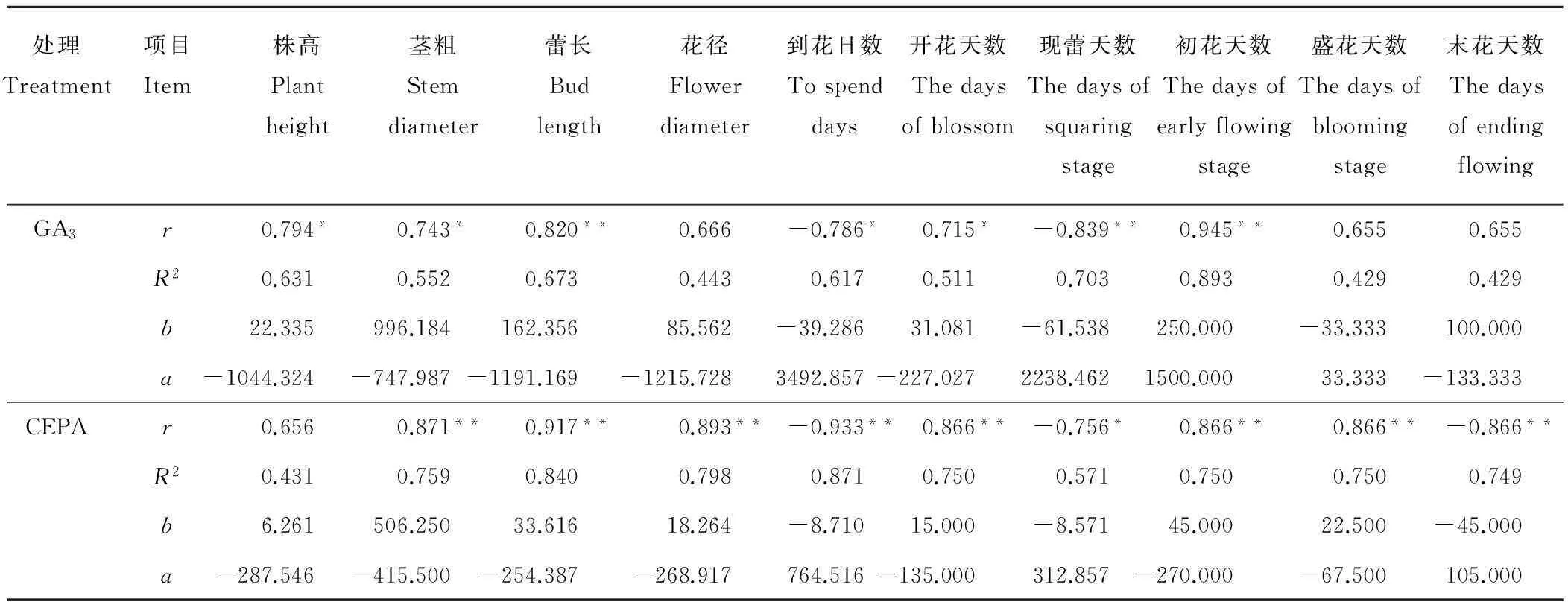
表3 GA3和CEPA对香水百合开花特性的相关性与线性回归分析
注:r、R2、b和a分别表示Pearson相关系数、决定系数、回归直线斜率和回归直线截距,*和**分别表示显著(P<0.05)和极显著相关(P<0.01)。
Note:r,R2,bandarepresent the Pearson correlation coefficient, the coefficient of determination, the regression line slope and the regression line intercept, respectively. * and ** represent significant (P<0.05) and highly significant correlation (P<0.01), respectively.
2.1.2GA3和CEPA对香水百合花期的影响由表4可知,GA3和CEPA处理对香水百合的花期调控有不同影响,其中,6号处理的现蕾期(5月20日)最早,到花日数最短(80 d),开花持续天数较长(16 d),与对照CK相比,差异达到显著水平(P<0.05)。在末花期,2号处理(低浓度GA3)和3号处理(高浓度GA3)的末花天数,分别比对照CK延长了2和1 d,而4号处理(低浓度CEPA)和5号处理(高浓度CEPA)的末花天数却比对照提前了2和1 d。7号处理和8号处理缩短了百合的到花日数,延长了开花持续天数,但与对照相比差异不显著。相关性分析表明(表3),GA3处理和CEPA处理分别与到花日数和现蕾天数呈显著负相关(P<0.01),与初花天数和盛花天数呈极显著正相关,说明GA3处理和CEPA处理均能促使香水百合提前开花,而CEPA处理与末花天数呈极显著负相关,加速香水百合花衰老。同时,GA3处理和CEPA处理与开花天数呈显著正相关关系,CEPA处理更是达到极显著水平,说明两种激素均不同程度地延长了香水百合开花时间,CEPA处理虽然使衰老提前,但由于同时提前了开花期,反而也延长了开花持续天数。
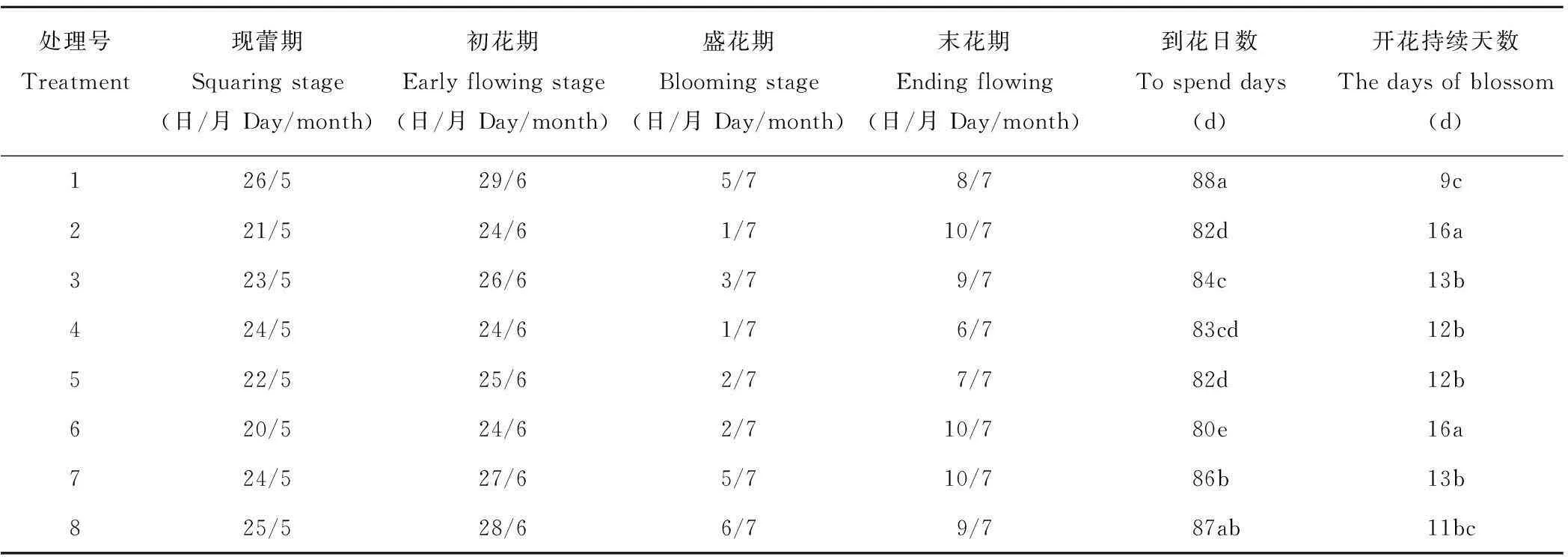
表4 GA3和CEPA对香水百合花期的影响
2.2 GA3和CEPA对香水百合光合生理的影响
2.2.1GA3和CEPA对香水百合光合色素含量影响由表5可知,在开花期(现蕾期、初花期、盛花期、末花期),各处理的叶绿素a(Chla)和类胡萝卜素(Car)含量呈逐渐下降的趋势,叶绿素b(Chlb)和叶绿素(Chl)呈先上升后下降的变化趋势,在初花期达到最大值,末花期降至最低。在不同水平GA3和CEPA处理下的开花各时期,香水百合叶片Chla、Chlb、Chl和Car含量均显著高于对照CK(P<0.05)。其中,在开花各时期,6号处理的Chla、Chlb、Chl和Car含量均最高,2号处理(低浓度GA3)和5号处理(高浓度CEPA)的Chla、Chlb和Chl含量均分别显著高于3号处理(高浓度GA3)和4号处理(低浓度CEPA),7号处理和8号处理的Chla、Chlb、Chl含量分别显著低于6号处理和单水平GA3(2号、3号)处理、单水平CEPA(4号、5号)处理,而Car含量只在现蕾期、初花期和盛花期,2号处理高于3号处理,5号处理高于4号处理,有显著差异。7号处理和8号处理显著低于6号处理。同时,对照CK的Chla、Chlb和Chl含量在末花期下降较大,分别比盛花期下降了9.40%,36.70%和18.01%,8号处理下降了7.01%,17.46%,7.95%,而5号处理、2号处理分别只下降了4.32%,9.50%,6.17%和2.10%,5.14%,4.77%,而Car含量在末花期下降不显著(P>0.05)。
2.2.2GA3和CEPA对香水百合气体交换参数和瞬时光能利用效率的影响由表6可知,GA3和CEPA处理对香水百合气体交换参数和瞬时光能利用效率的影响显著(P<0.05)。与对照相比,6号处理的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和气孔限制值(Ls)最高,而胞间二氧化碳浓度(Ci)和瞬时光能利用效率(LUE)最低,差异达到显著水平。2号处理(低浓度GA3)和5号处理(高浓度CEPA)分别比3号处理(高浓度GA3)和4号处理(低浓度CEPA)在净光合速率(Pn)、蒸腾速率(Tr)和瞬时光能利用效率(LUE)等参数变化更大,差异达到显著水平。说明,低浓度GA3处理和高浓度CEPA处理对香水百合叶片光合生理作用的影响效果更好。与对照CK相比,高浓度CEPA和高浓度GA3处理(7号、8号)对净光合速率(Pn)、蒸腾速率(Tr)的影响达显著水平,而对气孔导度(Gs)、胞间二氧化碳浓度(Ci)、瞬时光能利用效率(LUE)和气孔限制值(Ls)的影响不显著(P>0.05)。相关性分析表明(表7),叶片Pn与Gs、Ls和Tr呈显著正相关,与Ls更达到了极显著水平(P<0.01),而与Ci和LUE呈显著负相关,与LUE也达到极显著水平。说明,GA3处理和CEPA处理均不同程度增强了叶片细胞的活性,提高了叶片的光合生理,并有效调节了香水百合开花期光合作用。
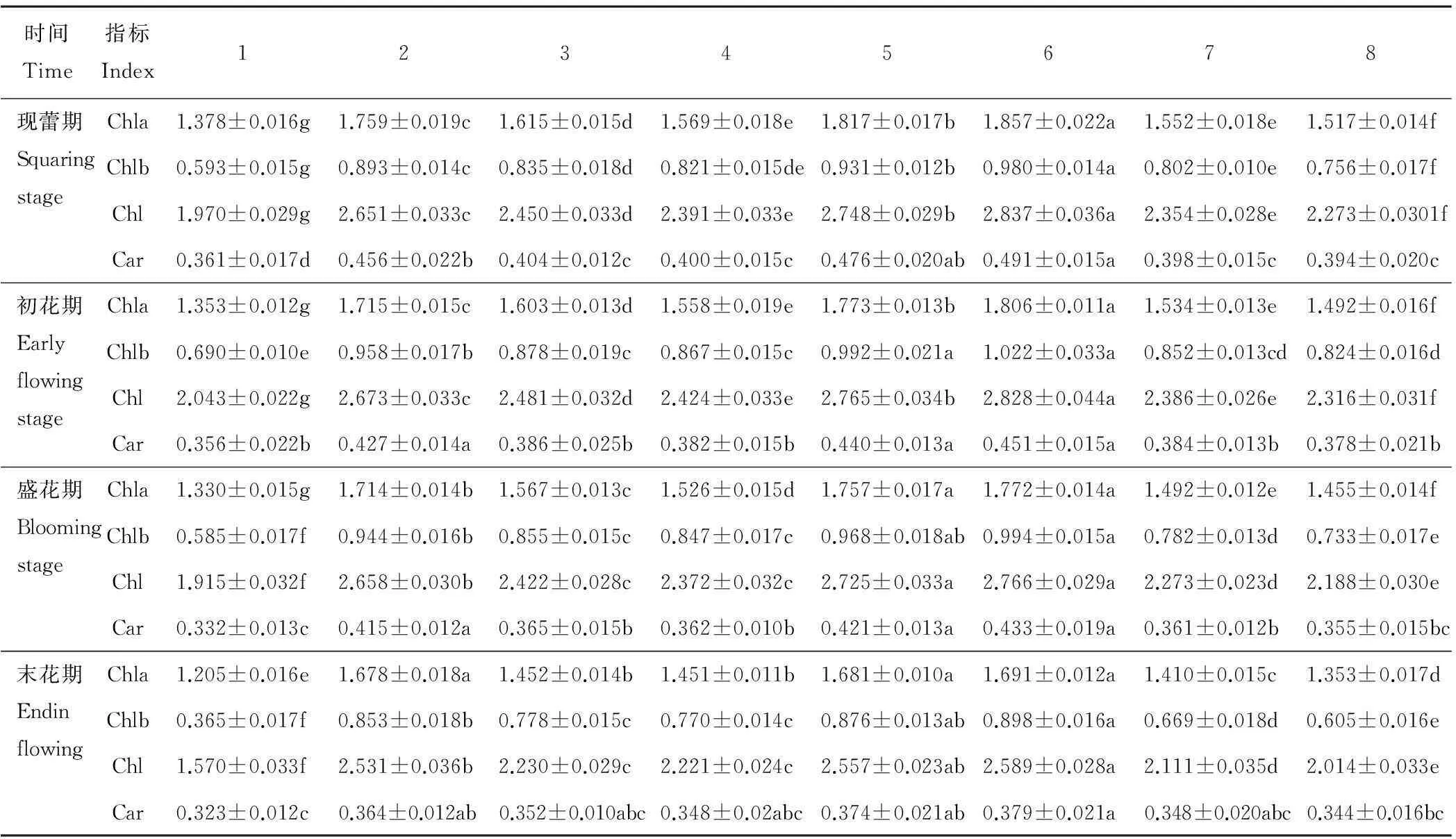
表5 GA3和CEPA对香水百合叶片光合色素含量的影响(平均值±标准差)
注:同行不同小写字母表示在不同处理之间差异显著(P<0.05)。
Note: Different small letters in the same row indicate significant difference among the different treatments atP<0.05.
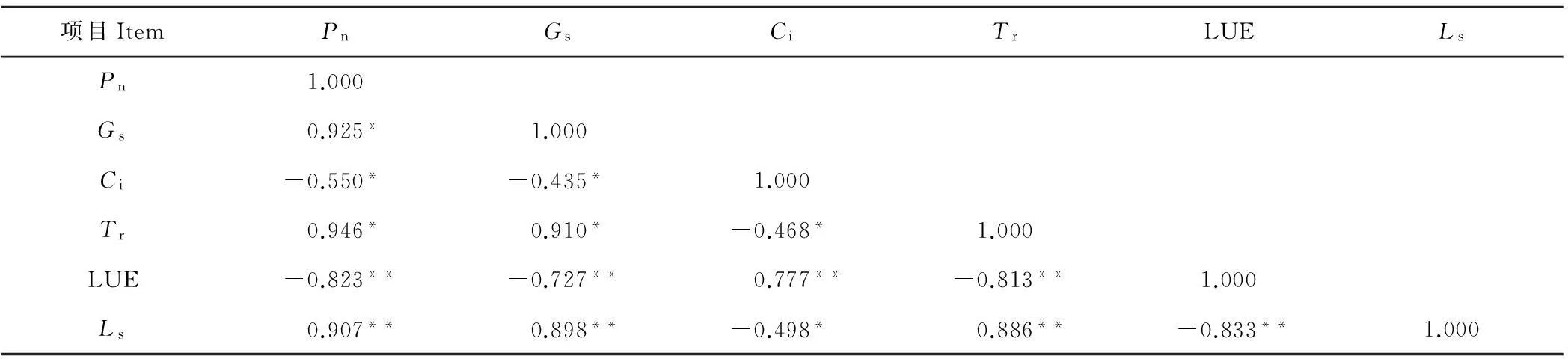
表7 GA3和CEPA对百合叶片气体交换参数和瞬时光能利用效率的相关性(n=24)
注:表中结果根据GA3和CEPA在8个处理水平的数据计算。 *,P<0.05(双侧);**,P<0.01(双侧);下同。
Note:Results in the table are calculated based on data of eight concentration treatment levels of GA3and CEPA,*P<0.05(bilateral); **P<0.01(bilateral); The same below.
2.3 GA3和CEPA对香水百合叶片酶活性影响
2.3.1GA3和CEPA对香水百合叶片SOD活性影响由图1可知,香水百合叶片中SOD活性在整个开花期呈先上升后下降的趋势,在初花期达到最大值,末花期降至最低。其中,与对照相比,6号处理的SOD活性在各开花期最高,差异达到显著水平。2号处理(低浓度GA3)在盛花期和末花期显著高于3号处理(高浓度GA3),而在现蕾期和初花期差异不显著(P>0.05)。5号处理(高浓度CEPA)的SOD活性在开花各时期显著低于4号处理(低浓度CEPA)。说明低浓度GA3处理和高浓度CEPA处理对提高SOD活性的效果更好,尤其在末花期对叶片的抗氧化作用更加明显。但7号处理和8号处理对SOD活性提高作用在各开花期显著低于6号处理,也低于单水平GA3(2号、3号)处理、单水平CEPA(4号、5号)处理。
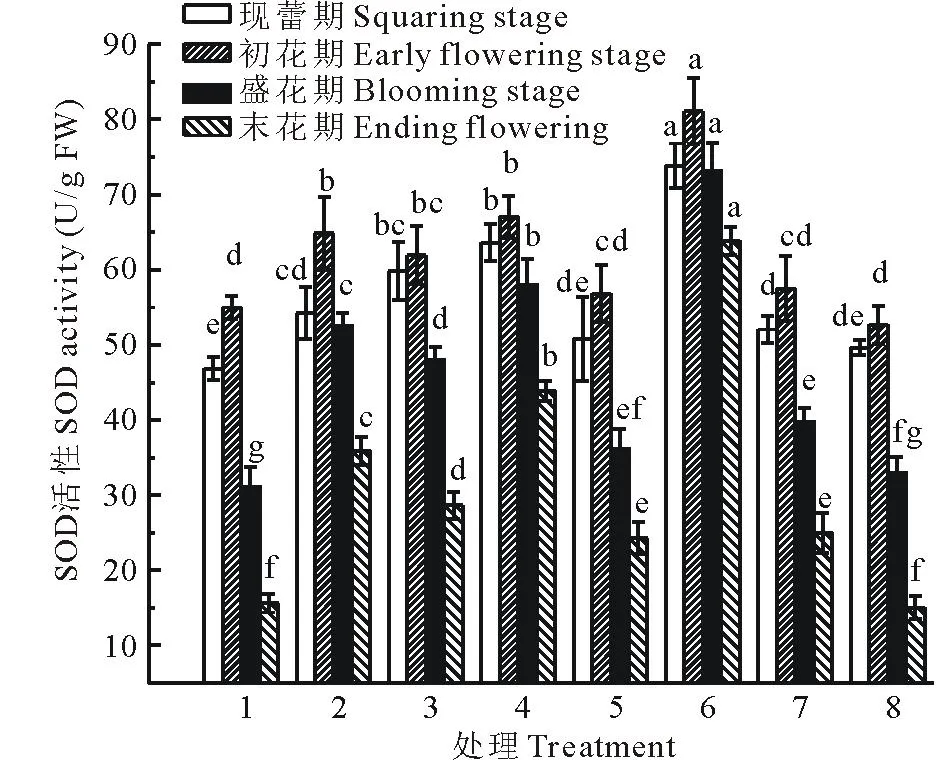
图1 SOD活性变化Fig.1 Changes of SOD activity 图中不同小写字母表示相同开花期在不同处理间差异显著(P<0.05)。下同。Different small letters above the bars indicate significant difference in the same flowering phase at P<0.05. The same below.
2.3.2GA3和CEPA对香水百合叶片CAT活性影响由图2可知,香水百合叶片中CAT活性在开花期呈先上升后下降的趋势,在初花期达到最大值,末花期降至最低。其中,6号处理的CAT活性在开花各时期最高,分别比对照高32.49%,28.29%,20.02%和19.19%,差异达到显著水平(P<0.05)。2号处理(低浓度GA3)比3号处理(高浓度GA3)在开花各时期提高效果较好,5号处理(高浓度CEPA)和4号处理(低浓度CEPA)也有促进作用,但差异不显著(P>0.05)。7号处理和8号处理也提高了CAT活性,但低于6号处理和单水平GA3(2号、3号)处理和单水平CEPA(4号、5号)处理。说明,GA3处理和CEPA处理提高了香水百合叶片CAT活性,增强了叶片抗氧化作用,延缓了植株衰老,低浓度GA3和CEPA协同处理效果最好,而高浓度GA3和CEPA协同处理对叶片衰老的缓解作用下降。

图2 CAT活性变化Fig.2 Changes of CAT activity
2.3.3GA3和CEPA对香水百合叶片MDA含量的影响由图3可知,各处理的MDA含量在整个开花期呈上升的趋势,在现蕾期最低,末花期达到最高。在香水百合的开花进程中,与对照相比,6号处理的MDA含量在开花各时期最低,差异达到显著水平(P<0.05),其次为2号处理和4号处理。2号处理(低浓度GA3)与3号处理(高浓度GA3)在开花各时期差异不显著(P>0.05)。4号处理(低浓度CEPA)比5号处理(高浓度CEPA)在开花各时期含量较低,除末花期外,其他各时期差异不显著。在开花中后期,7号处理和8号处理的MDA含量显著高于其他处理,但7号处理和8号处理之间没有显著差异。说明,GA3处理和CEPA处理能显著降低开花各时期叶片中MDA含量,但GA3处理之间和CEPA处理之间差异不显著,而高浓度CEPA和GA3协同处理对开花中后期MDA抑制效果降低。

图3 MDA含量变化Fig.3 Changes of MDA content
2.3.4GA3和CEPA对香水百合叶片抗氧化酶活性相关性分析由表8分析表明,在开花各时期香水百合叶片SOD活性与MDA含量呈显著负相关(P<0.05),在开花中后期达到了极显著水平(P<0.01)。同时,在开花中后期CAT活性较高(图6),与MDA含量呈显著负相关,在末花期也达到了极显著水平。说明,GA3处理和CEPA处理均显著提高了SOD和CAT活性,并有效清除开花过程中过氧自由基,尤其在开花中后期SOD和CAT显著抑制了MDA含量,减缓了百合花衰败,延长了百合开花时间。
3讨论
3.1 GA3、CEPA对香水百合花期及其开花品质的影响
GA3具有促进细胞分裂与伸长生长的作用,能显著促进百合株高的增加,而对茎粗有一定抑制作用[15],同时适宜的浓度能提高开花整齐度[22-23],较低浓度GA3处理可以提早百合花期,增加花径[7]。大量研究认为,百合多数品种对CEPA敏感[24-25],它可以促进百合花蕾开放,提早开花,但同时加速衰老[26]。本研究显示,GA3和CEPA均不同程度地提高了百合开花品质(表2),GA3能显著提高百合株高(表2),并且低浓度GA3(2号处理)促进效果更好,这与黄樟华[15]的研究结果一致。但对花径影响不显著,这可能是因为GA3促进百合前期营养生长,而对进入开花期的生殖生长影响减弱。CEPA对百合茎粗、蕾长和花径的促进作用均达到极显著水平,而且高浓度促进效果更加明显,然而对株高影响不显著(表3),蔡宣梅等[22]研究也有类似观点。同时,GA3处理和CEPA处理都提前了香水百合开花进程,延长了开花持续天数,但作用效果不同。相关性分析表明(表3),GA3和CEPA处理与到花日数和现蕾天数呈显著负相关,与初花天数和盛花天数呈极显著正相关,能够促进百合提前进入初花期,缩短现蕾天数,但是CEPA处理与末花天数呈极显著负相关。因此,CEPA处理促进百合提前开花,但也加速了衰老。这可能是因为,CEPA处理在促进提前开花的同时,不仅加速了开花进程中相关的生理代谢[27],同时也对花器官造成了一定的损伤,对香水百合开花形成一定的负效应,从而影响了香水百合开花质量。而协同处理(6号处理)的株高、茎粗、蕾长和花径均显著地提高,到花日数比单水平处理提前2~4 d,开花持续天数延长3~4 d,不仅有效缓解了单一CEPA处理末花期的衰老现象,也比高浓度协同处理延长3~5 d。同时,开花整齐度和开花率也明显好于单一处理。但是,高浓度GA3和CEPA协同处理下(7号、8号处理)的香水百合开花效应明显降低。GA3与CEPA协同处理在一定程度上缓解了CEPA对开花的负作用,有利于GA3对增加株高、延长花期等开花效应的表达,同时CEPA的施入也削弱了GA3对茎粗和蕾长的抑制作用。因此,应用GA3和CEPA协同作用有效改善了香水百合开花效应,调节了香水百合花期,但同时,GA3和CEPA协同调节香水百合开花与处理的浓度有很大的关系,高浓度GA3和CEPA协同处理,对开花质量和花期都产生显著的负效应,这与Rood[28]的研究结论相吻合。但对于香水百合(Liliumcasablanca)的花朵开放与衰老来说,外源激素协同作用有关的浓度与平衡关系,还有待进一步研究确证。

表8 GA3和CEPA对百合叶片抗氧化酶
3.2 光合生理变化对香水百合花期的响应
光合色素是植物进行光合作用的物质基础,其含量的高低反映了叶片光合作用的强弱,植物生长调节剂对调控植物的光合色素具有重要的作用[29-31],通过调控光合色素含量,可以调节开花各时期植物的光合能力,达到调控花期的目的。本研究中,单水平GA3和CEPA处理均不同程度提高了各开花时期的Chla、Chlb、Chl和Car含量,并且随开花进程效果更明显,在末花期显著缓解了光合色素下降趋势(表5),这些表现与各处理较高的光合强度相一致(表6),与赵莉等[8]的研究结果相同。其中,在开花各时期低浓度GA3和CEPA协同处理对光合色素的增加效果最好,而高浓度处理的光合色素开始降低,但显著高于对照。这可能有两方面的原因,其一,一定浓度的植物生长调节剂促进了香水百合体内养分积累和矿物质的运输,导致了光合色素的增多,光合作用明显增强,而高浓度协同处理导致植物体内代谢活动过快,造成相关组织的损伤,反而加重了植物开花期体内营养物质的积累和运输负担,因而进一步使开花相关的水分蒸腾、碳水化合物和蛋白质代谢等活动紊乱,导致光合色素含量的下降。其二,适宜浓度的植物生长调节剂提高了香水百合叶片中的相关抗氧化酶活性(图1,图2),提高了植物清除体内活性氧的能力,使光合色素结构免遭破坏而分解,延长了光合作用时间。而高浓度协同处理抑制了开花各时期的抗氧化酶活性,不利于对开花后期光合色素的保护。同时,Car 既是光合色素,又是内源抗氧化剂,在细胞内还可以淬灭活性氧,防止膜脂过氧化[32],本试验中,适宜浓度处理的Car在开花中后期下降趋势缓慢(表5),有效地协同抗氧化酶清除衰老过程中产生的活性氧,保护了Chl细胞膜,这对延长光合作用和开花持续时间具有重要意义。
光合作用强弱直接影响着植物生长开花进程,光合气体交换参数的测定是了解植物光合调控机理的重要方法。Farquhar和Sharkey[33]认为,如果Ci和Pn变化方向相同且减少,Ls增大时,可认为光合速率的变化主要是由于Gs导致的,如果Pn下降,Ci上升,Ls减少,则可认为光合速率变化的决定因素是叶肉细胞活性。本研究表明,单水平GA3和CEPA处理均对香水百合光合气体参数有提高的作用,在两者低浓度协同作用时,能显著提高开花各时期Pn、Gs和Ls,并与胞间二氧化碳浓度(Ci)呈显著负相关(表7),说明GA3和CEPA通过提高香水百合开花期叶肉细胞活性增强了叶片对外界CO2吸收能力,提高了开花进程中光合速率,同时,较高的Tr促进了叶片体内水分传导,加快体内矿物质运输,也促使光合速率的提高(表6)。而高浓度GA3和CEPA协同处理对气体交换参数的提高作用开始下降,这也与光合色素的相关变化表现一致,与李改丽等[31]研究结果类似。因此,适宜浓度GA3和CEPA协同处理显著增强了开花期叶片细胞的活性,提高了叶片的光合生理,并有效调节了香水百合开花期光合作用。
3.3 抗氧化酶活性对香水百合花期的响应
植物随着开花及衰老的过程,体内会产生大量的O2-,此时保护酶活性增强或维持在较高水平,才能清除活性氧自由基使之保持较低水平,防止自由基对生物膜结构和功能的破坏[34-35]。SOD是清除生物体内O2-的唯一酶类,CAT是植物体内H2O2的清除酶,其活性大小是植株抗性的重要指标[36]。本研究中,MDA含量随着百合开花进程逐渐上升(图3),膜的损坏程度越大,花的衰老越明显,而作为与开花衰老有关的SOD和CAT,在百合开花初期活性较大,开花中后期逐渐降低(图1、图2)。说明,SOD和CAT活性越高,百合花抗衰老的能力越强[12],本试验也证实了这一点。其中,单水平GA3和CEPA处理的百合叶片MDA含量在开花各时期均显著低于对照CK(图3),提高了抗氧化酶SOD、CAT活性,增强了香水百合花期抗氧化能力。低浓度GA3和CEPA协同处理的效果比单水平处理效果更好,而高浓度GA3和CEPA协同处理对抗氧化酶活性的促进作用下降,在开花各时期与对照CK差异不显著。这是由于单水平和低浓度协同处理增强了香水百合开花期SOD和CAT活性,有效地清除植株内产生的自由基,而高浓度协同处理破坏了自由基和抗氧化酶活性的平衡,对生物膜造成了损伤。随着百合开花进程,盛花期以后百合体内活性氧自由基浓度进一步升高,当超出植物所能耐受的范围时,抗氧化酶活性降低,百合花开始衰败,刘雅莉等[29]、赵莉等[8]也有类似结论。但是,单水平GA3和CEPA和低浓度协同处理减缓了开花中后期SOD活性下降趋势(图1),有效缓解了衰老进程,达到延长香水百合花期的目的。这与香水百合生长、光合色素和光合作用强度的相关变化一致。
4结论
本试验通过盆栽试验,研究了GA3和CEPA影响下,香水百合花期进程,以及光合生理和抗氧化酶活性变化对花期的响应。综合以上分析,GA3和CEPA处理提高了开花各时期香水百合叶片光合生理作用,并增强了抗氧化酶活性,有效缓解了末花期膜脂过氧化,进而改善了开花品质并调节了香水百合花期进程,对香水百合花期有显著影响。其中,低浓度协同处理对香水百合花期调节效果最佳,其次为单水平2号处理和5号处理。但是,香水百合开花是一个复杂的过程,除了受到激素影响外,还和种球类型、品质以及土壤营养和气候变化有关,因此,有待于进一步研究多种因素对香水百合花期调节的综合作用。
References:
[1]Wang F Z, Tang J. Flora Republicae Popularis Sinicae(Tomus 14)[M]. Beijing: Science Press, 1980:116-166.
[2]Chen R S. Flowering Bulbs[M]. Fuzhou: Fujian Science and Technology Public House, 2001.
[3]Long Y Y. Lily: The King of the Bulb Flower[M]. Beijing: Jingdun Publishing House, 1999:5.
[4]Blankenship S M, Bailey D A, Miller J E. Effects of continous low levels of ethylene on growth and flowering og Easter lily. Scientia Horticulturae, 1993, 53(4): 311-317.
[5]Sodi A M, Panizza M. Tognoni F. Ethylene involvement in vitro regeneration of lily. Acta Horticulturae, 1990, 280: 151-154.
[6]Elgar H J, Woolf A B, Bieleski R L. Ethylene production by three lily species and their response to ethylene exposure. Postharvest Biology and Technology, 2002, 16(3): 257-267.
[7]Chen S L, Huang M L. Effects of chilling and gibberellin on flowering and bulb reproduction of asiatic hybrid lily. Journal of Jilin Agricultural University, 2007, 29(5): 511-517.
[8]Zhao L, Pan Y Z, Zhu Q,etal. Effects of 6-BA, GA3and IBA on photosynthetic pigment content and related enzyme activities ofLiliumcasablanca. Acta Prataculturae Sinica, 2012, 21(5): 248-256.
[9]Ren Y F, He J Y, Wang S M,etal. Changes of anti-oxidant enzymes activities during florescence and flower senescence of navel orange. Chinese Agricultural Science Bulletin, 2009, 25(19): 62-64.
[10]Li Y H, Wan G H, Ye Q S. Studies on photosynthetic characteristics ofGerberahybridavar.diablo. Subtropical Plant Science, 2005, 34(1): 14-17.
[11]Zhou Y L. The Role of the Endogenous Anti-oxidant System on Flower Opening and Senescence Process in Tree Peony[D]. Beijing: Beijing Forestry University, 2010.
[12]Zheng D F, Zhao L M, Feng N J. Effects of plant growth regulators (PGRs) on endogenous hormone contents and activities of protective enzymes in soybean leaves. Acta Agronomica Sinica, 2008, 34(7): 1233-1239.
[13]Jia H S, Lu C M. Effects of abscisic acid on photo inhibition in maize plants. Plant Science, 2003, 165: 1403-1410.
[14]Huang Z Z. The Flowering Regulation of Flowers[M]. Beijing: Chinese Forestry Press, 1990: 33-41.
[15]Huang Z H. Study on the Effects of GA3on the Photosynthetic Characteristics and Growth of Tissue-cultured Derived Plant Lily[D]. Guilin: Guangxi University, 2006.
[16]Zhu Q. Effects of Different N,P,K,Ca Application Levels on Plant Growth and Cut Flower Quality ofLiliumcasablanca[D]. Chengdu: Sichuan Agricultural University, 2012.
[17]Peng G Q, Wang L H. Quantitative variation of endogenous hormones inRosarugosaleaf during flower bud differentiation. Bulletin of Botanical Research, 2006, 26(2): 206-210.
[18]Zhao J Y, Pan Y Z, Li Y H. Effects of abscisic acid on flowering and some key enzymes ofBougainvilleaglabra. Acta Horticulturae Sinica, 2014, 41(10): 2085-2093.
[19]Gao J F. Experimental Guidance for Plant Physiology[M]. Beijing: Higher Education Press, 2006.
[20]Xiong Q E. Plant Physiology[M]. Chengdu: Sichuan Science and Technology Press, 2003.
[21]Li H S. Principle and Technology of Plant Physiological and Biochemical Experiment[M]. Beijing: Higher Education Press, 2000.
[22]Cai X M, Lin Z, Zheng D J,etal. The study of chemical regulation on florescence of Lilium oriental “Sorbonne”. Chinese Agricultural Science Bulletin, 2006, 22(6): 280-282.
[23]Shen H J, Huang Z X, Gui R Y. Studies on regulation of flower bud differentiation ofLiliumlongiflorum,CyclamenpersicumandSeneciocruentus. Journal of Nanjing Forestry University, 2001, 25(2): 55-57.
[24]Gao J P. The role of ethylene in the senescence of cut flower. Annual Review of Gardening[M]. Beijing: Science Press, 1995.
[25]Reid M S, Paul J L, Farhoomand M B,etal. Pulse treatments with the silver thiosulfate complex extend the vase life of cut carnations. Journal of the American Society for Horticultural Science, 1980, 105(1): 25-27.
[26]Zhang L, Xia Y P, Du F,etal. Research advance in relationship between ethylene and vase life of cut lily flowers. Acta Horticulturae Sinica, 2013, 40(9): 1826-1836.
[27]Ren X L, Li H F, Gong D Q,etal. Effects of application of ethephon and GA3in fall on bud sprouting and flowering of peony. Acta Botanica Boreali-Occidentalia Sinica, 2004, 24(5):895-898.
[28]Rood S B. Endogenous gibberellins and shoot growth and development inBrassicanapus. Plant Physiology, 1989, 89:530-534.
[29]Liu Y L, Wang F, Huang S. Study on the ethylene release and the membrantlipid peroxidation in the different development stage of lilium flower. Acta Botanica Boreali-Occidentalia Sinica, 1999, 19(6): 143-147.
[30]Vavilin D, Vermaas W. Chlorophy B can serve as the major pigment in functional photosystem II complexes of cyanobacteria. Proceedings of the National Academy of Science, 2001, 98(24): 14168-14173.
[31]Li G L, Zhang Y L, Niu L X. Effects of thidiazuron fruit growth and development lilium oriental hybrids ‘Sorbonne’. Acta Horticulturae Sinica, 2013, 40(2): 299-306.
[32]Sun X L, Xu Y F, Ma L Y,etal. A review of acclimation of photosynthetic pigment composition in plant leaves to shade environment. Chinese Journal of Plant Ecology, 2010, 34(8): 989-999.
[33]Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33: 317-345.
[34]Zou Y, Wang R X, Shen L Y,etal. Effects of exogenous meJA on physiological characteristics ofBrassicanapusunder osmotic stress. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(3): 564-568.
[35]Sun L X, Sun P, Cai S Z,etal. Physiological responses of four cold-season turfgrasses to oxidative stress of SO2. Acta Prataculturae Sinica, 2014, 23(4): 237-244.
[36]Milone M T, Sgherri C, Clijsters H,etal. Antioxidative responses of wheat treated with realistic concentration of cadmium. Environmental and Experimental Botany, 2003, 50(3): 265-276.
参考文献:
[1]汪发缵, 唐进. 中国植物志(第14卷)·百合科[M]. 北京: 科学出版社, 1980: 116-166.
[2]陈榕生.球根花卉[M]. 福州: 福建科学技术出版社, 2001.
[3]龙亚宜.百合—球根花卉之王[M]. 北京: 京盾出版社, 1999: 5.
[7]陈诗林, 黄敏玲. 低温和赤霉素对亚洲百合开花及鳞茎繁殖的效应. 吉林农业大学学报, 2007, 29(5): 511-517.
[8]赵莉, 潘远智, 朱峤, 等. 6-BA、GA3和IBA对香水百合叶绿素含量及抗氧化酶活性的影响. 草业学报, 2012, 21(5): 248-256.
[9]任艳芳, 何俊瑜, 王思梦, 等. 脐橙花开放和衰老过程中抗氧化酶活性变化. 中国农学通报, 2009, 25(19): 62-64.
[10]李永华, 万国辉, 叶庆生. 非洲菊光合特性研究. 亚热带植物科学, 2005, 34(1): 14-17.
[11]周昕蕾. 内源抗氧化酶在牡丹开放和衰老进程中作用的研究[D]. 北京: 北京林业大学, 2010.
[12]郑殿峰, 赵黎明, 冯乃杰. 植物生长调节剂对大豆叶片内源激素含量及保护酶活性的影响. 作物学报, 2008, 34(7): 1233-1239.
[14]黄章智. 花卉的花期调节[M]. 北京: 中国林业出版社, 1990: 33-41.
[15]黄樟华. 赤霉素对百合组培苗光合特性和生长状况的影响研究[D]. 桂林:广西大学, 2006.
[16]朱峤. 不同氮、磷、钾、钙水平对香水百合生长发育和切花品质效应的研究[D]. 成都: 四川农业大学, 2012.
[17]彭桂群, 王力华.平阴玫瑰花芽分化期叶片内源激素的变化.植物研究, 2006, 26(2): 206-210.
[18]赵家昱, 潘远智, 李永红. 外源ABA对叶子花开花及内源ABA合成关键酶的影响. 园艺学报, 2014, 41(10): 2085-2093.
[19]高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006.
[20]熊庆娥. 植物生理学实验教程[M]. 成都: 四川科学技术出版社, 2003.
[21]李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[22]蔡宣梅, 林真, 郑大江, 等. 东方百合“Sorbonne”花期化学调控技术研究. 中国农学通报, 2006, 22(6): 280-282.
[23]沈慧娟, 黄作喜, 桂仁意. 麝香百合、仙客来、瓜叶菊花芽分化的调控. 南京林业大学学报, 2001, 25(2): 55-57.
[24]高俊平. 切花衰老与乙烯.园艺学年评[M]. 北京: 科学出版社, 1995.
[26]张琳, 夏宜平, 杜方, 等. 乙烯与百合切花瓶插寿命的关系研究进展. 园艺学报, 2013, 40(9): 1826-1836.
[27]任小林, 李海峰, 弓德强, 等. 秋施乙烯利和赤霉素对牡丹萌芽及开花的影响. 西北植物学报, 2004, 24(5): 895-898.
[29]刘雅莉, 王飞, 黄森. 百合花朵不同发育期乙烯释放量与膜脂过氧化作用的研究. 西北植物学报, 1999, 19(6): 143-147.
[31]李改丽, 张延龙, 牛立新. 植物生长调节剂TDZ对“索邦”百合果实生长发育的影响. 园艺学报, 2013, 40(2): 299-306.
[32]孙小玲, 许岳飞, 马鲁沂, 等. 植株叶片的光合色素构成对遮阴的响应. 植物生态学报, 2010, 34(8): 989-999.
[34]邹燕, 王瑞雪, 沈亮余, 等. 渗透胁迫下外源茉莉酸甲酯对油菜种子生理特性的影响. 西北植物学报, 2011, 31(3): 564-568.
[35]孙凌霞, 孙萍, 蔡仕珍, 等. 四种冷季型草坪草对二氧化硫胁迫的生理响应研究. 草业学报, 2014, 23(4): 237-244.
