尕海湿地CH4、CO2和N2O通量特征初步研究
2016-01-27马维伟王辉李广赵锦梅王跃思
马维伟,王辉,李广*,赵锦梅,王跃思
(1.甘肃农业大学林学院, 甘肃 兰州 730070; 2.中国科学院大气物理研究所, 北京 100029)
尕海湿地CH4、CO2和N2O通量特征初步研究
马维伟1,王辉1,李广1*,赵锦梅1,王跃思2
(1.甘肃农业大学林学院, 甘肃 兰州 730070; 2.中国科学院大气物理研究所, 北京 100029)
摘要:2011年7月-2012年7月,采用静态箱-气相色谱法同步研究了尕海4种典型湿地类型的CH4、CO2和N2O通量及其与温度因子的关系,并估算了其全球变暖潜势值(GWP)。结果表明,尕海湿地的CH4、CO2和N2O通量具有明显的空间变化特征,CH4、CO2和N2O通量最小值分别为亚高山草甸(-0.014±0.126) mg/(m2·h),沼泽湿地(137.17±284.51) mg/(m2·h)和高山湿地(-0.008±0.022) mg/(m2·h),而最大值分别为沼泽湿地(0.498±0.682) mg/(m2·h),高山湿地(497.81±473.09) mg/(m2·h)和草本泥炭地(0.094±0.117) mg/(m2·h);同时CH4、CO2通量有明显的时间变化特征,通量最大值分别出现在2011年的7-10月和2012年的5-7月,而后降低并维持相对稳定的变化趋势;5 cm地温、气温、地表温度及箱内温度与4种类型湿地CO2通量呈极显著正相关关系(P<0.01),与高山湿地CH4通量均存在显著正相关关系(P<0.05),与其他3种湿地类型CH4通量的相关性均较差,但与4种湿地类型N2O通量无显著相关性;尕海草本泥炭地、沼泽湿地、高山湿地和亚高山草甸4种类型湿地的温室效应贡献潜力依次为35.311,13.520,34.816和30.236 t CO2/(hm2·a), 沼泽湿地能够显著降低温室效应。
关键词:尕海湿地; CH4通量;CO2通量; N2O通量
DOI:10.11686/cyxb2014350http://cyxb.lzu.edu.cn
马维伟,王辉,李广,赵锦梅,王跃思. 尕海湿地CH4、CO2和N2O通量特征初步研究. 草业学报, 2015, 24(8): 1-10.
Ma W W, Wang H, Li G, Zhao J M, Wang Y S. A preliminary study of carbon dioxide, methane and nitrous oxide fluxes from the Gahai wetland. Acta Prataculturae Sinica, 2015, 24(8): 1-10.
收稿日期:2014-08-21;改回日期:2014-11-03
基金项目:国家自然科学基金项目(31260155),高等学校博士学科点专项科研基金联合资助课题(20126202110006),草地农业生态系统国家重点实验室2014年度开放课题和甘肃省教育厅项目(2014A-057)资助。
作者简介:马维伟(1980-),男,甘肃靖远人,讲师,博士。E-mail:maww@gsau.edu.cn
通讯作者*Corresponding author. E-mail:lig@gsau.edu.cn
A preliminary study of carbon dioxide, methane and nitrous oxide fluxes from the Gahai wetland
MA Wei-Wei1, WANG Hui1, LI Guang1*, ZHAO Jin-Mei1, WANG Yue-Si2
1.CollegeofForestry,GansuAgriculturalUniversity,Lanzhou730070,China; 2.InstituteofAtmosphericPhysics,ChineseAcademyofSciences,Beijing100029,China
Abstract:A study has been undertaken to estimate fluxes of the greenhouse gases carbon dioxide (CO2), methane (CH4) and nitrous oxide (N2O) in wetlands, to understand the effects of temperature factors on these processes and to estimate global warming potential (GWP). Using static chamber techniques, we measured CH4, CO2, and N2O fluxes from four wetland types in Gansu Gahai Wetlands, China, from July 2011 to July 2012. The results showed high variations in CH4, CO2and N2O fluxes between the four wetlands, with the smallest values in the subalpine meadow (-0.014±0.126 mg/m2·h), marsh wetland (137.17±284.51 mg/m2·h) and mountain wetland (-0.008±0.022 mg/m2·h) respectively. The highest values of CH4, CO2and N2O fluxes were in marsh wetland (0.498±0.682 mg/m2·h), mountain wetland (497.81±473.09 mg/m2·h) and herbaceous peat (0.094±0.117 mg/m2·h) respectively. CH4and CO2fluxes varied seasonally. Maximal fluxes occurred between July-October 2011 and May-July 2012, then decreased and remained relatively steady, with some slight fluctuations during the winter and thawing or freezing periods. Further analysis showed that air temperature, soil temperature (at 5 cm), surface temperature and temperature inside the box were highly significantly positively correlated with CO2flux from the four wetlands. These variables were significantly positively correlated with CH4flux from mountain wetland but not from the other wetland types. They were significantly negatively correlated with N2O flux from all four wetland types. The GWP estimates were 35.311, 13.520, 34.816 and 30.236 t CO2/(hm2·a) from herbaceous peat, marsh wetland, mountain wetland and subalpine meadow respectively. These results show that marsh wetland could significantly decrease the emission of greenhouse gases from the Gahai Wetlands.
Key words:Gahai wetland; CH4fluxes; CO2fluxes; N2O fluxes
CO2、CH4和 N2O是大气中最重要的3种温室气体,对全球气候变化有着重要影响。由于人类活动的影响, 大气中温室气体的体积分数分别比工业化以前增加了大约26%,148%和8%[1]。近年来研究表明这3种气体对全球气候变暖的贡献率已超过90%[2],而其浓度增加是全球气候变暖的主要原因。所以,近年来与其相关的土壤碳、氮损失备受关注。
湿地系统作为全球三大生态系统之一,虽然仅占地球陆地表面的一小部分(4%~6%)[3],但却是温室气体的重要“源”和“汇”[4],且多数湿地是CO2的汇和CH4的源(湿地对全球CH4排放的贡献高达15%~40%)[5-7],但湿地并不一致表现为碳汇,研究表明,一个湿地在某些季节和年份可能会由碳汇向碳源转变[8-11]。相对于CO2和CH4的排放,自然湿地的N2O排放量相对较低,一般表现为弱源或者汇[12-13]。因此,目前对于湿地是温室气体的“源”还是“汇”问题还存在一些争议。
若尔盖高原位于青藏高原东缘,其上分布着面积最大的泥炭沼泽湿地,尕海湿地是若尔盖湿地的重要组成部分。近年来,关于青藏高原的土壤碳储量、土壤温室气体排放、土壤有机质周转以及土壤养分等方面开展了大量的研究工作[12-13],但是目前很少有涉及青藏高原东北边缘尕海湿地系统不同湿地类型温室气体排放的研究报道。因此,对尕海湿地不同湿地类型CO2、CH4和N2O的排放进行研究十分必要,而且这将有助于精确估计这一地区湿地的温室气体排放量。为此,本文拟通过对尕海4种典型湿地类型(高山湿地,沼泽湿地,草本泥炭地和亚高山草甸)主要温室气体CO2、CH4和N2O排放特征的研究,以便为客观评价我国高寒地区自然湿地温室气体排放总量、控制温室气体排放及对高寒湿地保护与合理利用提供科学参考依据。
1材料与方法
1.1 研究区概况
研究区位于青藏高原东北边缘碌曲县境内的甘肃尕海-则岔国家级自然保护区(33°58′-34°30′ N,102°05′-102°29′ E),属典型的高寒湿地,海拔3430~4300 m。气候为高寒湿润气候,气温年较差较大,为19.6℃,年均温1.2℃,年降雨量781.8 mm,年蒸发量1150.5 mm。土壤类型主要为暗色草甸土、沼泽土和泥炭土等,有机质含量较高。植被以玛曲嵩草(Kobresiamaquensis)、圆穗蓼(Polygonummacrophyllum)、藏嵩草(Kobresiatibetica)、华扁穗草(Blysmussinocompressus)等草本植物为主。研究区内湿地面积43176 hm2,主要包括:草本泥炭地10429 hm2,高山湿地14882 hm2,洪泛地12281 hm2,永久性淡水草本沼泽、泡沼2780 hm2,永久性河流201 hm2[14]。研究区在试验期间(2011年7月-2012年7月)具体气温变化如图1。
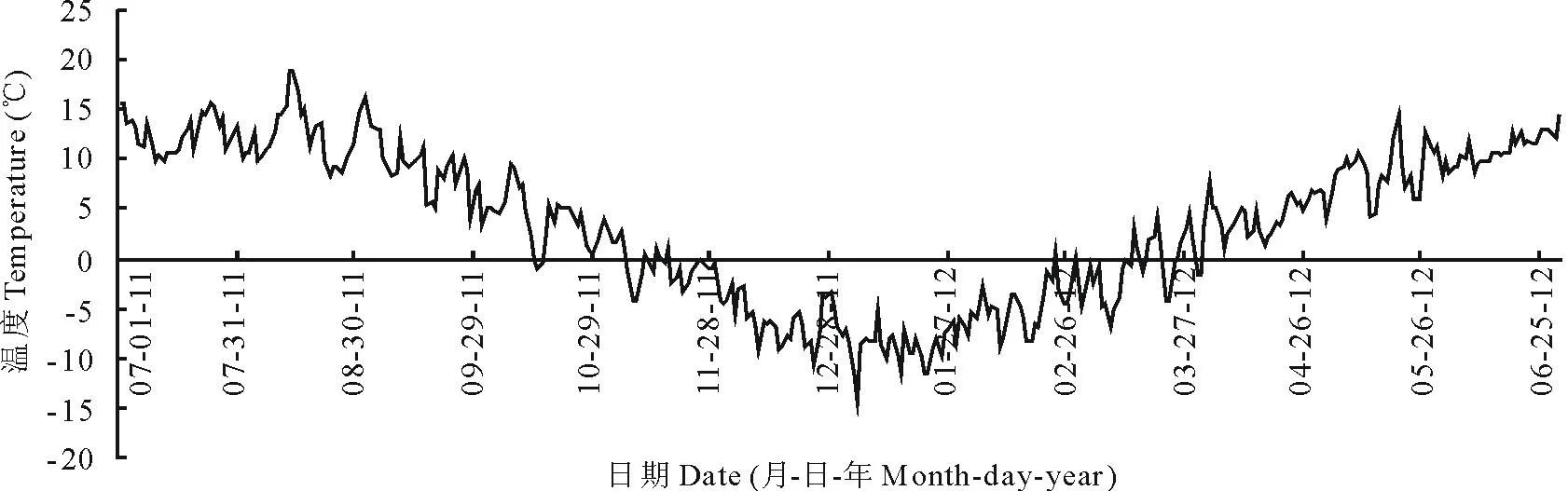
图1 2011年7月-2012年6月尕海湿地日平均气温状况Fig.1 Daily mean air temperature in Gahai wetland during the period from July 2011 to June 2012
1.2 样地设置
2011年7月选取湿地区内的草本泥炭地、沼泽湿地、高山湿地和亚高山草甸的4种代表性湿地作为实验样地,在每个实验样地的中心位置各布设1个定位观测点,每个点设置3个重复来测定CO2、CH4和 N2O排放速率。具体湿地类型的基本情况如表1。
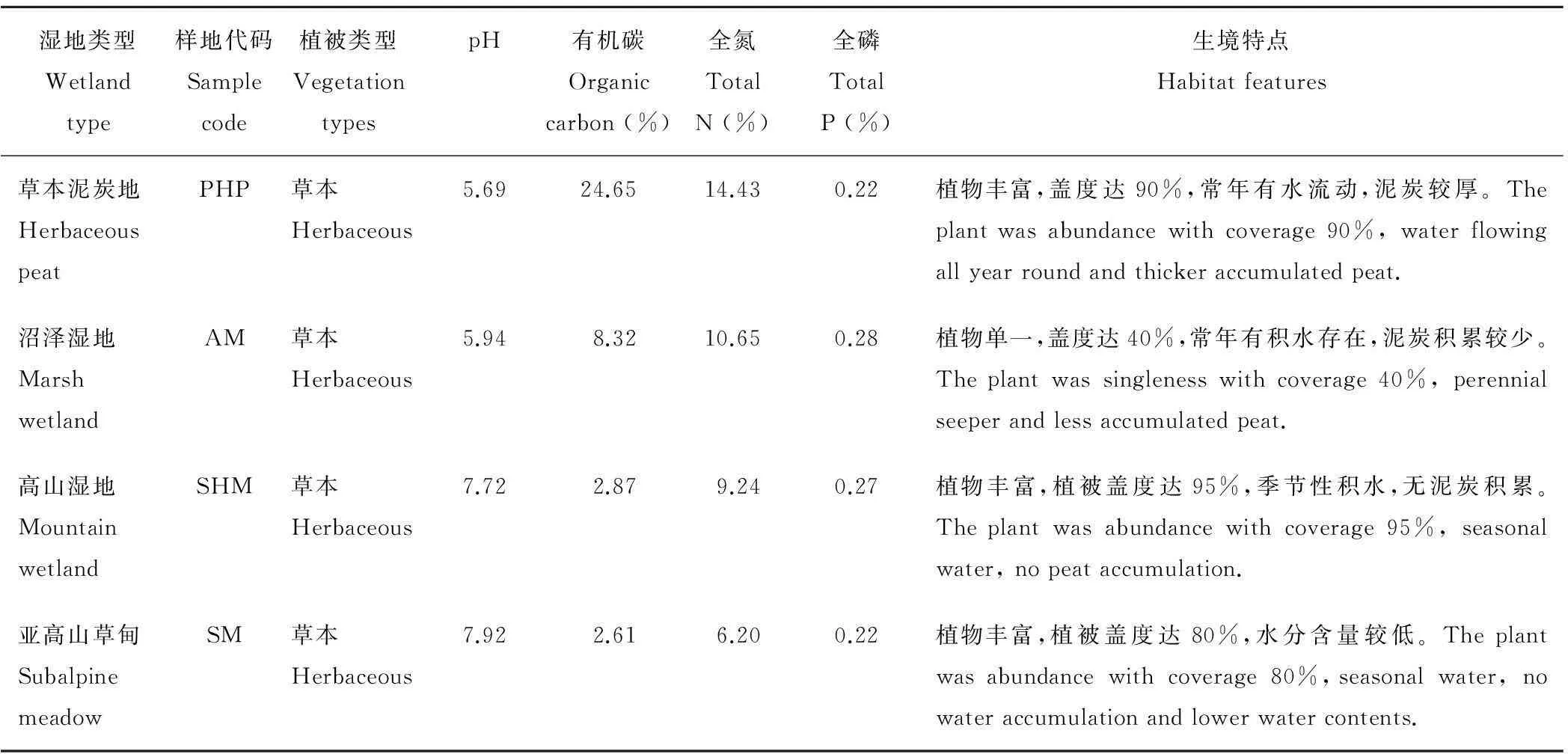
表1 湿地的基本情况
1.3 样品的采集与分析
本实验采用静态暗箱-气相色谱法测定CO2、CH4和N2O的排放通量。采样箱由箱体(50 cm×50 cm×50 cm 四周和顶部密闭,外围覆盖保温材料)和不锈钢底座(50 cm×50 cm×10 cm) 两部分组成。取样前数天将底座底插入土中10 cm,安装过程未对底座内植被进行干扰,整个采样阶段底座固定在试验样地保持不动,最大限度降低对植被和土壤内部的干扰。采集气体样品时,样箱和底座之间用水密封。采样箱外用泡沫包裹以确保箱内温度变化不大,箱内装有小风扇和温度传感器。取样时间为9:00-12:00,取样时在静态箱封闭后 0,10,20,30,40 min,用注射器取气后注入500 mL的铝塑复合气袋(大连光明化工厂生产)中储存,两周内在中国科学院大气物理研究所使用HP5890II气相色谱仪分析气体。CO2和CH4用离子火焰化检测器(FID)检测,N2O用电子捕获检测器(ECD)检测。40 min内采集的5个气体样品浓度与采样时间间隔存在线性相关关系,所有样品的决定系数R2>0.95时被视为有效并被采用。气样采样频率为:2011年7-11月和2012年4-7月,每周采样1次,2012年2、3月,每月15日采样一次,2011年12月和2012年1月未采样(由于这一时段气温太低,空气湿度相对较大,注射器抽取气体时很快结冰而无法工作,故未采集气体样品)。同时,原位同步测定气温、箱内温度,5 cm地温。
1.4 气体通量计算
利用以下公式计算CO2,CH4和 N2O的排放通量:
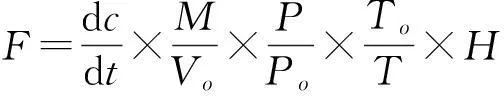
式中,F为气体通量(mg/m2·h),dc/dt为采样时气体浓度随时间变化的直线斜率,M为被测气体的摩尔质量,P为采样点气压,T为采样时绝对温度,Vo,Po,To分别为标准状态下的气体摩尔体积、空气气压和绝对温度,H为地面以上采样箱高。
利用各月CO2,CH4和N2O排放通量均值计算年排放量:
年排放通量(kg/hm2·a)=月排放通量均值(mg/m2·h)×12×30×24(h)×0.01
1.5 数据处理与分析方法
尕海4种类型湿地单位面积每年CO2、CH4和N2O的排放量通过每月的均值计算得到。应用One-wayANOVA法分析4种类型湿地CO2、CH4和N2O排放量的差异性,显著性P<0.05变量的影响将被考虑。利用SPSS11.5 和MicrosoftExcel2003对数据进行处理分析。
2结果与分析
2.1 CH4、CO2和N2O排放通量的时空变化
2.1.1CH4排放通量4种湿地的CH4排放明显不同(图2),在整个试验阶段,CH4排放量均值最大的为沼泽湿地(0.498±0.682)mg/(m2·h),最小的为亚高山草甸(-0.014±0.126)mg/(m2·h),且亚高山草甸CH4排放量表现为负值,说明亚高山草甸整体吸收大气中甲烷;排放量居中的为高山湿地和草本泥炭地,分别为(0.157±0.298)mg/(m2·h) 和(0.233±0.790)mg/(m2·h)。
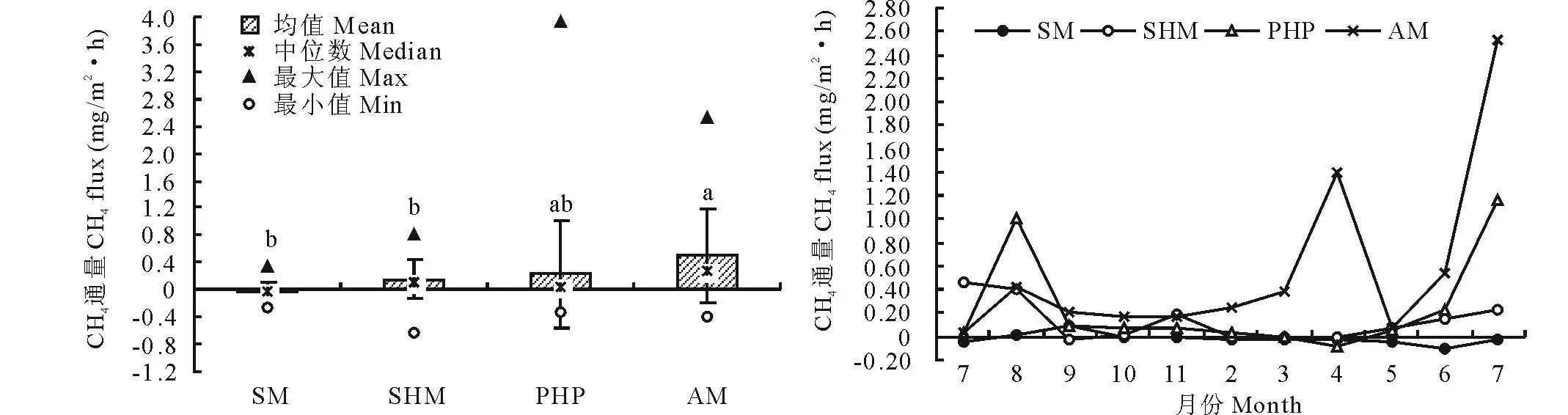
图2 2011-2012年不同湿地类型的CH4排放通量Fig.2 Methane emissions in different wetland types during the period from 2011 to 2012 不同小写字母表示各处理间差异显著,相同字母表示处理间无显著差异(P<0.05, n=27),下同。The different letters (a, b) above the box indicate significant differences, the same letters indicate no significant differences (Kruskal-Wallis ANOVA test, P<0.05, n=27). The same below.
尕海4种湿地类型在整个试验期间(2011年7月-2012年7月)CH4排放具有明显的时间性变化特征(图2)。其中,2011年7-10月和2012年5-7月CH4排放通量最高,而后降低并维持相对稳定的变化趋势,但在冬季的冰冻和解冻期CH4排放通量有点轻微波动。除此而外,CH4排放通量从2012年5月份以后开始显著增加,且2012年7月份的CH4排放通量显著高于2011年7月。其主要原因是由于2012年7 月份区内降雨较2011年7月多,而气温及土壤温度相对一致,致使CH4的产生和排放较大。
2.1.2CO2排放通量尕海4种湿地类型CO2排放通量差别较大(图3),高山湿地CO2排放通量均值最大(497.81±473.09)mg/(m2·h),沼泽湿地CO2排放通量均值最小(137.17±284.51)mg/(m2·h),高山湿地CO2排放通量测定的最小值为负值,这是由于取样时的随机误差导致。CO2排放通量居中的为亚高山草甸和草本泥炭地,值分别为(445.62±328.94)mg/(m2·h)和(453.29±427.72)mg/(m2·h)。
尕海4种湿地类型CO2排放通量在试验期间(2011年7月-2012年7月)具有明显的时间变化特征(图3),且与CH4排放通量相似,尕海4种湿地类型CO2排放通量较大值均出现在2011年7-10月和2012年5-7月,即湿地植物生长季,10月份进入非生长季后,随着植物的不断干枯,CO2排放通量明显降低,且2012年7月份的排放通量与2011年的7月基本一致,整个试验期间CO2排放通量呈“U”型变化规律。除此而外,尕海湿地CO2排放通量从2012年7月份以后开始显著增加,反映了植物生长状况对CO2排放有重要影响。
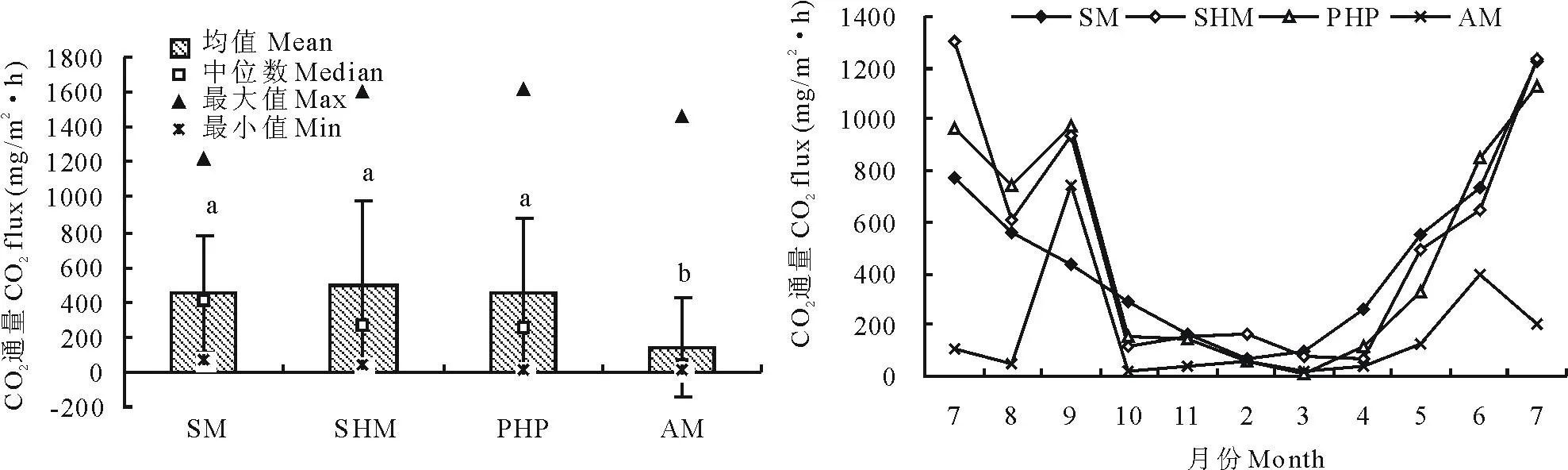
图3 2011-2012年不同湿地类型的CO2排放通量Fig.3 Carbon dioxide emissions in different wetland types during the period from 2011 to 2012
2.1.3N2O排放通量在尕海湿地,从亚高山草甸到沼泽湿地,N2O的排放通量变化显著(图4),N2O排放通量最大值出现在草本泥炭地,为(0.094±0.117)mg/(m2·h),最小值出现在高山湿地,为(-0.008±0.022)mg/(m2·h),N2O排放通量居中的为亚高山草甸和沼泽湿地,排放通量分别为(0.033±0.037)mg/(m2·h)和(0.002±0.016)mg/(m2·h)。图中N2O通量为负值说明亚高山草甸吸收大气中N2O;其他湿地类型N2O通量均为正值,说明其他3类湿地向大气中排放N2O。
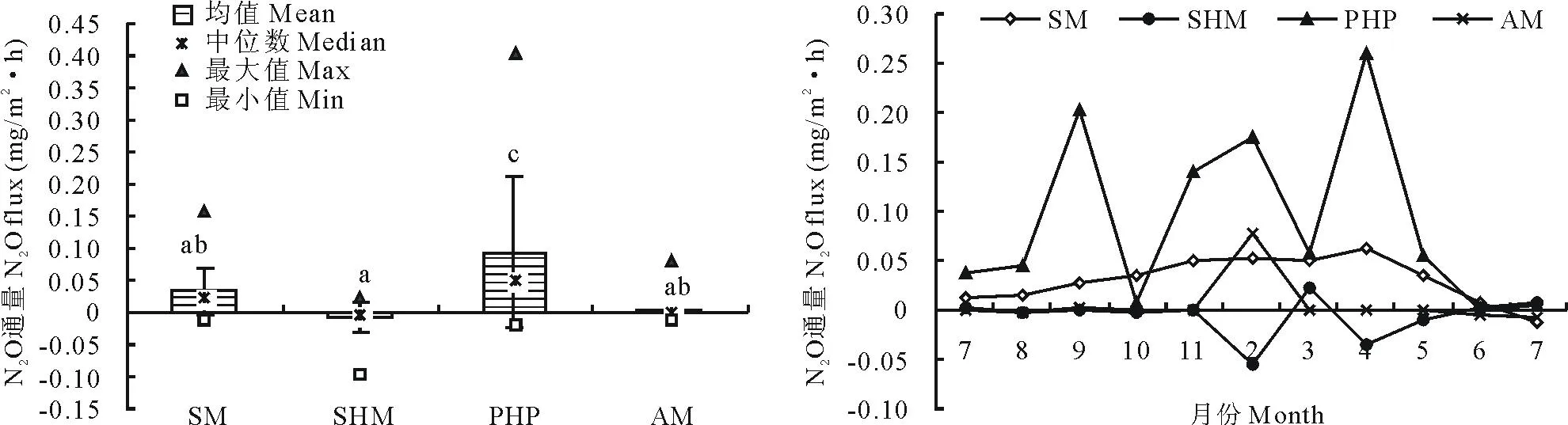
图4 2011-2012年不同湿地类型N2O排放通量Fig.4 Nitrous oxide emissions in different wetland types during the period from 2011 to 2012
尕海4种湿地类型在试验期间(2011年7月-2012年7月)N2O排放无明显的时间变化规律(图4)。4种湿地类型N2O排放通量显著低于CH4排放通量,且N2O排放通量呈现较大的波动性变化。具体表现为,草本泥炭地在实验期间N2O排放通量呈波动性3个峰值的单峰变化趋势,即2011年9月,2012年2月和4月N2O排放量最高,且波动性较大,其他时段均较低,甚至出现吸收;亚高山草甸N2O排放量为先增加后降低的单峰变化趋势,在整个试验期前均向大气中排放N2O;沼泽湿地和高山湿地N2O排放量相对变化趋势较为稳定,这两类湿地N2O排放相对较低,甚至有好几个月表现为吸收过程。
2.2 CH4、CO2和N2O年排放量及其全球变暖潜势值
尕海4种湿地类型的CH4、CO2和N2O年排放通量(2011年7月-2012年7月)差别较大。沼泽湿地的CH4年排放通量最大,为30.144kg/(hm2·a),亚高山草甸最小且为负值,为-1.805kg/(hm2·a),高山湿地的CO2年排放通量最大,为3.504×104kg/(hm2·a), 沼泽湿地最小,为1.237×104kg/(hm2·a),而草本泥炭地的N2O年排放量最高,为9.549kg/(hm2·a),高山湿地最小,为-1.341kg/(hm2·a)。由此看出,沼泽湿地增加了CH4的年排放通量,而降低了CO2年排放通量,高山湿地增加了CO2的年排放通量,降低了N2O年排放通量,草本泥炭地显著的增加了N2O年排放通量。
结合IPCC第二次全球变暖潜势值(globalwarmingpotential,GWP),CO2、CH4和N2O的GWP值依次为1、21和310,草本泥炭地、沼泽湿地、高山湿地和亚高山草甸(本实验为2011年7月-2012年7月)的温室气体GWP值如表2所示,可以看出温室效应贡献潜力(3种气体换算为CO2的总和)依次为35.311,13.520,34.816和30.236tCO2/(hm2·a),沼泽湿地能够削弱尕海湿地系统的温室效应贡献潜力。
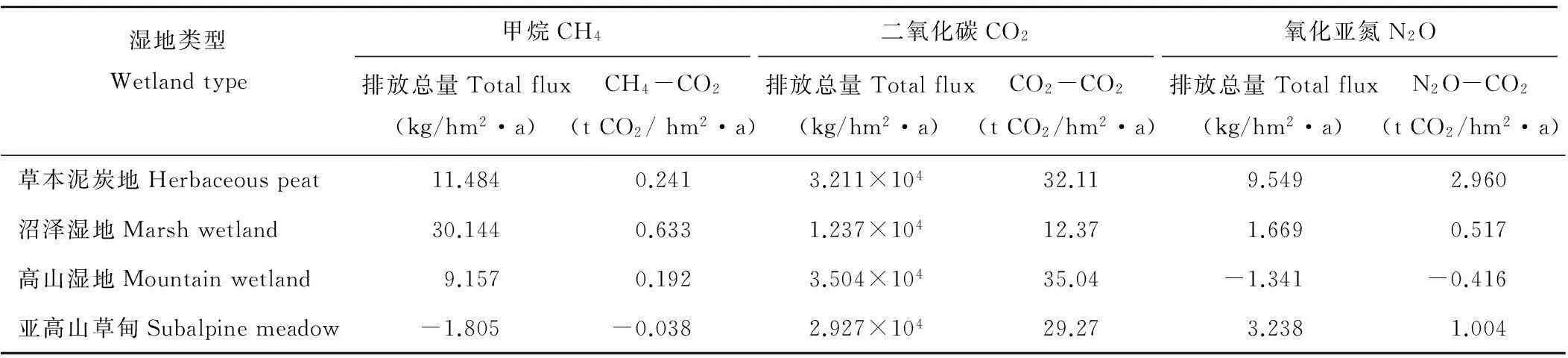
表2 2011-2012年不同湿地类型温室气体的排放量及GWP值
2.3 温度与CH4、CO2和N2O排放通量相关分析
对4种湿地类型气体通量和各温度因子相关分析表明,除高山湿地CH4通量与5 cm地温和箱内温度呈显著正相关(P<0.05),与地表温度、箱外气温呈极显著正相关(P<0.01)外,其他3种湿地类型CH4通量与各温度因子的相关性均不显著(表3)。沼泽湿地CO2通量与5 cm地温呈显著正相关,而与其他温度因子相关性均不显著,但其他3种湿地类型与各温度因子均呈极显著正相关(P<0.01)。此外,除沼泽湿地的 N2O 通量与箱外气温、地表温度、5 cm地温呈显著(P<0.05)或极显著(P<0.01)负相关,高山湿地N2O通量与地表温度、箱外气温呈显著正相关(P<0.05)外,草本泥炭地、高山草甸的N2O通量与各温度因子相关性均不显著。
3讨论
3.1 国内外相关研究对比
目前,人们对北半球温带和寒带泥炭地温室气体排放做了大量研究, 但关于其他湿地类型温室气体排放的研究较少。本研究分析了尕海湿地系统4种湿地类型(不仅仅是泥炭地)单位面积每小时、每年CO2,CH4和 N2O的排放状况,这4种湿地类型具有相同气候条件,但土壤、植被特征不同(表1)。
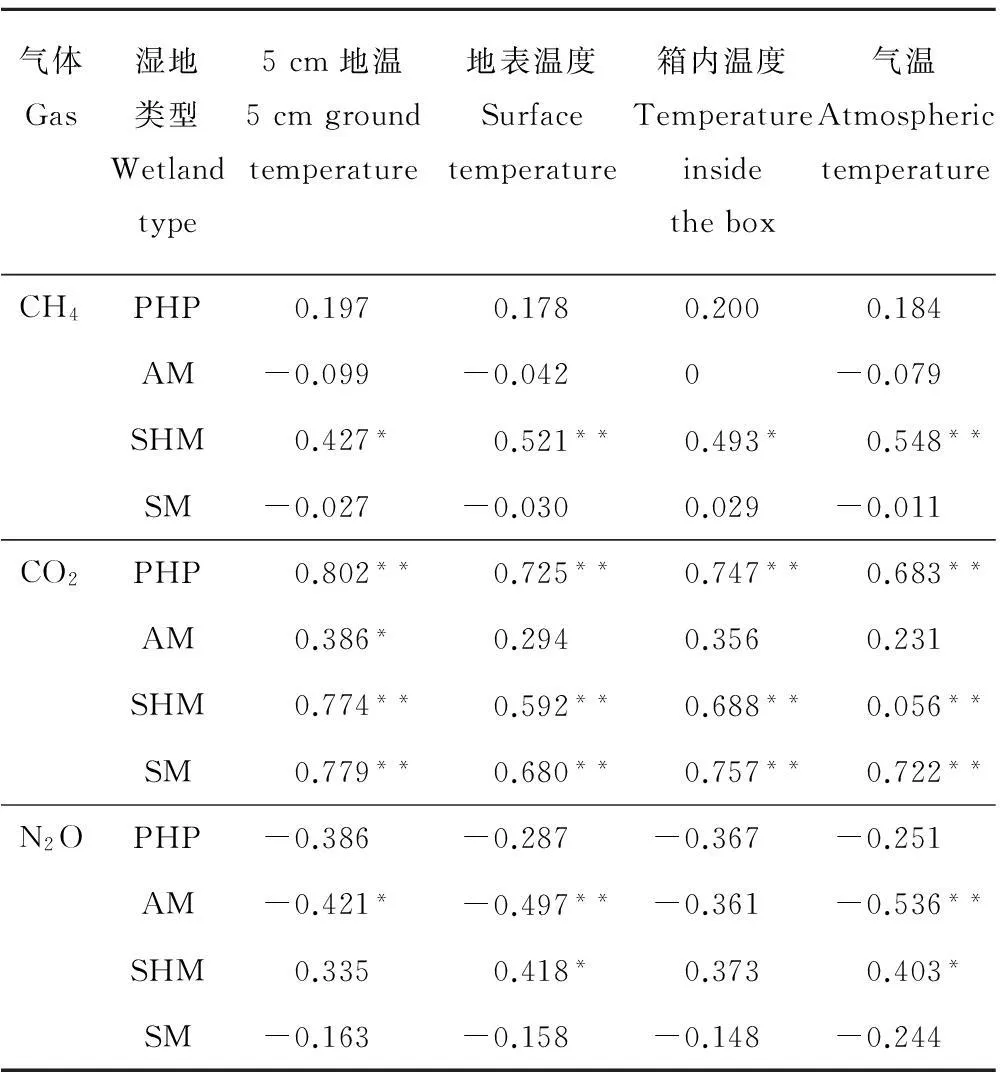
表3 温度与CH4、CO2和N2O 通量的Pearson 相关性分析
**P<0.01; *P<0.05.
CH4排放存在明显的空间性,滨海沼泽研究发现在1~50 m的范围内CH4排放明显不同[15-16]。本研究也表明尕海湿地系统CH4排放具有明显的空间变化(图2),CH4排放最大值出现在沼泽湿地,而最小为亚高山草甸。尕海沼泽湿地CH4通量的最大值远远低于同区域青藏高原的沼泽湿地,其排放量为0.556~14.450 mg/(m2·h)[17-18]之间,而排放量的最小值为负值,这说明尕海湿地系统的亚高山草甸吸收大气中CH4,能够降低大气中CH4浓度。本研究和前人对高山苔草(Carexinfuscatevar.gracilenta)的研究结果一致,研究都认为亚高山草甸是大气中CH4的汇[19-21],类似研究结果也出现在平原地区的草甸系统[22-23]。但本研究中草甸对CH4的吸收值远远高于青藏高原吸收值0.008 mg/(m2·h)[21]。研究表明,在尕海湿地系统,只有亚高山草甸是CH4的汇,其他3种湿地类型均是CH4的源。前人研究表明湿地通常有助于增加大气中的CH4[3,24],本研究也表明自然湿地通常为CH4的排放源。
尕海湿地生态系统CO2排放通量有明显的空间变化特征(图3),研究表明,本区沼泽湿地生态系统呼吸通量最小。尕海湿地生态系统呼吸通量的标准偏差为(384.06±407.83) mg/(m2·h),范围在-47.76~1613.76 mg/(m2·h)之间,这远远高于青藏高原高寒湿地生态系统呼吸通量(范围为-5.28~10.8 mg/m2·h)[25]。
尕海4种湿地类型N2O的排放具有明显的差异性(图4),研究表明,N2O排放通量最大值出现在草本泥炭地,为(0.094±0.117) mg/(m2·h),本研究尕海泥炭地N2O排放通量显著低于北方森林排水泥炭地(0.45 mg/m2·h)、欧洲泥炭地(1.00 mg/m2·h)及爱沙尼亚泥炭地(0.39 mg/m2·h)[26-28]。然而,最小值出现在高山湿地,为(-0.008±0.022) mg/(m2·h),这是由于高山湿地土壤N2O产生量受到有机氮含量和有效性的影响,一些研究成果已证实C/N能够很好地预测N2O的通量[29]。此外,本研究中N2O的通量值有时较小或为负值,这表明尕海湿地不会总产生N2O或消耗大气中N2O,这与Hayden和Ross[30]对美国佛蒙特州泥炭地研究结果相似。
3.2 环境因子对温室气体排放通量的影响
3.2.1温度对温室气体排放通量的影响研究时段内,环境因子变化较为明显的是温度(气温、地表温度、5 cm地温和箱内温度)。温度对CH4、CO2和N2O的排放有一定的驱动作用,但不是唯一的驱动因素,土壤温度和土壤水分均有可能成为影响土壤呼吸变化的主导因子[31]。在2011年9月-2012年5月,尕海湿地气温变化较小(图1),导致CH4和CO2的排放相对稳定(图2,3,4)。
温度在CH4的产生和排放中起着非常重要的作用,一是土壤温度直接影响土壤微生物的活动,包括CH4产生和氧化过程中所涉及的一系列微生物菌群的数量、结构和活性;二是对土壤中CH4的输送也有明显的影响。研究时段内,研究区内不同类型尕海湿地CH4通量在生长季节明显高于非生长季节。由于生长季地表温度相对较高,可能增强了CH4氧化菌的活性,引起CH4产生量的增加,使得CH4排放通量较大,这和前人研究结果一致[32-33]。
CO2排放量与气温和土壤温度均有显著的正相关关系(表3),研究时段内,尕海不同类型湿地CO2通量在生长季节明显高于非生长季节,这是由于4月以后,气温逐渐上升(表1),植物生长逐渐加快,土壤微生物活动逐渐加强,使得尕海湿地生态系统呼吸速率呈现逐渐升高;在7月至8月,水热条件均达到最佳状态,植物进入旺盛生长阶段,微生物活动强烈,使得呼吸速率达到最高水平的趋势,因此CO2排放量在这个阶段达到最高值,这与许多研究结论一致[8,34]。研究发现温度因素对CO2排放量的季节变化有显著的影响,很多研究认为土壤温度能够很好解释CO2排放量[27-28,35]。
在4种类型湿地中,N2O排放量随气温和土壤温度的升高无明显变化规律。研究发现除高山湿地N2O通量与地表温度、箱外气温呈显著正相关外(P<0.05),草本泥炭地、高山草甸的N2O通量与各温度因子的相关性均不显著,这说明温度对N2O的排放影响较弱,其他因素可能在N2O排放过程中发挥了更为重要的作用,进而掩盖了温度变化的影响,这些因素可能是水分、植被以及沉积物基质状况等。
3.2.2水分对温室气体排放通量的影响土壤水分是控制生物(异养微生物和植物)产生CO2的最重要因子之一,同时也是控制厌氧环境条件下CH4,N2O产生与排放的关键因素,它直接影响O2可利用率、气体扩散速率和微生物活性,并间接影响与气体产生相关的土壤pH值、氧化还原电位等因素,最终影响到气体的产生与扩散[36]。在本研究的草本泥炭地、沼泽湿地和高山湿地中,由于这3类湿地常年积水或季节性积水,导致其CH4年排放通量明显高于高山草甸,这是由于产甲烷菌群落对底物中还原状态变化非常敏感,导致土壤条件或者微生物群落机构和动态的不同。而对于水分和CH4排放通量相关性,由于实验中未测定水分含量,故无法做出正确的定性分析。对于CO2排放通量,本研究发现沼泽湿地较小,这是由于沼泽湿地水分含量较大,但植被较少,而本研究CO2排放通量主要包括植物呼吸和微生物呼吸的CO2,所以植被水分对其影响较小。另外,许多研究表明,湿地的N2O释放与土壤含水量呈正相关[37-39],本研究也得到类似的研究结果,但本研究中高山湿地与土壤水分呈负相关,这可能与不同研究湿地类型的环境状况有关。
3.2.3植物对温室气体排放通量的影响植物对温室气体排放具有重要的调控作用,在泥炭地中的研究表明植被对CO2、CH4和N2O排放通量有潜在的控制作用[26],这是由于植物残体能够增加土壤有机物的有效性和反消化作用。植物呼吸本身就是土壤-植物系统呼吸的重要组成部分,凋落物的分解和根系分泌物都会影响土壤呼吸;植物对CH4和N2O产生与排放的影响主要通过以下途径:1)植物根系及分泌物等影响土壤相应气体产生菌的活动;2)植物自身产生或吸收气体植物起到了导管作用,将土壤产生的气体排放到大气[40]。本研究发现,CO2年排放通量为:高山湿地>草本泥炭地>亚高山草甸>沼泽湿地,这与研究湿地类型植被盖度(表1)的排序恰好一致,说明植被盖度是控制尕海湿地CO2排放通量的主要因素。在本研究中,高山湿地和草本泥炭地水分条件与植被条件相似,致使CH4排放通量较接近,但草本泥炭地年排放通量稍微高于高山湿地,这可能与土壤基质有关。植物对N2O的吸收与排放早有报道[41],尕海湿地系统N2O排放的形成可能也与4类湿地植物种类本身对N2O的吸收与排放有关,但4类湿地中的植物是如何影响N2O的吸收或排放,以及这些过程与哪些代谢活动有关,仍需进一步深入研究。
4结论
尕海湿地系统CH4和CO2排放通量具有明显的时空差异性。从空间上看,在4种湿地类型中,沼泽湿地CH4排放量最大,亚高山草甸最小;高山湿地CO2排放通量最大,沼泽湿地最小。从时间上看,4种湿地类型CH4和CO2排放通量均在2011年7-10月和2012年5-7月的最高,而后降低并维持相对稳定的变化趋势,但在相同时段,沼泽湿地CH4高于其他湿地类型,高山湿地CO2通量高于其他湿地类型。
尕海湿地系统N2O排放通量存在明显的空间差异,N2O排放通量最大的为草本泥炭地,最小的为高山湿地,且仅高山湿地均值表现为吸收N2O。4种湿地类型N2O排放无明显时间变化特征,N2O排放通量均显著低于CH4,排放通量呈现较大的波动性变化。
气温、地表温度、5 cm低温和箱内温度与尕海湿地生态系统CO2排放通量呈极显著正相关关系,与CH4排放通量均存在一定正相关,但对N2O无明显影响。
沼泽湿地增加了CH4的年排放通量而降低了CO2年排放通量,高山湿地增加了CO2的年排放通量而降低了N2O年排放通量,草本泥炭地显著的增加了N2O年排放通量。草本泥炭地、沼泽湿地、高山湿地和亚高山草甸温室效应贡献潜力依次为35.311,13.520,34.816和30.236 t CO2/(hm2·a)。
References:
[1]Wang M X, Zhang R J, Zheng X H. The source and sink of greenhouse gas. Climatic and Environmental Research, 2000, 5(1): 75-79.
[2]Han Q T, Xu X S, Lu C Q,etal. Net exchanges of CO2, CH4, and N2O between China’s terrestrial ecosystems and the atmosphere and their contributions to global climate warming. Journal of Geophysical Research, 2011, 116: G02011, doi: 10. 1029/2010 JG001393.
[3]Aselmann I, Crutzen P J. Global distribution of natural freshwater wetlands and rice paddies, their net primary production, seasonality and possible methane emissions. Journal of Atmospheric Chemistry, 1989, 8: 307-358.
[4]Whiting G J, Chanton J P. Greenhouse carbon balance of wetlands: methane emission versus carbon equestration. Tellus, 2001, B53: 521-528.
[5]Bridgham S D, Megonigal J P, Keller J K. The carbon balance of North American wetlands. Wetlands, 2006, 26: 889-916.
[6]Brix H, Sorrell B K, Lorenzen B. Are phragmites-dominated wetlands a net source or net sink of greenhouse gases. Aquatic Botany, 2001, 69: 313-324.
[7]Bubier J L, Moore T R. An ecological perspective on methane emission from northern wetlands. Trends in Ecology and Evolution, 1994, 9: 460-464.
[8]Bubier J L, Bhatia G, Moore T R,etal. Spatial and temporal variability in growing-season net ecosystem carbon dioxide exchange at a large peatland in Ontario, Canada. Ecosystem, 2003, 6: 353-367.
[9]Alm J, Schulman J, Walden H,etal. Carbon balance of a boreal bog during a year with an exceptionally dry summer. Ecology, 1999, 80: 161-174.
[10]Alm J, Talanov A, Saamio S,etal. Reconstruction the carbon balance for microsites in a boreal oligotrophic pine fen, Finland. Oecologia, 1997, 110: 423-431.
[11]Whiting G J. Exchange in the Hudson-Bay lowlands-community characteristics and multispectral reflectance properties. Journal of Geophysical Research, 1994, 99: 1519-1528.
[12]Wand J L, Zhong Z M, Wang Z H,etal. Soil C/P distribution characteristics of alpine steppe ecosystems in the Qinhai-Tibetan Plateau. Acta Prataculturae Sinica, 2014, 23(2): 9-19.
[13]Zhao P, Dai W A, Du M X,etal. Response ofAmorphafruiticosaplanting to soil nutrients in the Tibetan Plateau. Acta Prataculturae Sinica, 2014, 23(3): 175-181.
[14]Wei W B, Li T, Li J Z. Gahai wetland ecosystem conservation and managment. Wetland Science and Management, 2010, 6(3): 32-34.
[15]Juutinen S, Alm J, Martikainen P,etal. Effects of spring flood and water level draw-down on methane dynamics in the littoral zone of boreal lakes. Freshw Biology, 2001, 46: 855-869.
[16]Kaki T, Ojala A, Kankaala P. Diel variation in methane emissions from stands ofPhragmitesaustralis(Cav.) Trin. ex Steud. andTyphalatifoliaL. in a boreal lake. Aquat Bottany, 2001, 71(4): 259-271.
[17]Hirota M Y, Tang Y, Hu Q,etal. Methane emissions from different vegetation zones in a Qinghai-Tibetan Plateau wetland. Soil Biology and Bio-chemistry, 2004, 36: 737-748.
[18]Chen H, Yao S, Wu N,etal. Determinants influencing seasonal variations of methane emissions from alpine wetlands in Zoige Plateau and their implications. Journal of Geophysical Research: Atmospheres, 2008, 113:D12303, doi: 10.1029/2006JD008072.
[19]Mosier A R. Impact of agriculture on soil consumption of atmospheric CH4and a comparison of CH4and N2O flux in subarctic, temperate and tropical grasslands. Nutrient Cycling in Agro-ecosystems, 1997, 49(1-3): 71-83.
[20]West A E, Schmidt S K. Acetate stimulates atmospheric CH4oxidation by an alpine tundra soil. Soil Biology and Biochemistry, 1999, 31: 1649-1655.
[21]Pei Z Y, Hua Q Y, Zhou C P,etal. Fluxes of CO2, CH4and N2O from alpine grassland in the Tibetan Plateau. Journal of Geographical Sciences, 2003, 13(1): 27-34.
[22]Dong Y, Zhang S, Qi Y. Fluxes of CO2, N2O and CH4from typical temperate grassland in Inner Mongolia and its daily variation. Chinese Science Bulletin, 2000, 45(17): 1590-1594.
[23]Kammann C. Methane flux from differentially managed grassland study plots: the important role of CH4oxidation in grassland with a high potential for CH4production. Environmental Pollution, 2001, 115: 261-273.
[24]Joabsson A, Chistensen T R. Methane emissions from wetlands and their relationship with vascular plants: an Arctic example. Global Change Biology, 2001, 7: 919-932.
[25]Zhang F W, Liu A H, Li Y N,etal. CO2flux in alpine wetland ecosystem on the Qingha-Tibetan Plateau. Acta Ecologica Sinica, 2008, (2): 453-462.
[26]Danevcic T, Mandic-Mulec I, Stres B,etal. Emissions of CO2, CH4and N2O from Southern uropean peatlands. Soil Biology and Biochemistry, 2010, 42: 1437-1446.
[27]Ojanen P, Minkkinen K R, Almb J K,etal. Soil-atmosphere CO2, CH4and N2O fluxes in boreal forestry-drained peatlands. Forest Ecology and Management, 2010, 260: 411-421.
[28]Salm J R, Maddison M, Tammik S,etal. Emissions of CO2, CH4and N2O from undisturbed, drained and mined peatlands in Estonia. Hydrobiologia, 2012, 692: 41-55.
[29]Klemedtsson L, Von-Arnold K, Weslien P,etal. Soil C, N ratio as a scalar parameter to predict nitrous oxide emissions. Global Change Biology, 2005, 11: 1142-1147.
[30]Hayden M J, Ross D S. Denitrification as a nitrogen removal mechanism in a Vermont peatland. Journal of Environment Quality, 2005, 34: 2052-2061.
[31]Li X D, Shen X K, Zhang C P,etal. Factors influencing soil respiration in a pea field in the Loess Plateau. Acta Prataculturae Sinica, 2014, 23(5): 24-30.
[32]Huttunen J T, Nykänen H, Turunen J,etal. Methane emissions from natural peatlands in the northern boreal zone in Finland, Fennosca-ndia. Atmospheric Environment, 2003, 37: 147-151.
[33]Freeman C, Nevison G B, Kang H. Contrasted effects of simulated drought on the production and oxidation of methane in a mid Wales wetland. Soil Biology and Biochemistry, 2002, 34: 61-67.
[34]Liikanen A, Huttunen J T, Karjalainen S M,etal. Temporal and seasonal changes in greenhouse gas emissions from a constructed wetland purifying peat mining runoff waters. Ecological Engineering, 2006, 26: 241-251.
[35]Koh H S, Ochs C A, Yu K. Hydrologic gradient and vegetation controls on CH4and CO2fluxes in a spring-fed forested wetland. Hydrobiologia, 2009, 630: 271-286.
[36]Hirota M, Senga Y, Seike Y,etal. Fluxes of carbon dioxide, methane and nitrous oxide in two contrastive fringing zones of coastal lagoon, Lake Nakaumi, Japan. Chemosphere, 2007, 68(3): 597-603.
[37]Sun Z G, Liu J S, Yang J S,etal. Nitrification denih-ification and N2O emission of typicalCalamagrostisangustifoliawetland soils in San jiang Plain. Chinese Journal of Applied Ecology, 2007, 18(1): 185-192.
[38]Dowrick D J, Hughes S, Freeman C,etal. Nitrous oxide emissions from a gully mire in mid Wales, U K, under simulated summer drought. Biogeochemistry, 1999, 44: 151-162.
[39]Sun Z G, Liu J S, Yang J S,etal. N2O flux characteristics and emission contributions ofCalamagrostisangustifoliawetland during growth and non-growth seasons. Acta Prataculturae Sinica, 2009, 18(6): 242-247.
[40]Wang L L, Sun Z G, Mou X J,etal. A preliminary study on carbon dioxide, methane and nitrous oxide fluxes from intertidal flat wetlands of the Yellow River estuary. Acta Prataculturae Sinica, 2011, 20(3): 51-61.
[41]Yang S H, Chen G X, Lin J H,etal. N2O emission from woody plants and its relation to their physiological activities. Chinese Journal of Applied Ecology, 1995, 6(4): 337-340.
参考文献:
[1]王明星, 张仁健, 郑循华. 温室气体的源与汇. 气候与环境研究, 2000, 5(1): 75-79.
[12]王建林, 钟志明, 王忠红, 等. 青藏高原高寒草原生态系统土壤碳磷比的分布特征. 草业学报, 2014, 23(2):9-19.
[13]赵萍,代万安,杜明新,等. 青藏高原种植紫穗槐对土壤养分的响应. 草业学报, 2014, 23(3): 175-181.
[14]魏文彬, 李婷, 李俊臻. 尕海湿地生态系统的保护与管理. 湿地科学与管理, 2010, 6(3): 32-34.
[25]张法伟, 刘安花, 李英年, 等. 青藏高原高寒湿地生态系统CO2通量. 生态学报, 2008, (2): 453-462.
[31]李旭东,沈晓坤,张春平, 等. 黄土高原农田土壤呼吸特征及其影响因素. 草业学报, 2014, 23(5): 24-30.
[37]孙志高,刘景双, 杨继松,等. 三江平原典型小叶章湿地土壤硝化-反硝化作用与氧化亚氮排放. 应用生态学报, 2007, 18(1): 185-192.
[39]孙志高, 刘景双, 杨继松,等. 生长季与非生长季小叶章湿地N2O通量特征及排放贡献.草业学报, 2009, 18(6): 242-247.
[40]王玲玲, 孙志高, 牟晓杰,等. 黄河口滨岸潮滩湿地 CO2、CH4和 N2O通量特征初步研究.草业学报, 2011, 20(3): 51-61.
[41]杨思河, 陈冠雄, 林继慧,等. 几种木本植物的N2O释放与某些生理活动的关系. 应用生态学报, 1995, 6(4): 337-340.
