色素上皮衍生因子对人肺腺癌SPC-A-1细胞增殖及凋亡的影响
2016-01-20杨福堂李燕王淑云聊城市第二人民医院山东聊城252601
杨福堂,李燕,王淑云(聊城市第二人民医院,山东聊城252601)
色素上皮衍生因子对人肺腺癌SPC-A-1细胞增殖及凋亡的影响
杨福堂,李燕,王淑云
(聊城市第二人民医院,山东聊城252601)
摘要:目的观察色素上皮衍生因子( PEDF)对人肺腺癌SPC-A-1细胞增殖及凋亡的影响,为其临床应用提供依据。方法将对数生长期的人肺腺癌细胞株SPC-A-1随机分为观察组和对照组,观察组分别加入终浓度为180、360、720 nmol/L的PEDF处理24、48、72 h,对照组不添加PEDF。采用MMT法检测两组细胞增殖抑制率,流式细胞仪检测细胞凋亡率。结果同一时间点,观察组不同浓度PEDF细胞增殖抑制率、凋亡率均高于对照组( P均<0.05)。随着PEDF作用时间的延长及浓度的增加,观察组细胞增殖抑制率、凋亡率均逐渐增加( P均<0.05) ;但干预24 h时,观察组不同浓度PEDF细胞凋亡率比较,P均>0.05。结论PEDF能抑制人肺腺癌SPC-A-1细胞增殖,并促进其凋亡。
关键词:肺肿瘤;肺腺癌;色素上皮衍生因子;细胞增殖;细胞凋亡
肺癌是临床常见恶性肿瘤,5年生存率不到15%,腺癌是其主要组织学类型[1]。色素上皮衍生因子( PEDF)属于丝氨酸蛋白酶超基因家族,具有抑制新生血管形成及肿瘤细胞浸润、转移的作用,其在肺癌各组织学类型细胞株中均有表达[2~4]。2013 年6月~2014年9月,我们观察了PEDF对人肺腺
癌SPC-A-1细胞增殖及凋亡的影响,为其临床应用提供依据。
1 材料与方法
1.1材料人肺腺癌细胞株SPC-A-1购自上海拜力生物科技有限公司,FBS、DMEM/F12培养液购自北京百奥森泰生物技术有限公司,胰酶、四甲基偶氮唑盐、二甲基亚砜购自美国Sigma公司,PEDF蛋白购自美国Hyclone公司。CO2培养箱购自德国Heraeus公司,酶标仪购自美国BioTek公司,CytoFLEX流式细胞仪购自美国Beckman Coulter公司。
1.2细胞培养人肺腺癌细胞株SPC-A-1置于含100 mL/L FBS及2.5 mmol/L谷氨酰胺的DMEM/F12培养基中,在37℃、5% CO2细胞培育箱中常规无菌培养。
1.3 PEDF对SPC-A-1细胞增殖抑制作用的观察
将对数生长期的SPC-A-1细胞随机分为观察组和对照组。采用胰酶消化后离心制备单细胞悬液,以每孔5×104/mL接种在96孔板中,加入DMEM/F12培养液,置于培养箱过夜。细胞贴壁后,观察组分别加入终浓度为180、360、720 nmol/L的PEDF,对照组不添加PEDF,观察组每个浓度及对照组均设5个复孔。培养24、48、72 h时分别加入10 μL MTT,继续培养4 h;出现结晶后吸去培养液,加入150 μL二甲基亚砜,摇床震荡10 min;待结晶溶解后,使用酶标仪于570 nm波长处检测各组光密度( OD)值,重复3次。增殖抑制率= ( 1-OD观察组/OD对照组)×100%[5]。
1.4 PEDF对SPC-A-1细胞凋亡作用的观察取对数生长期的SPC-A-1细胞,采用胰酶消化后以2 ×106/mL密度接种于细胞培养瓶中,待细胞贴壁生长后,吸去上清液,将细胞随机分为两组。观察组分别加入终浓度为180、360、720 nmol/L的PEDF,对照组不添加PEDF;观察组每个浓度及对照组均设5个复孔。两组培养24、48、72 h时分别用PBS清洗,再次消化后室温孵育48 h,收集两组细胞,70%乙醇固定30 min; PBS冲洗后加入5 μL Annexin V-FITC 及10 μL PI溶液混匀,置于流式管中,室温避光染色30 min;使用流式细胞仪检测各组细胞凋亡率。细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.5统计学方法采用SPSS21.0统计软件。计量资料以珋x±s表示,多组间比较采用重复测量数据的方差分析,组间两两比较采用SNK检验。P<0.05为差异有统计学意义。
2 结果
2.1两组细胞增殖抑制率比较同一时间点,观察组的细胞增殖抑制率均高于对照组( P均<0.05) ;随着PEDF作用时间的延长及浓度的增加,观察组细胞增殖抑制率均逐渐增加( P均<0.05)。
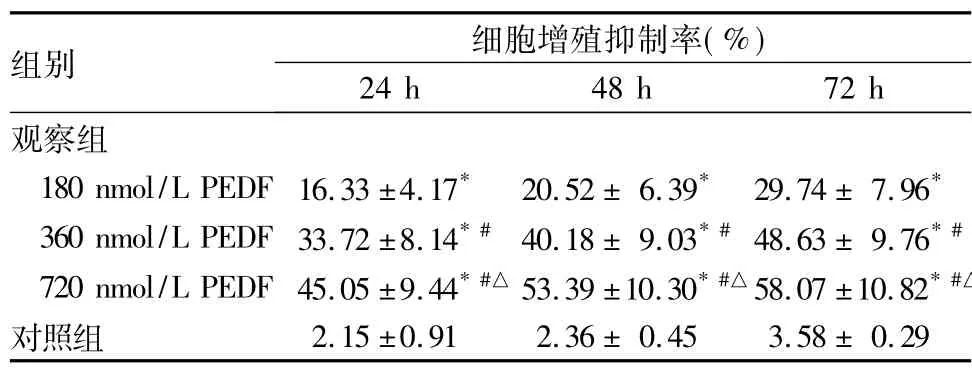
表1 各组培养24、48、72 h时细胞增殖抑制率比较(珔x±s)
2.2两组细胞凋亡率比较同一时间点,观察组不同浓度PEDF细胞凋亡率均高于对照组( P均<0.05) ;随着PEDF作用时间的延长及浓度的增加观察组细胞凋亡率均逐渐增加( P均<0.05),但干预24 h时,观察组不同浓度PEDF细胞凋亡率比较,P均>0.05。

表2 各组培养24、48、72 h时细胞凋亡率比较(珔x±s)
3 讨论
研究发现,抑制血管增生可控制肿瘤的发展[6]。血管增生通过内皮细胞迁移及增殖完成,为肿瘤细胞提供营养;同时,血管增生刺激因子与抑制因子平衡紊乱,导致新生血管出现[7]。肿瘤细胞的快速成长有赖于新生血管的形成,并通过新生血管形成肿瘤细胞的转移途径[8]。PEDF是目前发现的最强的血管增生抑制因子,对肝癌、肺癌等多种恶性肿瘤均有抑制作用。研究发现,PEDF通过Fas通路上调细胞凋亡相关基因表达,并激活胱天蛋白酶信号通路,诱导肿瘤细胞凋亡[9];此外,PEDF可抑制毛细血管形成,阻碍内皮细胞迁移[10]。PEDF低表达的肺癌细胞更易发生淋巴结转移,且PEDF表达水平与肺癌分化程度、临床分期及远处转移密切相关,因此检测PEDF有助于判断肺癌病变程度[11]He等[7]研究发现,腺病毒介导的PEDF表达可抑制Lewis肺癌的生长。
本研究发现,PEDF可抑制人肺腺癌SPC-A-1
细胞增殖,且随着PEDF浓度增加、作用时间延长,细胞增殖抑制率逐渐增高。细胞增殖失控是肿瘤形成的重要原因。肿瘤细胞的增殖周期包含G1、S、G2及M期,与细胞增殖关系最为密切的是DNA倍增、染色体复制的S期。如果在S期通过外界因素作用抑制或减慢DNA合成,则会影响细胞周期的进展。PEDF可抑制肿瘤细胞周围新生血管的形成,减少细胞增殖所需蛋白质的合成,使DNA含量较多的S期细胞减少,而DNA含量较少的G1期细胞增多,从而减慢肿瘤细胞周期进程,抑制肿瘤细胞增殖。
本研究还发现,PEDF也具有诱导细胞凋亡的作用,随着PEDF浓度的增加、作用时间的延长,细胞凋亡率逐渐增高。细胞凋亡是一种主动的、受遗传控制的程序性死亡,PEDF可能通过作用于肿瘤的某些旁路途径,或参与细胞周期的某些重要的酶、蛋白,进而诱导肿瘤细胞凋亡。本研究发现,PEDF抑制细胞增殖、诱导细胞凋亡的作用具有剂量依赖性,这与娄志霞等[12]对人肺腺癌A549细胞、刘正兵等[13]对肺大细胞癌NCI-H460细胞的研究结果一致。因此,PEDF有望成为治疗肺癌的辅助用药。
参考文献:
[1]Cancer Genome Atlas Research Network.Comprehensive genomic characterization of squamous cell lung cancers[J].Nature,2012,489( 7417) : 519-525.
[2]Tombran-Tink J,Chader GG,Johnson LV.PEDF: a pigment epithelium-derived factor with potent neuronal differentiative activity [J].Exp Eye Res,1991,53( 3) : 411-414.
[3]徐锡明,陈金强,郑楠薪,等.PEDF结构和功能的关系[J].现代肿瘤医学,2012,20( 9) : 1956-1958.
[4]Henschke CI,Yankelevitz DF,Libby DM,et al.Survival of pa tients with stage I lung cancer detected on CT screening[J].N En gl J Med,2006,355( 17) : 1763-1771.
[5]娜仁图娜拉,闫雷,赵瑞杰,等.流式细胞术及其在细胞凋亡检测中的应用[J].中国组织工程研究与临床康复,2009,13 ( 27) : 5353-5356.
[6]王嫱.miRNA对VEGF介导肿瘤血管生成的调控作用研究进展[J].山东医药,2012,52( 34) : 91-94.
[7]He SS,Shi HS,Yin T,et al.AAV-mediated gene transfer of hu man pigment epithelium-derived factor inhibits Lewis lung carcino ma growth in mice[J].Oncol Rep,2012,27( 4) : 1142-1148.
[8]赵庆香,王中奇.肿瘤相关巨噬细胞与肺癌侵袭转移的研究进展[J].山东医药,2014,54( 17) : 98-100.
[9]Tan ML,Choong PF,Dass CR.Anti-chondrosarcom effects o PEDF mediated via molecules important to apoptosis,cell cycling adhesion and invasion[J].Biophys Res Commun,2010,398( 4) : 613-618.
[10]Konson A,Pradeep S,D'Acunto CW,et al.Pigment epithelium derived factor and its posphomimetic mutant induce JNK-dependen apoptosis and p38-mediated migration arrest[J].J Biol Chem 2011,286( 5) : 3540-3551.
[11]郑民,梁岳培,王洋.非小细胞肺癌组织中VEGF、PEDF的表达变化及意义[J].山东医药,2011,51( 18) : 53-54.
[12]娄志霞,束军,金程,等.PEDF对人肺腺癌A549细胞增殖与凋亡的影响[J].安徽医科大学学报,2014,49( 10) : 1361-1364.
[13]刘正兵,束军.色素上皮衍生因子对非小细胞肺癌NCI-H460细胞增殖和凋亡的影响[J].安徽医科大学学报,2013,48( 6) : 604-606.
·临床研究·
收稿日期:( 2015-04-02)
文章编号:1002-266X( 2015) 32-0034-03
文献标志码:A
中图分类号:R734.2
doi:10.3969/j.issn.1002-266X.2015.32.013
