缺血性卒中患者静脉rt-PA溶栓治疗的性别差异及其相关因素分析
2016-01-18李姗姗嵇碧莹沈佳慧张沈阳张清秀衡卫卫李晓波张鹏徐运张梅娟
李姗姗,嵇碧莹,沈佳慧,张沈阳,张清秀,衡卫卫,李晓波,张鹏,徐运,张梅娟
卒中是导致人类死亡的第四大病因[1]。近年来,虽然全球卒中发病率已呈下降趋势,但相比于男性卒中而言,由于发病年龄大、主要危险因素及女性特异性危险因素复杂等特点,女性卒中呈现发病率及死亡率下降缓慢、卒中负担重、卒中预后差的趋势[2]。重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)静脉溶栓是目前治疗缺血性脑卒中唯一有效的方法,而女性接受缺血性卒中溶栓治疗后的获益相比于男性而言可能存在差异。目前虽有部分关于溶栓治疗获益程度的性别差异及其可能相关因素的研究,但结果仍存在争议。而国内尚少有对中国人群急性缺血性卒中患者溶栓治疗后男女性获益及其相关影响因素的数据分析。因此本研究将对江苏地区急性缺血性卒中静脉rt-PA溶栓治疗后男女性反应性差异及可能危险因素进行回顾性分析及探讨。
1 对象和方法
1.1 病例选择
①本研究搜集江苏省临床卒中中心包括南京、徐州和扬州地区,6家三级医院神经内科2012至2013年收治的急性缺血性卒中发病6 h内符合溶栓条件,完成rt-PA静脉溶栓的病例(标准剂量0.9 mg/kg);②所有纳入患者均签署知情同意书;③由接受过专门培训的神经内科医生完成数据登记;④每例患者均完成溶栓前、溶栓后24 h头颅计算机断层扫描(computed tomography,CT)检查,溶栓治疗后72 h内头颅磁共振成像(magnetic resonance imaging,MRI)检查。
1.2 数据采集
1.2.1 基线资料 患者入院时临床和实验室资料,如年龄、性别、既往史[吸烟、饮酒、高血压、糖尿病、高血脂、心房颤动、短暂性脑缺血发作(transient ischemic attack,TIA)或卒中、肝肾功能不全和外周血管事件等],溶栓前服用降糖、降脂、抗血小板聚集、抗凝药物情况,溶栓前血压、血糖情况,基线时白细胞计数及分类、血小板计数、肝肾功能、血脂、电解质、凝血功能、血清同型半胱氨酸、糖化血红蛋白,急性缺血性卒中试验(Trial of Org 10 172 in Acute Stroke Treatment,TOAST)分型、溶栓第2天平均收缩压、溶栓后24 h内收缩压下降情况。
1.2.2 影像学资料 溶栓后24 h及住院期间头颅CT提示脑出血的发生率,并依据临床症状及头颅CT结果将颅内出血(intracerebral hemorrhage,ICH)分为无症状性脑出血(asymptomatic cerebral hemorrhage,aSICH)和症状性脑出血(symptomatic cerebral hemorrhage,sICH),sICH定义为:CT证实的颅内出血与患者临床症状恶化有时间相关性,神经功能缺损评分(National Institutes of Health Stroke Scale,NIHSS)增加4分以上,参照欧洲协作性急性卒中研究(European Cooperative Acute Stroke Study,ECASS-Ⅲ)标准[3];颈动脉、椎动脉血管超声或头颈部计算机断层扫描血管造影术(computed tomographic angiography,CTA)显示的血管内斑块(稳定;不稳定);磁共振血管造影(magnetic resonance angiography,MRA)或CTA显示的颅内外血管狭窄程度(无狭窄;轻度狭窄;中度狭窄;重度狭窄;闭塞)。
1.2.3 神经功能评估 评估患者溶栓前、溶栓后24 h及出院时(溶栓后10~14 d)NIHSS、日常生活活动能力评定量表(Barthel Index,BI)、格拉斯哥昏迷评分(Glasgow Coma Scale,GCS)、意识状态(清醒、嗜睡、昏睡、浅昏迷、中昏迷和深昏迷)。同时评估早期神经功能改善(early major neurological improvement,ENI),定义为24 h内NIHSS下降≥8分或24 h NIHSS为0或1分[4];早期神经功能恶化(early neurological deterioration,END),定义为24 h内NIHSS增加≥4分[5];早期意识状态改善(early consciousness improvement,ECI),本研究中定义为24 h内GCS评分中意识单项评分下降的发生率;早期意识状态恶化程度(early consciousness deterioration,ECD),本研究中定义为24 h内GCS评分中意识单项评分上升;意识状态恶化程度(consciousness deterioration,CD),本研究中定义为住院期间GCS评分中意识单项评分上升。由对患者和临床资料不知情的神经内科主治医师进行上述神经功能评分。
1.2.4 卒中相关并发症发生率 记录溶栓后住院期间发生脑出血、肺部感染、心血管事件、消化道出血、肝肾功能紊乱、再发卒中、卒中进展和死亡等并发症的发生率。
1.3 统计分析 采用SPSS 19.0统计软件包对资料进行单因素分析,符合正态分布的计量资料用平均数±标准差表示,组间比较采用独立样本t检验;不符合正态分布的计量资料采用中位数、四分位数间距表示,组间比较采用非参数检验;计数资料以频数和百分数表示,组间比较采用χ2检验。采用单因素及多因素线性回归分析对影响男性及女性溶栓后神经功能结局的可能因素进行初步探究。所有分析采用双侧检验,P<0.05认为差异有显著性。
2 结果
本研究共纳入289例rt-PA静脉溶栓患者,其中女性111例,男性178例。女性组中位发病年龄高于男性组[72(65,77)vs64.5(56,73),P=0.000],尤其女性组年龄≥75岁比率显著高于男性组(37.8%vs19.1%,P=0.000),而年龄>80岁在两组间差异无显著性(9.9%vs6.2%,P=0.245)。
2.1 女性溶栓组与男性溶栓组常见危险因素及实验室指标比较(表1) 女性组既往吸烟史和饮酒史所占比率低于男性组(吸烟史:0.9%vs34.3%,P=0.000;饮酒史:1.8%vs10.1%,P=0.014);既往有心房颤动、高血压病史比率高于男性组(心房颤动:40.5%vs24.7%,P=0.005;高血压病史:80.2%vs64.0%,P=0.004),而两组在既往脑血管事件和糖尿病病史等方面差异无显著性(既往脑血管事件:23.4%vs26.4%,P=0.571;糖尿病病史:19.8%vs15.2%,P=0.305)。此外,女性组在血小板计数、球蛋白、高密度胆固醇和D-二聚体方面均高于男性组[血小板计数:204.23±65.10vs188.98±53.24,P=0.042;球蛋白:29.21±5.12vs26.65±5.38,P=0.000;高密度胆固醇:1.25±0.34vs1.14±0.34,P=0.010;D-二聚体:1.08(0.57,49)vs0.62(0.24,1.36),P=0.001],而在白球比和活化部分凝血活酶时间方面均低于男性组[白球比:1.48(1.3,1.66)vs1.6(1.4,1.8),P=0.002;活化部分凝血活酶时间:24.7(22.4,29.05)vs25.95(23.78,34.58),P=0.031]。

表1 女性溶栓组与男性溶栓组常见危险因素及实验室指标比较
2.2 女性溶栓组与男性溶栓组卒中发病特点比较(表2) 女性组溶栓前平均收缩压高于男性(156.26±25.03vs149.77±24.84,P=0.032)。TOAST分型中男性组大动脉粥样硬化性卒中(large-artery atherosclerosis,LAA)发生率高于女性组(71.3%vs58.6%,P=0.025),心源性栓塞性卒中(cardioembolism,CE)发生率低于女性(24.7%vs39.6%,P=0.007)。男性组MRA或CTA提示颅内外血管内轻度狭窄发生率高于女性组(32.6%vs19.8%,P=0.018)。而溶栓前舒张压、溶栓前血糖、发病距离溶栓时间等方面在两组之间差异均无显著性。
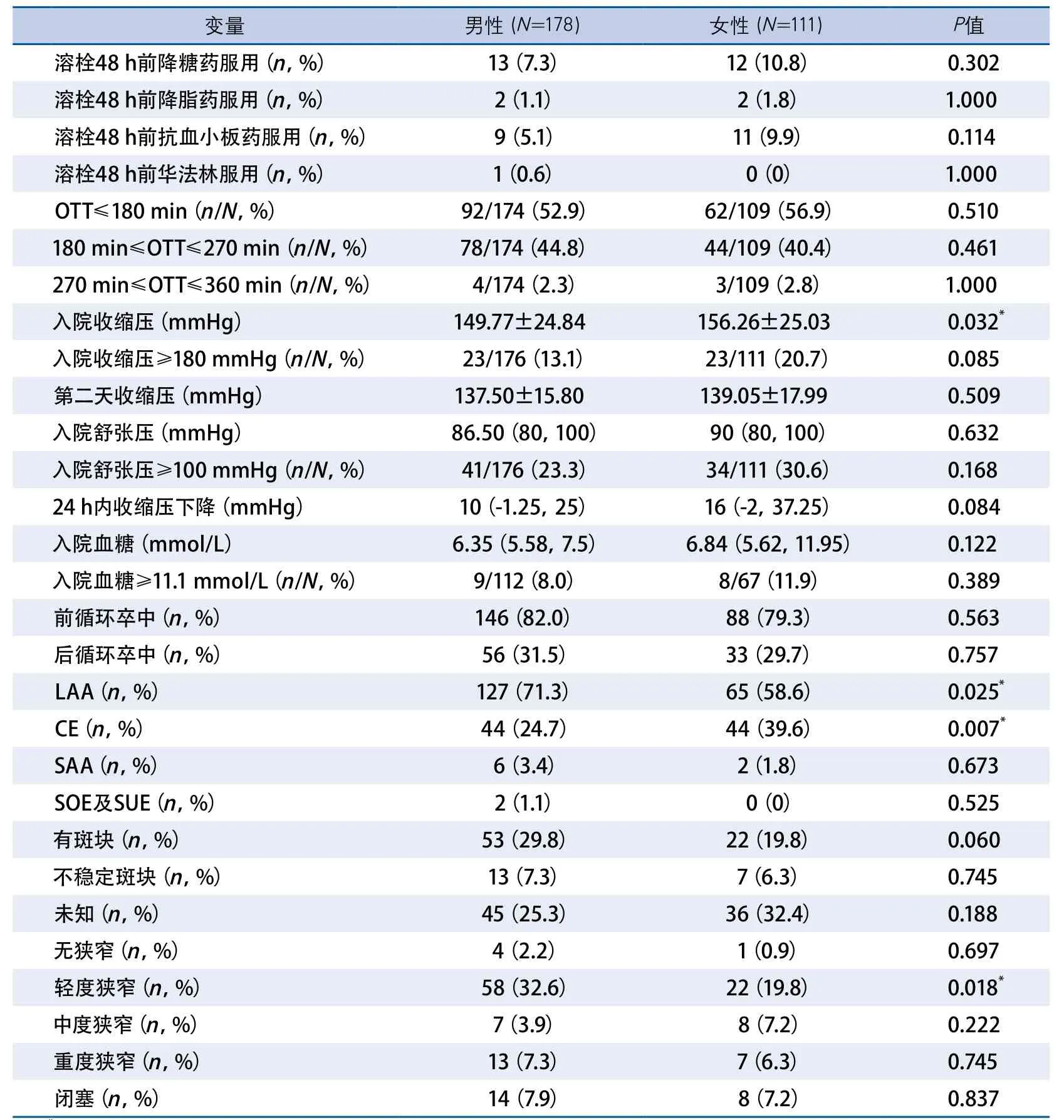
表2 女性溶栓组与男性溶栓组卒中发病特点比较
2.3 女性溶栓组与男性溶栓组溶栓结局比较(表3) 女性组入院、24 h、出院NIHSS均高于男性组[入院NIHSS:10(4,16)vs7(4,13),P=0.028;24 h NIHSS:8.5(3,15)vs6(3,11.5),P=0.005;出院NIHSS:5(2,11.5)vs3(1,7.25),P=0.008],入院、出院BI均低于男性组[入院BI:40(20,65.75)vs45(30,75),P=0.044;出院BI:67.5(35,100)vs80(48.75,100),P=0.006]。
女性组入院、24 h GCS评分,入院、24 h内及出院意识受累程度均较男性组增高[入院GCS:14(9.5,15)vs14.5(11,15),P=0.046;24 h GCS:14(10.5,15)vs15(13,15),P=0.008;入院意识受累:0(0,1)vs0(0,0),P=0.039;24 h意识受累:0(0,1)vs0(0,0),P=0.002;出院意识受累:0(0,0)vs0(0,0),P=0.020]。男性组CD发生率低于女性组(29.8%vs46.8%,P=0.003)。
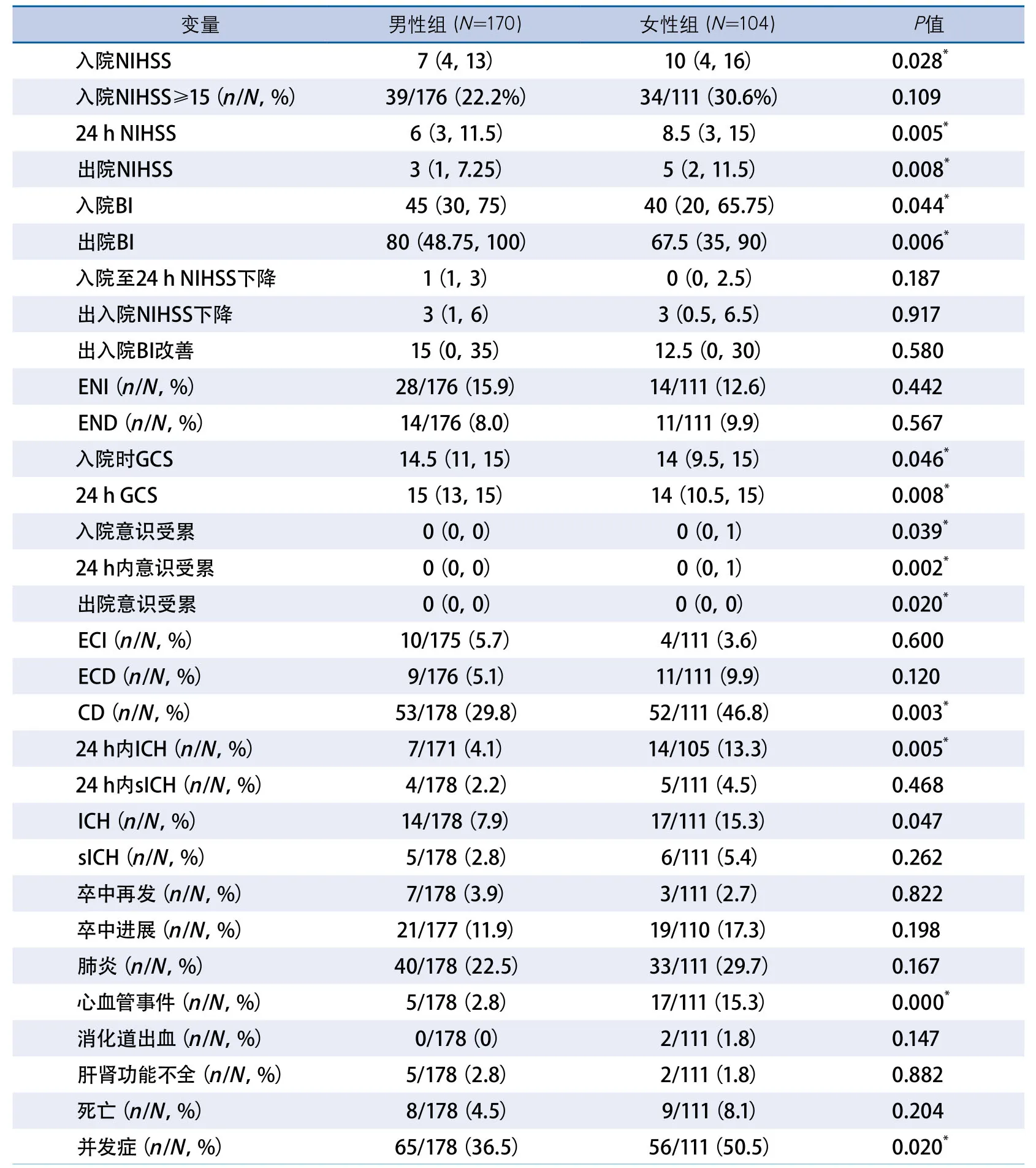
表3 女性溶栓组与男性溶栓组溶栓结局比较
此外,女性组24 h内ICH发生率、住院期间ICH发生率均高于男性组(24 h ICH:13.3%vs4.1%,P=0.005;ICH:15.3%vs7.9%,P=0.047)。女性组住院期间卒中相关并发症发生率,尤其心血管相关事件发生率高于男性组(15.3%vs2.8%,P=0.000),而24 h内、住院期间sICH发生率及死亡发生率在两组之间差异均无显著性。
2.4 影响溶栓后10~14 d神经功能结局相关因素的线性回归分析 以出院NIHSS为因变量,选择单因素分析中有统计学意义的变量并结合专业知识选择的变量为自变量,代入多因素线性回归模型。如表4和表5,对女性组及男性组可能相关因素进行线性回归分析发现,既往心房颤动病史、基线高密度胆固醇水平、ENI、入院NIHSS及住院期间sICH发生可能是本组溶栓的女性患者发病10~14 d神经功能的独立危险因素;同时,入院NIHSS评分、24 h较入院NIHSS评分的改善程度,住院期间sICH的发生率,发病距离溶栓时间≤180 min的发生率可能是本组溶栓男性患者发病10~14 d神经功能的独立危险因素。
3 讨论
近年来,与男性卒中相比,女性卒中发病率及死亡率下降相对缓慢,女性卒中相关危险因素的日益突出,使得女性卒中的预防、治疗、疾病转归及预后得到了广泛的关注。本研究对2012至2013年江苏省地区6家三级医院6 h内接受rt-PA静脉溶栓治疗的卒中患者进行回顾性研究,以探讨女性卒中患者溶栓后预后影响因素。
未溶栓情况下,女性卒中后3个月神经功能预后差于男性,且生存率低于男性[6-7]。静脉溶栓是治疗缺血性卒中急性期血管再通最有效的方法,但性别可能影响其溶栓的疗效和安全性。在本研究中,女性在入院时、24 h及出院时(10~14 d)神经功能缺损程度均重于男性组,且溶栓后24 h以及出院时神经功能缺损改善程度低于男性,提示女性组溶栓前神经功能缺损程度重,溶栓后神经功能恢复慢。并且溶栓后女性组24 h内、住院期间发生颅内出血概率均高于男性组,但sICH发生率差异却无显著性。卒中相关并发症尤其是心血管事件并发症女性组增高。一项333例3 h行rt-PA静脉溶栓的多中心随机对照试验(randomized controlled trial,RCT)研究中,3个月BI≥95比率,mRS≤1比率男性偏高,在调整相关协变量后男性仍预后更好,表明溶栓治疗并未逆转女性卒中预后较男性差的现象[8]。此外,对90项研究进行综述得出,男性与女性从溶栓中获益相当。但女性由于年龄更大、严重卒中更多导致卒中后神经功能预后良好发生率较低[9],女性溶栓后3个月预后仍差于男性[10]。
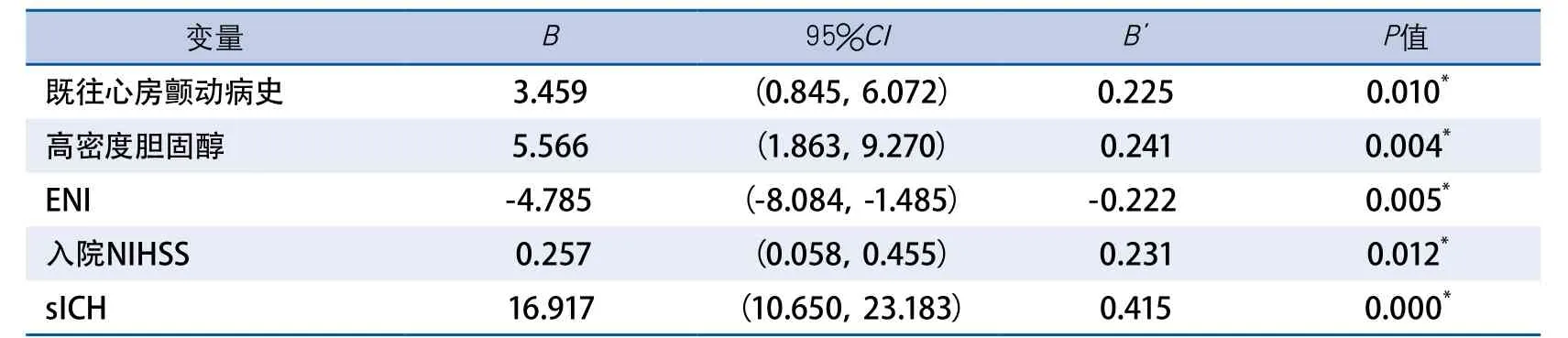
表4 女性组10~14 d神经功能结局的多因素线性回归分析
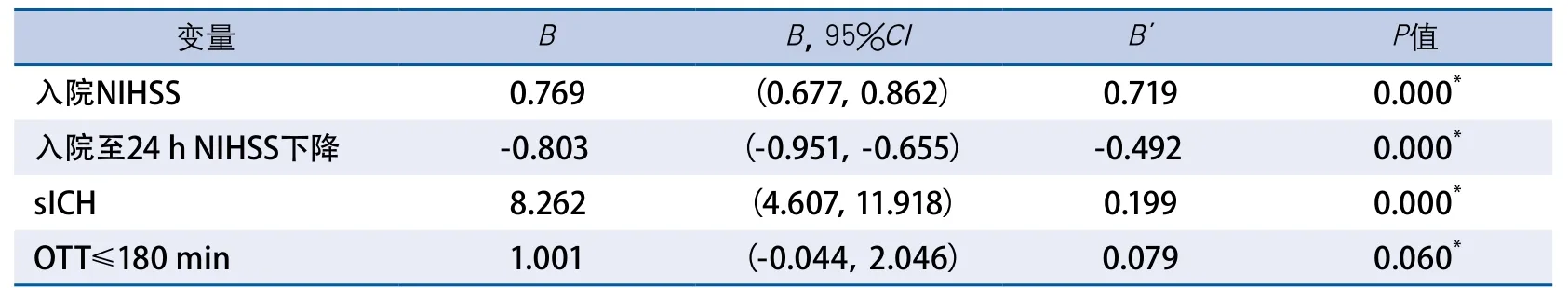
表5 男性组10~14 d出院神经功能结局多因素线性回归分析
卒中溶栓后获益的性别差异可能与基线状态相关,包括年龄、既往高血压病史、糖尿病、心房颤动病史、基线凝血状态、血压和血糖水平等。
在既往研究中,女性接受溶栓者平均年龄高于男性,尤其高龄段女性[11-13]。年龄已经被证实是影响卒中预后尤其女性卒中溶栓预后的重要因素,女性溶栓者年龄更高可能增加女性溶栓预后不良的风险[6,9]。本研究中,女性平均发病年龄为(70.21±9.33)岁,其中年龄≥75岁占37.8%;男性组平均发病年龄为(63.64±11.56)岁,其中年龄≥75岁占19.1%。因而女性平均发病年龄及平均年龄≥75岁均高于男性组,但线性回归分析却未发现年龄及高龄对卒中预后的重要影响。
高血压、心房颤动、糖尿病和吸烟是卒中最强的危险因素[14]。其中心房颤动是重要的卒中可干预危险因素,与卒中死亡率及致残率密切相关[15]。女性心房颤动发生率高,因而在自然卒中病程中,女性由于心房颤动导致心源性栓塞发生率高,导致严重神经损害及更高的死亡率[16]。高血压是重要的卒中危险因素之一[17],由于女性存在动脉僵硬度高,肾素-血管紧张素系统过度激活,卵巢激素对血压的影响,以及老年绝经后非激素依赖性的血压调控等因素,老年女性与男性相比在血压调控方面具有差异[18],女性血压控制率明显低于男性,尤其老年女性血压控制不良[19]。一项美国加州294例接受溶栓治疗的研究数据中,男性既往吸烟、冠状动脉粥样硬化性心脏病和心肌梗死病史显著多于女性,既往心房颤动病史少于女性[11]。近期国内一项研究数据表明,7 d之内发生急性缺血性脑卒中患者,老年女性既往高血压、糖尿病、高血脂和心脏病的发病率均高于男性[20]。在本研究人群中,女性溶栓组在既往心房颤动病史、高血压病史、心源性栓塞发生率和溶栓前收缩压水平方面均高于男性组,而在既往吸烟史、饮酒史、大动脉粥样硬化型卒中比例和颅内外血管内轻度狭窄发生率方面均低于男性。本研究还发现,溶栓的女性组在基线及住院期间的意识障碍受累程度均高于男性组。而住院期间意识障碍的恢复程度不如男性组,可能与心房颤动相关。一项瑞典登记的24 633例发生卒中事件的患者,3个月随访时女性生存率明显低于男性,主要可能与发病年龄偏大,入院时意识状态受累相关[6]。
此外,女性在免疫、凝血等遗传因素、激素、妊娠和分娩等生殖因素,以及易出现抑郁和心理压力等社会因素方面均与男性存在显著差异,直接影响卒中的临床转归[2]。在本研究中,女性组在基线血小板计数、球蛋白、高密度胆固醇、D-二聚体方面均高于男性组,而在白球比、活化部分凝血活酶时间方面均显著低于男性组。因而女性可能存在血液黏稠度高,内源性凝血途径及免疫系统激活程度广,以及抗动脉粥样硬化作用强等特点,从而对女性卒中预后产生影响。
对本研究的溶栓结局进行线性回归发现,除了与入院神经功能缺损评分、溶栓后24 h内神经功能改善程度、溶栓后症状性脑出血发生与男性及女性卒中溶栓结局均相关外,既往心房颤动病史、基线高密度胆固醇水平均对女性卒中溶栓的结局可能有显著影响。而发病距离溶栓事件<3 h对男性卒中溶栓的结局可能有影响。
而美国国立神经疾病与卒中研究所(National Institute of Neurological Disorders and Stroke,NINDS)数据研究发现,女性卒中溶栓预后较差的原因不是基线状态的差异,而是对rt-PA的反应低下,但这一研究主要针对美洲白种人及黑种人[21]。此外,性别独立基因导致性别差异被证实。编码凝集素样氧化低密度脂蛋白受体的OLR1基因的错义SNPrs11053646(K167N)与女性所有斑块显性相关,而与男性无关,提示脂代谢相关基因多变性可能与颈动脉斑块的性别差异有关,提示该基因能识别心血管事件高危女性[22]。有研究认为,女性纤溶酶原激活剂抑制剂-1升高可能对缺血再灌注产生影响,而雌激素水平可影响脑部对缺血和再灌注的反应[7]。在缺血性卒中大鼠的机制研究中发现,女性在缺血性卒中损伤后早期释放细胞色素C和蛋白酶活化,从而影响细胞凋亡通路,发挥保护作用,而男性无此获益,因此男性与女性在缺血损伤及神经保护药物功效方面均存在性别差异[23]。
然而,也有不同研究结果显示女性卒中溶栓肯定获益。2005年RCT研究的汇总分析表明,6 h内接受溶栓的患者中,女性90 d mRS≤1发生率较男性低,而女性溶栓者较未溶栓者mRS≤1发生率显著增高,并且在调整混杂因素后,性别仍被证实是影响卒中溶栓治疗预后的重要因素[7]。另一项汇总分析也得出女性rt-PA治疗后90 d预后显著优于男性[11]。而一项45 079例溶栓登记中心卒中溶栓安全性监测观察(Safe Implementation of Thrombolysis in Stroke-Monitoring Study,SIT-MOST)分析认为,虽然女性3个月死亡率高、独立率低,但调整混杂变量后,未发现两组卒中后90 d独立率(mRS≤2)存在差异,并且男性与更高死亡率及sICH相关,因而可能女性获益更多[12,14]。既往一项RCT汇总分析及加拿大组织纤溶酶原激活剂治疗卒中疗效研究(Canadian Alteplase for Stroke Effectiveness,CASES)、尿激酶治疗急性缺血性脑卒中2期研究(Pro-Urokinase for Acute Cerebral Thromboembolism-2,PROACT-2)认为溶栓之间无性别差异,并认为溶栓逆转了卒中后的自然性别差异[7,24-25]。而女性常见更多的心源性栓塞发生,常可见纤维蛋白丰富的小体积血凝块,也可能是溶栓治疗后容易再通而获益原因之一[16]。
女性卒中存在预后差的自然病程,而女性溶栓是否获益多于男性,是否能逆转其卒中预后差于男性的趋势,影响两性对溶栓的获益程度的最重要的因素等问题目前尚无定论,其研究结果的不同可能与研究设计、研究人群及各个研究样本量大小有关。在本研究中,女性卒中患者溶栓后神经功能预后仍然差于男性患者,其中溶栓后10~14 d心脏相关并发症、脑出血发生率及意识障碍累及程度均高于男性,并且女性患者存在平均年龄高于男性,既往高血压和心房颤动病史多于男性,基线凝血状态差于男性的特点。但本研究尚存在诸多不足之处:第一,本研究对象为静脉溶栓患者,缺乏与同等条件的未溶栓患者的对照研究;第二,本研究卒中预后评估时间短,仅能说明溶栓治疗对卒中后短期预后的获益性别差异,未来可对溶栓后卒中远期预后的获益进一步探索研究;第三,本研究为回顾性病例分析,未来可进行大样本前瞻性随机对照研究,对中国人群卒中溶栓获益的影响因素进一步探索。
1 Roger VL, Go AS, Lloyd-Jones DM, et al. Heart disease and stroke statistics--2012 update:a report from the American Heart Association[J]. Circulation, 2012,125:e2-e220.
2 Bushnell C, Mc Cullough LD, Awad IA, et al.Guidelines for the prevention of stroke in women:a statement for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2014, 45:1545-1588.
3 Brott T, Adams HP Jr, Olinger CP, et al. Measurements of acute cerebral infarction:a clinical examination scale[J]. Stroke, 1989, 20:864-870.
4 Saposnik G, Di Legge S, Webster F, et al. Predictors of major neurologic improvement after thrombolysis in acute stroke[J]. Neurology, 2005, 65:1169-1174.
5 Tisserand M, Seners P, Turc G, et al. Mechanisms of unexplained neurological deterioration after intravenous thrombolysis[J]. Stroke, 2014, 45:3527-3534.
6 Eriksson M, Glader EL, Norrving B, et al. Sex differences in stroke care and outcome in the Swedish national quality register for stroke care[J]. Stroke, 2009,40:909-914.
7 Kent DM, Price LL, Ringleb P, et al. Sex-based differences in response to recombinant tissue plasminogen activator in acute ischemic stroke:a pooled analysis of randomized clinical trials[J]. Stroke, 2005,36:62-65.
8 Elkind MS, Prabhakaran S, Pittman J, et al. Sex as a predictor of outcomes in patients treated with thrombolysis for acute stroke[J]. Neurology, 2007,68:842-848.
9 Appelros P, Stegmayr B, Terént A. A review on sex differences in stroke treatment and outcome[J]. Acta Neurol Scand, 2010, 121:359-369.
10 Elkind MS, Prabhakaran S, Pittman J, et al. Sex as a predictor of outcomes in patients treated with thrombolysis for acute stroke[J]. Neurology, 2007, 68:842-848.
11 Tafreshi GM, Raman R, Ernstrom K, et al. Gender differences in acute stroke treatment:the University of California San Diego experience[J]. Stroke, 2010,41:1755-1757.
12 Lorenzano S, Ahmed N, Falcou A, et al. Does sex in fl uence the response to intravenous thrombolysis in ischemic stroke?:answers from safe implementation of treatments in Stroke-International Stroke Thrombolysis Register[J]. Stroke, 2013, 44:3401-3406.
13 de Ridder I, Dirks M, Niessen L, et al. Unequal access to treatment with intravenous alteplase for women with acute ischemic stroke[J]. Stroke, 2013, 44:2610-2612.
14 Wassertheil-Smoller S. Stroke in women[J]. Nutr Metab Cardiovasc Dis, 2010, 20:419-425.
15 Goldstein LB, Bushnell CD, Adams RJ, et al.Guidelines for the primary prevention of stroke:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2011, 42:517-584.
16 Förster A, Gass A, Kern R, et al. Gender differences in acute ischemic stroke:etiology, stroke patterns and response to thrombolysis[J]. Stroke, 2009, 40:2428-2432.
17 Turnbull F, Woodward M, Neal B, et al. Blood Pressure Lowering Treatment Trialists’ Collaboration. Do men and women respond differently to blood pressurelowering treatment? Results of prospectively designed overviews of randomized trials[J]. Eur Heart J, 2008,29:2669-2680.
18 Ong KL, Tso AW, Lam KS, et al. Gender difference in blood pressure control and cardiovascular risk factors in Americans with diagnosed hypertension[J].Hypertension, 2008, 51:1142-1148.
19 Gu Q, Burt VL, Paulose-Ram R, et al. Gender differences in hypertension treatment, drug utilization patterns, and blood pressure control among US adults with hypertension:data from the National Health and Nutrition Examination Survey 1999-2004[J]. Am J Hypertens, 2008, 21:789-798.
20 Pu Y, Liu L, Wang Y, et al. Geographic and sex difference in the distribution of intracranial atherosclerosis in China[J]. Stroke, 2013, 44:2109-2114.
21 Mandava P, Murthy SB, Munoz M, et al. Explicit consideration of baseline factors to assess recombinant tissue-type plasminogen activator response with respect to race and sex[J]. Stroke, 2013, 44:1525-1531.
22 Wang L, Yanuck D, Beecham A, et al. A candidate gene study revealed sex-specific association between the OLR1 gene and carotid plaque[J]. Stroke, 2011, 42:588-592.
23 Liu F, Li Z, Li J, et al. Sex differences in caspase activation after stroke[J]. Stroke, 2009, 40:1842-1848.
24 Kent DM, Buchan AM, Hill MD. The sex effect in stroke thrombolysis:of CASES, controls, and treatmenteffect modi fi cation[J]. Neurology, 2008, 71:1080-1083.
25 Hill MD, Kent DM, Hinchey J, et al. Sex-based differences in the effect of intra-arterial treatment of stroke:analysis of the PROACT-2 study[J]. Stroke, 2006,37:2322-2325.
