2,5-二酮哌嗪衍生物的一锅法合成及其细胞毒活性*
2016-01-17李晋昇廖升荣刘永宏中国科学院南海海洋研究所广东广州5030中国科学院大学北京00049
李晋昇,廖升荣,汤 勇,刘永宏(.中国科学院南海海洋研究所,广东广州 5030; 2.中国科学院大学,北京 00049)
2,5-二酮哌嗪衍生物的一锅法合成及其细胞毒活性*
李晋昇1,2,廖升荣1,汤勇1,2,刘永宏1
(1.中国科学院南海海洋研究所,广东广州510301; 2.中国科学院大学,北京100049)
摘要:以DMF为溶剂,Cs2CO3为碱,N,N-二乙酰基-2,5-二酮哌嗪,芳醛和卤代烷经一锅法合成了10个2,5-二酮哌嗪类衍生物(4a~4j,其中4c,4f和4i为新化合物),收率54.2%~75.7%,其结构经1H NMR,13C NMR和ESI-MS确证。生物活性研究结果表明:(Z)-1-乙酰基-3-(1-亚甲基萘)-4-烯丙基-2,5-二酮哌嗪(4c)对U937,Hela和Du145等细胞具有一定的细胞毒活性。
关键词:2,5-二酮哌嗪;一锅法; Aldol缩合;合成;细胞毒活性
2,5-二酮哌嗪(DKPs)类化合物是一类广泛存在于自然界中的次生代谢产物[1-2],具有抗污、抗菌、抗肿瘤、抗病毒、抗氧化等多种生物活性[3-5],以及特殊的生物活性及生理作用,如神经保护、代谢节律、跨膜运输等[5-6]。DKPs的骨架是稳定的六元环,在药物化学中是重要的药效团[7]。DKPs因氢键及与支链芳香环发生π-π堆叠致使脂溶性差,导致生物利用度低[8]。在N上引入的保护基能破坏分子内氢键及π-π堆叠,从而改善其溶解性[9]。
在碱性环境中的Aldol缩合是DKPs骨架引入不饱和支链的常见方法之一,具有操作简便和反应效率高等优点[10]。这种一侧不饱和取代的DKPs衍生物被报道具有强的抗污损活性,其EC50达0.034 μM[11]。此类衍生物也具有潜在的细胞毒活性,能作为中间体后续合成出具有显著细胞毒活性的目标化合物[9]。而选用烯丙基作为保护基不仅能解决溶解性问题,而且还有望提高细胞毒活性[12]。但引入N上保护基通常是在Aldol缩合结束后再进行,其反应中间体因溶解性差而导致操作繁琐、产率较低。
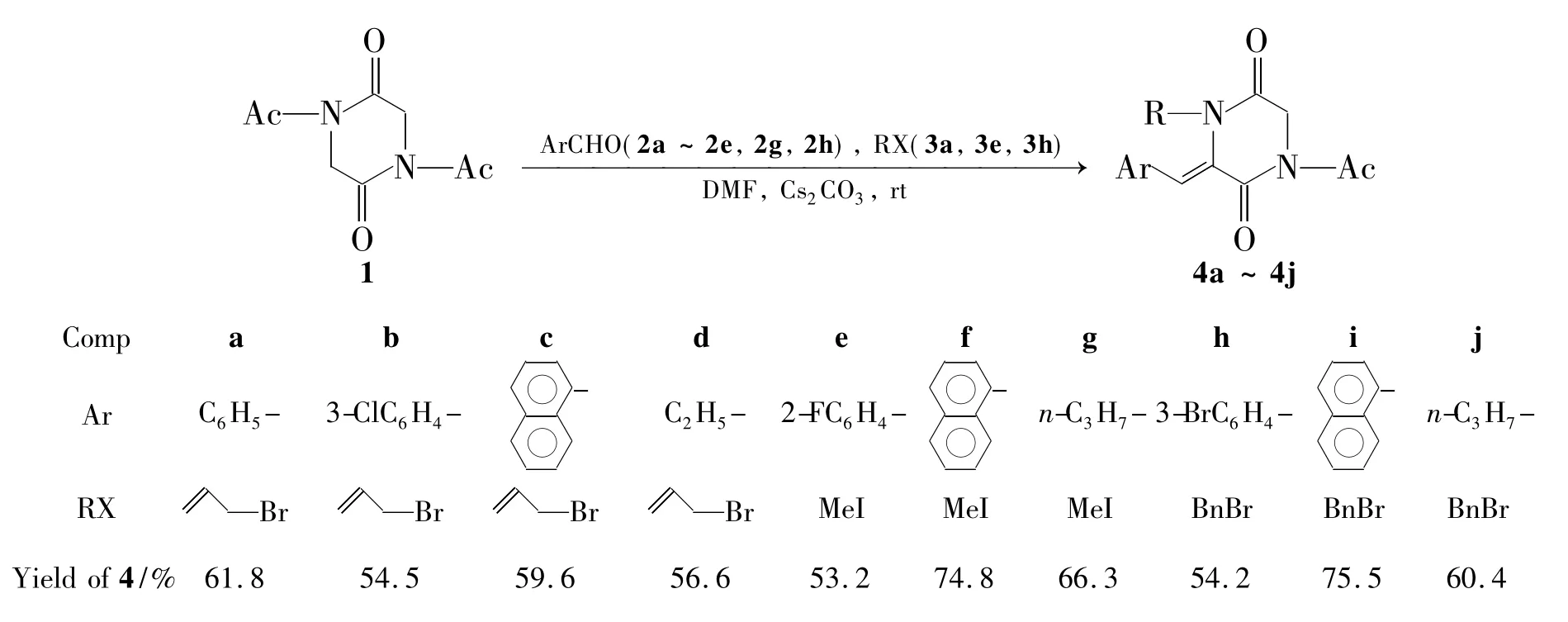
Scheme 1
为此,本文探究在DKPs骨架上同时引入醛基与保护基以合成易溶产物,采用一锅法直接合成具有N保护基的Aldol缩合产物。以DMF为溶剂,Cs2CO3为碱,N,N-二乙酰基-2,5-二酮哌嗪(1),苯甲醛(2a)和烯丙基溴(3a)经一锅法合成了4a(Scheme 1)。并对合成4a的最佳反应条件进行优化。在最佳反应条件[以DMF为溶剂,Cs2CO3为碱,1 0.252 4 mmol,n(1)∶n(2a)=1.0∶1.0,当量比q=(Cs2CO3)∶(3a)=2.0∶2.5,于室温反应4 h]下对底物进行扩展,1分别与芳醛(2b~2e,2g和2h)和卤代烃(3e和3h)经一锅法合成了9个2,5-二酮哌嗪类衍生物(4b~4j,Scheme 1),收率54.2%~75.7%。4c,4f和4i为新化合物,其结构1H NMR,13C NMR和ESI-MS确证。并研究了4a~4j的细胞毒活性。
1 实验部分
1.1仪器与试剂
Bruker AV 500 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标); API 2000型ESI质谱仪; ZYJS型超净工作台;薄层色谱硅胶和柱色谱硅胶,青岛海洋化工厂。
所用试剂均为分析纯;无水溶剂用前按标准方法纯化。
1.2 4的合成通法
在反应瓶中依次加入1 50 mg(0.252 4 mmol),2 0.252 4 mmol,DMF 1.5 mL,Cs2CO3164.5 mg(0.504 9 mmol)和3 0.631 mmol,搅拌下于室温反应24 h(TLC跟踪)。加水7 mL终止反应,用乙酸乙酯(3×20 mL)萃取,合并萃取液,用水洗涤,无水硫酸钠干燥。旋蒸除溶后经硅胶(200目~300目)柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=10∶1]纯化得淡黄色固体4。
4a(C16H16N2O3):收率61.8%;1H NMR δ:2.63(s,3H),4.10(d,J=6.5 Hz,2H),4.53(s,2H),4.74(d,J=8.5 Hz,1H),5.03(d,J=10.0 Hz,1H),5.48~5.56(m,1H),7.30(s,1H),7.34~7.37(m,2H),7.38~7.41(m,3H);13C NMR(126 MHz,下同)δ:171.41,164.90,164.45,132.71,131.10,129.78,129.66,129.34,128.81,126.77,118.97,46.47,45.33,26.72; ESI-MS m/z:285{[M +H]+},307{[M +Na]+}。
4b(C16H15N2O3Cl):收率54.5%;1H NMR δ:2.63(s,3H),4.10(d,J=6.0 Hz,2H),4.54(s,2H),4.74(d,J=16.5 Hz,1H),5.05(d,J=10.5 Hz,1H),5.48~5.56(m,1H),7.22(s,1H),7.23~7.25(m,1H),7.32(s,1H),7.35~7.38(m,2H);13C NMR δ:171.31,164.73,163.99,134.89,134.55,130.92,130.48,130.05,129.73,129.38,127.61,124.76,119.14,46.66,45.29,26.76; ESI-MS m/z:341{[M +Na]+}。
4c(C20H18N2O3):收率59.6%;1H NMR δ:2.68(s,3H),3.91(d,J=6.0 Hz,2H),4.40(d,J=17.5 Hz,1H),4.61(s,2H),4.85(d,J=10.0 Hz,1H),5.35~5.44(m,1H),7.42(d,J=7.0 Hz,1H),7.50(t,J=7.5 Hz,1H),7.53~7.61(m,2H),7.87(s,1H),7.89~7.95(m,3H);13C NMR δ:171.64,164.63,164.14,133.64,131.35,131.00,130.88,130.37,130.26,128.96,127.31,127.28,126.81,125.27,124.55,124.49,119.07,46.06,45.49,26.96; ESI-MS m/z:335{[M + H]+},357{[M + Na]+}。
4d(C12H16N2O3):收率56.6%;1H NMR δ:1.13(t,J=7.5 Hz,3H),2.22~2.33(m,2H),2.57(s,3H),4.29(d,J=5.5 Hz,2H),4.39(s,2H),5.12~5.22(m,2H),5.72~5.82(m,1H),6.32(t,J=7.5 Hz,1H);13C NMR δ:171.43,164.79,164.20,133.13,131.85,131.26,118.06,48.54,45.37,26.63,21.81,13.28; ESI-MS m/z:237{[M +H]+},259{[M +Na]+}。
4e(C14H13N2O3F):收率53.2%;1H NMR δ:2.63(s,3H),2.87(s,3H),4.53(s,2H),7.13(t,J=9.5 Hz,1H),7.20(t,J=7.5 Hz,1H),7.28(t,J=7.5 Hz,1H),7.31(s,1H),7.34~7.42(m,1H);13C NMR δ:171.61,164.64,163.31,131.53,131.46,130.68,124.41,124.38,117.87,116.17,116.00,45.41,33.99,26.96; ESI-MS m/z:277{[M +H]+},299{[M +Na]+}。
4f(C18H16N2O3):收率74.8%;1H NMR δ:2.68(s,3H),2.69(s,3H),4.60(s,2H),7.35(d,J=7.0 Hz,1H),7.49(t,J=7.5 Hz,1H),7.54~7.62(m,2H),7.87(s,1H),7.90(t,J=7.5 Hz,2H),7.97(d,J=8.0 Hz,1H);13C NMR δ:171.75,164.58,163.39,133.57,133.35,131.52,130.42,130.04,128.97,127.43,127.33,126.77,125.20,124.49,123.22,45.54,34.17,26.99; ESI-MS m/z:309{[M + H]+},331{[M +Na]+}。
4g(C11H16N2O3):收率66.3%;1H NMR δ:0.94(t,J=7.0 Hz,3H),1.46~1.56(m,2H),2.24(q,J=7.5 Hz,2H),2.51(s,3H),3.19(s,3H),4.34(s,2H),6.29(t,J=7.5 Hz,1H);13C NMR δ:171.74,164.97,163.82,132.94,131.14,45.21,35.06,30.30,27.02,22.35,14.08; ESI-MS m/z:225{[M + H]+},247{[M + Na]+}。
4h(C20H17N2O3Br):收率54.2%;1H NMR δ:2.55(s,3H),4.56(s,2H),4.66(s,2H),6.83~6.89(m,2H),7.16(s,1H),7.19~7.24(m,3H),7.30~7.36(m,2H),7.50(s,1H),7.55(d,J=7.0 Hz,1H);13C NMR δ:171.41,165.10,164.03,135.65,134.91,132.89,132.49, 130.91,130.47,128.82,128.22,127.84,124.98,123.12,47.61,45.33,26.74; ESI-MS m/z:414{[M +H]+},436{[M +Na]+}。
4i(C24H20N2O3):收率75.7%;1H NMR δ:2.62(s,3H),4.48(s,2H),4.65(s,2H),6.58(d,J=7.5 Hz,2H),7.04(t,J=7.5 Hz,2H),7.12(t,J=7.5 Hz,1H),7.47(d,J=7.5 Hz,1H),7.53(q,J=8.0 Hz,2H),7.57(t,J=7.5 Hz,1H),7.71(d,J=8.0 Hz,1H),7.80(s,1H),7.93(t,J=8.5 Hz,2H);13C NMR δ:171.64,164.95,164.08,135.53,133.62,131.46,130.92,130.50,130.21,128.91,128.50,127.84,127.80,127.46,127.29,126.81,125.27,124.77,124.52,46.79,45.44,26.85; ESI-MS m/z:385{[M +H]+},407{[M +Na]+}。
4j(C17H20N2O3):收率60.4%;1H NMR δ:0.90(t,J=7.0 Hz,3H),1.45~1.54(m,2H),2.18(q,J=7.5 Hz,2H),2.47(s,3H),4.39(s,2H),4.86(s,2H),6.30(t,J=7.5 Hz,1H),7.10(d,J=7.0 Hz,2H),7.22~7.36(m,3H);13C NMR δ:171.26,165.06,164.15,136.00,132.03,131.90,128.68,127.75,127.00,49.24,45.20,30.34,26.38,21.97,13.69; ESI-MS m/z:301{[M +H]+},323{[M +Na]+}。
2 结果与讨论
2.1反应条件优化
以1,2a和3a合成4a为模板反应,对反应条件进行优化。1 0.252 4 mmol,n(1)∶n(2a)=1∶1,其余反应条件同1.2,考察3a和碱用量,溶剂,反应温度以及时间对反应的影响,结果见表1。
从表1的No.1~No.8可见,在其余反应条件下同的条件下,以Cs2CO3为碱时产率最高(37.8%,No.2); Cs2CO3用量对产率的影响见No.2和No.9~No.11,从中发现,Cs2CO3用量为2 eq.(0.504 9 mmol)时产率最佳(No.2); 3a用量对产率的影响见No.13~No.15,从中发现,3a用时为2.0 eq.时,产率最高(58.2%,No.14);当量比q=(Cs2CO3)∶n(3a)对产率的影响见No.16~No.20,从中发现,当q=2.0∶2.5时,产率最高(61.8%,No.18);反应时间对产率的影响见No.2和No.12,发现时间并不是提高产率的因素,且反应时间为4 h时基本完成。故选择4 h为

表1 反应条件优化*Table 1 Optimization of reaction conditions
最佳反应时间。温度也不是提高产率的关键因素,而且温度过高会有其他的副产物出现(TLC杂点),导致产率下降(No.21~No.22)。溶剂对反应的影响见No.18和No.23~No.27,实验中发现,非极性非质子溶剂二甲苯与甲苯只能部分溶解反应物,严重影响了产率,而在极性质子溶剂MeOH中,反应没有进行。与DMF同为极性非质子溶剂的DMSO与THF在24 h内能使反应基本完成,但产率远低于DMF为溶剂时的产率,故DMF为最佳反应溶剂(61.8%,No.18)。
综上所述,合成4a最佳的反应条件为No.18,即以DMF为溶剂,Cs2CO3为碱,1 0.252 4 mmol,n(1)∶n(2a)=1.0∶1.0,q=(Cs2CO3)∶(3a)=2.0∶2.5,于室温反应4 h,产率61.8%。
2.2底物扩展
在最佳反应条件下对底物进行扩展,结果见Scheme 1。从Scheme 1结果可见,一锅法能推广应用,此条件能用于常见醛(芳香醛、脂肪醛等)及常用保护基(溴丙烯、碘甲烷、溴苄等),反应基本都能在4 h内完成,且产率较高(平均大于60%),其中,4f和4i的产率达70%以上。溶解度实验结果表明,4a~4j均溶于常见溶剂,如DMF,乙酸乙酯,二氯甲烷,氯仿等。
2.3合成
1与2a进行Aldol缩合,产物再与溴丙烯进行SN2反应能得到易溶性产物。但由于中间步骤得到的反应产物脂溶性差,后处理以及纯化相对困难,直接影响到合成的效率,两步法产率低于40%[9]。2与3的同时引入理论上是可行的,在初步尝试后,证明了其可行性。
2.4反应机理
1,2和3的一锅法反应机理见Scheme 2。实验初期,TLC跟踪发现只观察到中间产物,证明Aldol缩合先于SN2反应发生;投料5 min检测到中间产物和目标产物同时存在,故推测碱诱导进行了Aldol缩合,缩合后裸露的氮负离子进攻溴丙烯(SN2反应);反应4 h检测发现只有产物,证明Aldol缩合后的产物中间体与溴丙烯反应完全。
2.5细胞毒活性
对4a~4j进行细胞毒活性测定,发现只有4c具有细胞毒活性,结果见表2。从表2可见,4c对人类肿瘤细胞株有一定的抑制活性,特别对U973 及Hela癌细胞有较明显的细胞毒活性。而同样是引入萘甲醛4f和4i并没发现活性,由此推导烯丙基作为保护基更有利于细胞毒活性。相对萘甲醛,引入苯甲醛(或取代苯甲醛)与脂肪醛的化合物均没有显示出活性,初步推导以双键连接的类三环结构为活性结构。

Scheme 2
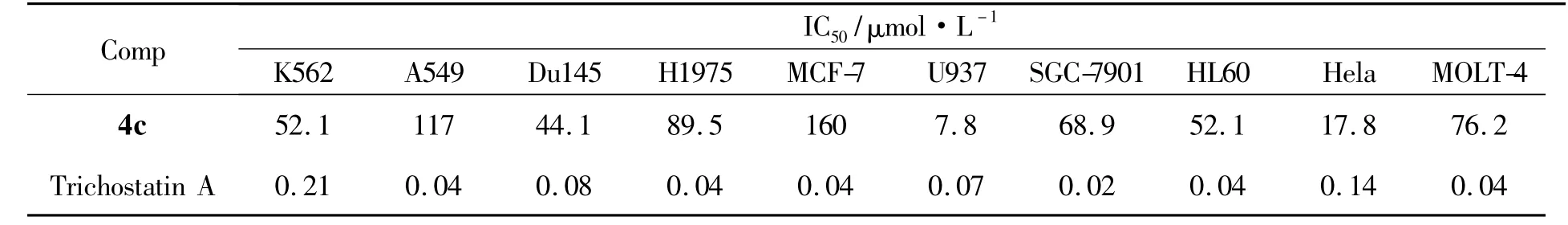
表2 4c的细胞毒活性*Table 2 Cytotoxic activities of 4c
3 结论
以DMF为溶剂,Cs2CO3为碱,N,N-二乙酰基-2,5-二酮哌嗪,芳醛和卤代烷经一锅法合成了10个2,5-二酮哌嗪类衍生物。此一锅法合成反应条件温和,反应时间短且产率较高。省去了中间难溶产物的分离纯化步骤,经过实验验证能推广应用于常见醛(芳香醛及脂肪醛)及保护基(溴丙烯、碘甲烷及溴苄)。所得的化合物具有良好的脂溶性,易溶于常见的有机溶剂。
生物活性研究结果表明:(Z)-1-乙酰基-3-(1-亚甲基萘)-4-烯丙基-2,5-二酮哌嗪(4c)对U937,Hela和Du145等细胞具有一定的细胞毒活性。为进一步研究提供了良好的基础。因此,本合成方法有大规模合成及高通量筛选的潜力,能为2,5-二酮哌嗪类物质进一步的合成以及构效关系研究做贡献。
参考文献
[1]郭秀春,郑立,周文辉,等.海洋微生物中二酮哌嗪类化合物的研究进展[J].微生物学通报,2009,36(10):1596-1603.
[2]Huang R,Zhou X,Xu T,et al.Diketopiperazines from marine organisms[J].Chemistry&Biodiversity,2010,7(12):2809-2829.
[3]Bolognesi M,Tran H,Staderini M,et al.Discovery of a class of diketopiperazines as antiprion compounds[J].Chem Med Chem,2010,5(8):1324-1334.
[4]Borthwick A.2,5-Diketopiperazines:Synthesis,reactions,medicinal chemistry,and bioactive natural products[J].Chem Rev,2012,112(7):3641-3716.
[5]Wang Y,Wang P,Ma H,et al.Developments around the bioactive diketopiperazines:A patent review[J].Expert Opinion on Therapeutic Patents,2013,23(11):1415-1433.
[6]Teixido M,Zurita E,Malakoutikhah M,et al.Diketopi perazines as a tool for the study of transport across the blood-brain barrier(BBB)and their potential use as BBB-shuttles[J].J Am Chem Soc,2007,129:11802-11813.
[7]林浩,王德心.哌嗪二酮衍生物的合成研究进展[J].药学学报,2003,38(5):395-400.
[8]Ressurreição A,Delatouche R,Gennari C,et al.Bifunctional 2,5-diketopiperazines as rigid three-dimensional scaffolds in receptors and peptidomimetics[J].European Journal of Organic Chemistry,2011,2:217-228.
[9]Liao S,Qin X,Li D,et al.Design and synthesis of novel soluble 2,5-diketopiperazine derivatives as potential anticancer agents[J].Eur J Med Chem,2014,83:236-244.
[10]Johnson A,Janosik T,Bergman J.Synthesis of the diketopiperazine dipodazine[J].Arkvoc,2002,8:57-61.
[11]Sjogren M,Johnson A,Hedner E,et al.Antifouling activity of synthesized peptide analogs of the sponge metabolite barettin[J].Peptides,2006,27(9):2058-2064.
[12]Sundaram S,Milner J.Diallyl disulfide induces apoptosis of human colon tumor cells[J].Carcinogenesis,1996,17:669-673.
·研究论文·
通信联系人:刘永宏,研究员,Tel.020-89023174,E-mail:yonghongliu@ scsio.ac.cn
Synthesis and Cytotoxic Activities of
2,5-Diketopiperazine Derivatives by One-pot Method
LI Jin-sheng1,2,LIAO Sheng-rong1,TANG Yong1,2,LIU Yong-hong1
(1.South China Sea Institute of Oceanology,Chinese Academy of Sciences,Guangzhou 510301,China; 2.University of Chinese Academy of Sciences,Beijing 100049,China)
Abstract:Ten 2,5-diketopiperazine derivatives(4a~4j,4c,4f and 4i were novel compounds)in yield of 54.2%~75.7% were synthesized by Aldol reaction of N,N-diacetyl-2,5-diketopiperazine,arylaldehyde and RX by one-pot method,using DMF as the solvent and Cs2CO3as the alkali.The structures were confirmed by1H NMR,13C NMR and ESI-MS.Preliminary biological activities tests indicated that(Z)-1-acetyl-4-allyl-3-(naphthalen-1-ylmethylene)piperazine-2,5-dione(4c)exhibited better cytotoxic activities against U937,Hela and Du145 cell lines.
Keywords:2,5-diketopiperazine; one-pot method; Aldol condensation; synthesis; cytotoxic activity
作者简介:李晋昇(1989-),男,汉族,广东广州人,硕士研究生,主要从事天然产物的合成研究。E-mail:lijinsheng12@mails.ucas.ac.cn
基金项目:国家自然科学基金青年基金资助项目(21402218)
收稿日期:2015-01-16;
修订日期:2015-08-20
DOI:10.15952/j.cnki.cjsc.1005-1511.2015.12.1095 *
文献标识码:A
中图分类号:O626.4; O621.3
