噁唑酮类化合物的合成及其抗炎活性*
2016-01-17孙银星绪广林侯丙波敖桂珍苏州大学药学院江苏苏州53南京师范大学生命科学院新药研究中心江苏南京0046
孙银星,绪广林,侯丙波,敖桂珍(.苏州大学药学院,江苏苏州 53; .南京师范大学生命科学院新药研究中心,江苏南京 0046)
噁唑酮类化合物的合成及其抗炎活性*
孙银星1,绪广林2,侯丙波1,敖桂珍1
(1.苏州大学药学院,江苏苏州215123; 2.南京师范大学生命科学院新药研究中心,江苏南京210046)
摘要:以马尿酸为原料,与取代苯甲醛经Erlenmeyer环合反应合成了8个噁唑酮类化合物(3a~3h),其结构经1H NMR,FT-IR和HR-MS确证。二甲苯致小鼠耳肿胀实验结果表明:3f[4-3,5-二甲氧基甲撑基)-2-苯基-4H-5-噁唑酮]抗炎活性最好,其抑制率为50.3%,优于阿司匹林(41.5%)。
关键词:马尿酸;噁唑酮;合成;抗炎活性
非甾体抗炎药(NSAIDs)是一类具有良好解热镇痛和抗炎抗风湿功效的药物[1]。但长期使用会导致严重胃肠道(GI)损伤等副作用[2]。如何降低NSAIDs的GI不良反应是其研究重点。目前,降低NSAIDs的GI副作用的有效途径主要是使用COX-2,COX-2/5-LOX等抑制剂[3-5]。如敖桂珍等[6]合成了一系列对甲磺酰基苯乙烯杂环酮类化合物,发现噁唑酮类化合物ZA7的抗炎活性最强。其抗炎作用与双氯芬酸(DC)和罗非昔布(RC)相当,且GI副作用显著小于DC(P<0.05),与RC相当。因此,噁唑酮类化合物在开发NSAIDs新药领域有较大潜力。
基于此,本文以马尿酸(1)为原料,与取代苯甲醛(2a~2h)经Erlenmeyer环合反应合成了8个噁唑酮类化合物(3a~3h,Scheme 1),其结构经1H NMR,FT-IR和HR-MS确证。并以二甲苯致小鼠耳肿胀实验研究了3a~3h的抗炎活性。结果表明:3f[4-3,5-二甲氧基甲撑基)-2-苯基-4H-5-噁唑酮]抗炎活性最好,其抑制率为50.3%,优于阿司匹林(41.5%)
1 实验部分
1.1仪器与试剂
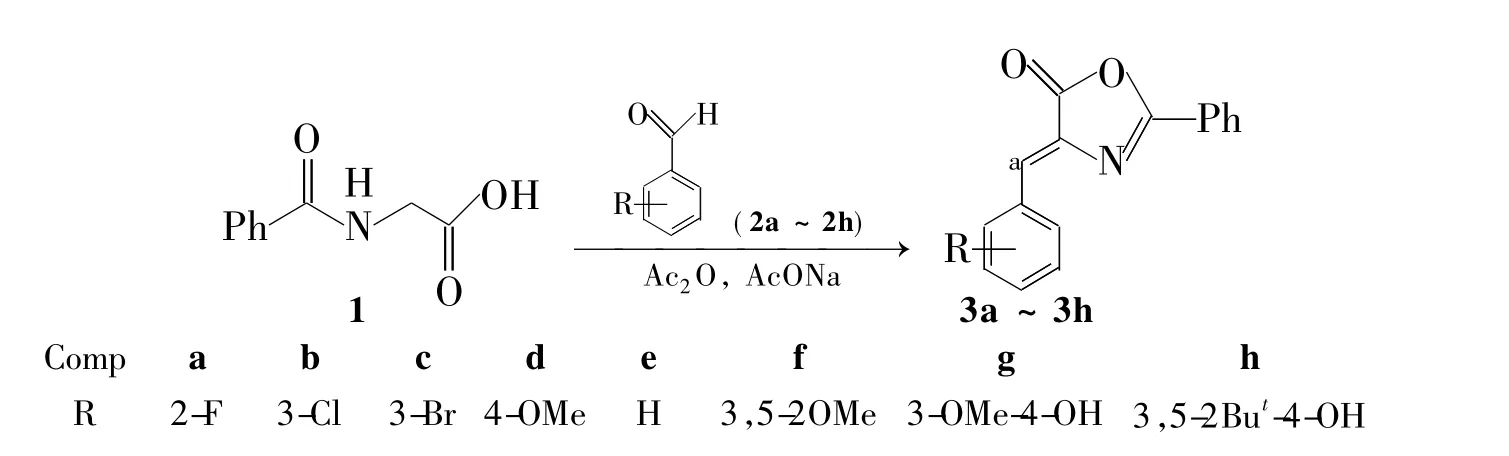
Scheme 1
XT-5型熔点仪器(温度未校正); Varian UNTIY INOVA 400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标); Nicolet AVATAR 360 FT-IR型红外光谱仪(KBr压片); Micromass TOF-MS型高分辨质谱仪。
所用试剂均为化学纯或分析纯;其中乙酸酐用前经重蒸纯化。
1.2 3a~3h的合成(以3a为例)
在反应瓶中加入乙酸酐10 mL,1 1.91 g(10.66 mmol),2-氟苯甲醛(2a)1.322 g(10.66 mmol)和AcONa 0.874 g,搅拌下回流反应12 h。冷却至室温,加入95%乙醇10 mL,过滤,滤饼干燥后用DMF/H2O(5/1)重结晶得淡黄色固体3a 1.70 g。
以2b~2h替代2a,用类似的方法合成淡黄色固体3b~3h。
3a:产率61.0%,m.p.167.0℃~168.0℃;
1H NMR δ:8.83(t,J=7.25 Hz,1H,ArH),8.15(d,J=7.83 Hz,2H,ArH),7.75(t,J=7.38 Hz,1H,ArH),7.65(t,J=7.71 Hz,2H,ArH),7.60(dt,J=1.36 Hz,7.51 Hz,1H,ArH),7.44(d,J=7.61 Hz,1H,ArH),7.38(m,1H,ArH),7.28(s,1H,a-H); FT-IR ν:1 794(C=O),1 772(C=N),1 659,1 609,1 556,1 483(C=C)cm-1; HR-MS m/z:Calcd for C16H10NO2F{[M + H]+}267.069 6,found 267.069 7。
3b:产率72.6%,m.p.145.2℃~146.1℃;
1H NMR δ:8.36(s,1H,ArH),8.28(t,J=3.87 Hz,1H,ArH),8.13(d,J=7.63 Hz,2H,ArH),7.76(t,J=7.27 Hz,1H,ArH),7.66(t,J=7.59 Hz,2H,ArH),7.57(d,J=4.66 Hz,2H,ArH),7.36(s,1H,a-H); FT-IR ν:1 791(C=O),1 737(C=N),1 659,1 599,1 560,1 489,1 450(C=C)cm-1; HR-MS m/z:Calcd for C16H10NO2Cl{[M + H]+} 283.040 0,found 283.040 2。
3c:产率80.9%,m.p.153.6℃~154.5℃;
1H NMR δ:8.51(s,1H,ArH),8.34(d,J=7.79 Hz,1H,ArH),8.13(d,J=7.68 Hz,2H,ArH),7.75(t,J=7.39 Hz,1H,ArH),7.71(d,J=8.19 Hz,1H,ArH),7.67(t,J=7.64 Hz,2H,ArH),7.51(t,J=7.90 Hz,1H,ArH),7.36(s,1H,a-H); FT-IR ν:1 796(C=O),1 770(C=N),1 654,1 594,1 559,1 489(C=C)cm-1; HR-MS m/z:Calcd for C16H10NO2Br{[M + H]+} 326.989 5,found 326.989 4。
3d:产率71.5%,m.p.155.1℃~156.1 ℃;1H NMR δ:8.87(d,J=7.94 Hz,1H,ArH),8.18(d,J=7.56 Hz,2H,ArH),7.95(s,1H,ArH),7.65(m,2H,ArH),7.54(m,2H,ArH),7.39(m,1H,ArH),7.24(s,1H,a-H),3.92(s,3H,CH3); FT-IR ν:2 976,2 843,1 790(C=O),1 771(C=N),1 653,1 602,1 571,1 508(C=C)cm-1; HR-MS m/z:Calcd for C17H13NO3{[M +H]+}279.089 5,found 279.089 2。
3e:产率70.5%,m.p.167.3℃~168.3℃;
1H NMR δ:8.29(m,2H,ArH),8.11(d,J=7.77 Hz,2H,ArH),7.71(t,J=7.33 Hz,1H,ArH),7.63(t,J=7.66 Hz,2H,ArH),7.52(m,3H,ArH),7.33(s,1H,a-H); FT-IR ν:1 793(C=O),1 769(C=N),1 653,1 597,1 554,1 489(C=C)cm-1; HR-MS m/z:Calcd for C16H11NO2{[M +H]+}249.079 0,found 249.079 0。
3f:产率79.3%,m.p.150.4℃~151.4℃;
1H NMR δ:8.18(d,J=8.20 Hz,2H,ArH),7.63(d,J=6.40 Hz,1H,ArH),7.54(t,J=6.72 Hz,2H,ArH),7.43(s,2H,ArH),7.19(s,1H,ArH),6.60(s,1H,a-H),3.92(s,6H,OCH3); FT-IR ν:2 937,2 840,1 798(C=O),1 659,1 591,1 450,1 429(C=C)cm-1; HR-MS m/z:Calcd for C18H15NO4{[M + H]+} 309.100 3,found 309.100 5。
3g:产率74.4%,m.p.200.0℃~201.0℃;
1H NMR δ:8.18(s,1H,ArH),8.13(d,J=7.49 Hz,2H,ArH),7.91(d,J=8.40 Hz,1H,ArH),7.74(t,J=7.38 Hz,1H,ArH),7.65(t,J=7.59 Hz,2H,ArH),7.38(s,1H,a-H),7.27(d,J=8.23 Hz,1H,ArH),3.98(s,3H,CH3); FT-IR ν:3 447(OH),2 962,2 846,1 796(C=O),1 757(C=N),1 653,1 602,1 558,1 508,1 491(C=C)cm-1; HR-MS m/z:Calcd for C17H13NO4{[M + H]+}295.084 5,found 295.084 6。
3h:产率76.3%,m.p.214.0℃~215.0℃;
1H NMR δ:8.17(s,2H,ArH),8.13(d,J=7.68 Hz,2H,ArH),7.56(t,J=7.22 Hz,1H,ArH),7.52(t,J=7.54 Hz,2H,ArH),7.25(s,1H,ArH),5.76(s,1H,a-H),1.52(s,18H,CH3in Bu); FT-IR ν:3 552(OH),2 953,2 873(CH3),1 786(C=O),1 762(C=N),1 651,1 599,1 557,1 491(C=C)cm-1; HR-MS m/z:Calcd for C24H27NO3{[M +H]+}377.199 1,found 371.199 3。
1.3抗炎活性测定
以二甲苯致小鼠耳肿胀实验测定3a~3h的抗炎活性,实验步骤按文献[7-8]方法进行。
2 结果与讨论
2.1抗炎活性
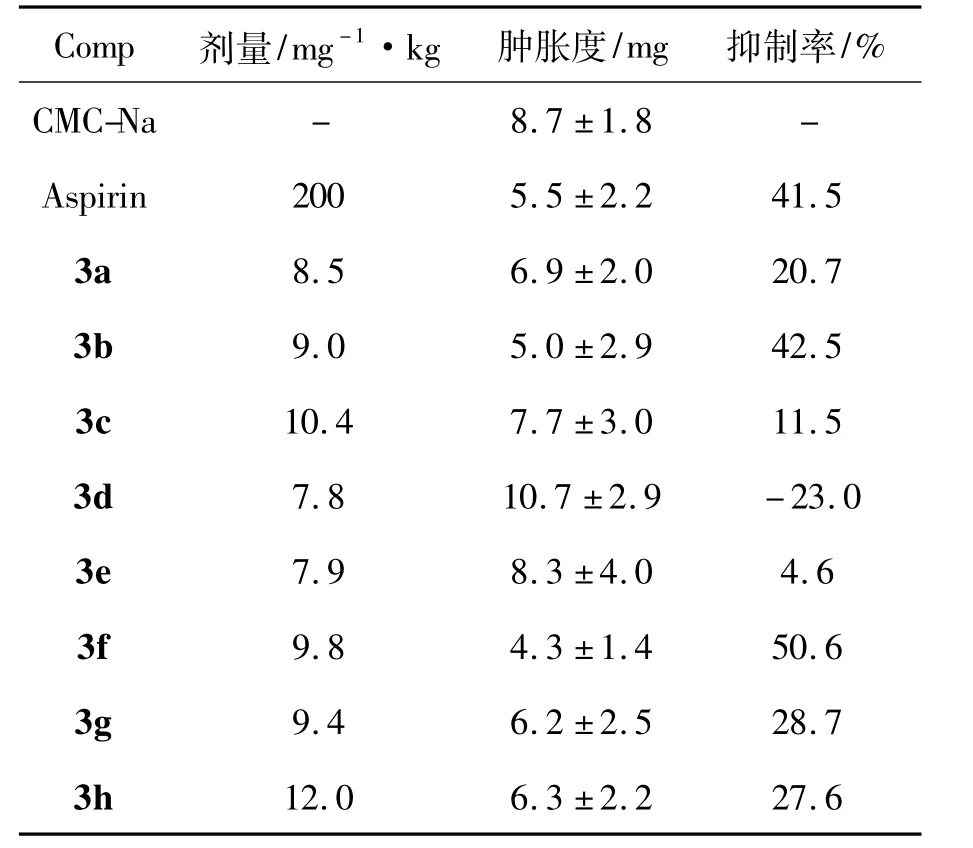
表1 3a~3h的抗炎活性Table 1 The anti-inflammatory activities of 3a~3h
表1为3a~3h的抗炎活性。由表1可见,3a~3c和3f~3h均有抗炎活性。由表1还可见,3f的活性最强,其抑制率为50.6%,高于阿司匹林(41.5%)。3d不仅没有抗炎活性,反而会促进炎症反应。这可能是因为3d的苯环上为给电子基,使其抗炎活性受到抑制; 3a~3c和3f的苯环上均为吸电子基,抗炎活性增强; 3g和3h结构中有酚羟基,具有一定清除自由基的作用,故也能提高抗炎活性;3e的苯环上既无吸电子基和给电子基,也没有酚羟基,因此抗炎活性较弱。
2.2合成
在Erlenmeyer环合反应中[9],必须严格控制反应条件和试剂无水,否则会生成副产物,降低产率。
参考文献
[1]姚中强,于孟学,韩淑玲.非甾体抗炎药[J].北京医学,2005,27:295-300.
[2]刘延江.非甾体抗炎药的不良反应分析[J].中国医疗前沿,2011,6:7-8.
[3]Goldstein J L,Cryer B.Gastrointestinal injury associated with NSAID use:A case study and review of risk factors and preventative strategies[J].Drug Healthcare and Patient Safety,2015,7:31-41.
[4]Suthar S K,Sharma M.Recent developments in chimeric NSAIDs as safer anti-inflammatory agents[J].Medicinal Research Reviews,2015,35:341-407.
[5]Kangwan N,Park J M,Hahm K B.Development of GI-safe NSAID:Progression from the bark of willow tree to modern pharmacology[J].Current Opinion in Pharmacology,2014,19:17-23.
[6]敖桂珍,张奕华,季晖,等.对甲磺酰基苯乙烯环酮类衍生物的合成及抗炎活性[J].中国药科大学学报,2004,39:803-807.
[7]Xu G L,Liu F,Ao G Z,et al.Anti-inflammatory effects and gastrointestinal safety of NNU-hdpa:A novel dual COX/5-LOX inhibitor[J].Eur J Pharmacol,2009,611:100-106.
[8]陈诗语,杭琪,敖桂珍,等.新型布洛芬衍生物的合成及其抗炎活性[J].合成化学,2014,22(6):781-784.
[9]Parveen M,Ali A,Ahmed S,et al.Synthesis,bioassay,crystal structure and ab initio studies of Erlenmeyer azlactones[J].Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy,2013,104:538-545.
·综合评述·
Synthesis and Anti-inflammatory Activities of Oxazolone Compounds
SUN Yin-xing1,XU Guang-lin2,HOU Bing-bo1,AO Gui-zhen1
(1.Faculty of Pharmaceutical Sciences,Soochow University,Suzhou 215123,China;
2.New Drug Research Center of Faculty of Life Science,Nanjing Normal University,Nanjing 210046,China)
Abstract:Eight oxazolone compounds(3a~3h)were synthesized by Erlenmeyer cyclization of hippuric acid with substituted benzaldehyde.The structures were confirmed by1H NMR,FT-IR and HR-MS.The results of anti-inflammation by xylene-induced mice ear edema suggested that 3f[4-(3,5-dimethoxy-benzylidene)-2-phenyl-4H-5-oxazolone]exhibited better anti-inflammatory activity(50.3%)than aspirin(41.5%).
Keywords:hippuric acid; oxazolone; synthesis; anti-inflammatory activity
通讯作者:敖桂珍,副教授,E-mail:aoguizhen2007@ sohu.com
作者简介:孙银星(1990-),男,汉族,江苏淮安人,硕士研究生,主要从事药物合成的研究。
基金项目:苏州市科技计划项目(SYS201317)
收稿日期:2015-03-19;
修订日期:2015-11-05
DOI:10.15952/j.cnki.cjsc.1005-1511.2015.12.1175 *
文献标识码:A
中图分类号:O626.24
