姜黄素对大脑中动脉缺血模型大鼠的神经保护作用及机制研究
2016-01-17李姝雅王伊龙王春雪刘改芬王拥军
李姝雅,王伊龙,王春雪,刘改芬,王拥军
脑缺血后局部炎性因子的表达显著增加,且急性炎性因子的升高程度与临床预后紧密相关[1]。Notch信号通路调控神经干细胞的浸润分化和血管新生[2-4],并参与炎症反应过程[5]。研究发现,Notch 1可与经典炎性因子NF-κB共活化参与炎症反应的调控。姜黄素(curcumin),黄色粉末,为姜黄根茎的生物活性成分,具有抗炎、抗氧化、抗癌、抗血管粥样硬化及保护肝肾等多种生物学作用[6-7]。本研究拟通过公认的线栓法建立稳定的大鼠大脑中动脉梗死(middle cerebral artery occlusion,MCAO)模型,通过观察姜黄素对Notch 1和NF-κB的作用,进一步探讨其神经保护的作用机制。
1 材料与方法
1.1 试验动物及试剂
成年健康雄性Sprague-Dawley大鼠93只,体重250~280 g,清洁级,由河北医科大学基础医学院动物实验中心提供。姜黄素(Sigma-Aldrich,St. Louis,MO,USA):用含0.5 mol/L NaOH的0.01 PBS配制,浓度12.5 mg/ml。
1.2 试验动物分组与给药
1.2.1 姜黄素对Notch 1和NF-κB表达的影响 试验动物分为三组(63只):①姜黄素组(CUR):参照Longa线栓法制作大鼠右侧MCAO模型。在MCAO模型基础上按80 mg/kg剂量腹腔注射配制好的姜黄素溶液。②溶剂对照组(vehicle-control):在MCAO模型基础上按80 mg/kg剂量腹腔注射含0.5 mol/L NaOH的0.01 PBS。③假手术组(sham):除不在颈内动脉插入线栓外,其余步骤同Longa线栓法操作,模型制作完成后按80 mg/kg剂量腹腔注射含0.5 mol/L NaOH的0.01 PBS。每组均按时间点分为对照、3 h、6 h、12 h、24 h、48 h、72 h共7个亚组,每个亚组3只大鼠。用免疫组化和Western blot的方法测定Notch 1和NF-κB的动态表达。
1.2.2 姜黄素急性脑缺血的神经保护作用 30只大鼠随机分配至CUR组、vehicle-control组、sham组,建模48 h评价神经功能学评分,5只用于脑含水量测定,5只用于梗死体积测定。
1.3 试验方法
1.3.1 神经功能学评分 Longa改良评分法:0分:没有神经功能缺损;1分:左侧(瘫痪侧)前爪不能完全伸展;2分:左侧(瘫痪侧)前肢不能伸展;3分:行走时,大鼠向左侧(瘫痪侧)转大圈;4分:行走时,大鼠向左侧(瘫痪侧)转小圈;5分:行走时,大鼠身体向左侧(瘫痪侧)倾倒[8]。
1.3.2 脑含水量的测定 将成功入组的大鼠在相应时间点麻醉后断头处死,取出完整脑组织,前去额极,后去部分枕叶,留取脑组织中间部分厚约4 mm。将脑组织放入事先称重的锡箔纸中包好称重,减去锡箔纸重量即得湿重。将包有锡箔纸的脑组织放入95℃烤箱内烘干24 h,取出待测脑组织恢复到室温,反复称量至恒重,减去锡箔纸重量即得干重。脑组织含水量:(湿重-干重)/湿重×100%。
1.3.3 脑梗死体积百分比测定 大鼠麻醉断头处死后,取出完整新鲜脑组织,连续切成2 mm厚的冠状组织切片,置于新鲜配制的2%的2,3,5-三苯基四唑氮红(triphenyltetrazolium chloride,TTC)中,37℃孵育30 min。用Olympus SP560数码相机采取图像,Image Pro-Plus 5.1分析系统对图片进行分析。总梗死体积=总梗死面积×脑片的厚度。水肿修正后梗死体积=对侧半球体积-(损伤侧半球体积-损伤侧半球梗死体积)。梗死体积百分比(%)=修正后梗死体积/对侧半球体积。
1.3.4 免疫组织化学法检测Notch 1和NF-κB阳性细胞 按照SP试剂盒说明书(北京中杉生物工程有限公司)进行免疫组织化学染色。所用Notch 1兔抗大鼠多克隆抗体(1∶400,Abcam Biotechnology),NF-κB P65兔抗大鼠多克隆抗体(1∶150,Santa Cruz Biotechnology)。光镜下胞质中棕黄色颗粒为阳性产物。
1.3.5 Western blot法检测Notch 1和NF-κB蛋白按照总蛋白提取试剂盒说明书(北京普利莱公司)提取蛋白,BCA蛋白检测试剂盒(美国Novagen)测定蛋白浓度。取等质量的样本蛋白(30 μg),进行SDS-聚丙烯酰胺凝胶电泳(初始电压80 V 1 h,后100 V 1 h);将标本蛋白转移至PDVF膜上;TBST洗涤3次,每次5 min;加入TBST稀释的一抗(兔抗大鼠Notch 1抗体,1∶300,Abcam Biotechnology,兔抗大鼠NF-κB P65抗体,1∶100,Santa Cruz Biotechnology),4℃摇床过夜。TBST洗涤3次,每次10 min;封闭2 h后加入荧光标记的二抗工作液(1∶6000,Rockland),室温下避光振荡1 h。TBST洗涤3次,每次10 min;图像扫描分析。
1.4 统计分析
采用SPSS 17.0统计软件进行统计学分析。计量资料以表示,多组间比较采用单因素方差分析(one-way ANOVA)和SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 姜黄素下调了Notch 1和NF-κB在MCAO中的表达
与vehicle-control组相比,CUR组中Notch 1和NF-κB表达下调,比较差异有显著性(P<0.05)。见表1、图1和图2。
2.2 姜黄素降低神经功能评分
与vehicle-control组相比,CUR组降低MCAO后48 h时神经功能评分,比较差异有显著性(P<0.05)。见图3。
2.3 姜黄素减轻脑水肿
用干湿重法测得的脑组织含水量结果显示:sham组为(78.16±8.00)%,vehicle-control组为(83.71±7.00)%,CUR组的脑组织含水量较vehicle-control组有所下降,为(80.42±9.00)%,比较差异有显著性(P<0.05)。见图4A。
2.4 姜黄素减少梗死体积
脑梗死体积测定结果显示,CUR组为(28.94±6.20)%,低于vehiclecontrol组的(40.08±3.66)%,比较差异有显著性(P<0.05)。见图4B。
3 讨论
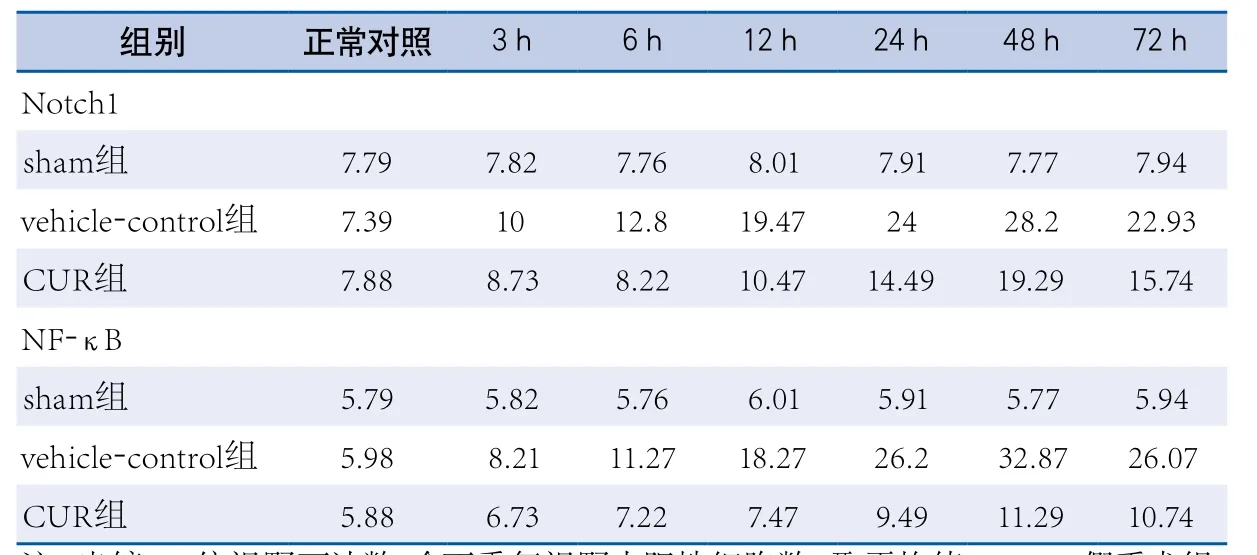
表1 免疫组织化学阳性细胞数的动态表达
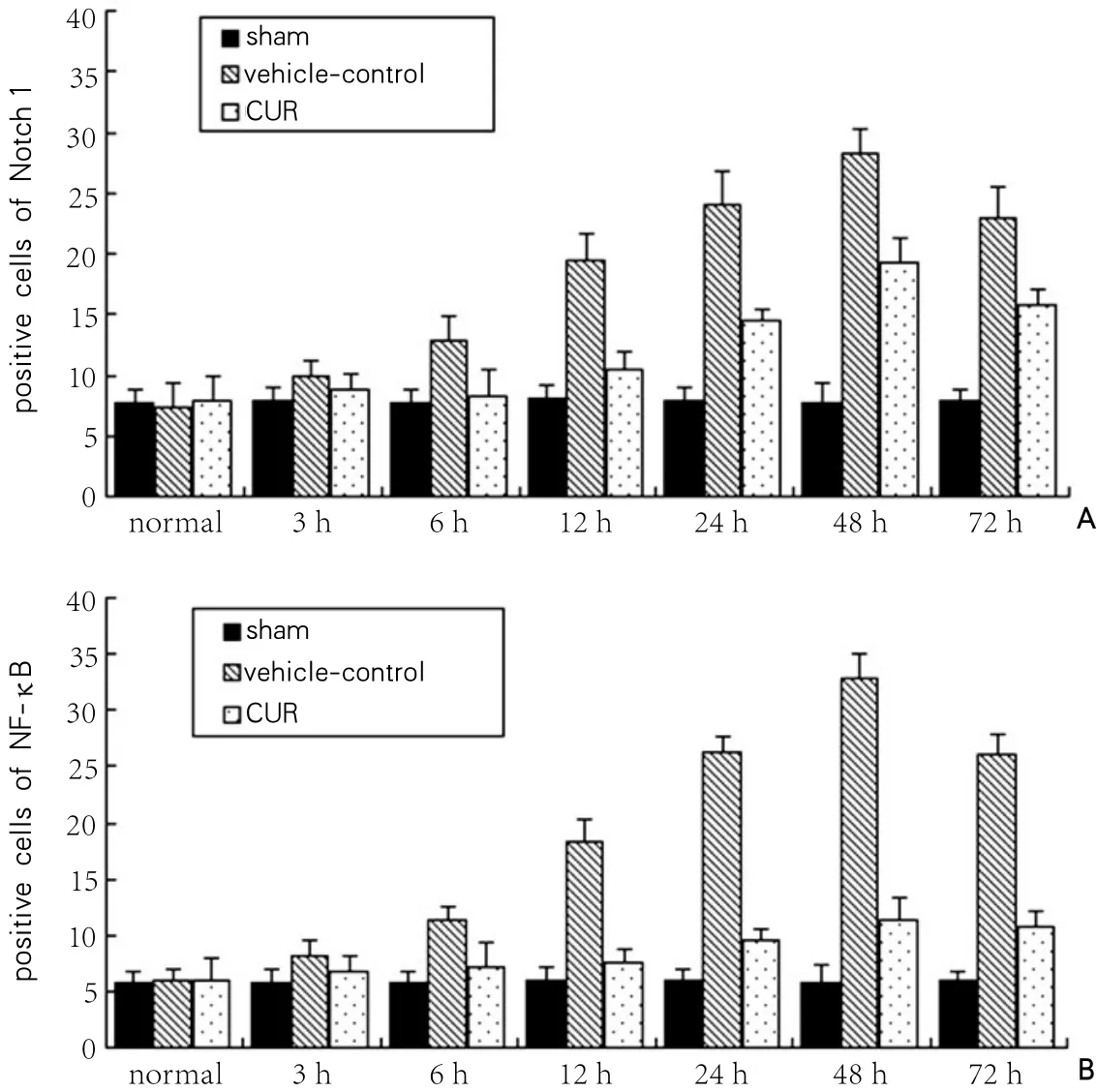
图1 免疫组织化学阳性细胞数的动态表达
姜黄素是从姜科姜黄属植物的根茎中提取的一种植物多酚,是姜黄发挥药理作用最重要的活性成分,具有抗炎、抗氧化、抗肿瘤、保护肝肾功能等多种生物学功能。在宫颈癌的研究中发现,姜黄素可通过降低Notch和NF-κB的表达起到抗癌作用,说明姜黄素与Notch通路间存在联系[9-10]。姜黄素用于治疗缺血性脑血管病,可减少脑水肿和梗死面积,改善神经功能学评分,其作用机制尚未明确。研究证实,姜黄素能升高超氧化物歧化酶(superoxide dismutase,SOD)水平,降低脑缺血病灶周围的氧化应激反应,挽救缺血半暗带的神经元,减轻缺血后脑损伤。炎症反应在缺血后脑损伤机制中的作用已得到共识,NF-κB作为炎症反应的核心因子,在缺血性脑损伤中起到重要作用。姜黄素通过抑制NF-κB的表达,干扰下游基因的转录发挥抗炎作用。对于姜黄素的抗炎作用是否可作为其脑保护作用机制之一,本实验结果提示,姜黄素可同步降低缺血后脑组织中NF-κB和Notch 1的表达,推测Notch信号通路可能通过调节NF-κB的表达参与姜黄素的脑保护作用。
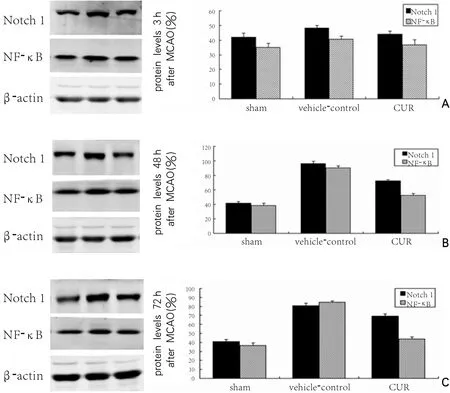
图2 不同时间点测定Western blot蛋白表达水平
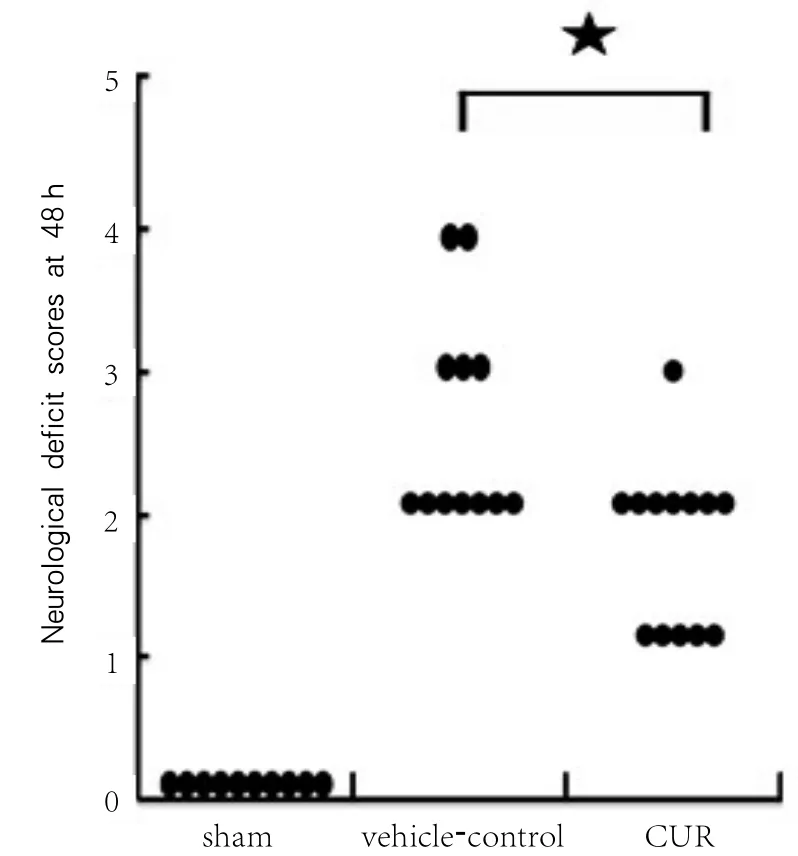
图3 不同组别神经功能学评分
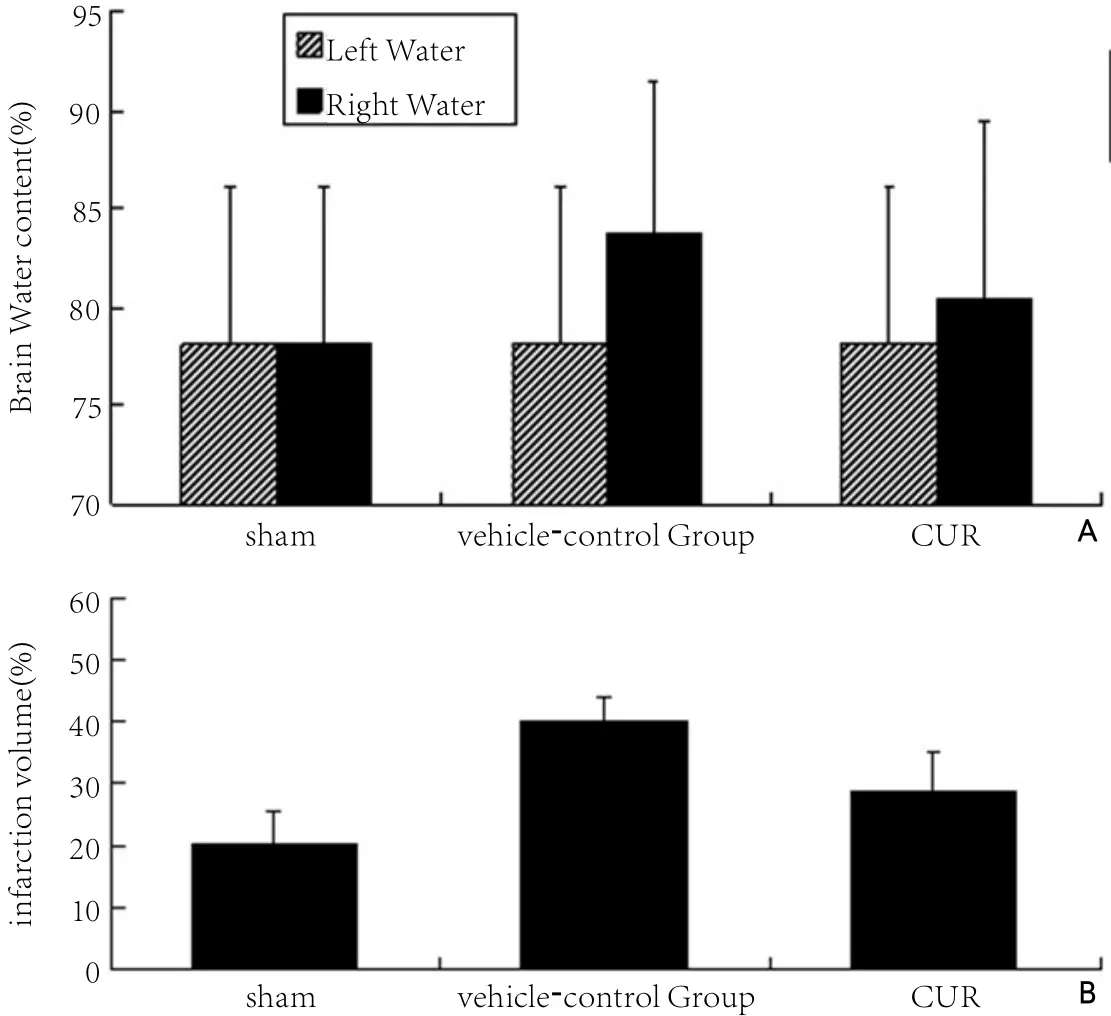
图4 姜黄素对脑含水量及梗死体积的影响
1 Lopes LR,Zekavati A,Syrris P,et al. Genetic complexity in hypertrophic cardiomyopathy revealed by high-throughput sequencing[J]. J Med Genet,2013,50:228-239.
2 Oya S,Yoshikawa G,Takai K,et al. Attenuation of Notch signaling promotes the differentiation of neural progenitors into neurons in the hippocampal CA1 region after ischimic injury[J]. Neuroscience,2009,158:683-692.
3 Chen J,Zacharek A,Li A,et al. Atorvastatin promotes presenilin-1 expression and Notch 1 activity and increases neural progenitor cell proliferation after stroke[J]. Stroke,2008,39:220-226.
4 Hellström M,Phng LK,Hofmann JJ,et al. Dll4 signalling through Notch 1 regulates formation of tip cells during angiogenesis[J]. Nature,2007,455:776-780.
5 Arumugam TV,Chan SL,Jo DG,et al. Gamma secretase-mediated Notch signaling worsens brain damage and functional outcome in ischemic stroke[J].Nat Med,2006,12:621-623.
6 Chan WH,Wu HJ. Protective effects of curcumin on methylglyoxal-induced oxidative DNA damage and cell injury in human mononuclear cells[J]. Acta Pharmacol Sin,2006,27:1192-1198.
7 Tong QS,Zheng LD,Lu P,et al. Apoptosis-inducing effects of curcumin derivatives in human baldder cancer cells[J]. Anticancer Drugs,2006,17:279-287.
8 Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniotomy in rats[J]. Stroke,1989,20:84-91.
9 Hackler L Jr,Ózsvári B,Gyuris M,et al. The curcumin analog C-150,influencing NF-κB,UPR and Akt/Notch pathways has potent anticancer activity in vitro and in vivo[J]. PLoS One,2016,11:e0149832.
10 Liu S,Cao Y,Qu M,et al. Curcumin protects against stroke and increases levels of Notch intracellular domain[J]. Neurol Res,2016,38:553-559.
