裙带菜(Undaria pinnatifida)配子体对氨态氮和硝态氮的吸收利用比较*
2016-01-15李大鹏邓海临詹冬梅
李大鹏 邓海临 李 慧 詹冬梅
(1. 山东省海洋生物研究院 青岛 266104; 2. 福建农林大学食品科学学院 福州 350002;3. 温州大学生命与环境科学学院 温州 325000)
氮是细胞中蛋白质的主要组成成分, 是藻类生长繁殖必需的主要营养元素之一。氮在海水中的形态较多, 包括无机氮(NO3-、NO2-、NH4+)和有机氮(PON、DON), 此外还存在气态的N2、N2O、NH3, 其中NO3--N和 NH4+-N是海藻生长繁殖所利用的主要氮源。海藻对NO3--N和NH4+-N的吸收也各不相同。NH4+-N的吸收在正常条件下大于 NO3--N的吸收, 这是因为藻类吸收NO3--N消耗较多的能量(Raven, 1984), NO3--N在结合入氨基酸之前必须被还原成NH4+-N (Lobban et al,1994)。因此对潮间带藻类来说, 在冬天光照不足的情况下, 藻类倾向于吸收NH4+-N; 而在夏天光照充足时,同时吸收NO3--N和NH4+-N (Phillips et al, 2003)。
在裙带菜人工育苗过程中, 多采用半封闭的循环流动海水或静水培养, 水量有限, 主要营养盐类含量低, 不能满足裙带菜配子体生长的需要。为了促进配子体正常生长, 均采用在自然海水中添加肥料的办法, 加以补充。裙带菜单倍体育苗技术作为新兴的育苗生产技术, 其潜在的应用前景和技术上的优势,越来越受到人们的重视(Kaas et al, 1989; Pang et al,1997), 单倍体的快速丰富培养是这项技术实施的重要前提。本文通过在不同浓度NO3--N和NH4+-N下培养裙带菜配子体, 测定各自的生长状况, 从而找出配子体丰富培养合适的氮源及浓度。同时测定其对NO3--N和 NH4+-N的吸收速率, 揭示裙带菜配子体材料在丰富培养过程中对氮离子的吸收规律, 最大程度的调整丰富培养技术方法, 使氮的供给适时的满足配子体生长的需要。以期为裙带菜的人工育苗和养殖业的发展提供理论基础。
1 材料与方法
1.1 实验材料
1.1.1 裙带菜配子体的预培养 裙带菜配子体由中国科学院海洋研究所海藻种质库提供。雌雄配子体按1 : 1比例混合。经丰富培养后的配子体经组织捣碎机捣碎, 使其呈 4—8细胞状态, 用消毒海水反复冲洗, 加入新鲜培养液培养 1d后, 更换培养液继续培养, 每日在显微镜下镜检, 大约 2—3d后发出新枝后方可使用(李大鹏等, 2006)。
1.1.2 裙带菜配子体饥饿处理 取上述处理的配子体培养于5L的三角瓶中, 加入无氮的PES培养液培养4d, 使配子体处于氮饥饿状态, 避免自身排出的氮影响实验结果。培养条件为: 温度23℃, 光强60μE/(m2·s), 光周期 12h : 12 h, 充气培养。
1.1.3 裙带菜配子体快速培养的最适氮源及浓度设置一系列氮浓度梯度(5、10、20、30μmol/L), 不同氮源(NO3--N和NH4+-N)的PES培养液。培养条件同上,培养密度为1g/L。加入配子体后隔天分析一次, 实验进行 8d, 以配子体的鲜重增加量作为生长速度的指标, 并镜检比较不同氮源及氮浓度下配子体的生长状态。
1.1.4 氮的吸收与配子体鲜重增长的关系 氮的初始浓度为 30μmol/L, 加入配子体后 1h取样分析,以后隔天分析一次, 每天定时测定穿透光强的变化,以消光值的变化作为生长速度的指标。
1.1.5 NO3--N和NH4+-N的吸收规律及两者之间的相互影响 设置不同浓度氮源, NO3--N浓度分别为5、10、20、25、30μmol/L, NH4+-N 浓度为 30、25、20、10、5μmol/L, 每组设3个重复。

表1 实验组NO-3-N和NH+4-N不同浓度配置(μmol/L)Tab.1 Concentration setting for NO-3-N and NH+4-N in the experiment
1.2 实验方法
称取 0.75g(鲜重)饥饿处理的裙带菜配子体放入盛有750mL上述实验组培养液的1L三角烧瓶中培养,实验条件: 温度23, ℃光强60μE/(m2·s), 光周期12h :12h, 充气培养。实验分别用紫外分光光度法和次溴酸盐氧化法测定水样中的NO3--N和NH4+-N浓度, 后每小时测一次, 共测4h, 每个水样测3次。
1.2.1 配子体鲜重测定 培养结束后用筛绢将藻过滤出, 在天平上测量藻重, 以便在不同氮浓度梯度之间进行比较。
1.2.2 配子体鲜重平均日增长率的计算


1.2.3 氮吸收速率的计算
吸收速率的计算公式如下

式中,R为吸收速率(μmol/(g·h));Ci和Cf分别为实验前后培养液中NO3--N和NH4+-N的浓度(μmol/L);V为培养液体积(L);t为取样时间间隔(h);W为配子体重量(g)。
1.2.4 NO3--N浓度的测定 NO3--N的测定采用紫外分光光度法, 此方法的原理是硝酸盐在紫外光区220nm处会出现一个特征吸收峰, 通过测定其吸光度,利用制备的标准曲线及相关公式, 可以得到硝酸盐在水样中的浓度(Colloset al, 1999)。具体步骤如下:
1) 取25mL具塞比色管, 蒸馏水润洗2次, 加入预处理后的水样10mL;
2) 将比色皿用蒸馏水润洗2—3次后, 水样倒入比色皿中, 体积超过比色皿的2/3, 润洗2—3次。滤纸吸干比色皿外壁的水, 用擦镜纸将比色皿光滑的两外壁擦干净, 放入紫外可见分光光度计中测定溶液在220nm和275nm光波处的吸光度值。每次测完一个样后, 均应用蒸馏水润洗和水样润洗 2—3次后才能测样;
3) 根据 NO3--N 标准曲线(图 1), 计算出样品中NO3--N的浓度。
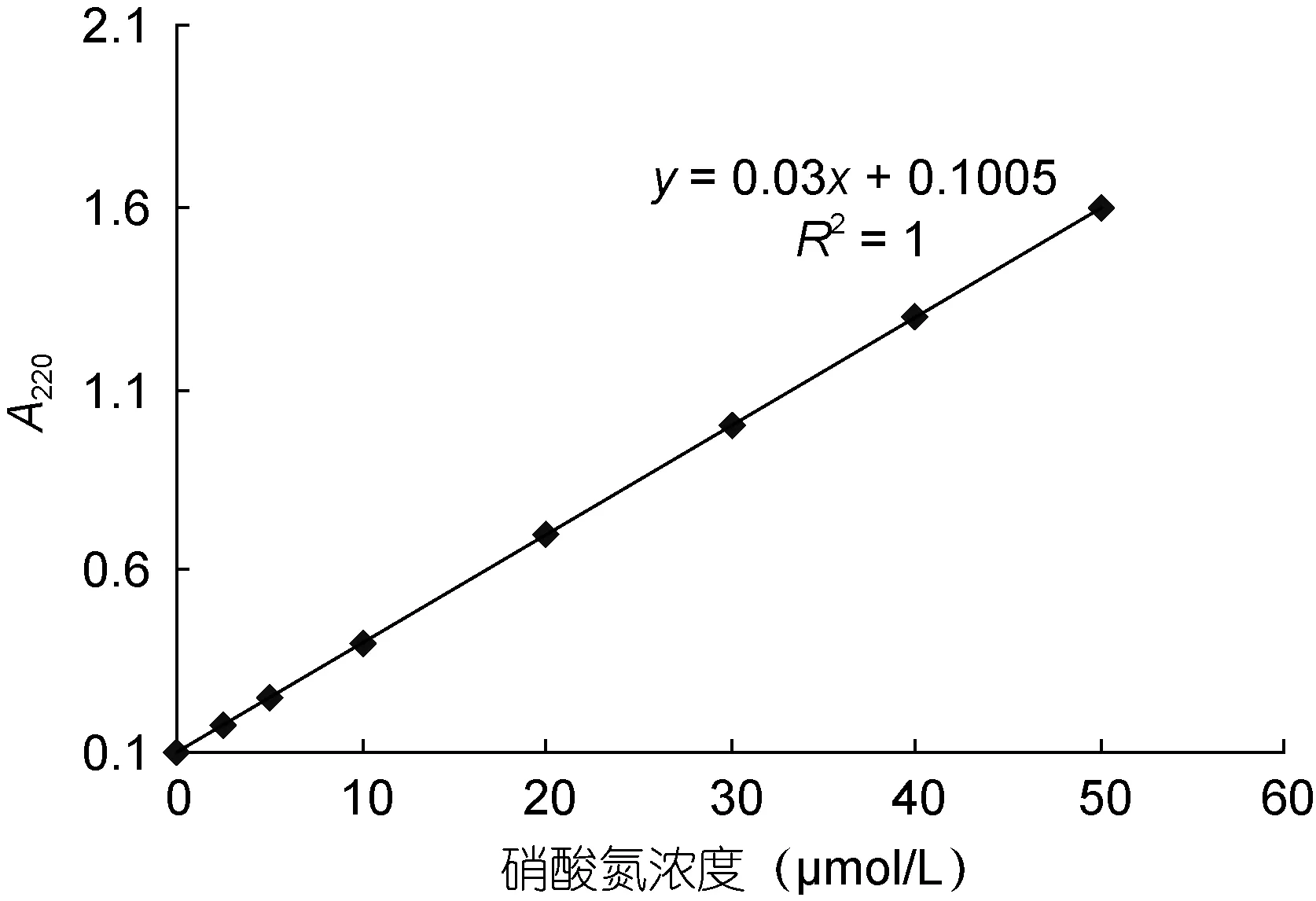
图1 硝态氮的标准曲线Fig.1 The standard curve of NO-3-N
1.2.5 NH4+-N浓度的测定 次溴酸钠法测 NH4+-N浓度的原理为: 在碱性条件下, 次溴酸钠将水样中的氨定量氧化为亚硝酸盐, 亚硝酸盐在酸性条件下, 与磺胺进行重氮化反应, 生成的物质再与盐酸萘乙二胺偶合生成红色偶氮染料, 在 543nm波长测定吸光值, 对照标准曲线, 计算出 NH4+-N浓度(GB/T 12763.4-2007海洋调查规范)。
具体步骤如下:
1) 抽取待测水样 10mL(如果浓度超过本方法的测定范围, 则采用稀释的方法, 将其浓度调节到适当的范围), 加入50mL具塞磨口锥形瓶中;
2) 加入 1mL的次溴酸钠溶液, 混匀, 放置30min;
3) 加入1mL 2g/L的磺胺溶液, 混匀, 放置5min;
4) 加入 0.2mL 1.0g/L的盐酸蔡乙二胺溶液, 混匀, 放置15min;
5) 选543nm波长, 测定吸光值;
6) 对照 NH4+-N的标准曲线(图 2), 计算出待测液的氨态氮浓度。
2 结果与讨论
从表2可以看出, 在氮浓度为30μmol/L下, 配子体生长速度最快, 无论是硝态氮或氨态氮, 两者相差不大, 平均日生长率分别为 24.39%和 25.03%。但是由于配子体生长迅速, 培养 9d之后, 配子体出现了缠绕聚团现象, 对后面的生长有一定的影响。观察各个浓度下硝态氮培养的配子体与氨态氮培养的配子体形态个体并无差异, 生长状况也相似, 这说明裙带菜配子体能同时吸收利用硝态氮和氨态氮, 进行生理代谢, 进行快速扩增。
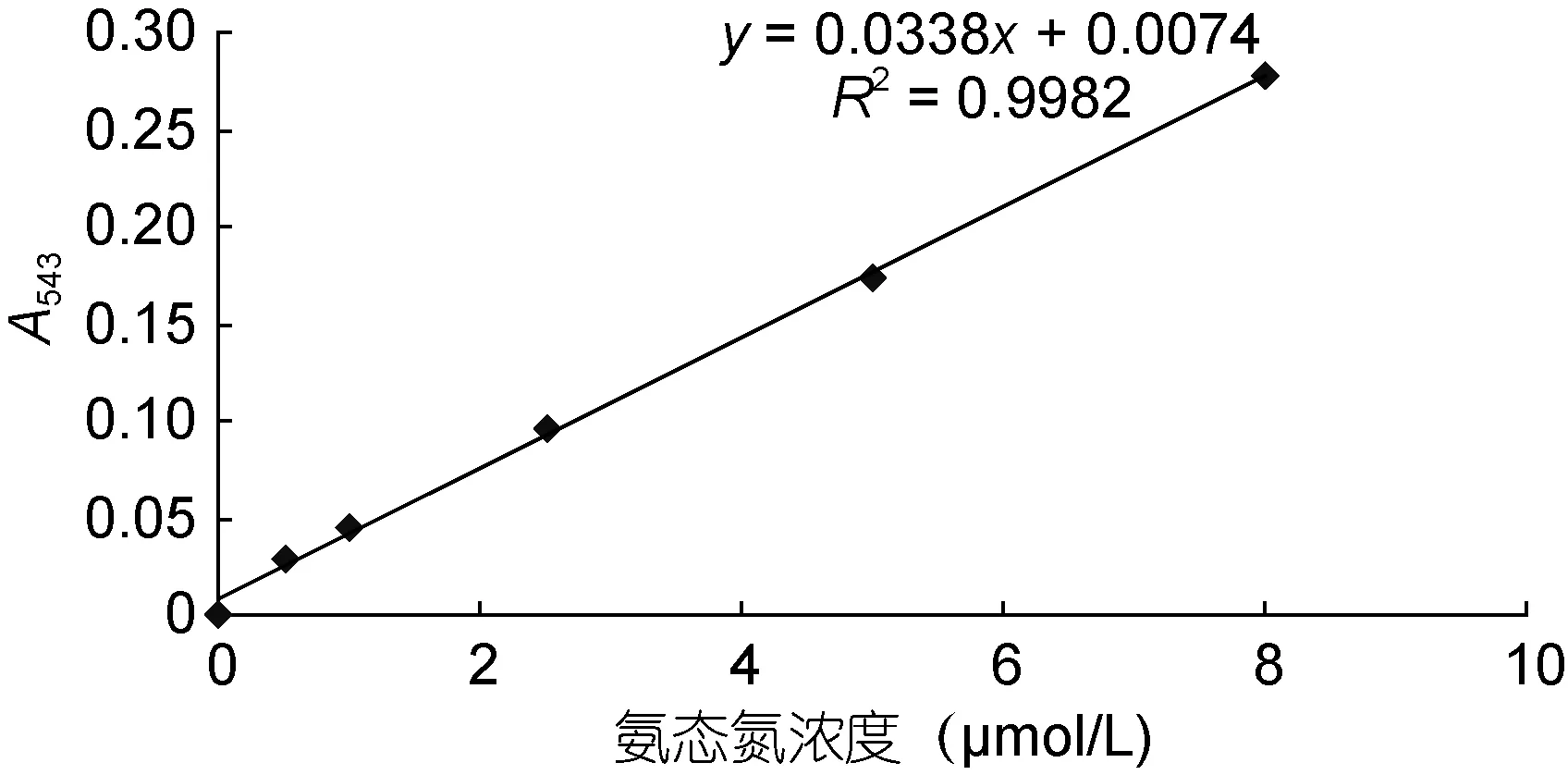
图2 氨态氮标准曲线Fig.2 The standard curve of NH4+-N
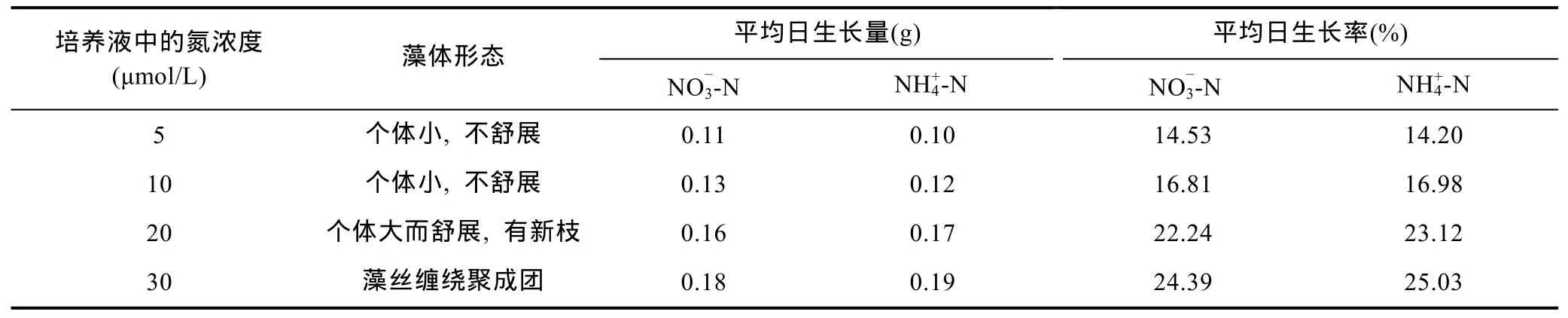
表2 氨态氮硝态氮浓度对裙带菜配子体培养的影响Tab.2 Effect of concentration of NH+4-N and NO-3-N on U. pinnatifida gametophyte culture
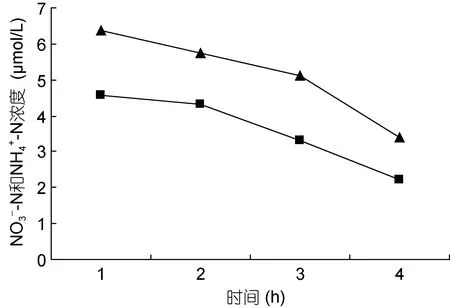
图3 NO-3-N 5μmol/L; NH+4-N 25μmol/L
裙带菜配子体培养液中硝态氮和氨态氮的浓度随着时间的推移, 浓度逐渐降低(图3—图8); 并且裙带菜配子体在前4h内吸收氨态氮和硝态氮的速率也各不相同(图 9—图 14)。总的来说, 裙带菜配子体在第一个小时内氮吸收速率高于其它任何时间段。另外在六组样品中, 最高吸收速率为 24.3μmol/(g·h), 对硝态氮的平均吸收速率为 1.04—6.51μmol/(g·h), 对氨态氮的平均吸收速率为0.69—6.61μmol/(g·h)。

图 4 NO-3-N 10μmol/L; NH+4-N 20μmol/L

图3—6 在不同的NO-3-N和NH+4-N浓度组合下, 培养液中两种氮源浓度随时间的变化Fig.3—6 Temporal change in concentration of two nitrogen sources of NO-3-N and NH+4-N

图7—8 在 30μmol/L的NO-3-N和NH+4-N浓度下, 培养液中两种氮源浓度随时间的变化Fig.7—8 Temporal change in concentration at 30μmol/L of two nitrogen sources of NO-3-N and NH+4-N
在本研究中, 并没有发现裙带菜对硝态氮的吸收抑制氨态氮的吸收, 或者氨态氮的吸收抑制硝态氮的吸收。裙带菜配子体同时吸收氨态氮和硝态氮。并且第一小时内的吸收速率随着氮浓度的增加而加快(图 15)。

图 9 NO3--N 5μmol/L; NH4+-N 25μmol/L
3 讨论

图 10 NO3--N 10μmol/L; NH4+-N 20μmol/L

图9—12 在不同的NO-3-N和NH+4-N浓度组合下, 裙带菜配子体对两种氮源的吸收速率随时间的变化Fig.9—12 Temporal change of ammonium and nitrate uptake rates in Undaria pinnatifida gametophyte in combination of different concentrations of NO-3-N and NH+4-N
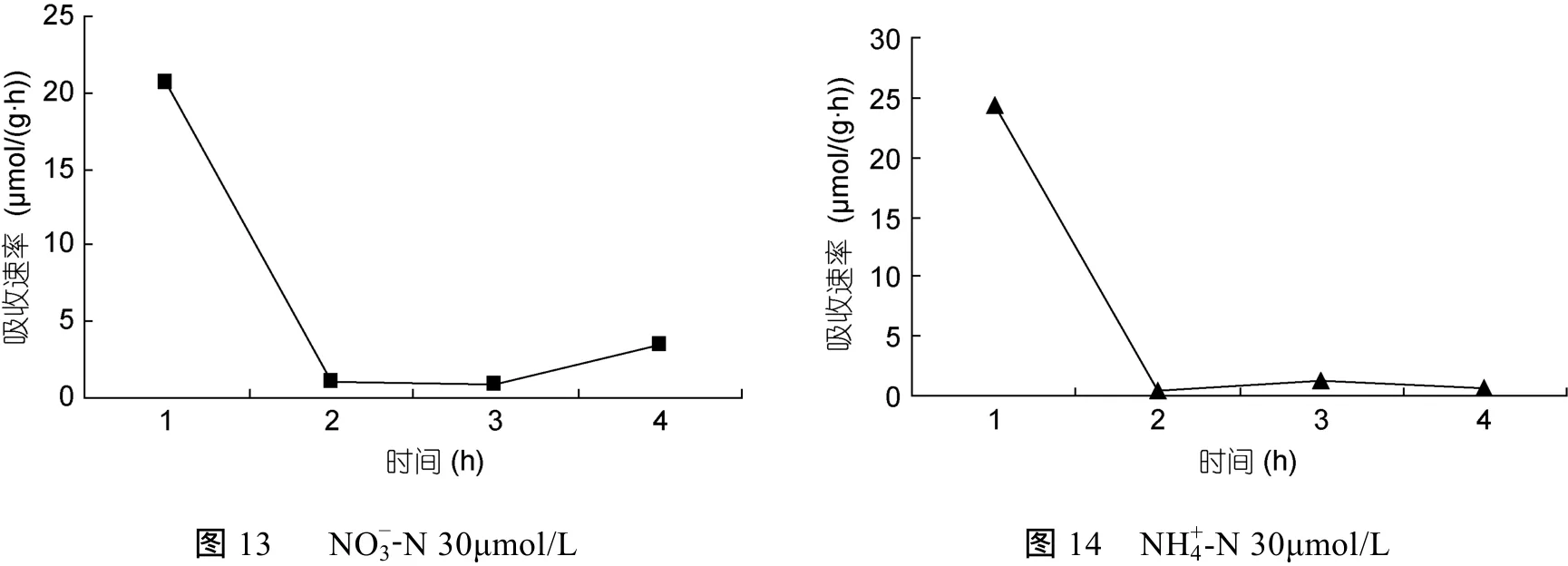
图 13—14 在 30μmol/L的 NO-3-N和NH+4-N浓度下, 裙带菜配子体对两种氮源的吸收速率随时间的变化Fig.13—14 Temporal change of ammonium and nitrate uptake rates in Undaria pinnatifida gametophyte at 30μmol/L concentration of NO-3-N and NH+4-N

图15 相同氮浓度下, 氨态氮吸收速率与硝态氮吸收速率比较Tab.15 Com-parison in absorption rate between NH+4-N and NO3-N at a same nitrogen concentration
氮是构成蛋白质的主要成分, 占蛋白质含量的16%—18%, 而在海藻的细胞质、细胞核及酶中都含有蛋白质, 因此, 氮也是细胞质、细胞核和酶的重要组成成分。此外, 核酸、辅酶、磷脂、叶绿素等化合物中都含有氮, 同时某些植物激素、维生素和生物碱等也含有氮。由此可见, 氮在海藻生命活动中占有首要的地位。由于氮元素是裙带菜配子体细胞生长、繁殖的必要元素, 氮的存在形式和浓度对裙带菜配子体的生长产生一定的影响。
研究结果显示, 无论是硝态氮还是氨态氮, 只要浓度满足裙带菜配子体的需求, 都能促使其生长良好, 这与有些藻类不同。邓祥元(2009)的研究显示,氨态氮对海带配子体的生长具有抑制作用, 究其原因, 可能由于氨态氮是一种抑制氮素固定的含氮化合物, 影响海带配子体的生长。但是在实验室培养海带孢子体时, 孢子体又可以吸收氨态氮, 维持其正常生长, 浓度为 30μmol/L的氮就能使裙带菜配子体快速扩增, 其日生长率达到25%左右。这样看来, 无论是硝态氮还是氨态氮都可以用于裙带菜配子体快速扩增的氮源。
研究发现, 裙带菜配子体同时吸收氨态氮和硝态氮, 并且对两种氮的吸收速率基本相同(图 15), 氨态氮的吸收速率略微高一些。这与海囊藻相似,Harrison等(1986)发现海囊藻能够同时利用氨态氮和硝态氮, 氮的吸收速率也基本相同。一种巴西海藻Laminaria abyssalis的配子体, 能够同时吸收硝态氮和氨态氮, 但是对氨态氮的吸收速率快于硝态氮(dā Costa Braga et al, 1996)。Thomas等(1987)和 Harrison(1986)的研究显示, 同时吸收氨态氮和硝态氮有助于单位时间内获取更大量的氮源。
总之, 氮吸收速率与培养液中氮的浓度在一定范围内呈一定的线性关系(图15)。在培养的第一小时内氮浓度迅速下降, 最大吸收速率分别为24.3μmol/(g·h)和 20.73μmol/(g·h), 推测这是主要是因为藻体经过饥饿处理, 一接触氮源主动运输和扩散运动的共同进行的结果。
我们的研究并没有发现氨态氮的吸收抑制硝态氮的吸收, 或者硝态氮的吸收抑制氨态氮吸收。这与Harlin等(1978)在Laminaria longicruris的研究结果相似, 与L. greonlandica中的情况不同, 它对硝态氮的吸收受到氨态氮抑制(Harrison et al, 1986)。同样,Hanisak等(1978)的研究也发现, 在绿色大型海藻刺松藻中硝态氮的吸收受到10倍浓度氨态氮的抑制。
我们对裙带菜配子体氨态氮硝态氮的吸收做了研究, 结果显示裙带菜配子体对两种氮源的吸收没有选择性, 同时吸收两种氮源, 氨态氮的吸收略微快于硝态氮, 与先前其它藻类研究结果类似(Lobban et al, 1994)。30μmol/L的氮源既可以很好地满足配子体快速扩增的营养需求, 需要注意的是过高浓度的氮对配子体具有毒害作用。这可能是因为氨氧化磷酸化和光合磷酸化的解偶联剂能一直进行光合作用, 而且当细胞内铵离子大量积累时还会造成 NADH的大量消耗, 使能量供应受阻, 进而中断三羧酸循环, 最终导致配子体变白死亡。在其它海藻中也发现了铵离子抑制生长和光合作用的现象。Thomas等(1980)研究发现, 当铵离子浓度大于 0.1mmol/L时, 沟鞭藻(dinoflagellates)的生长和光合作用受到明显的抑制;另外, Bates等(1993)报道, 当铵离子浓度大于0.11mmol/L时, 将会严重影响硅藻Nitzschia pungens的生长和光合作用; 更有甚者, 当铵离子作为唯一氮源, 浓度在 3—220μmol/L时, 即可使一些藻类在几周的时间内死亡(Touchette et al, 2000)。此外, 配子体经多次分裂后, 形成多分枝的丝状体。如果培养液中这样的丝状体过多, 它们之间就会相互缠绕, 彼此争夺养分, 遮挡光线。在实验过程中, 当克隆被培养至第 15天左右时, 消光值有明显的下降。这是由于藻丝相互缠绕造成穿透光强的增高。在进行藻体代谢产物对裙带菜雄配子体生长的影响的实验时也发现,克隆密度高的情况下, 生长速度会有所下降。因此在培养时应该注意及时分瓶扩养。
邓祥元, 2009. 转基因海带配子体的制备与高效增值. 青岛:中国科学院海洋研究所硕士学位论文, 98—105
李大鹏, 李文茹, 2006. 裙带菜配子体发育过程的研究. 海洋与湖沼, 37(S): 237—242
Bates S S, Worms J, Smith J C, 1993. Effects of ammonium and nitrate on growth and domoic acid production by Nitzschia pungens in batch culture. Can J Fish Aquat Sci, 50(6):1248—1254
Collos Y, Mornet F, Sciandra A et al, 1999. An optical method for the rapid measurement of micromolar concentrations of nitrate in marine phytoplankton cultures. J Appl Phycol,11(2): 179—184
dā Costa Braga A, Yoneshigue-Valentine Y, 1996. Nitrogen and phosphorus uptake by the Brazilian kelp Laminaria abyssalis (Phaeophyta) in culture. Hydrobiologia, 326—327(1): 445—450
Hanisak M D, Harlin M M, 1978. Uptake of inorganic nitrogen by Codium fragile subsp. tomentosoides (Chlorophyta). J Phycol, 14(4): 450—454
Harlin M M, Craigie J S, 1978. Nitrate uptake by Laminaria longicruris (Phaeophyceae). J Phycol, 14(4): 464—467
Harrison P J, Druehl L D, Lloyd K E et al, 1986. Nitrogen uptake kinetics in three year-classes of Laminaria groenlandica(Laminariales: Phaeophyta). Mar Biol, 93(1): 29—35
Kaas R, Perez R, 1989. Study of the intensive culture of Undaria on the coast of Brittany. outdoor seaweed cultivation. In:The Proceedings of the Second Workshop of COST 48 Subgroup. Brussels: European Economic Community, 1:31—33
Lobban C S, Harrison P J, 1994. Seaweed Ecology and Physiology. Cambridge, London: Cambridge University Press, 163—209
Pang S J, Hu X Y, Wu C Y et al, 1997. Intraspecific crossings of Undaria pinnatifida (Harv.) Sur.-a possible time-saving way of strain selection. China J Oceanol Limnol, 15(3):227—235
Phillips J C, Hurd C L, 2003. Nitrogen ecophysiology of intertidal seaweeds from New Zealand: N uptake, storage and utilisation in relation to shore position and season. Mar Ecol Prog Ser, 264: 31—48
Raven J A, 1984. Energetics and Transport in Aquatic Plants.New York: AR Liss, 587
Thomas T E, Harrison P J, 1987. Rapid ammonium uptake and nitrogen interactions in five intertidal seaweeds grown under field conditions. J Exp Mar Biol Ecol, 107(1): 1—8
Thomas W H, Hastings J, Fujita M, 1980. Ammonium input to the sea via large sewage outfalls-Part 2: effects of ammonium on growth and photosynthesis of southern California phytoplankton cultures. Mar Environ Res, 3(4):291—296
Touchette B W, Burkholder J M, 2000. Review of nitrogen and phosphorus metabolism in seagrasses. J Exp Mar Biol Ecol,250(1—2): 133—167
