不同环境因子对珍稀观赏蕨类金毛狗配子体性别分化的影响
2018-07-19余蓉培汪国鲜阮继伟吴丽芳单芹丽杨春梅
余蓉培,汪国鲜,阮继伟,吴丽芳,单芹丽,杨春梅*
(1 云南农业科学院花卉研究所, 国家观赏园艺工程技术研究中心,昆明650205;2 玉溪云星生物科技有限公司,云南玉溪653100;3 云南大学 生命科学学院,昆明 650091)
蕨类植物(ferns)又称羊齿植物,是位于苔藓植物和种子植物之间的过渡类群。蕨类植物具有明显的世代交替,即:小而简单的单倍体配子体世代和大而复杂的二倍体孢子体世代,是维管束植物中配子体和孢子体都能够独立生存的唯一类群[1]。同型孢子蕨类的孢子萌发后,会形成雄配子体、雌配子体、两性配子体等不同性别配子体[2],同时,也可能有无性配子体形成[3]。同型孢子蕨类植物中,除了极少数种类的配子体性别分化受遗传因素影响[4],大部分种类的配子体性别分化受环境因子调控[5]。蕨类植物配子体性别分化研究对于揭示植物性别决定机制和植物不同进化类群有性生殖的特异性具有重要意义[5],同时,还对观赏蕨类人工繁育技术及杂交育种研究具有重要参考价值。
现有研究表明,配子体性别分化受激素[6-8]、培养密度[3, 9-10]、光照[11-12]、营养物质[2,13]等环境因子影响。目前,蕨类植物配子体性别决定机制研究主要集中于水蕨(Ceratopterisrichardii)[2,14-15]、海金沙(Lygodiumjaponicum)[16],已有研究显示,成精子囊素(antheridiogens)由先成熟的两性配子体产生并分泌到环境中,是一类与赤霉素结构类似的激素,能够促进雄配子体形成而抑制雌配子体形成,在配子体性别分化中起关键作用。Tanaka等[16]提出并证实了成精子囊素介导的赤霉素信号通路在海金沙配子体性别分化中的调控模式。
金毛狗 [Cibotiumbarometz(L.) J. Sm.],隶属于金毛狗科(Cibotiaceae)金毛狗属[17],为多年生大型树状蕨类,在欧美地区,广泛应用于庭院造景中[18]。金毛狗为国家二级重点保护野生植物[19],同时也被列入《濒危野生动植物种国际贸易公约(附录II)》[20]。目前,尚未见金毛狗配子体性别分化研究的相关报道。本研究以金毛狗孢子为培养材料,探究培养密度、外源赤霉素、光质等环境因子对金毛狗配子体性别分化的影响,研究结果将为珍稀观赏蕨类金毛狗人工繁育以及蕨类植物配子体性别决定机制研究提供参考。
1 材料和方法
1.1 试验材料
金毛狗孢子采集于云南屏边地区,孢子收集和保存参照余蓉培等[21]所述方法。
1.2 试验方法
1.2.1孢子无菌培养参照余蓉培等[21]所述方法进行金毛狗孢子无菌培养。孢子无菌培养所用培养基为:1/2MS+3%蔗糖+0.7%琼脂(pH 5.8),暗培养24 h后,放置于培养室中培养,培养条件为:光照强度30~40 μmol·m-2·s-1,光照时间12 h·d-1,温度25±2 ℃。
1.2.2配子体培养密度处理采用王晓倩等[22]所述方法对金毛狗孢子播种密度进行调控,形成不同的孢子培养密度,孢子萌发后将形成不同的配子体培养密度。培养80 d和100 d时,分别选取配子体培养密度为:1个/cm2、5个/cm2、(40±5)个/cm2、(80±5)个/cm2进行观察,每个培养密度下随机选取5组配子体(20个/组),对不同性别配子体比率、单个配子体上精子器(颈卵器)平均数进行统计。试验进行3次重复。
1.2.3配子体外源赤霉素处理对金毛狗孢子进行无菌培养,孢子萌发后1周左右,调整培养密度至1个/cm2,分别滴加不同浓度的GA4和GA3,浓度梯度为:0、0.01、0.1和1 μmol/L,每2周滴加一次。GA4和GA3处理后60 d进行数据统计,统计方式同上。试验进行3次重复。
1.2.4配子体不同光质处理对金毛狗孢子进行无菌培养,孢子萌发后1周左右,调整培养密度至1个/cm2,分别放置于白、红、蓝的飞利浦LED灯下进行培养,光照强度均为40 μmol·m-2·s-1。光照处理后60 d进行数据统计,统计方式同上。试验进行3次重复。
1.3 数据处理
使用SPSS 16.0软件对数据进行方差分析,所用方法为最小显著差数法(LSD),并使用Excel 2007绘图。相关计算公式如下:
雌配子体比率 = (雌配子体数/配子体总数)× 100%
雄配子体比率 = (雄配子体数/配子体总数)× 100%
两性配子体比率 = (两性配子体数/配子体总数)× 100%
无性配子体比率 = (无性配子体数/配子体总数)× 100%
单个配子体上精子器平均数 = 各性别配子体的精子器总数/配子体总数
单个配子体上颈卵器平均数 = 各性别配子体的颈卵器总数/配子体总数
2 结果与分析
2.1 金毛狗配子体性别分化对培养密度的响应
2.1.1培养密度对金毛狗配子体性别比率的影响如图1所示,低培养密度下(1个/cm2和5个/cm2),配子体多为雌配子体;随着培养密度的增加,雌配子比例下降,雄配子体和两性配子体比率上升;配子体培养密度为40个/cm2时,雄配子体和两性配子体比率达到最高,雄配子体多簇生于发育较早的两性或雌配子体周围。但在80个/cm2高培养密度下,雄配子体和两性配子体比率均发生下降。随着培养密度的增大,无性配子体比率相应增加,在80个/cm2的高培养密度下,无性配子体比率达40%以上。
与80 d相比,100 d时,低培养密度下(1个/cm2和5个/cm2),雌配子体比率下降,两性配子体比率上升,说明随着培养时间延长,部分雌配子逐渐发育成为两性配子体;40个/cm2时,随着培养时间的延长,雄配子体比例下降,两性配子体比例增加,说明部分雄配子体逐渐向两性配子体发育。
2.1.2培养密度对金毛狗配子体性器官数量的影响如图2所示,1个/cm2和5个/cm2时,金毛狗配子体上的颈卵器平均数量最多,随着培养密度的增加,单个配子体上的颈卵器平均数量减少。40个/cm2时,配子体精子器平均数量最多,较低或较高培养密度下,精子器数量均较少。与80 d相比,100 d时,除80个/cm2下的精子器平均数量无显著变化,其他处理下的颈卵器和精子器数量均有所增加。
2.2 金毛狗配子体性别分化对外源赤霉素的响应
2.2.1外源GA3和GA4对金毛狗配子体性别比率的影响如图3所示,对照(无外源激素)除极少数有两性配子体形成,其他均为雌配子体。不同浓度的GA4处理后,雌配子体比率显著下降,雄配子体比率显著增加,两性配子体比例略微上升;0.1和1μmol/L处理后,可实现较高的雄配子形成率,未见无性配子体形成。但与GA4相比,GA3对金毛狗配子体性别分化的影响较为微弱,说明金毛狗配子体对GA4的敏感性更高。

图1 培养密度对金毛狗配子体性别分化的影响Fig.1 Effect of cultivation density on the sex differentiation of Cibotium barometz gametophytes
GA4和GA3对金毛狗配子体性别分化影响的差异可能源于两者分子结构上的差异,导致配子体对两者的敏感性存在差异。
2.2.2外源GA3和GA4对金毛狗配子体性器官数量的影响如图4所示,GA4处理后,金毛狗单个配子体上颈卵器平均数量减少,精子器平均数量增加,0.1和1 μmol/L GA4处理对颈卵器形成的抑制作用和精子器形成的促进作用较为显著。相反,GA3处理对单个配子体上颈卵器和精子器的形成没有产生显著影响。
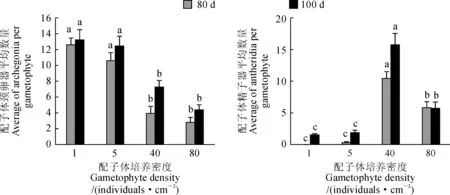
不同小写字母表示同一时间不同培养浓度间差异显著(P<0.05)图2 培养密度对金毛狗配子体性器官形成的影响Different lowercase letters indicate that results of different cultivation density are significant each other (P<0.05) at the same timeFig.2 Effect of cultivation density on the sexual organ formation of C. barometz gametophytes
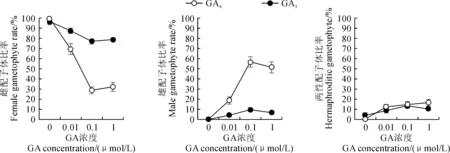
图3 外源赤霉素GA3和GA4对金毛狗配子体性别分化的影响Fig.3 Effect of exogenous GA3 and GA4 on the sex differentiation of C. barometz gametophytes

不同小写字母表示同一处理下不同培养浓度间差异显著(P<0.05)图4 外源赤霉素GA3和GA4对金毛狗配子体性器官形成的影响Different lowercase letters indicate that results of different cultivation density are significant each other (P<0.05) at the same treatmentFig.4 Effect of exogenous GA3 and GA4 on the sexual organ formation of C. barometz gametophyte
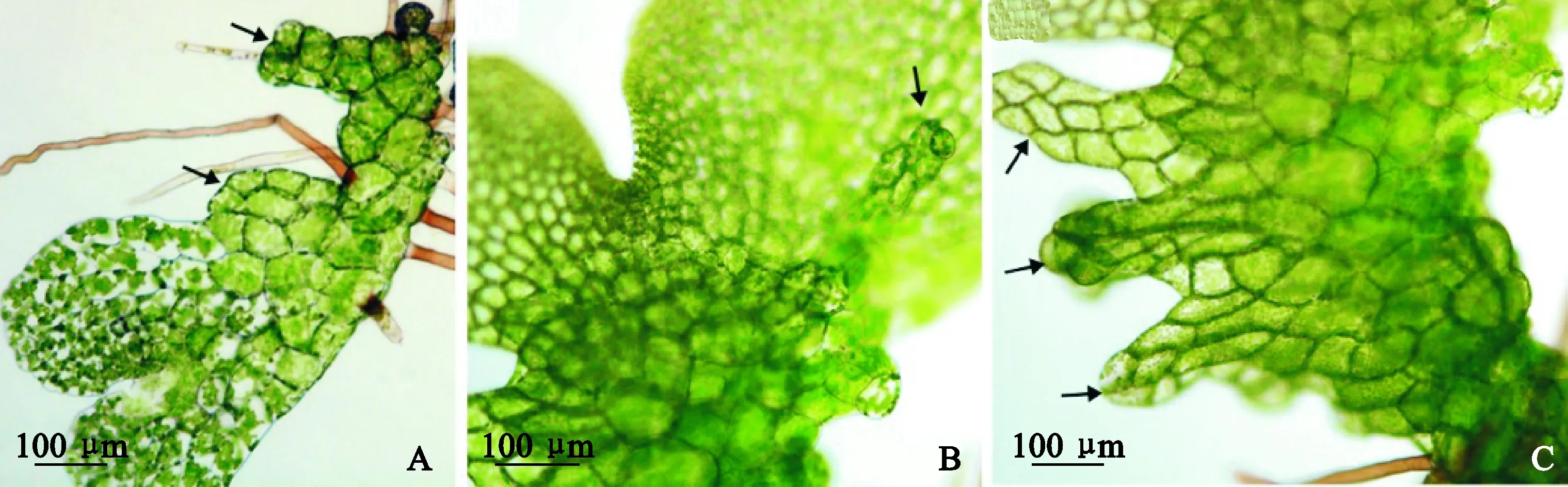
GA4处理后,部分配子体发育成为雄配子体(图5,B~D),0.1和1 μmol/L处理下,部分雄配子体上产生大量的精子器。但与典型的雄配子体形态(图5,A)相比,GA4处理后形成的雄配子体可见较浅的“U” 形生长点,后期如果培养环境中缺乏GA4,存在向两性配子体发育的可能性。
2.3 金毛狗配子体性别分化对光质的响应
2.3.1光质对金毛狗配子体性别分化的影响分别采用白光、红光、蓝光等不同光照处理后,均只有雌配子体和两性配子体的形成,未见雄配子体和无性配子体形成(图6);且仅红光处理下,两性配子体比率略有上升,但未见雄配子体形成。说明光质在金毛狗的配子体性别分化中未起到关键作用。但不同光照对于金毛狗配子体发育及形态建成会产生一定影响。红光和蓝光处理下,部分配子体会形成新的增殖位点,并逐步发育形成新的配子体(图7,A~C)。
2.3.2光质对金毛狗配子体性器官数量的影响分别采用白光、红光、蓝光等不同光照处理后,配子体的颈卵器和精子器平均数未产生显著变化,红光处理下,精子器数量虽略有增加,但差异不显著。说明光照对金毛狗配子体性器官的形成没有显著影响。

A.正常的雄配子体;B. 0.01 μmol/L GA4处理后45 d;C. 0.1 μmol/L GA4处理后60 d;D. 1 μmol/L 处理后60 d。箭头所示为精子器图5 正常雄配子体和外源赤霉素GA4处理后形成的雄配子体A. Normal male gametophyte; B. 45 days after using 0.01 μmol/L GA4; C. 60 days after using 0.1 μmol/L GA4;D. 60 days after using 1 μmol/L GA4. Arrows indicate antheridiaFig.5 Normal male gametophytes and male gametophytes obtained after using exogenous GA4
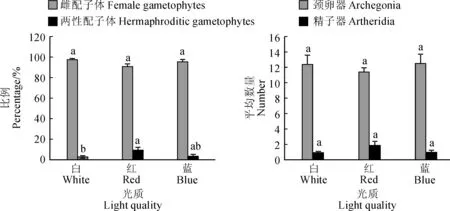
不同小写字母表示同一指标在不同光质间差异显著(P<0.05)图6 光照对金毛狗配子体性别分化和性器官形成的影响Different lowercase letters indicate that results of different light quality are significant each other (P<0.05) at the same indexFig.6 Effect of light on the sex differentiation and sexual organ formation of C. barometz gametophytes
A. 红光处理,箭头所示为新的增殖位点正在形成新的配子体;B~C. 蓝光处理,箭头所示为新的增殖位点正在形成新的配子体。图7 光照对金毛狗配子体发育的影响A. Red light, arrows indicate the new multiplication points forming the new gametophytes; B-C. Blue light, arrows indicate the new multiplication points forming the new gametophytesFig.7 Effect of light on the gametophyte development of C. barometz
3 讨 论
现有研究表明,培养密度会影响配子体的性别分化,培养密度较低时,配子体通常发育为雌性或两性配子体,培养密度较高时,配子体则多发育为雄性或无性配子体[3]。在分株紫萁(Osmundacinnamomea)中,当培养密度为1~3个/cm2时,配子体体为雌配子体,培养密度大于60个/cm2时,配子体则多为无性配子体,培养密度在3~41个/cm2时,配子体以两性配子体和雄性配子体居多[3]。在狗脊蕨(Woodwardiaradicans)中,随培养密度增加,雄配子体比率增加,随培养时间增长,两性配子体比例增加[9]。水蕨(Ceratopteristhalictroides)配子体性别也会随培养密度发生变化,低密度培养下发育为两性配子体,高密度培养下发育为雄配子体[10]。本研究中,低培养密度下(1个/cm2和5个/cm2),金毛狗配子体多为雌配子体;随着培养密度的增加,雄配子体和两性配子体比例上升;配子体培养密度为40个/cm2时,雄配子体和两性配子体比例达到最高;培养密度增高至80个/cm2时,无性配子体比例显著上升。金毛狗配子体性别随培养密度的变化趋势与分株紫萁相似[3]。随着培养时间的延长,不同培养密度下两性配子体比率都有所增加,与狗脊蕨的情况相似[9]。
成精子囊素能够促进雄配子体形成而抑制雌配子体形成,其结构和化学性质与赤霉素类似[23]。已有研究显示,外源GA3能够诱导密穗蕨(Anemiaphyllitidis)精子器形成[8]。海金沙成精子囊素的主要成分为GA9甲酯[24]和GA73甲酯[25],Tanaka 等[16]研究发现外源GA9甲酯和GA4能促进海金沙精子器形成,抑制颈卵器形成,并证实了成精子囊素对海金沙配子体的性别调控是通过赤霉素信号通路实现。Menendez等[26]采用外源GA4+7和GA3对乌毛蕨(Blechnumspicant)配子体进行处理,仅GA4+7对精子器和颈卵器的形成起轻微的促进作用,GA3未产生作用。本研究中,外源GA4能促进金毛狗精子器形成而抑制颈卵器形成,与GA4在海金沙配子体性别分化中的作用相同[16],但外源GA3在金毛狗配子体性别分化中不产生显著作用,这与密穗蕨存在差异,但与乌毛蕨中的情况相似[26]。在金毛狗配子体性别分化中,外源GA4和GA3的作用存在显著差异,可能源于两者分子结构上的差异,导致配子体对两者的敏感性存在差异。
光质在不同蕨类植物的配子体性别分化中存在差异,红光、远红光以及蓝光对水龙骨属(Polypodium)、鹿角蕨属(Platycerium)、铁角蕨属(Asplenium)以及乌毛蕨属的精子器形成产生抑制作用[12]。在密穗蕨精子器形成过程中,蓝光起促进作用,红光起抑制作用,但都依赖于Ca2+的存在[27]。本研究发现,光质在金毛狗配子体性别分化中未产生显著作用,但对金毛狗配子体发育和形态建成会产生一定影响。
综上所述,培养密度和外源GA4等环境因子对金毛狗配子体性别分化和性器官形成产生影响,但由此产生的配子体性别分化对后期孢子体形成以及有性繁殖效率的影响还有待进一步深入研究。
