西北太平洋柔鱼角质颚微结构及其生长纹周期性研究*
2016-01-15刘必林林静远陈新军胡贯宇
刘必林 林静远 陈新军① 胡贯宇
(1. 上海海洋大学海洋科学学院 上海 201306; 2. 国家远洋渔业工程技术研究中心 上海 201306; 3. 大洋渔业资源可持续开发省部共建教育部重点实验室 上海 201306; 4. 远洋渔业协同创新中心 上海 201306 )
角质颚是位于头足类口球内主切割食物功能的硬组织结构, 由上下两片组成(刘必林等, 2009), 其主要成分为角质纤维和蛋白质(Hunt et al, 1981;Miserez et al, 2007)。作为头足类少数硬组织之一, 角质颚因其具有结构稳定、耐腐蚀以及信息储存良好等特点而受到国内外学者的广泛关注(刘必林等, 2014,2015)。随着 Clarke(1964)首先在强壮桑椹乌贼Moroteuthis ingens的角质颚中发现生长纹后, 越来越多的学者致力于利用角质颚微结构来研究头足类的年龄和生长(Perales-Raya et al, 2010, 2014a;Oosthuizen, 2004; Canali et al, 2011; Castanhari et al,2012; Cuccu et al, 2013)。然而, 研究只集中在真蛸Octopus vulgaris (Cuccu et al, 2013; Perales-Raya et al,2014b)和玛雅蛸 O. maya (Rodríguez-Domínguez et al,2013; Bárcenas et al, 2014)这两种蛸类身上, 关于柔鱼类仅有 Mereu等(2011)和胡贯宇等(2015)对角质颚的生长纹进行了判读。为此, 本文以西北太平洋海域的柔鱼为例, 分析柔鱼类角质颚的微结构特征, 通过与耳石判定的日龄做比较以确定角质颚生长纹的日周期性, 并建立柔鱼胴长、体重和角质颚喙长与日龄的关系。研究结果不仅为柔鱼类年龄鉴定与生长估算提供新方法, 而且为我国头足类学者开展相关研究提供重要基础。
1 材料和方法
1.1 材料来源
2010年5—6月和2011年9—11月共采集柔鱼样本 35尾, 样本实验室解冻后小心将耳石和角质颚取出, 清洗其表面的黏液及其它有机物后, 分别保存于盛有 75%酒精的离心管和管口瓶中, 并贴好标签以备后用。与此同时, 记录样本的胴长(mantle length,ML)、体重(body weight, BW)、性别、性腺成熟度等基础生物学数据, 角质颚喙长(Upper rostrum length,URL)的测量依据刘必林等(2010)。
1.2 角质颚
取出保存于管口瓶中的角质颚上颚, 用带有0.3 mm刀片的小型手持切割机沿角质颚喙部顶端至头盖后缘纵向切割成两半(图 1), 用剪刀将其中半个角质颚的喙部截面(Rostrum sagittal section, RSS)剪下(图 2a); 使角质喙部切割面朝下平放于塑料模具(图 2b)中, 倒入调配好的冷埋树脂溶液包埋(图 2c),然后置常温避光处待其硬化; 硬化后的树脂块切割成 2—3mm 的薄片, 并用强力热熔胶粘于载玻片上(图 2d); 先后以 240、600、1200、2000目水磨砂纸将切片研磨至中心面, 最后以 0.05μm氧化铝剂抛光研磨面(图 2e、f)。

图2 角质颚喙部切片制作流程图Fig.2 Flow charts of upper beak RSS preparation
1.3 生长纹计数
制作好的角质颚切片在 Olympus显微镜100×和400×下, 采用控制摄像系统(Charged Coupled Device,CCD)分别对喙部整体和顶端的生长纹进行拍照, 然后用Photoshop 7.0图像处理软件对两个倍数下所拍的图片分别进行拼图处理。生长纹计数时, 先对100×下采集的图像由喙部后端向前端, 始终沿生长纹垂直的方向计数喙部背侧的生长纹数目, 直至喙部背侧边缘处, 再对 400×下采集的图像继续计数, 边缘空白处的生长纹数目由临近的生长纹宽度推算而得。每个样本分别独立计数 3次, 采用变异系数(Coefficient of variation, CV)检验计数的准确性, 其计算公式如下
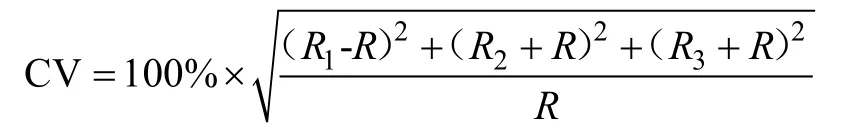
式中 R1、R2、R3分别代表每个样本独立的 3次计数值, R代表3次计数的平均值。
1.4 耳石日龄鉴定
每个角质颚对应的耳石样本, 依据 Dawe等(1991)的方法对其进行包埋、切割、研磨、抛光、观察、计数等。根据柔鱼类耳石生长纹“一日一龄”的理论, 柔鱼耳石的生长纹个数即其实际日龄。
1.5 角质颚生长纹日周期性验证
采用独立样本配对t检验检查角质颚生长纹与日龄是否存在显著差异, 同时对角质颚生长纹数目与耳石日龄进行线性回归分析, 并比较拟合线性方程的斜率和相关系数是否接近1。
1.6 建立生长方程
采用线性、幂函数、指数、对数、逻辑斯蒂、von Bertalanffy和Gompertz等7个生长模型来拟合柔鱼体长、体重和角质颚喙部的生长, 其中赤池信息准则(Akaike information criterion , AIC)值最小的为最适生长模型(Arkhipkin et al, 2000)。AIC计算公式如下

式中k为模型的参数数量, n为样本数量, RSS为剩余平方和。
2 结果
2.1 角质颚微结构
角质颚上颚喙部截面由背侧的头盖和腹侧的脊突两部分组成(图 1c), 周期性的生长带明显, 每一条生长带由明、暗两条生长纹组成。头盖部的生长纹明显比脊突部的生长纹清晰, 两部分的生长纹交汇于内轴成“<”形, 生长纹后端逐渐平行于脊突背缘(图1c, 图 2)。角质颚的喙部顶端以及后端常有明显的标记轮(图3a, b)。截面中部的生长纹最宽(图3c), 顶端生长纹最窄(图 3d), 而同一条生长纹越接近内轴的部分其宽度越宽(图 3e), 越远离内轴的部分其宽度越窄(图 3f)。柔鱼角质颚喙部生长纹的平均宽度为 12.4 μm。
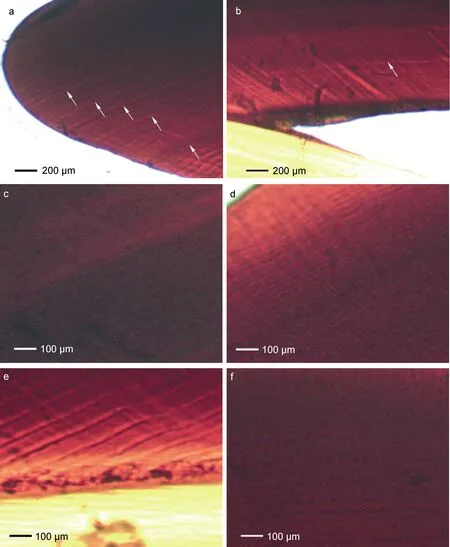
图3 柔鱼角质颚上颚喙部微结构图Fig.3 Light microstructure of upper beak RSS
2.2 角质颚生长纹数目与耳石日龄关系
分析结果显示, 三次独立计数 CV值为 2.97%±1.11%, 明显小于 5%, 因此角质颚生长纹计数准确,每个角质颚生长纹的形成需要1.018±0.039天。独立样本配对t检验显示, 角质颚喙部生长纹数目与耳石日龄无明显差异(P=0.057>0.05)。拟合线性方程显示,斜率(1.0177)和相关系数R2(0.9693)均接近于1(图4)。耳石估算日龄为 112—270 天, 角质颚估算日龄为102—266 天, 两者基本相当, 因此, 柔鱼角质颚生长纹的沉积为“一日一纹”。
2.3 角质颚日龄与柔鱼胴长和体重关系
根据最小AIC法(表1), 柔鱼胴长和体重与角质颚日龄关系均适合用逻辑斯蒂曲线来描述, 日龄 200天以前柔鱼胴长和体重增长较快, 200天以后增长变缓(图 5), 其关系式分别如下, 其中 ML为胴长, BW为体重, A为日龄。
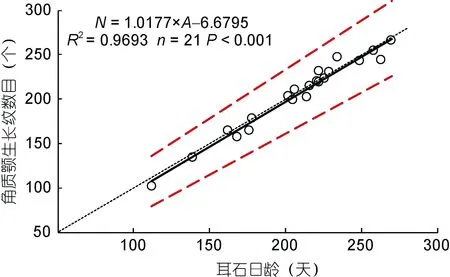
图4 柔鱼角质颚上颚喙部生长纹数目与耳石日龄的关系Fig.4 Relationship between number of growth increments of upper beak rostrum sagittal section and statolith determined age for O. batramii

表1 线性、幂函数、指数、对数、逻辑斯蒂、von Bertalanffy和Gompertz等7个生长方程拟合柔鱼胴长-日龄、体重-日龄上颚喙长-日龄参数值Tab.1 Parameters of linear, power, exponential, logarithmic,logistic, von Bertalanffy and Gompertz models fitted to ML-age, BW-age and URL-age data for O. batramii.
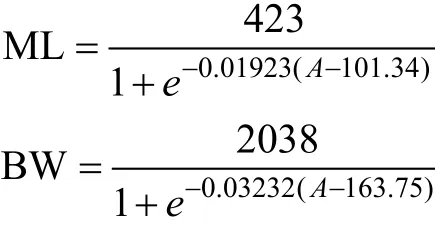
2.4 角质颚日龄与喙长关系
根据最小AIC法(表1), 柔鱼角质颚喙长与日龄适合用逻辑斯蒂曲线来描述, 日龄200天以前角质颚喙部生长较快, 200天以后生长变缓(图6), 其关系式如下, 其中URL表示角质颚喙长,A为日龄:

3 讨论
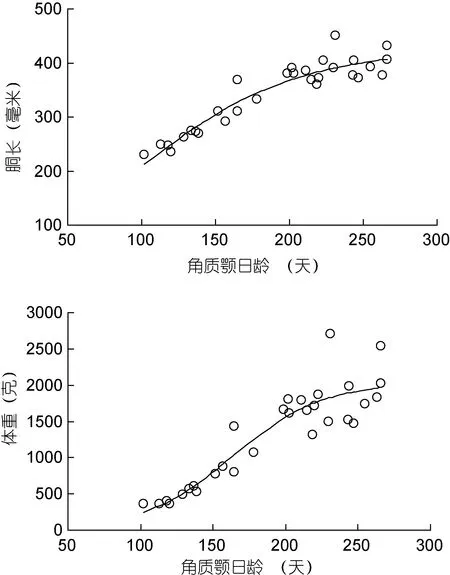
图5 柔鱼胴长、体重与角质颚日龄关系Fig.5 Correlations of ML and BW to the increment-determined age for O. bartramii

图6 角质颚上颚喙长与日龄关系Fig.6 Relationship between URL and increment determined age for O. bartrami
头足类的角质颚与其耳石、内壳、眼晶体等硬组织一样, 存在明显的生长纹结构, 角质颚头盖、脊突、侧壁、翼部等各部表面的生长纹明显, 肉眼可见, 而喙部的生长纹则须要切割研磨后才可见(刘必林等,2014)。Clarke(1964)首次详细报道了强壮桑椹乌贼角质颚中的生长纹结构, Nixon(1973)和Smale等(1993)先后在其它头足类角质颚中也发现了类似的结构。然而截至目前, 有关头足类角质颚生长纹的研究主要集中在侧壁和喙部两个部位, 侧壁生长纹是以喙顶端为中心的同心环纹(Perales-Rayaet al, 1998), 而喙部生长纹则是以内轴为对称轴的“<”形条纹(图 1c)。本研究发现, 与真蛸相似, 柔鱼角质颚喙部顶端生长纹最窄(图 3d), 中部的生长纹最宽(图 3c) (Perales-Rayaet al, 2010)。此外, 在一些柔鱼角质颚样本的喙部顶端和后端发现了明显的标记纹, 以往的研究认为它们的形成与头足类特殊的生活史事件(如孵化、交配、产卵)以及突发事件(温度波动、捕食者攻击)等密切相关(Arkhipkin, 2005; Perales-Raya et al, 2014b)。
Perales-Raya等(1998)首先提出真蛸角质颚生长纹的形成可能与其年龄相关, 直到 2001年Hernández-López才从实验角度证实了幼体真蛸角质颚侧壁生长纹具有日周期性。在此之后, Oosthuizen(2004)、Canali 等(2011)、Rodríguez-Domínguez 等(2013)、Bárcenas等(2014)和 Perales-Raya 等(2014)先后采用四环素标记、温度突变标记、实验室饲养法验证了真蛸和玛雅蛸角质颚喙部生长纹的日周期性。酒井光夫等(2007)尝试分析 5种柔鱼类(茎柔鱼 D.gigas、柔鱼、阿根廷滑柔鱼Illex. argentinus、鸢乌贼thenotheuthis oualaniensis和太平洋褶柔鱼Todarodes pacificus)仔鱼角质颚生长纹的周期性, 结果表明, 除鸢乌贼外, 其余 4种角质颚的生长纹均为“一日一纹”。然而, 本文首次验证了柔鱼类整个生命史周期内角质颚生长纹的日周期性, 弥补了前者只限于仔鱼期的不足。
研究表明, 在利用硬组织鉴定头足类的日龄时,弄清第1条生长纹形成的时间至关重要: 当其形成于头足类孵化时, 则估算的日龄与实际日龄相等; 而当其形成于孵化前, 则估算的日龄比实际日龄大, 反之则比实际日龄小(刘必林等, 2009, 2014)。此外, 计数者的经验也是影响日龄鉴定准确性的关键, 计数结果的可重复性可用作检验准确性的标准。一般来说,在年龄鉴定研究中, 生长纹计数的可信临界标准为,独立重复计数 2—3次, 几次计数值的差异不高于10%(Jackson et al, 1997; Oosthuizen, 2004)。本文 3次独立计数值的差异为 2.97 %±1.11%, 明显小于10%,加之已有研究证明柔鱼角质颚的第 1生长纹形成于孵化时(酒井光夫等, 2007)。因此, 本文通过角质颚喙部估算的柔鱼日龄是准确的, 其结果显示柔鱼寿命小于1年, 这与耳石估算的柔鱼寿命相符(Yatsu et al,1997)。最小 AIC法显示, 柔鱼胴长、体重以及角质颚喙长与日龄呈显著的逻辑斯蒂关系, 这说明柔鱼在其幼体期胴长、体重以及喙长生长较快, 而随着性腺不断成熟生长逐步变缓, 这符合头足类的一般生长规律(Arkhipkin, 2005)。
4 结论
过去几十年, 尽管耳石微结构分析被认为是研究头足类年龄和生长的最有效方法(Jackson, 1994),然而近年来, 头足类研究者们仍在不断尝试寻找另外一些可靠的途径(如内壳、角质颚、眼晶体微结构分析)来代替耳石(Doubleday et al, 2011; Cárdenas et al, 2011; Perales-Raya et al, 2014b)。对于蛸类而言,其耳石晶体结构紊乱导致生长纹不清晰, 因而角质颚微结构分析逐步成为其年龄和生长研究的最有效方法之一(Perales-Raya et al, 1998, 2010, 2014a;Hernández-López et al, 2001; Oosthuizen, 2004; Canali et al, 2011; Castanhari et al, 2012; Cuccu et al, 2013)。角质颚个体比耳石大许多, 更容易提取、更方便研磨,而且具有结构稳定、耐腐蚀的特点, 常存于大型鱼类、海鸟以及哺乳动物的胃内(Boyle et al, 2005), 更易间接获取, 因此角质颚的这些特点使其在头足类的年龄和生长中的研究前景更为广阔。然而, 有一点需要注意的是, 头足类的捕食活动常常会造成角质颚喙顶端一定程度的磨损。因此, 建议在利用角质颚喙部鉴定头足类日龄时, 需要选择那些角质颚磨损较小的样本, 以免过度低估实验样本的实际日龄。
刘必林, 陈新军, 2009. 头足类角质颚的研究进展. 水产学报,33(1): 157—164
刘必林, 陈新军, 2010. 印度洋西北海域鸢乌贼角质颚长度分析. 渔业科学进展, 31(1): 8—14
刘必林, 陈新军, 方 舟等, 2014. 利用角质颚研究头足类的年龄与生长. 上海海洋大学学报, 23(6): 930—936
刘必林, 陈新军, 方 舟等, 2015. 基于角质颚长度的头足类种类判别. 海洋与湖沼, 46(6): 1365—1372
胡贯宇, 陈新军, 刘必林等, 2015. 茎柔鱼耳石和角质颚微结构及轮纹判读. 水产学报, 39(3): 361—370
酒井光夫, Brunetti N, Bower J et al, 2007. アカイカ科稚仔5種Illex argentinus, Todarodes pacificus, Dosidicus gigas,Ommastrephes bartramii, Sthenoteuthis oualaniensis におけ る 上 顎 板 輪 輪 の 日 齢 形 質 . イ カ 類 類 源 研究会 議 , 9:1—7 (in Japanese with English abstract)
Arkhipkin A I, 2005. Statoliths as ‘black boxes’ (life recorders) in squid. Marine and Freshwater Research, 56(5): 573—583
Arkhipkin A I, Jereb P, Ragonese S, 2000. Growth and maturation in two successive seasonal groups of the short-finned squid,Illex coindetii from the Strait of Sicily (central Mediterranean). ICES Journal of Marine Science, 57(1):31—41
Bárcenas G V, Perales-Raya C, Bartolomé A et al, 2014. Age validation in Octopus maya (Voss and Solís, 1966) by counting increments in the beak rostrum sagittal sections of known age individuals. Fisheries Research, 152: 93—97
Boyle P, Rodhouse P, 2005. Cephalopods: Ecology and Fisheries.Oxford: Blackwell Science Ltd, 234—258
Cárdenas E R B, Correa S M, Guzman R C et al, 2011. Eye lens structure of the octopus Enteroctopus megalocyathus:evidence of growth. Journal of Shellfish Research, 30(2):199—204
Canali E, Ponte G, Belcari P et al, 2011. Evaluating age in Octopus vulgaris: estimation, validation and seasonal differences. Marine Ecology Progress Series, 441: 141—149
Castanhari G, Tomás A R G, 2012. Beak increment counts as a tool for growth studies of the common octopus Octopus vulgaris in Southern Brazil. Boletim do Instituto de Pesca,São Paulo, 38(4): 323—331
Clarke M R, 1964. “Growth Rings” in the beaks of the squid Moroteuthis ingens (Oegopsida: Onychoteuthidae).Malacologia, 3(2): 287—307
Cuccu D, Mereu M, Cau A et al, 2013. Reproductive development versus estimated age and size in a wild Mediterranean population of Octopus vulgaris (Cephalopoda:Octopodidae). Journal of the Marine Biological Association of the United Kingdom, 93(3): 843—849
Dawe E G, Natsukari Y, 1991. Light microscopy. In: Jereb P,Ragonese S, Boletzky S V eds. Squid age determination using statoliths. Proceedings of the International Workshop,9—14 October 1989, Istituto di Tecnologia della Pesca e del Pescato, N.T.R.-I.T.P.P. Mazara del Vallo, Sicily, Italy.Special Publication No. 1: 83—95
Doubleday Z A, White J, Pecl G T et al, 2011. Age determination in merobenthic octopuses using stylet increment analysis:assessing future challenges using Macroctopus maorum as a model. ICES Journal of Marine Science, 68(10):2059—2063
Hernández-López J L, Castro-Hernández J L, Hernández-García V, 2001. Age determined from the daily deposition of concentric rings on common octopus (Octopus vulgaris)beaks. Fishery Bulletin, 99(4): 679—684
Hunt S, Nixon M, 1981. A comparative study of protein composition in the chitin-protein complexes of the beak, pen,sucker disc, radula and oesophageal cuticle of cephalopods.Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 68(4): 535—546
Jackson G D, 1994. Application and future potential of statolith increment analysis in squids and sepioids. Canadian Journal of Fisheries and Aquatic Sciences, 51(11): 2612—2625
Jackson G D, Forsythe J W, Hixon R F et al, 1997. Age, growth,and maturation of Lolliguncula brevis (Cephalopoda:Loliginidae) in the northwestern Gulf of Mexico with a comparison of length-frequency versus statolith age analysis.Canadian Journal of Fisheries and Aquatic Sciences, 54(12):2907—2919
Mereu M, Stacca D, Cannas R et al, 2011. On the growth rings on Histioteuthis bonnellii (Férussac, 1835) upper beaks.Biologia Marina Mediterranea, 18(1): 124—127
Miserez A, Li Y L, Waite J H et al, 2007. Jumbo squid beaks:inspiration for design of robust organic composites. Acta Biomaterialia, 3(1): 139—149
Nixon M, 1973. Beak and radula growth in Octopus vulgaris.Journal of Zoology (London), 170(4): 451—462
Oosthuizen A, 2004. A development and management framework for a new Octopus vulgaris fishery in South Africa. South Africa: Doctor Dissertation of Rhodes University, 183
Perales-Raya C, Bartolomé A, García-Santamaría M T et al, 2010.Age estimation obtained from analysis of octopus (Octopus vulgaris Cuvier, 1797) beaks: improvements and comparisons. Fisheries Research, 106(2): 171—176
Perales-Raya C, Almansa E, Bartolomé A et al, 2014a. Age validation in Octopus vulgaris beaks across the full ontogenetic range: beaks as recorders of life events in octopuses. Journal of Shellfish Research, 33(2): 481—493
Perales-Raya C, Jurado-Ruzafa A, Bartolomé A et al, 2014b. Age of spent Octopus vulgaris and stress mark analysis using beaks of wild individuals. Hydrobiologia, 725(1): 105—114 Perales-Raya C, Hernández-González C L, 1998. Growth lines within the beak microstructure of the octopus Octopus vulgaris Cuvier, 1797. South African Journal of Marine Science, 20(1): 135—142
Rodríguez-Domínguez A, Rosas C, Méndez-Loeza I et al, 2013.Validation of growth increments in stylets, beaks and lenses as ageing tools in Octopus maya. Journal of Experimental Marine Biology and Ecology, 449: 194—199
Smale M J, Clarke M R, Klages N T W et al, 1993. Octopod beak identification-resolution at a regional level (Cephalopoda,Octopoda: Southern Africa). South African Journal of Marine Science, 13(1): 269—293
Yatsu A, Midorikawa S, Shimada T et al, 1997. Age and growth of the neon flying squid, Ommastrephes bartrami, in the North Pacific Ocean. Fisheries Research, 29(3): 257—270
