天津滨海湿地一株高效异养硝化细菌的分离鉴定及脱氮特性研究
2023-12-03王春萍郭宏宇霍玉珠王丽霞马成仓王银华
王春萍,郭宏宇,霍玉珠,王丽霞,马成仓,王银华
(1.天津师范大学生命科学学院,天津 300387:2.天津师范大学天津市动植物抗性重点实验室,天津 300387)
近年来,随着人类社会的快速发展,氮污染日益增加,已成为全球性生态问题之一. 当前人为活动导致的大气氮沉降约占表层海洋年氮输入的20%[1],氮输入的急剧增加使全球主要地区水体氮污染趋势明显. 氮污染引起沿海地区湿地和水体的富营养化,将会导致大量水生生物死亡,降低生物多样性,破坏湿地和水体系统生态功能,威胁沿海地区生态环境健康. 天津滨海湿地位于渤海之滨,是京津冀区域湿地生态系统的重要组成部分[2],在维持区域气候稳定、维护生物多样性、防护海岸线等方面发挥着重要的生态服务功能[3-4]. 但天津滨海湿地也面临着较为严重的氮污染问题[5]. 研究表明,渤海湾水域可溶性无机氮含量呈逐年显著上升趋势[6],其中渤海湾近岸水体中氮营养盐含量较高,达到(0.80 ± 0.12)mg/L[7],氮污染已对天津滨海湿地的生态服务功能造成了威胁.
生物脱氮法具有操作简单、稳定高效、不产生二次污染等优点,已成为当前氮污染治理的研究热点[8].硝化细菌所驱动的将氨态氮转化为亚硝酸盐和硝酸盐的硝化作用是生物脱氮的重要过程[9-10]. 同自养型硝化细菌相比,异养型硝化细菌生长速率快,对环境适应性强,在生物脱氮技术中具有很好的应用前景[11].目前已分离出的具有较高硝化能力的异养硝化细菌多为芽胞杆菌属(Bacillussp.)[12]、产碱菌属(Alcaligenessp.)[13]、假单胞菌属(Pseudomonassp.)[14]、不动杆菌属(Acinetobactersp.)[15],且均在各自来源生境条件下具有最高的适应性和最佳的脱氮性能. 本研究从天津滨海湿地土壤中分离筛选得到一株具有高效脱氮能力的异养硝化细菌菌株WP5,利用分子生物学方法对其进行鉴定,并进一步研究碳源、氨氮负荷、温度、接种量对该菌株生长和脱氮特性的影响,应用正交实验探究其脱氮的优化条件. 本研究将为应用生物脱氮技术高效治理天津滨海湿地的氮污染提供理论依据.
1 材料与方法
1.1 培养基
富集培养基(LB 培养基):牛肉膏3 g/L、蛋白胨10 g/L、NaCl 5 g/L、pH 值为7.0~7.2.
异养硝化培养基:K2HPO47.0 g/L、KH2PO43.0 g/L、MgSO4·7H2O 0.1 g/L、(NH4)2SO40.943 g/L、FeSO4·7H2O 0.05 g/L、pH 值为7.2~7.4.
在以上培养基中分别加入2%的琼脂粉,制成平板培养基.
1.2 实验方法
1.2.1 异养硝化菌株的分离筛选与鉴定
称取10.0 g 土样,加入装有100 mL 无菌水的三角瓶中,振荡10 min 后,吸取悬浮液10 mL,接种到LB 液体培养基中,置于35 ℃、120 r/min 恒温旋转摇床中培养3 d. 采用梯度稀释法将菌液稀释,在异养硝化培养基上进行涂布,于35 ℃条件下培养2~3 d后,挑取湿润圆滑的单个菌落,采用平板划线法对形态不同的菌株进行菌株纯化,进一步分离纯化3~4次,直至形成均匀单一菌落.
将分离得到的菌株分别接种于100 mL LB 液体培养基中,置于35 ℃、120 r/min 恒温旋转摇床中培养12~16 h. 在细菌的细胞光密度(OD600)达到约为1.0后,按5%的接种量将细菌悬浮液分别接种在异养硝化液体培养基中,并置于35 ℃、150 r/min 恒温旋转摇床中培养48 h,每隔24 h 取样,10 000 r/min 下离心10 min,吸取上清液. 用标准方法分别测定氨态氮和总氮含量,计算氮去除率[16-18],挑选出氮去除效果最优的异养硝化菌株.
用细菌基因组DNA 提取试剂盒(北京索莱宝科技有限公司)提取细菌基因组DNA. 以基因组DNA 为模板,利用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)对细菌基因组DNA 的16S rRNA 片段进行PCR 扩增. 经纯化后的PCR 扩增产物送至生工生物工程(上海)股份有限公司进行测序分析,获得16S rRNA 片段序列数据. 将该菌株的16S rRNA 片段序列数据提交至GenBank 数据库,使用BLAST 程序(http://blast.st-va.ncbi.nlm.nih.gov/Blast.cgi)进行比对分析,鉴定到属分类学水平.
1.2.2 不同因素对菌株异养硝化特性的影响
(1)碳源. 在异养硝化液体培养基中分别加入不同单一碳源:柠檬酸钠(C6H5Na3O7·2H2O)8.17 g/L、蔗糖(C12H22O11)4.75 g/L、醋酸钠(CH3COONa)6.84 g/L,使不同单一碳源具有相同的碳含量. 将筛选获得的菌株接种于100 mL LB 液体培养基中,置于35 ℃、150 r/min的恒温旋转摇床中过夜培养至OD600约为1.0,以5%的接种量接种至含有不同单一碳源、pH 值为7、硫酸铵为唯一氮源、初始氨态氮质量浓度为200 mg/L 的异养硝化液体培养基中. 置于35 ℃、150 r/min 的恒温旋转摇床中培养24 h,每4 h 取样,分别测定OD600、氨态氮(NH4+-N)质量浓度和总氮(TN)质量浓度. 每种碳源设置3个重复,并以不接菌培养基作为空白对照.
(2)氨态氮负荷. 初始氨态氮质量浓度分别设置为50、100、200 mg/L.将筛选获得的菌株接种于100 mL LB 液体培养基中,置于35 ℃、150 r/min 恒温旋转摇床中过夜培养至OD600约为1.0,以5%的接种量接种至含有不同初始氨态氮质量浓度、pH 值为7、以蔗糖为单一碳源(2 g/L)、硫酸铵为单一氮源的异养硝化液体培养基中. 置于35 ℃、150 r/min 恒温旋转摇床中培养24 h,每4 h 取样,分别测定OD600、氨态氮质量浓度和总氮质量浓度. 每个氨态氮负荷水平设置3个重复,并以不接菌培养基作为空白对照.
(3)温度. 温度分别设置为15、25、35 ℃. 将筛选获得的菌株接种于100 mL LB 液体培养基中,置于35 ℃、150 r/min 恒温旋转摇床中过夜培养至OD600约为1.0,以5%的接种量接种至pH 值为7、以蔗糖为单一碳源(2 g/L)、硫酸铵为单一氮源、初始氨态氮质量浓度为200 mg/L 的异养硝化液体培养基中. 置于不同温度条件下,150 r/min 的恒温旋转摇床中培养24 h,每4 h 取样,分别测定OD600、氨态氮质量浓度和总氮质量浓度. 每个温度条件设置3个重复,并以不接菌培养基作为空白对照.
(4)接种量. 接种量分别设置为1%、5%、10%. 将筛选获得的菌株接种于100 mL LB 液体培养基中,置于35 ℃、150 r/min 恒温旋转摇床中过夜培养至OD600约为1.0,以不同接种量分别接种至pH 值为7、以蔗糖为单一碳源(2 g/L)、硫酸铵为单一氮源、初始氨态氮质量浓度为200 mg/L 的异养硝化液体培养基中. 置于35 ℃、150 r/min 恒温旋转摇床中培养24 h,每4 h取样,分别测定OD600、氨态氮质量浓度和总氮质量浓度. 每个接种量水平设置3个重复,并以不接菌培养基作为空白对照.
1.2.3 正交实验
选择碳源、温度、氨态氮负荷和接种量4个因素进行正交实验,每个因素设置3个水平,每组设置3个重复,如表1 所示. 以培养24 h 时的总氮去除率为依据,探究菌株脱氮的优化条件及其影响因素.
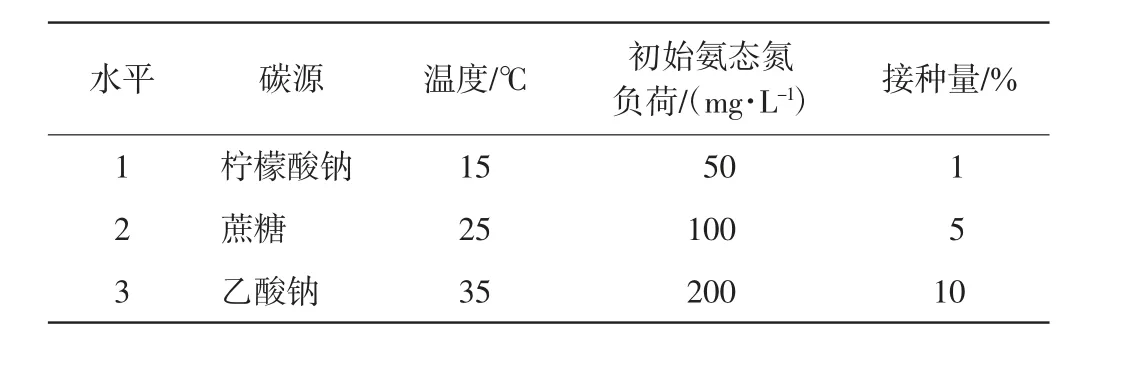
表1 正交实验各因素和水平Tab.1 Factors and levels in the orthogonal experiment
1.2.4 测定方法
菌体生长量的测定采用测量菌液细胞光密度的方法,即在600 nm 波长处测定菌液的吸光度(OD600)[19];采用水杨酸分光光度法[16]测定氨态氮质量浓度;采用碱性过硫酸钾消解-紫外分光光度法[17]测定总氮质量浓度.
1.3 数据分析
氨态氮和总氮去除率计算公式[18]:
式中:C0(mg/L)为氨态氮或总氮的初始质量浓度;Ct(mg/L)为氨态氮或总氮处理t小时后的质量浓度.
用JMP11 软件对数据进行统计分析,用SigmaPlot12.5 软件作图.
2 结果与分析
2.1 菌株的分离筛选和鉴定
本研究从天津滨海湿地土壤中分离筛选获得一株具有高效脱氮能力的异养硝化细菌WP5,该菌株对氨态氮和总氮均有较强的去除能力.对菌株WP5 基因组DNA 的16S rRNA 片段PCR 扩增产物的测序和对比分析结果表明,WP5 与数据库中肠杆菌属(Enterbacter)的相似性达99%,因此应属于肠杆菌属,将其命名为Enterbactersp.WP5.
2.2 碳源对菌株生长和脱氮效果的影响
不同碳源条件下WP5 菌株生长及其对氨态氮和总氮的去除效果如图1 所示.
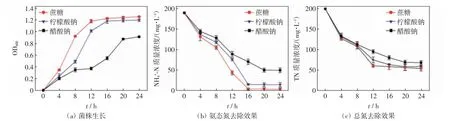
图1 不同碳源条件下菌株生长及其对氨态氮和总氮的去除效果Fig.1 Growth of strain and its removal of NH4+-N and TN under different carbon sources
由图1(a)可知,以柠檬酸钠和蔗糖为单一碳源时,菌株生长状况较好,4~12 h 由培养初期进入对数期,16 h 后进入稳定期;以醋酸钠为单一碳源时,菌株在0~12 h 时生长较为缓慢,12 h 后进入对数期,约20 h后进入稳定期.由图1(b)可知,以蔗糖为碳源时,菌株对氨态氮的去除效果最好,在8~16 h 期间氨态氮质量浓度快速下降,在16 h 后趋于稳定,24 h 时氨态氮去除率达98.38%;以柠檬酸钠和醋酸钠为单一碳源时,菌株对氨态氮的去除分别在16 h 和20 h 趋于稳定,24 h 时氨态氮去除率分别达92.77%和84.60%.由图1(c)可知,以蔗糖为单一碳源时,24 h 时总氮去除率达77.34%;以柠檬酸钠和醋酸钠为单一碳源时,24 h时总氮去除率分别达75.81%和71.38%. 单因素方差分析结果如表2 所示,碳源对菌株的生长和脱氮效果均有显著影响(P<0.05).
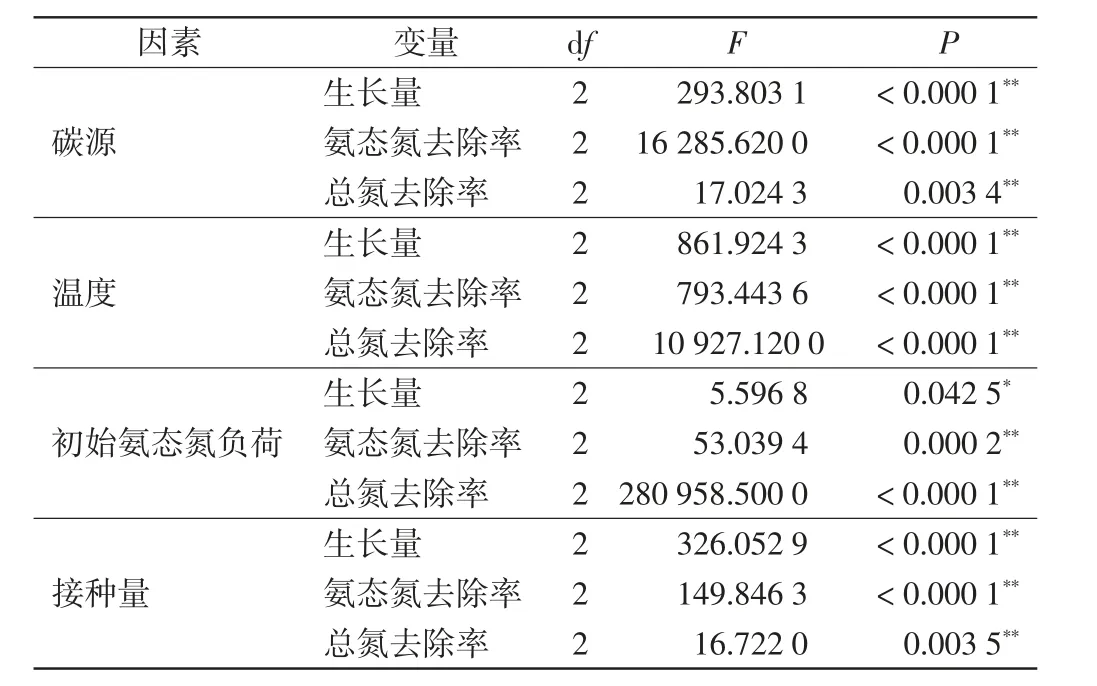
表2 碳源、温度、氨氮负荷、接种量对菌株生长和脱氮效果影响的方差分析结果Tab.2 ANOVA results of the effects of carbon source,temperature,initial NH4+-N concentration and inoculum amount on the growth and nitrogen removal efficiency of the strain
2.3 温度对菌株生长和脱氮效果的影响
不同温度条件下菌株的生长、对氨态氮和总氮的去除效果如图2 所示.
由图2(a)可知,在35 ℃条件下,菌株生长状况最佳,经过短暂的迟缓期后进入对数期,12 h 后进入稳定期;25 ℃条件下,菌株的生长曲线变化趋势与35 ℃条件下较为相似;15 ℃条件下,培养初期菌株生长缓慢,8 h 后进入对数期,约16 h 后进入稳定期.由图2(b)可知,在35 ℃条件下,菌株对氨态氮的去除效果最好,氨态氮的质量浓度呈快速下降趋势,在16 h后趋于稳定,24 h 时氨态氮去除率达99.41%;25 ℃和15 ℃条件下,菌株在24 h 时的氨态氮去除率分别为98.10%和87.94%.由图2(c)可知,35 ℃、25 ℃和15 ℃条件下,菌株在24 h 时的总氮去除率分别达78.74%、73.81%和67.36%.由此可见,在35 ℃条件下,该菌株具有较高的生长率和较强的脱氮能力.表2 中的单因素方差分析结果表明,温度对菌株的生长和脱氮效果均有显著影响(P<0.05).
2.4 氨氮负荷对菌株生长和脱氮效果的影响
不同初始氨态氮负荷条件下菌株的生长、对氨态氮和总氮的去除效果如图3 所示.
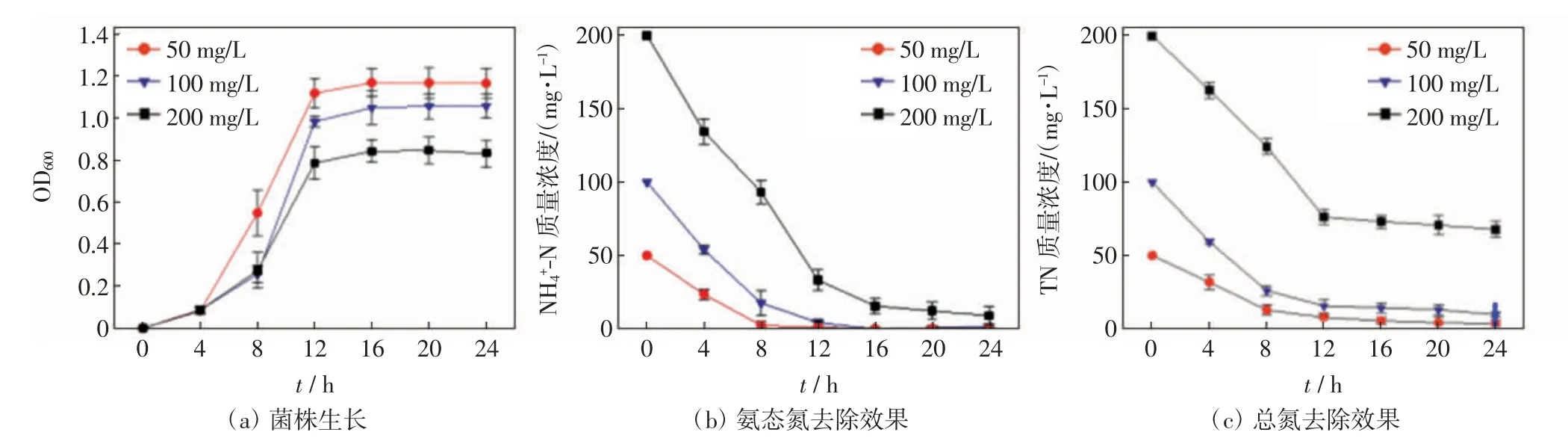
图3 不同氨氮负荷条件下菌株生长及其对氨态氮和总氮的去除效果Fig.3 Growth of strain and its removal of NH4+-N and TN under different initial NH4+-N concentrations
由图3(a)可知,初始氨态氮质量浓度为50 mg/L条件下,菌株生长状况最佳,培养4 h 后进入对数期,12 h 后进入稳定期;初始氨态氮质量浓度为100 mg/L和200 mg/L 条件下,菌株生长相对缓慢,培养8 h 后进入对数期,约12 h 后进入稳定期.由图3(b)可知,初始氨态氮质量浓度为50 mg/L 条件下,氨态氮去除效果最佳,在8 h 内大部分氨态氮已被去除,24 h 时的氨态氮去除率达98.77%;初始氨态氮质量浓度为100 mg/L 和200 mg/L 条件下,24 h 时的氨态氮去除率分别达98.10%和97.47%. 由图3(c)可知,初始氨态氮质量浓度为50、100 和200 mg/L 条件下,24 h 时的总氮去除率分别达95.81%、94.19%和71.54%.表2中的单因素方差分析结果表明,初始氨态氮质量浓度对菌株的生长和脱氮效果均有显著影响(P<0.05).
2.5 接种量对脱氮效果的影响
不同接种量条件下菌株的生长、对氨态氮和总氮的去除效果如图4 所示. 由图4(a)可知,接种量为5%条件下,培养初期菌株生长较为缓慢,12 h 后进入对数期,16 h 后进入稳定期,菌株稳定期时的OD600值最高;接种量为1%时,菌株的生长趋势与接种量为5%条件下大致相似;接种量为10%时,菌株生长迟缓期较短,生长率较高,4 h 后进入对数期,12 h 后进入稳定期,但菌株稳定期时的OD600值最低.由图4(b)可知,接种量为1%、5%和10%条件下,菌株24 h 时对氨态氮的去除率分别达到99.16%、99.75%和81.22%. 由图4(c)可知,接种量为1%、5%和10%条件下,菌株24 h 时对总氮的去除率分别达到75.53%、76.79%和64.46%.表2 中的单因素方差分析结果表明,接种量对菌株的生长和脱氮效果均有显著影响(P<0.05).
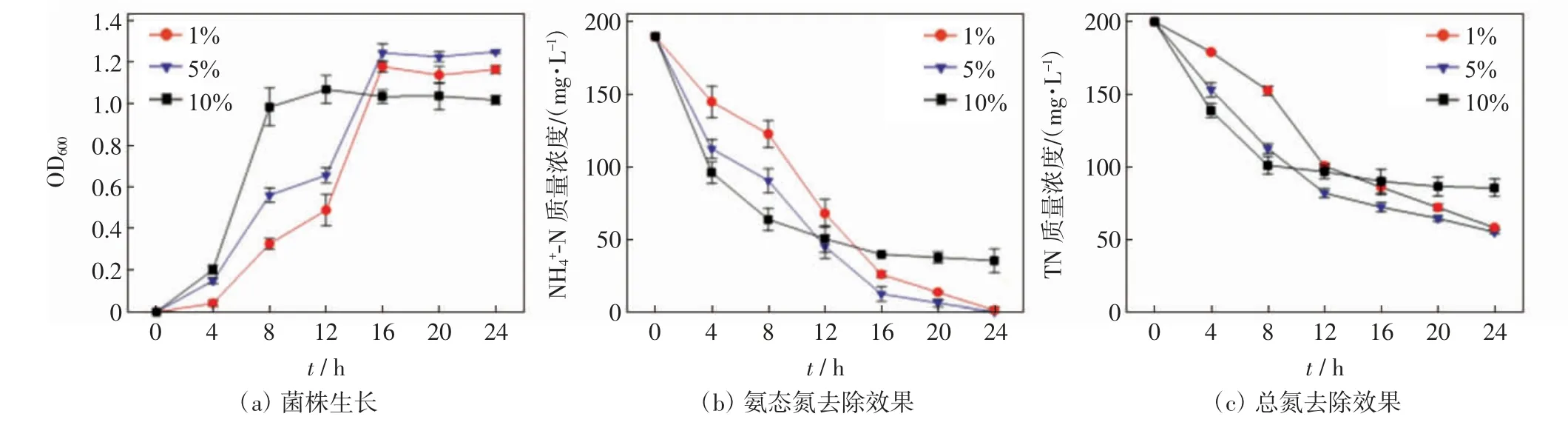
图4 不同接种量下菌株生长及其对氨态氮和总氮的去除效果Fig.4 Growth of strain and its removal of NH4+-N and TN under different inoculum amount
2.6 正交实验
正交实验结果如表3 所示. 由表3 可以看出,4个因素中温度的极差值(R)最大,为21.60;其次为碳源的R值,为12.45;再次为氮负荷的R值,为9.99;接种量的R最小,为2.98.由此可知,4个因素对该菌株总氮去除效果的影响由高到低的顺序为:温度>碳源>氨氮负荷>接种量.正交实验结果表明,获得最佳总氮去除率(91.41%)的条件为:碳源为蔗糖、温度为35 ℃、初始氨氮负荷为50 mg/L、接种量为5%.
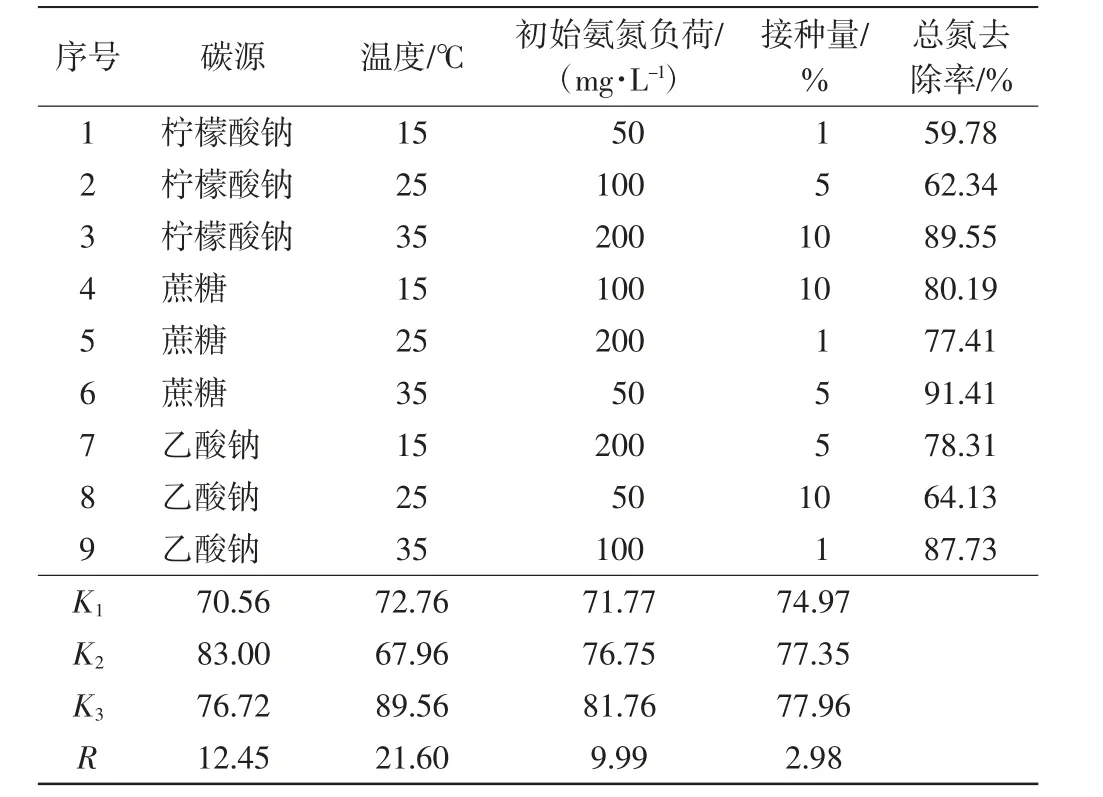
表3 正交实验结果Tab.3 Results of the orthogonal experiment
3 讨论与结论
本研究从天津滨海湿地土壤中分离到一株具有高效脱氮能力的异养硝化细菌,对其基因组DNA 的16S rRNA 片段进行PCR 扩增,结果表明该菌株属于肠杆菌属(Enterbacter),将其命名为Enterbactersp.WP5.研究碳源、温度、氨氮负荷和接种量对该菌株生长和脱氮特性的影响,结果发现,与柠檬酸钠和醋酸钠相比,以蔗糖为唯一碳源时,菌株Enterobactersp.WP5的生长状况、对氨态氮和总氮的去除效果均为最佳,这与余水静等[20]、陈猛等[21]对脱氮微生物最佳碳源的研究结果一致.碳源的主要作用是为微生物提供细胞生命活动所需的能量,以及作为硝化过程中的电子供体,且不同碳源由于分子结构差异,不同微生物对其利用程度也不同,进而会对硝化作用产生影响[22].另有一些研究也表明,脱氮微生物可利用其他碳源获得最佳脱氮性能,如白洁等[23]的研究表明,从禽畜粪便发酵沼液中分离获得的脱氮菌株Pseudomonassp.GK-01 以柠檬酸钠为最佳脱氮碳源;杜全能等[24]发现从养殖池塘污泥中分离得到的脱氮菌株Diutina rugosaDW-1 以乙酸钠为最佳脱氮碳源.
菌株Enterobactersp.WP5 的最适脱氮温度为35℃,在15~35 ℃范围内,相对较高的温度可提高该菌株的生长速率和脱氮效能.张峰峰等[25]研究了温度对从养殖池活性污泥中分离得到的异养硝化细菌菌株Pseudomonas alcaliphilaAD-28 氨态氮去除能力的影响,发现该菌株生长和去除氨态氮的最适温度为25~35 ℃.汪旭晖等[26]探究了温度对从SBR 活性污泥反应器中分离得到的异养硝化细菌菌株Pseudomonas putidaYH 氨态氮去除性能的影响,发现37 ℃条件下,此菌株氨态氮去除率达到最高值99.85%.本研究结果与这些研究较为相近.温度会显著影响微生物细胞膜的流动性和生物大分子的活性,从而影响微生物的新陈代谢过程,因此较低或过高的温度均不利于硝化细菌的生长,进而降低其硝化性能[27-28].
本研究发现,虽然较高的氨氮负荷会在一定程度上使菌株Enterobactersp.WP5 的脱氮性能有所降低,但在不同初始氨态氮质量浓度条件下,该菌株对氨态氮和总氮的去除率均保持较高的水平. 张多英等[29]从松花江水体中分离得到5 株脱氮菌株,发现初始氨态氮质量浓度高于45.94 mg/L 时,这些菌株对氨态氮的去除率随初始氨态氮质量浓度增加而降低.颜薇芝等[30]从污水处理池活性污泥中分离出脱氮菌株,发现在50~250 mg/L 浓度范围内,随着初始氨态氮质量浓度的提高,该菌株对氨态氮的去除效能逐渐降低.本研究结果与这些研究一致,均表明随初始氨态氮浓度的增加,硝化细菌的生长将受到一定程度的抑制,从而影响菌株去除氨态氮的能力.另一方面,本研究也表明菌株Enterobactersp.WP5 对初始氨态氮质量浓度水平具有较为宽泛的适应范围,可有效去除较高水平的氨态氮污染.
本研究中菌株Enterobactersp. WP5 的接种量为5%的条件下,氨态氮和总氮去除率最高.王田野等[31]从长期施用农家肥的土壤中筛选出一株脱氮菌株Acinetobactersp.SQ2,发现接种量为5%时此菌株对氨态氮去除率达到100%.刘淳等[32]从公园土壤中分离获得了一株异养硝化菌株Pseudomonas stutzeriHJ-7,发现接种量为5%时此菌株对氨态氮和总氮均有最佳的去除效能.本研究结果与这些研究相一致.本研究还发现,菌株接种量较低时,接种量的增加有利于菌群生长,从而促进氮污染的去除;但菌株接种量过高时,菌群生长反而受到一定程度的抑制,使氮去除率降低.因此,要获得较高的脱氮效能,菌株接种量应控制在适宜水平.
本研究中正交实验结果表明,各因素对菌株Enterobactersp.WP5 总氮去除效能的影响从大到小依次为:温度>碳源>氨氮负荷>接种量,在碳源为蔗糖、温度35 ℃、初始氨氮负荷为50 mg/L、接种量为5%的条件下,该菌株达到最佳总氮去除率91.41%.一些研究也探讨了不同脱氮菌株的最佳脱氮条件,如孙将等[33]从垃圾渗滤液处理厂的活性污泥中筛选得到一株脱氮菌株Paracoccus denitrificansZ53,通过正交实验得到其最佳脱氮条件为温度30 ℃、pH 值为7、装液量40 mL,各因素对其脱氮效能影响排序为:装液量>温度>pH值;李海红等[34]从活性污泥中分离筛选出一株脱氮菌株Paracoccus denitrificansTS-1,通过正交实验得到其最佳脱氮条件为接种量5%、温度为30 ℃、pH 值为8,各因素对其脱氮效能影响的顺序为:pH 值>温度>接种量.这些研究结果表明,不同脱氮菌株的最佳脱氮条件存在明显差异.因此,针对不同脱氮菌株研究其特定的最佳脱氮条件十分必要.本研究结果为异养硝化菌株Enterobactersp. WP5 在治理滨海湿地氮污染的实际应用中获得最佳脱氮效能提供了理论依据.
