GIK液对脑死亡猪供体心肌能量代谢的影响
2016-01-12
GIK液对脑死亡猪供体心肌能量代谢的影响
吴国俊1,杨绍军2
(1.川北医学院第二临床学院,南充市中心医院胸心外科,四川南充637000; 2.昆明医科大学第二附属医院胸心外科,云南昆明650101)
【摘要】目的:本研究旨在通过缓慢颅内加压法建立猪脑死亡模型并探讨GIK液干预治疗对猪脑死亡心脏供体的保护作用。方法: 12头健康版纳小耳猪随机分为2组(n =6),对照组(S组)和实验组(G组),检测两组血清钾、游离脂肪酸和乳酸、血糖和心肌能量代谢相关酶。结果:对照组和实验组在脑死亡后血糖急剧升高,脑死亡后与脑死亡前相比血糖有显著差异(P<0.05),脑死亡后实验组血糖略低于对照组,两组相比无显著差异(P>0.05)。血钾、乳酸脱氢酶(LDH)、Na+-K+-ATP酶实验组明显高于对照组,两组相比有显著差异(P<0.05)。游离脂肪酸在脑死亡后1 h两组相比有显著差异(P<0.05)。结论:应用改进的缓慢间断颅内加压法建立猪脑死亡模型,比较符合临床脑死亡的发展过程,经有效的呼吸和循环支持,脑死亡状态可稳定维持。GIK液能使猪脑死亡后血清乳酸和血钾升高,但不引起高钾血症,同时能抑制游离脂肪酸的释放。应用缓慢间断颅内加压法建立猪脑死亡模型能引起血糖显著升高,但GIK不会引起猪脑死亡后血糖升高。GIK使猪脑死亡后心肌组织糖酵解途径中的关键酶乳酸脱氢酶(LDH)的含量增多,Na+-K+-ATP酶活性增强。通过提高心肌能量代谢底物及相关酶的含量,并促进能量代谢产物的转化来改善心肌细胞能量代谢,增强心功能。
【关键词】脑死亡;心肌保护; GIK液;心肌能量代谢
心脏移植是治疗终末期心脏病最有效的措施[1],然而器官移植的最大障碍是供体器官的短缺,由于供体的缺乏,供体的保护显得尤为重要。脑死亡后机体发生一种严重的病理生理状态,对心脏的损害近年来备受关注。急性脑死亡后可引起供体血流动力学的剧烈改变以及循环中生化指标的紊乱并造成心肌形态学的损伤[2]。本实验采用缓慢间断颅内加压法建立版纳小耳猪的脑死亡模型,探讨脑死亡模型建立的方法,探索脑死亡模型建立过程给予GIK液干预性治疗以及脑死亡状态维持过程中的血液动力学、能量代谢底物、产物、相关酶变化的规律。
1 材料与方法
1.1实验动物及主要试剂、仪器
健康版纳小耳猪(25±5)kg,雌雄不限,12头,正常饮食,昆明医科大学动物实验中心提供。Porcine HK SLISA试剂盒、Pine LDH SLISA试剂盒、Porcine CACT SLISA试剂盒、Porcine ACS SLISA试剂盒、Porcine CS SLISA试剂盒(南京建成生物工程研究所)。简易呼吸机(江西特力TKR-200C动物呼吸机),420F生物机能实验系统(都泰盟科技有限公司)。
1.2实验分组及方法
1.2.1分组方法及脑死亡模型建立实验使用健康版纳小耳猪12头,(25±5)kg,雌雄不限,随机分为两组,对照组6头(S组),GIK液治疗组6头(G 组)。用3%戊巴比妥钠注射液(2~5 mg/kg)全身麻醉,气管切开及插管,接呼吸机辅助呼吸。颅骨矢状线外侧0.2~0.5 cm处钻一个直径约1 cm的孔,一根Foley20F气囊导尿管由此孔置入硬脑膜下腔内,缓慢向气囊导尿管内注入25~40 mL生理盐水,逐渐膨胀气囊,增加颅内压,建立脑死亡模型。
1.2.2脑死亡的判定方法目前,关于脑死亡的判定标准各国没有一个统一的标准,我们参考国内外相关文献[3-4],拟定本次实验采用的猪脑死亡判定标准是: (1)深昏迷:排除麻醉,低体温等可逆性昏迷的原因; (2)瞳孔:瞳孔中度或完全扩大,光反射全部消失; (3)角膜反射:角膜混浊,角膜反射消失; (4)呼吸:在脱离呼吸机的情况下无自主呼吸; (5)阿托品实验阴性:静脉注射阿托品l mg监测心率15 min无加快(心率增加20%~40%为阳性)。
1.2.3实验组干预方法和对照组处理方法实验组在脑死亡模型建立前30 min经深静脉给予25% GIK液治疗(1.5 mL/kg·h),脑死亡后给予0.9%生理盐水和多巴胺维持收缩压90 mmHg以上,MAP 为60 mmHg以上。对照组仅给予0.9%生理盐水和多巴胺维持收缩压90 mmHg以上,MAP为60 mm-Hg以上。两组实验过程中除采用GIK液干预外,其他都相同。
1.3观察指标
1.3.1能量代谢原料及产物测量脑死亡后-1 h、0 h、1 h、2 h、4 h、6 h、8 h、10 h监测微量血糖。建立脑死亡模型后0 h、1 h、5 h、10 h均采取静脉血6 mL,在室温下放置2 h,用离心机以3 000 r/min离心20 min,取上清液,检测游离脂肪酸、乳酸浓度。
1.3.2心肌能量代谢相关酶检测能量代谢在脑死亡模型维持10 h后,在心脏不停跳的情况下行正中开胸术取左心室心内膜下心肌组织,用4℃生理盐水冲洗干净,切成0.5 cm×1.0 cm大小的组织4块放入EP管中,存放于-80℃冰箱。待测心肌组织己糖激酶(HK)和乳酸脱氢酶(LDH)、肉碱脂酰转移酶(CACT)和脂酰辅酶A合成酶(ACS)、柠檬酸合成酶(CS)的含量,Na+-K+-ATP酶和Ca2 +-Mg2 +-ATP酶的活性。
1.4统计学分析
2 结果
2.1一般情况
通过缓慢颅内加压法建立猪脑死亡模型,12头猪术中手术成功率为100℅,术后10 h模型成活率83.3℅,建模过程中死亡2头,用于实验研究的版纳小耳猪有10头。1例因颈动脉导管脱落大量出血导致失血性休克而死亡,另1例在脑死亡模型建立后因无尿、频发室颤抢救无效死亡。
2.2血糖检测
通过缓慢颅内加压建立脑死亡模型,实验组和对照组在脑死亡时两组血糖均急剧升高,两组在脑死亡0 h、1 h、2 h、4 h、6 h、8 h、10 h血糖较脑死亡前1 h明显升高,脑死亡后的血糖与脑死亡前相比有显著差异(P<0.05)。见表1。
表1 对照组和实验组血糖变化(mmol/L,±s,n =5)
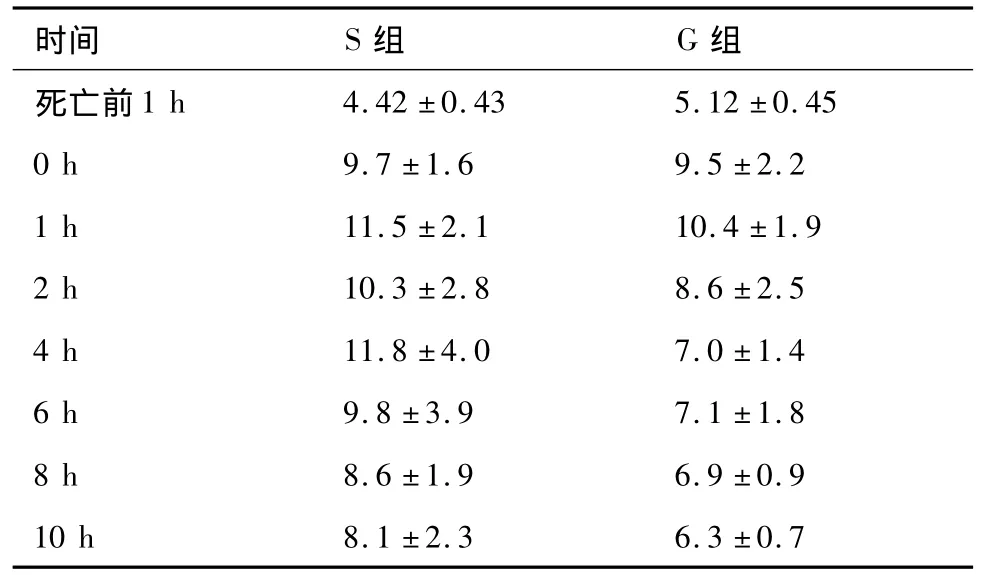
表1 对照组和实验组血糖变化(mmol/L,±s,n =5)
注: P<0.05,两组脑死亡前与脑死亡后相比有显著差异。
时间 S组 G组死亡前1 h 4.42±0.43 5.12±0.45 0 h 9.7±1.6 9.5±2.2 1 h 11.5±2.1 10.4±1.9 2 h 10.3±2.8 8.6±2.5 4 h 11.8±4.0 7.0±1.4 6 h 9.8±3.9 7.1±1.8 8 h 8.6±1.9 6.9±0.9 10 h 8.1±2.3 6.3±0.7
2.3乳酸检测
实验组(G)和对照组(S)在脑死亡0 h、1 h、5 h、10 h分别采血检测乳酸浓度,两组各时间点乳酸浓度相比,无明显差异,无统计学意义(P>0.05)。见表2。
表2 对照组和实验组乳酸变化(mmol/L,±s)

表2 对照组和实验组乳酸变化(mmol/L,±s)
时间 S组 G组0 h 1.92±0.36 2.15±0.09 1 h 1.96±0.12 2.28±0.34 5 h 2.14±0.24 2.35±0.26 10 h 2.24±1.25 2.43±0.34
2.4游离脂肪酸检测
在脑死亡0 h、1 h、5 h、10 h分别采血检测游离脂肪酸浓度,比较两组各时间点游离脂肪酸的差异。两组在脑死亡后1 h游离脂肪酸相比有显著差异(P<0.05),在0 h、5 h、10 h两组相比无显著差异(P>0.05),见表3。
表3 对照组和实验组游离脂肪酸变化(μmol/L,±s,n =5)
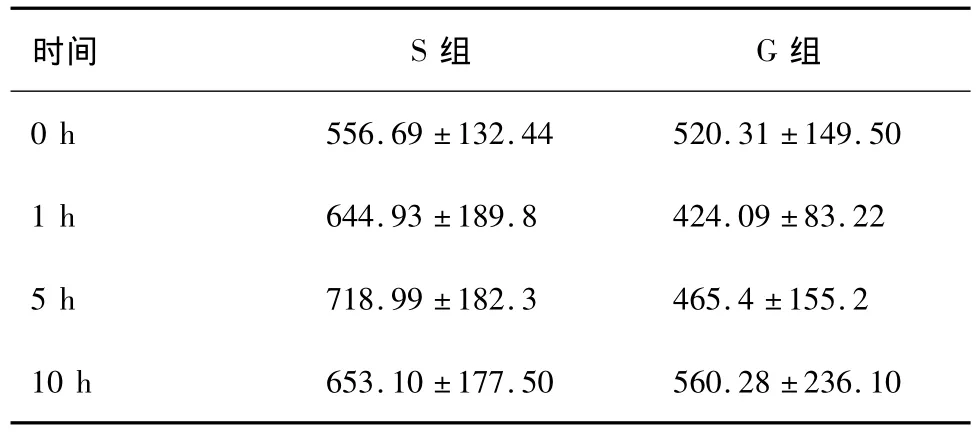
表3 对照组和实验组游离脂肪酸变化(μmol/L,±s,n =5)
P<0.05,与对照组相比有显著差异。
时间 S组 G组0 h 556.69±132.44 520.31±149.50 1 h 644.93±189.8 424.09±83.22 5 h 718.99±182.3 465.4±155.2 10 h 653.10±177.50 560.28±236.10
2.5心肌组织能量代谢酶检测
脑死亡后10 h在心脏不停跳下取左心室心肌组织,用ELISA(酶联免疫吸附剂测定)分析试剂盒检测酶的含量。LDH与对照组相比有显著差异(P<0.05)。见表4。
表4 对照组和实验组HK、LDH、CACT、ACS、CS变化(U/L,±s,n =5)
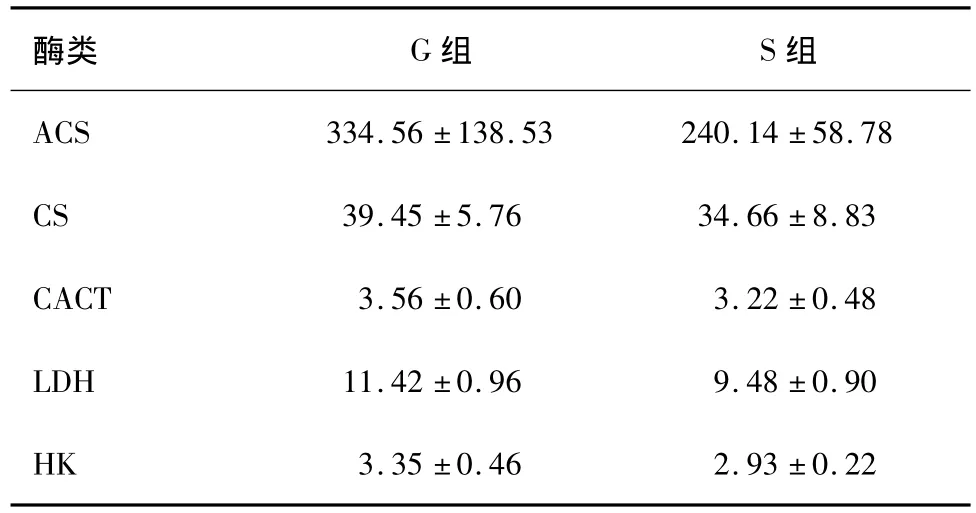
表4 对照组和实验组HK、LDH、CACT、ACS、CS变化(U/L,±s,n =5)
P<0.05,LDH与对照组相比有显著差异。
酶类 G组 S组ACS 334.56±138.53 240.14±58.78 CS 39.45±5.76 34.66±8.83 CACT 3.56±0.60 3.22±0.48 LDH 11.42±0.96 9.48±0.90 HK 3.35±0.46 2.93±0.22
2.6心肌组织Na+-K+-ATP酶和Ca2 +-Mg2 +-ATP酶检测
脑死亡后10 h在心脏不停跳下取左心室心肌组织,用生化法Na+-K+-ATP酶和Ca2 +-Mg2 +-ATP酶的活性,并行蛋白定量。Na+-K+-ATP酶与对照组相比酶活性明显升高,两组相比有显著差异(P<0.05)。Ca2 +-Mg2 +-ATP酶与对照组相比酶活性略升高,但两组相比无显著差异(P>0.05)。见表5。
表5 对照组实验组Na+-K+-ATP酶和Ca2 +-Mg2 +-ATP酶的变化(U/mgprot,±s,n =5)

表5 对照组实验组Na+-K+-ATP酶和Ca2 +-Mg2 +-ATP酶的变化(U/mgprot,±s,n =5)
P<0.05,Na+-K+-ATP酶与对照组相比有显著差异。
酶类 G组 S组Na+-K+-ATP酶1.63±0.51 0.99±0.16 Ca2 +-Mg2 +-ATP 1.91±0.26 1.76±0.50
2.7GIK液对脑死亡猪供体血钾的影响
实验组(G)和对照组(S)在脑死亡0 h、1 h、5 h、10 h分别采血检测血钾浓度,比较两组各时间点血钾浓度。脑死亡0 h、10 h两组血钾相比,实验组血钾浓度明显高于对照组,有显著差异(P<0.05)。见表6。
表6 对照组和实验组血钾变化(mmol/L,±s,n =5)

表6 对照组和实验组血钾变化(mmol/L,±s,n =5)
P<0.05,与对照组相比有显著差异。
时间 S组 G组0 h 2.28±0.31 3.01±0.22 1 h 2.53±0.34 2.87±0.43 5 h 2.41±0.37 3.04±0.52 10 h 2.48±0.31 3.15±0.28
3 讨论
脑死亡后机体发生一系列复杂的病理生理反应,严重影响供体心脏的功能。脑死亡后因交感神经系统的作用,导致大量儿茶酚胺释放入血液循环,“儿茶酚胺风暴”使收缩压、舒张压急剧升高。脑死亡后40~60 min,心脏收缩力从高血流动力学的峰尖降至明显低于正常水平以下,且实验过程中不会再恢复[5-7]。随后血压继续下降,心肌收缩力减退,心输出量减少,出现心力衰竭。脑死亡后抗尿激素减少[8],机体尿量增多伴随着血钾的丢失。钾是维持细胞膜静息电位的物质基础,静息膜电位主要决定于细胞膜对钾的通透性和膜内外钾浓度差。细胞外液钾明显降低时,膜对K+的通透性降低,K+随化学浓度差移向胞外的力受膜的阻挡,达到电化学平衡所需的电位差相应减小,即静息膜电位的绝对值减小,与阈电位的差距减小,心肌兴奋性升高,心率增快。给予GIK干预性治疗,可为细胞外液补充外源性K+。GIK液中的胰岛素刺激心肌细胞Na+-K+-ATP酶,促进心肌细胞摄取K+,从而稳定细胞膜的极化状态,减少心律失常的发生[9]。迷走神经末梢释放乙酰胆碱和窦房结细胞膜M受体结合,激活细胞膜K+通道,结果最大复极电位变得更负,窦房结的自律性降低,心率变慢[10]。因此,GIK能有效地减慢心率,减少心律失常的发生,改善心肌功能,增加心输出量。心力衰竭时心肌细胞出现血供和代谢需求之间的平衡打破,心肌出现一系列病理生理变化,包括高能磷酸盐合成减少、能量代谢关键酶的活性降低、线粒体数目和功能的改变等[11-12]。心肌能量代谢作为心力衰竭的一种新思路新策略,对心衰的常规用药及疗法进行能量代谢角度分析。通过调节异常的心肌能量代谢过程,辅助心衰的治疗,有望改善衰竭心肌的功能。心肌利用产生能量的物质有脂肪酸、糖、乳酸、氨基酸和酮体等,在正常成年人主要产能物质是脂肪酸,约占2/3,另1/3来自糖、乳酸、氨基酸和酮体[13]。脑死亡后随着心功能逐渐下降,心输出量减少,心肌缺血缺氧,心脏处于“能量饥饿状态”[14]。心力衰竭时心肌脂肪酸氧化减少、葡萄糖利用增加[15],这种能量代谢的改变是心肌的自我保护机制。脂肪酸利用减少,脂质在心脏沉积并造成脂毒性心脏异常[16],糖酵解代谢增强,乳酸产生增多造成酸中毒,心功能继之恶化,因此改善心肌能量代谢显得尤为重要。为了探索脑死亡后给予GIK干预治疗,来探讨心肌组织中能量代谢变化,本实验检测了猪脑死亡后左心室组织中能量代谢关键酶LDH、HK、ACS、CACT、CS含量的变化。GIK可促进心肌细胞糖酵解[17],糖酵解代谢增强可使乳酸产生增多造成酸中毒[18]。乳酸脱氢酶(LDH)使乳酸变为丙酮酸而进入柠檬酸循环提供能源,它的活性的强弱可以反应心肌细胞有氧代谢功能的强弱[19]。本实验检测乳酸脱氢酶(LDH)含量实验组高于对照组,两组相比有显著差异(P<0.05)。这说明LDH可将糖酵解产生一部乳酸转化为丙酮酸,可以避免乳酸越堆越多。由检测结果可以看出实验组的乳酸略多于对照组,但两组相比无显著差异(P>0.05)。脑死亡后机体释放大量的儿茶酚胺,儿茶酚胺可升高血浆游离脂肪酸(plasma free fatty acid,FFA),大量的FFA会对缺血心肌生产毒性作用,加重心肌功能障碍[20]。GIK液中的胰岛素既可促进细胞摄取和利用葡萄糖,又可降低血中FFA水平,GIK液给缺血心肌提供能量[21]。本实验检测血浆游离脂肪酸(FFA)显示,在脑死亡后1 h实验组的FFA明显少于对照组,两组相比有显著差异(P<0.05)。GIK液中胰岛素既可降低血液循环中的FFA水平,还可抑制缺血心肌细胞摄取和利用FFA,从而使缺血心肌免受FFA的细胞毒效应[22]。同时GIK中的胰岛素促进缺血心肌的功能恢复,在缺少胰岛素的情况下可加重泵功能的损害[23]。本实验检测在脑死亡前实验组和对照组的血糖分别是(5.12±0.45)mmol/L和(4.42±0.43)mmol/L,当行颅内加压脑死亡,血糖急剧升高。对照组脑死亡后各个时间点的血糖在(8.1±2.3)mmol/L~(11.8 ±4.0)mmol/L之间,实验组脑死亡后各个时间点的血糖在(6.3±0.7)mmol/L~(10.4±1.9)mmol/L之间,两组脑死亡后的血糖与脑死亡前相比有显著差异(P<0.05)。实验组脑死亡后各个时间点的血糖均低于对照组,脑死亡后4 h的血糖实验组明显低于对照组,两组相比有显著差异。本课题结果显示,给予GIK液干预治疗,给心肌细胞能量代谢提供糖原,而不会引起高血糖发生。
GIK治疗简易、廉价、无特殊禁忌证、容易广泛推广,其促进缺血心肌细胞摄取和利用葡萄糖,减少FFA的释放,提高心肌细胞相关酶的含量,能减慢心率,减少心律失常的发生,改善心肌功能,增加心输出量。GIK液的主要成分胰岛素是一种多项功能药物,在临床上应用较为广泛,价格便宜。所以,深入探讨GIK液在心力衰竭治疗中的保护作用,将其发展改善,可以进一步拓展心脏疾病方面的治疗领域。
参考文献
[1]Cancen C,Chanda J.Hearn transplantation[J].Ann Thorac Siog,2001,72(7):658-660.
[2]Palac RT,Sumner G,Laird R,et al.Reversible myocardial dysfunction after traumatic brain injury: mechanisms and implications for heart transplantation[J].Prog Transplant,2003,13(1):42-46.
[3]Kasama T,Miwa Y,Isozaki T,et al.Neutrophil-derived cytokines: potential therapeutic targets in inflame mation[J].Curr Drug Targets Infamm Allergy,2005,4(3):273-279.
[4]卫生部脑死亡判定标准起草小组.成人脑死亡判定标准(2009 版)[J].疑难病杂志,2009,8(5):271.
[5]Szabo G,Hackert T,Sebening C,et al.Role of neural and humoral factors in hyperdynamic reaction and cardiac dysfunction following brain death[J].J Heart Lung Transplant,2000,19 (7): 683-693.
[6]Chiari P,Hadour G,Michel P,et al.Biphasic response after brain death induction: prominent part of catecholamines release in this phenomenon[J].J Heart Lung Transplant,2000,19(7): 675-682.
[7]Zhai W,Feng R,Huo L,et al.Mechanism of the protective effects of N-acetylcysteine on the heart of brain-dead Ba-Ma miniature pigs[J].J Heart Lung Transplant,2009,28(9):944-949.
[8]Ranasinghe AM,Bonser RS.Endocrine changes in brain death and transplantation[J].Best Pract Res Clin Endocrinol Metab,2011,25(5):799-812.
[9]Broombead CJ,Colvin MP.Glucose,insulin,and the cardiovascular system[J].Heart,2001,85:495-496.
[10]Turel B,Gemici K,Baran I,et al.Effects of glucose-insulin-Potassium solution added to reperfusion treatment in acute Myocardial infarction[J].Anadolu Kardiyol Derg,2005,5(2):90-94.
[11]Kodde IF,Vander Stok J,Somolensi RT,et al.Metabolic and genetic regulation of cardic energy substrate preference[J].Comp Biochem physiol A Mol Inter Physiol,2007,146(1):26-36.
[12]Kotala VK,Khan M,Angelos MG,et al.Role of oxygen in postischemic injury[J].Antioxid Rodox Signal,2007(8):1193-1206.
[13]夏纪筑,罗兴林.心肌能量学研究进展[J].医学综述,2004,10(6):341-343.
[14]Neubauer S.The failing heart an engine out of fuel[J].New Eng J Med,2007,356 (11):1140-1151.
[15]Van BM,van NFA,der Vusser GJ.Metabplic remodeling of the falling heart: beneficial or detrimental?[J].Cardiovasc Res,2009,81(3):420-427.
[16]Sharma S,Adrogue JV,Golfman L,et al.Intramyocardial lipid accumulation in the failing human heart resembles the lipotoxic rat heart[J].FASEB J,2004,18(14):1692-1700.
[17]Mukherjee A,Smitherman TC,Robinson JB Jr,et al.Studies on human heart citrate synthase[J].Adv Myocardiol,1980,1: 329-337.
[19]吴洪海,谢虹,苏庆,等.实验性心肌损伤对大鼠房室束LDH、SDH的影响[J].实用临床医药杂志,2004,8(2):54-59.
[20]Guo WZ,Ji H,Yan ZH,et al.Lovastatin changes activities of lactate dehydrogenase A and B genes in rat myocardial cells[J].Chin Med J (Engl),2011,124(3):423-428.
[21]Doenst T,Richwine RT,Bray MS,et al.Insulin improves function and metabolic recovery of reperfused working rat heart[J].Ann Thorac Surg,1999,67:1682-1688.
[22]Gal J,Smith A,Riedel B,et al.Prservation and protection of myocardial function[J].J Cardiothor Vasc Anesth,2000,14 (3 suppl 1):22-36.
[23]Goa F,Chen J,Lopez BL,et al.Comparison of bisoprolol and Carvedilol cardioproteection in rabbit ischemia and reperfusion model[J].Eur J Pharmacol,2000,406(1):109-116.
(学术编辑:付茂勇)
Effects of GIK on myocardial energy metabolisma donor heart with the brain dead pig
WU Guo-jun1,YANG Shao-jun2
(1.Department of Thoracic and Cardiovascular Surgery,Nanchong Central Hospital,The Second Clinical School of North Sichuan Medical College,Nanchong 637000,Sichuan; 2.Department of Thoracic and Cardiovascular Surgery,The Second Affiliated Hospital of Kunming Medical College,Kunming 650101,Yunnan,China)
【Abstract】Objective: To aim to establish the pig brain deadth model used slowly increasing intracranial pressure which was and investigate GIK intervention the protective effects on pig brain death donor heart.Methods: 12 healthy Xishuangbanna Miniature pigs were randomly divided into two groups including the control group (group S,n =6)and the experimental group (group G,n =6).Serum potassium,free fatty acids,lactic acid,blood sugar and key enzyme of myocardial energy metabolism were detected.Results: Blood sugar was remarkably increased between control group and experimental group after brain death.Blood glucose was significant difference between before and after brain death (P<0.05).Blood glucose in the experimental group was slightly lower than that in control group after brain death,which was no significant difference between two groups (P>0.05).Potassium,lactate dehydrogenase (LDH)and Na+-K+-ATP enzyme in the experimental group were significantly higher compared with the control group (P<0.05).Free fatty acids were significantly different difference in the two groups after brain death 1 h (P<0.05).Conclusion: The pig brain death model established by slowly improved intermittent intracranial pressure is more in line with the development of clinical brain death and brain death can be stably maintained through effective respiratory and circulatory support.GIK solution enables increased serumbook=345,ebook=78lactate and potassium,but does not cause hyperkalemia,and can inhibit the release of free fatty acids after,pig brain death.Blood sugar is increased in the pig brain death model used slowly increased intermittent intracranial pressure but GIK does not cause blood sugar after pig brain death.GIK can increase the level of key enzyme lactate dehydrogenase (LDH)and the activity of Na+-k+atpase in the glycolytic pathway of myocardial tissue after pig brain death.It is feasible to improve myocardial energy metabolism and enhance cardiac function by increasing the level of myocardial energy metabolism and related enzyme substrates and promoting the transformation of energy metabolites.
【Key words】Brain dead; Myocardial protection; Glucose-insulin-potassium solution; Myocardial energy metabolism.
通讯作者:杨绍军,E-mail: yangsj8@Hotmail.com
作者简介:吴国俊(1973-),男,四川南充人,主治医师,主要从事胸心血管外科。
基金项目:云南省卫生科技基金资助项目((2009NS076)
收稿日期:2014-10-27
doi:10.3969/j.issn.1005-3697.2015.03.17
【文章编号】1005-3697(2015)03-0344-05
【中图分类号】R337
【文献标志码】A
网络出版时间: 2015-6-19 17∶39网络出版地址: http://www.cnki.net/kcms/detail/51.1254.R.20150619.1739.014.html
