促红细胞生成素原核表达载体构建分离纯化
2016-01-11马丽婷,高秀峰,王胤吉等
促红细胞生成素原核表达载体构建分离纯化*
马丽婷1高秀峰1王胤吉1潘佳欣1赵佳皓1阳文龙2李永生3
(1.四川大学华西基础医学与法医学院;2.四川大学临床医学院; 3.四川大学化学工程学院, 四川 成都 610041)
【摘要】目的构建和表达人源性促红细胞生成素(EPO),为促红细胞生成素发挥功能与结构差异研究做准备。方法通过NCBI查找人源性促红细胞生成素全基因序列并合成,构建原核表达载体pTWIN1-rhEPO,转化至大肠杆菌BL21(DE3),获得高效表达重组转化子菌株。结果成功构建人源性促红细胞生成素原核表达载体,经酶切和DNA序列测序分析,结果表明该基因序列与合成序列完全相同。终浓度0.5mmol/L ITPG诱导表达,SDS-PAGE电泳分析,4小时时蛋白表达量最高。结论构建和表达重组载体pTWIN1-rhEPO,分离纯化出目的蛋白,为进一步研究促红细胞生成素组织修复功能及突变体相关功能研究奠定基础。
【关键词】促红细胞生成素; 表达载体构建; 原核表达; 分离纯化
【中图分类号】R 331.1+4【文献标志码】A
基金项目:国家基础科学人才培养基金(J1103604)
通讯作者:高秀峰 教授 博士生导师 邮箱:Xiufengg@163.com
收稿日期:( 2015-01-07; 编辑: 张文秀)
Vector construction, expression and purification of erythropoietinMA Liting1, GAO Xiufeng1, WANG Yinji1,etal
(1.DepartmentofBiochemistryandMolecularBiology,WestChinaSchoolofPreclinicalandForensic
Medicine,SichuanUniversity,Chengdu610041,China;
2.WestChinaSchoolofMedicine,SichuanUniversity,Chengdu610041,China;
3.SchoolofChemicalEngineering,SichuanUniversity,Chengdu610041,China)
Abstract【】ObjectiveTo construct and express the human-derived erythropoietin in order to study the differences in structure and function for the further research. MethodsThe rhEPO sequence was identified through NCBI and was synthesized, constructed Prokaryotic expression vector pTWIN1-rhEPO, transformed into E. coli BL21 (DE3), to obtain efficient expression of recombinant transformant strains respectively. ResultsSuccessfully constructed human-derived erythropoietin prokaryotic expression vector, as a result of digestion and DNA sequencing analysis showed that the gene sequence was identical with the synthetic sequence. The final concentration of 0.5mmol/L IPTG was used to induce protein expression, SDS-PAGE electrophoresis analysis, protein expression was highest at 4h. ConclusionConstructed and expressed the Prokaryotic expression vector pTWIN1-rhEPO, utilized chitin affinity chromatography to separate and purify of rhEPO, for further study of erythropoietin tissue repair functions and the mutants’ related functions do research foundation.
【Key words】Erythropoietin; Expression vector construction; Prokaryotic expression; Separation and purification

促红细胞生成素(Erythropoietin, EPO)是细胞因子家族的成员之一,是糖蛋白类激素。主要功能是刺激骨髓的红系祖细胞分裂、分化为成熟的红细胞[1]。EPO受体(Erythropoietin Receptor, EPOR)不仅分布在骨髓造血系统,还广泛分布在非造血组织[2]。近年发现其还具有抗神经细胞凋亡、血管的再生和创面再生等效应[3],特别是在脑损伤的神经保护中起重要作用,已成为研究热点之一。但是,将EPO用于临床组织损伤治疗,会带来血液粘稠、血栓形成、高血压等副作用。因此,近年也有氨甲酰化EPO、EPO定点突变、EPO模拟肽等无促红细胞生成作用的EPO衍生物的相关报道[4]。本研究拟利用定点突变技术改造rhEPO构建其突变体,希望表达的重组蛋白能够对促红细胞生成素受体的亲和力下降,对神经组织表面的异源βcR的亲和力增强,达到对神经组织修复和保护作用的同时减少因红细胞生成过多导致的血液粘稠、血栓形成等副作用,为心、脑血管、组织损伤的治疗,以及药物的开发提供实验依据。此阶段的研究是构建EPO原核表达载体,筛选工程菌;并对表达EPO进行分离纯化,为进一步的突变和功能研究提供依据。
1材料与方法
1.1材料
1.1.1rhEPO基因、菌株及载体rhEPO全基因由北京三博远志生物技术有限责任公司合成,目的片段连接在pBLUE克隆载体上;DH5α购于全式金科技(北京)有限公司,E.coli BL21(DE3)由本实验室保存;原核表达载体p-TWIN1购于成都金线科技有限生物公司。
1.1.2试剂质粒小量抽取试剂盒和琼脂糖回收试剂盒由Axygen生物技术公司生产;酵母提取物和胰蛋白胨由OXOID公司生产;IPTG由生工生物工程有限公司进口分装;trans 2K plus II DNA Marker、PrimeStars DNA聚合酶由宝生物工程有限公司生产;T4 DNA连接酶、NcoI、BamHI限制性内切酶由Thermo Fisher科技公司生产;几丁质亲和层析柱购于NEB公司;其他试剂均为分析纯。
1.2方法
1.2.1质粒DNA小量提取根据《质粒小量抽取试剂盒说明书》进行操作。
1.2.2rhEPO基因与原核表达载体pTWIN1连接与转化将提取的质粒在37℃水浴下,NcoI和BamHI双酶切过夜。经1%琼脂糖电泳,胶回收目的片段rhEPO和pTWIN1大片段,经22℃水浴下,T4连接酶,连接1小时,转化至感受态DH5α,涂平板,37℃过夜培养,挑取阳性单菌落活化,提取重组质粒,进行双酶切及测序鉴定。
1.2.3重组质粒转入表达菌诱导表达从克隆菌中提取出重组质粒,转入感受态BL21(DE3),将工程菌菌落于液体LB中,37℃过夜培养后,接种到新LB培养基中生长3h,0.5mmol/LIPTG诱导下表达4h。离心收集沉淀,重悬于高纯水,超声破粹,离心收集上清获得粗蛋白液,SDS-PAGE电泳分析表达产物。
1.2.4重组蛋白rh-epo分离纯化。将工程菌接种于250mlLB培养基中,37℃培养至OD值约为0.5,加入0.5mmol/L IPTG,37℃诱导表达4h,4℃离心收集菌体,加入10ml细胞裂解液B1(20mM Tris-Hcl,1mM EDTA,50mM Nacl,PH为8.5)重悬菌体,冰浴超声破菌。破菌后菌液以12000g离心30分钟,取上清,流速为0.5~1ml/min上样于经过B1平衡后的几丁质柱,收集穿出液;再用20倍柱体积B1裂解液平衡洗去未结合杂蛋白,快速加入诱导自剪切缓冲液B2(20mM Tris-Hcl,1mM EDTA,50mM Nacl,pH为5.5),在室温条件下诱导自剪切过夜。过夜后用B1缓冲液洗脱目的蛋白,经SDS-PAGE鉴定。
2结果
2.1p-BLUE-rhEPO和pTWIN大片段基因纯化p-BLUE-rhEPO和pTWIN大片段基因纯化琼脂糖凝胶电泳图谱,见图1。
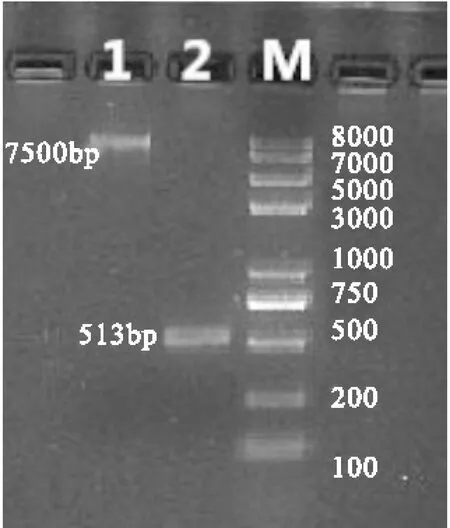
图1p-BLUE-rhEPO和pTWIN大片段基因纯化
Fig.1Purification of E.coil DH5α-pBLUE-rhEPO and E.coil DH5α-pTWIN1 gene segments
注:M:DNA Ladder; 1.pTWIN1基因片段;2.rh-EPO和pBULE-rhEPO基因片段
2.2重组pTWIN1-rhEPO的构建将上述纯化并获得的基因大片段利用T4连接酶连接转化到感受态DH5α,提取重组质粒,双酶切和测序鉴定。见图2双酶切琼脂糖凝胶电泳图谱。
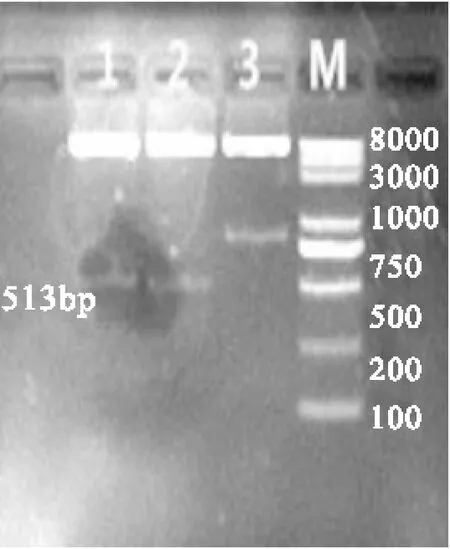
图2E.coil DH5α-pTWIN1-rhEPO 重组子 酶切鉴定
Fig.2Verification of positive clone with E.coli DH5α-pTWIN1-rhEPO by RE digestion
注:M:DNA Ladder; 1、2:E.col; DH5α-PTWIN1-rhEPO阳性克隆双酶切,3:E.coli DH5α-pTWINI阳性克隆双酶切
2.3含有pTWIN1-rhEPO质粒表达菌的构建将经鉴定成功的重组质粒pTWIN1-rhEPO 转化到E.coil BL21(DE3)感受态细胞,提取重组质粒DNA,双酶切鉴定,结果如图3所示,该菌为表达菌重组子。
2.4rhEPO重组蛋白表达在37℃,120rpm转速的摇床下,用250ml三角瓶装有50ml LB液体培养基接种500μl过夜扩0.5mmol/L IPTG诱导培养5h,使细

图3pTwin1-rhEPO重组子双酶切鉴定
Fig.3Verification of pTwin1-rhEPO by RE digestion.
注:M:DNA Ladder; 1、2:pTWINI-rhEPO双酶切
菌产生重组蛋白。实验结果如图4所示,生长时间为4h时,蛋白表达量最大。培养菌液,设定生长培养时间为1h、2h、3h、4h、5h,然后加入终浓度为加入终浓度为0.5mmol/L IPTG,37℃,120rpm转速下诱导5h,使细菌产生重组蛋白。实验结果如图4所示,可知其最适表达蛋白条件为当细胞生长OD600=0.5~0.7时,加入终浓度为0.5mmol/L IPTG,37℃,120rpm转速, 最适生长时间为4h时,蛋白表达量最大。
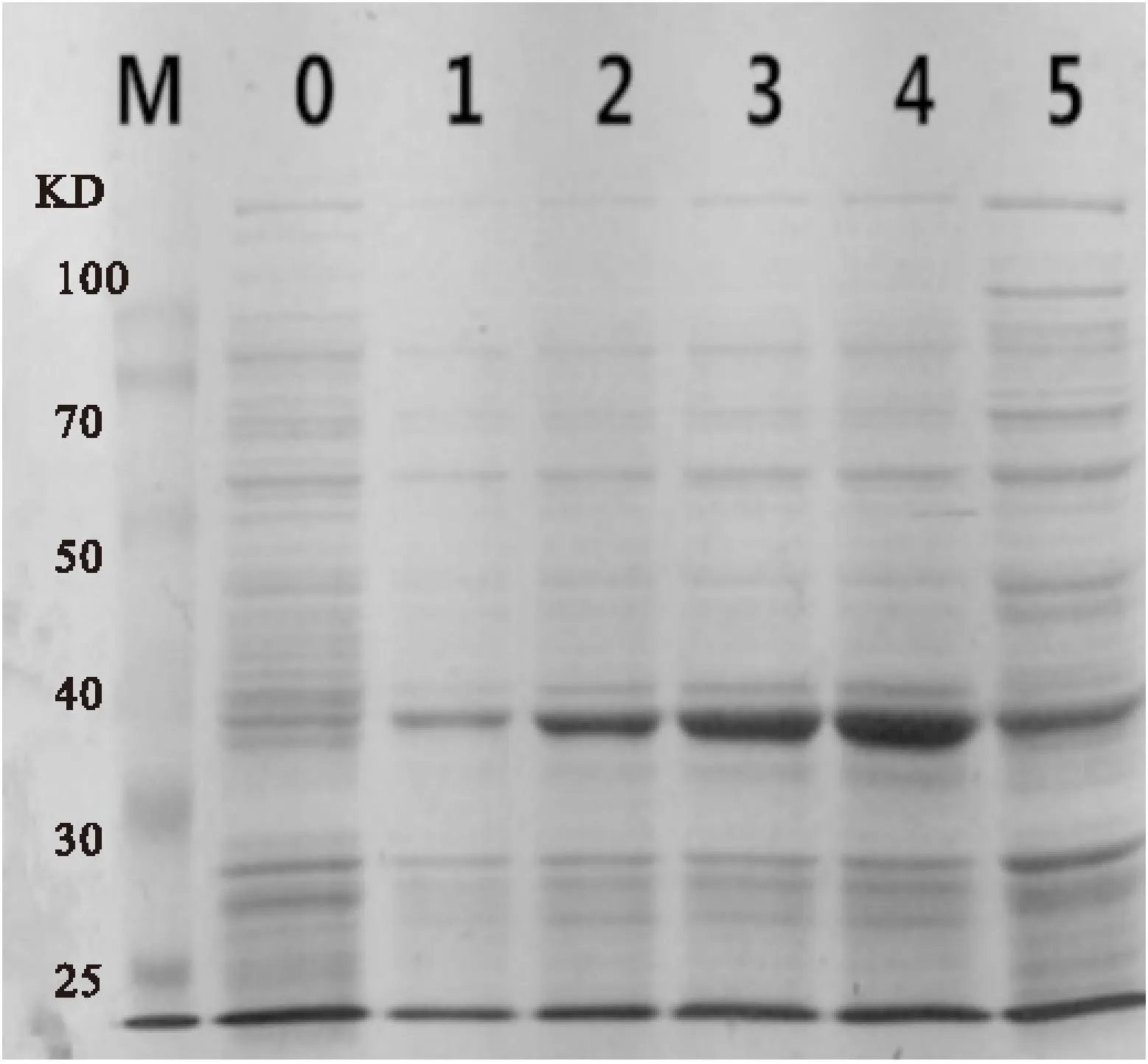
图4E.coliBL21(DE3)-pTWIN1-rhEPO表达产物的SDS-PAGE分析
Fig.4SDS-PAGE analysis of the recombinant protein produced by E.coli BL21(DE3)-pTWIN1-rhEPO
注:M:蛋白标记;0:E.col BL21(OE3)蛋白表达;1-5:1、2、3、4、5小时蛋白表达
2.5重组蛋白rhEPO初步分离纯化原核表达载体pTWIN1-rhEPO表达的融合蛋白含有的几丁质结合域 (chitin-binding domain,CBD)和内含肽1(intein1)。CBD可与几丁质亲和层析柱特异性结合,intein1在pH为5.5,室温条件下,对rhEPO的N末端发生自剪切,目的蛋白rhEPO与CBD-intein1蛋白脱离,rhEPO游离于平衡液中,得到纯化的rhEPO分子量约为18KD(见图5),与理论推导的分子量18Kd相符。
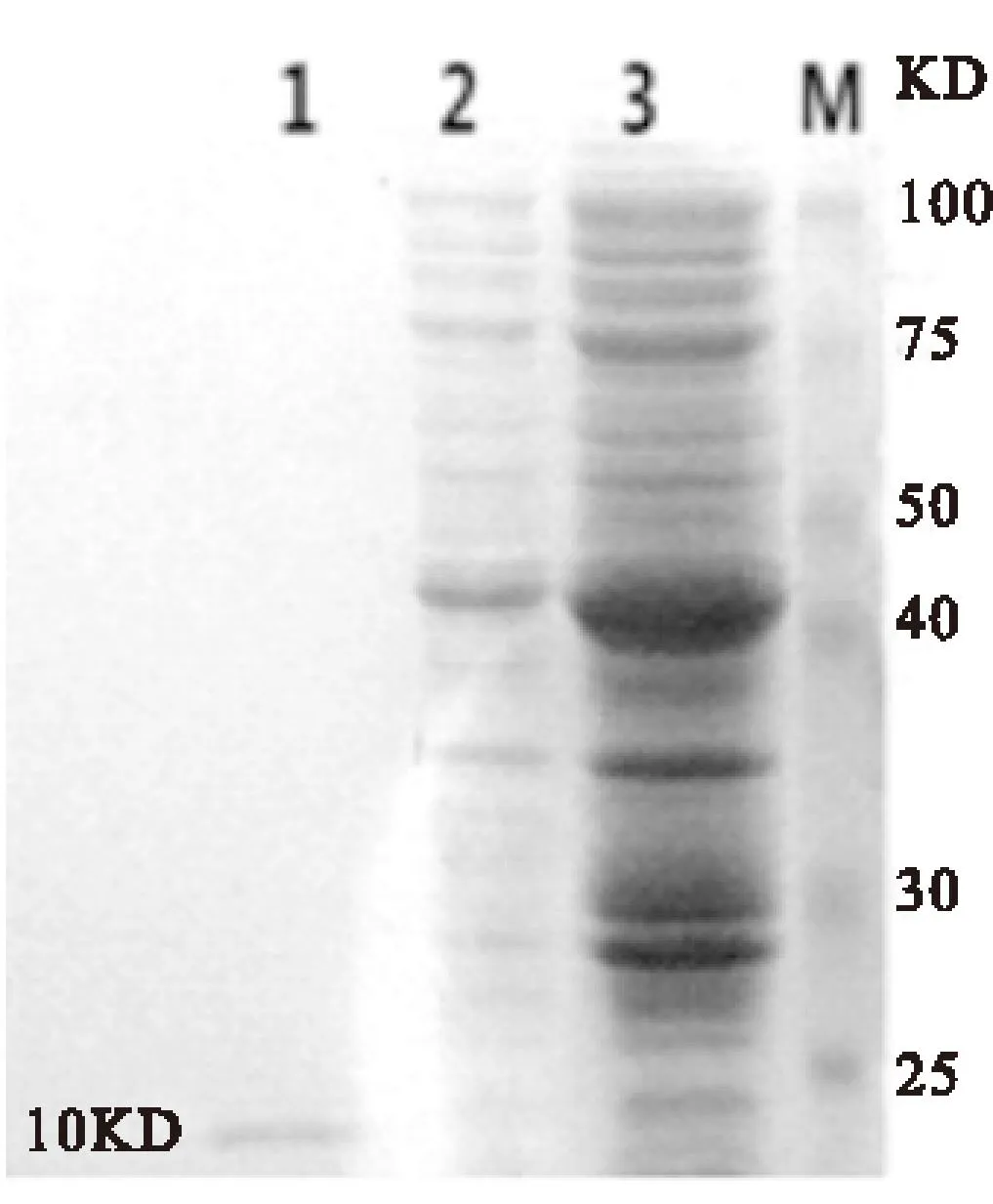
图5纯化的rhEPO的SDS-PAGE分析
Fig.5SDS-PAGE of rhEPO. M: protein marker;
注:rhEPO纯化色谱;2:E.coliBL21蛋白表达;3:IPTG蛋白表达
3讨论
促红细胞生成素是一种含唾液酸的糖蛋白,由一条多肽链,166个氨基酸残基组成,含有两个二硫键,形成4个稳定的α-螺旋结构,分子量为18 kD,约30%~40%是糖基,其主要是甘露糖、岩藻糖和唾液酸等,它们在维持EPO分子活性、防止EPO失活等方面具有重要作用。人EPOR是由484个氨基酸残基组成的Ⅰ型跨膜糖蛋白,它是细胞超家族和生长因子受体中的一员,其结构分为三部分:跨膜区、胞外区和胞内区,高度保守的近膜区WSXSW结构是胞内信号分子结合位点的必须组成部分,起到与EPO特异结合并激活一系列信号通路的作用[4]。EPO诱导的红祖系细胞和前体细胞的胞内信号通路的调节是通过同源二聚体EPOR实现[5,6]。EPO与EPOR结合后,EPOR形成二聚体,偶联酪氨酸激酶(Janus tyrosine kinase-2, JAK2),激活JAK2、信号转导子、转录激活子(signal transducer and activator of transcription-5,STAT5)、促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)和核因子κB,启动下游一系列因子,包括释放各种细胞因子,调节红细胞增埴、分化等[7]。肾脏及其他器官中存在β-common receptor(βcR, CD131),系GM-CSF、IL-3 和IL-5 的受体共同亚单位,能与EPOR形成异源二聚体,发挥抑制细胞凋亡和组织保护作用,但不启动造血信号的转导[8]。EPO有4个α螺旋(A-D),根据EPO与EPOR结合后的晶体结构,在C螺旋上,有6个位点Lys97、Ser100、Arg103、Ser104、Thr107、Leu108是与EPOR主要结合的位点[9,10],EPO氨基序列(1-17)、内部(99-109)羧基末端(147-151),及上述提及的几个位点在发挥促红作用时至关重要;国内外目前的主要研究是将以上重要位点进行氨甲酰化修饰、去唾液酸化[11,12]及定点突变,发现氨甲酰化的EPO无促红作用而具有组织保护修复作用,其具体作用机制尚不清楚。
4结论
本研究通过构建原核表达载体pTWIN1-EPO,转化表达菌BL21(DE3)利用0.5mmol/L IPTG诱导EPO表达,并成功利用几丁质亲和层析分离纯化出该蛋白,在此基础上将要构建促红细胞生成素突变载体并表达,为进一步研究EPO组织修复功能及突变体相关功能奠定了基础。
【参考文献】
[1]Rizzo JD,M Brouwers,P.Hurley,etal.American Society of Hematology and the American Society of Clinical Oncology Practice Guideline Update Committee[J].American Society of Hematology/American Society of Clinical Oncology clinical practice guideline update on the use of epoetin and darbepoetin in adult patients with cancer[J]. Blood, 2010, 116: 4045-4059.
[2]张胜叶,黄晏,张锦,等.内源性促红细胞生成素在急性心肌梗死介入前后的动态变化及心肌保护作用和抗炎作用.[J].实用医学杂志, 2011, 27(17):3124-3127.
[3]钟顺平,李景铧,李前进. 促红细胞生成素对难愈创面患者康复的影响.[J].西部医学,2014, 26(10): 1354-1356.
[4]Mammis A, McIntosh TK, Maniker AH,etal. Erythropoietin as a neuroprotective agent in traumatic brain injury[J]. Surg Neurol, 2009, 71(5): 527-531.
[5]齐帅,宋鹏飞.血清促红细胞生成素与急性心肌梗死的关系研究.[J].西部医学,2012, 24(12): 2327-2328.
[6]Yoshmiura A, Zmimers T, Neumann D,etal. Mutations in the Trp-Ser-X-Trp-Ser motif of the erythropoietin receptor abolish processing, ligand binding, and activation of the receptor[J]. Biol Chem, 1992, 267(16): 11619-11625.
[7]Szenajch J, G. Wcislo JY, Jeong C,etal.The role of erythropoietin and its receptor in growth, survival and therapeutic response of human tumor cells From clinic to bench- a critical review[J]. Biochim. Biophys, 2010, 1806: 82-85.
[8]Wojchowski DM,P. Sathyanarayana, and A.Dev,etal.Erythropoietin receptor response circuits[J]. Curr. Opin. Hematol, 2010, 17(3): 169-176.
[9]王锋,柴璐,范亚平,等.促红细胞生成素衍生肽治疗顺铂所致急性肾损伤的使用方法探讨.[J].实用医学杂志,2013, 29(17): 2781-2783.
[10] Gan Y. Mutant erythropoietin without erythropoietic activity is neuroprotective against ischemic brain injury[J]. Stroke, 2012, 43(11): p. 3071-3077.
[11] Leist M, Ghezzi P,Grasso G,etal. Derivatives of erythropoietin that are tissue protective but not erythropoietic[J]. Science, 2004, 305(5681): 239-242.
[12] Erbayraktar S,Grasso G,Sfacteria A,etal. Asialoerythropoietin is a nonerythropoietic cytokine withbroad neuroprotective activity in vivo[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(11): 6741-6746.

