革兰阳性球菌对利奈唑胺耐药机制的研究*
2016-01-11许宏涛陈东科赖惠英北京医院检验科国家老年医学研究中心北京100730
许宏涛,陈东科,赖惠英(北京医院检验科 国家老年医学研究中心,北京 100730)
利奈唑胺(linezolid,LZD)是一种新型恶唑烷酮类抗生素,2000年在美国上市,主要应用于万古霉素耐药肠球菌(VRE)、甲氧西林耐药金黄色葡萄球菌(MRSA)、青霉素耐药链球菌等多重耐药革兰阳性球菌的治疗。因为自然界中缺乏天然耐药基因库,理论上不易出现利奈唑胺耐药;但事实并非如此,2001年美国哈弗大学医学院报道了第一株利奈唑胺耐药的MRSA[1]。而后,多个国家出现了利奈唑胺耐药葡萄球菌的暴发性流行。我们收集了2012年1月~2014年12月我院临床标本中出现的6株利奈唑胺耐药革兰阳性球菌,对分子流行病学及其主要耐药分子机制进行了初步研究。
1 材料与方法
1.1 菌株来源 收集2012年1月~2014年12月我院临床标本中对利奈唑胺耐药的革兰阳性球菌6株,经过VITEK2 COMPACT鉴定5株为柯氏葡萄球菌、1株为粪肠球菌。
1.2 试剂 KB法药敏纸片为英国Oxoid公司产品;MH培养基干粉及E-test药敏条为法国生物梅里埃公司产品;Vitek-2 Compact全自动细菌鉴定仪购自法国生物梅里埃公司;ABI-2400 PCR仪购自美国ABI公司;细菌基因组DNA提取试剂盒购自凯捷公司;TaqDNA聚合酶、dNTP和DNA分子量Marker购自日本TaKaRa公司。PCR引物合成由北京赛百盛公司完成。
1.3 药敏试验 采用E-test法检测利奈唑胺、青霉素、苯唑西林、头孢西丁、万古霉素、替考拉宁、环丙沙星、红霉素、四环素、氯霉素的MIC;药敏方法和折点判断参照CLSI 2012,以ATCC29213作为质控菌株。
1.4 利奈唑胺耐药基因及相关突变检测 细菌基因组DNA提取应用凯捷公司的基因组提取试剂盒,23Sr DNA V区域引物及4个拷贝基因片段引物[2],L3和L4[3],cfr[4]基因扩增条件及引物序列参照文献进行,引物序列见表1;PCR扩增产物序列测定由上海生工公司完成。
1.5 柯氏葡萄球菌PFGE分析 5株柯氏葡萄球菌进行了脉冲场凝胶电泳(PFGE),染色体DNA制备及电泳条件参照Murchan等[11]的文献进行,条带分析应用软件BioNumerics software package (version 5.10, Applied Maths Inc.,Austin,TX,USA)完成。
2 结果
2.1 抗生素敏感试验 见表2。5株柯氏葡萄球菌利奈唑胺MIC介于16~64 mg/L,青霉素、苯唑西林及头孢西丁均耐药,万古霉素及替考拉宁敏感;粪肠球菌利奈唑胺MIC为8 mg/L,万古霉素及替考拉宁显示敏感。
2.2 利奈唑胺耐药基因及相关突变检测结果 5株柯氏葡萄球菌均表现为cfr基因阳性(图1),23Sr RNA及L4无突变,L3存在两对氨基酸突变,具体见表1;粪肠球菌cfr基因扩增阴性,存在23SrRNA点突变(表2)。
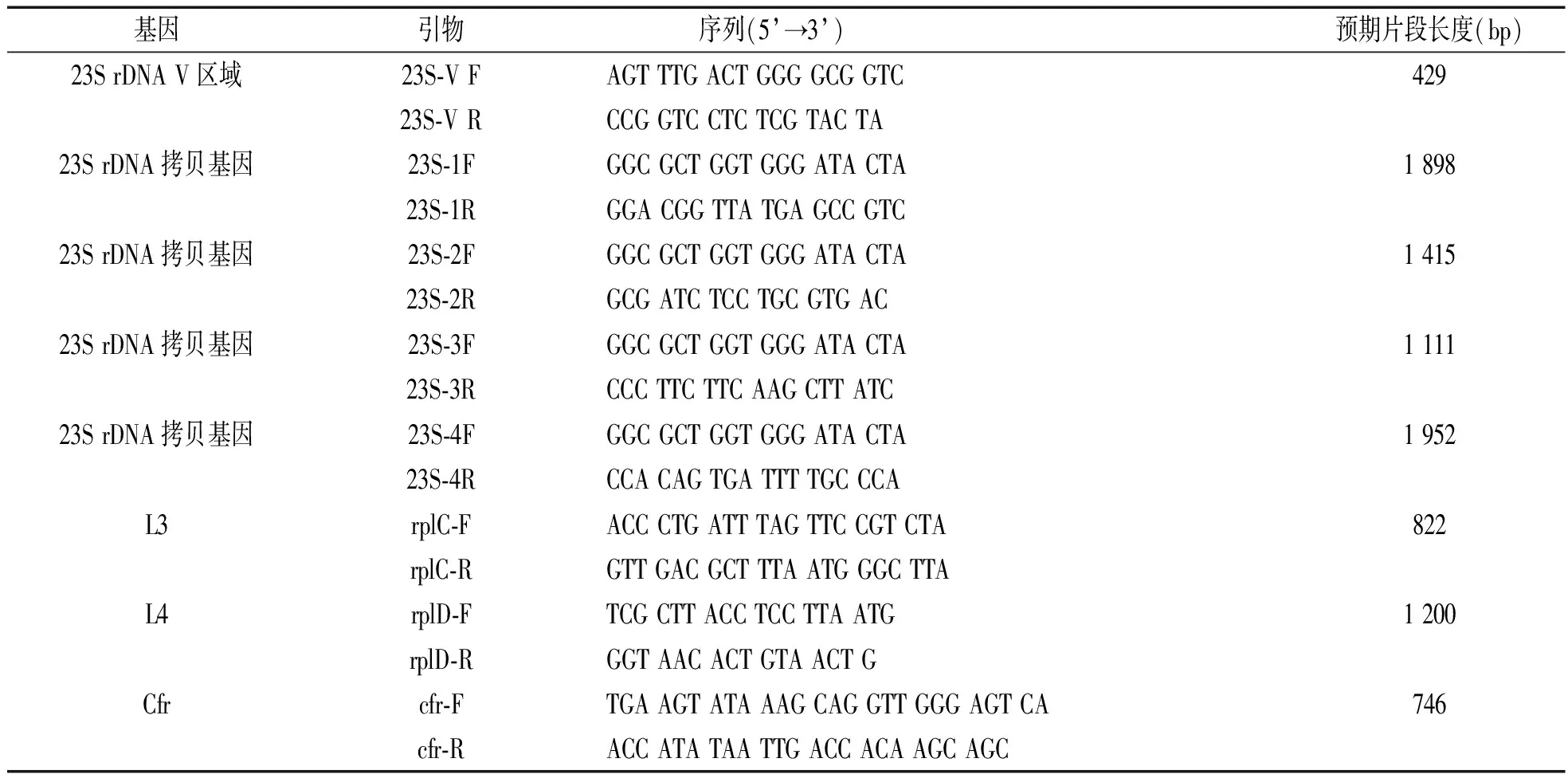
表1 本研究所应用引物序列
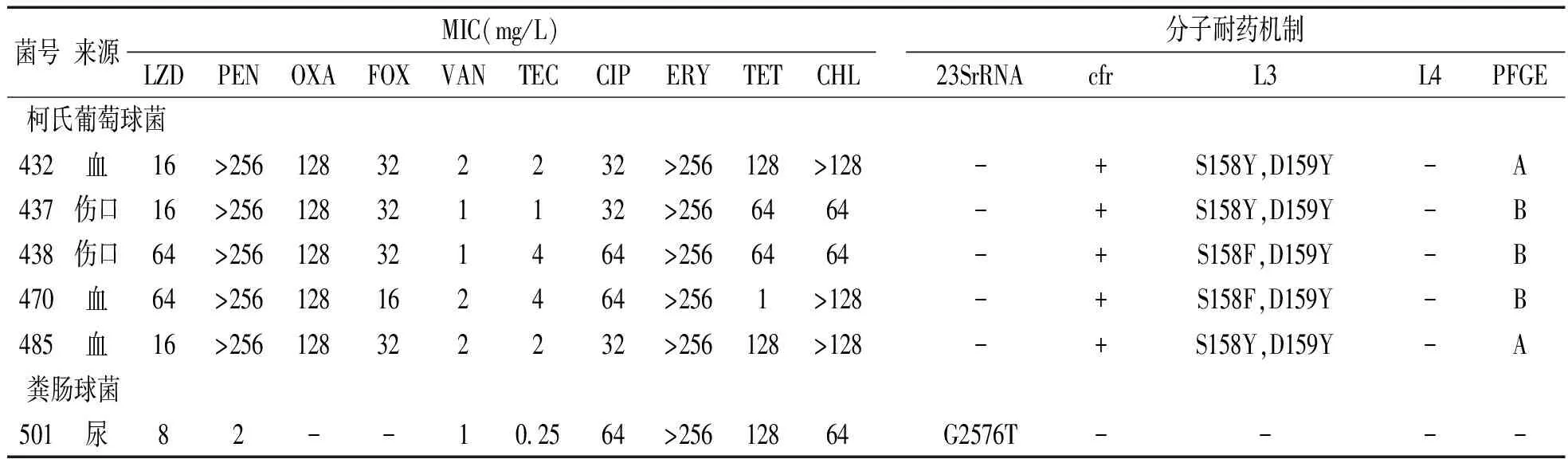
表2 6株革兰阳性球菌主要耐药机制及抗生素敏感性
注:MIC,最低抑菌浓度;LZD,利奈唑胺;PEN,青霉素;OXA,苯甲异噁唑青霉素;FOX,头孢西丁;VAN,万古霉素;TEC,替考拉宁;CIP,环丙沙星;ERY,红霉素;TET,四环素;CHL,氯霉素;S:丝氨酸;Y:酪氨酸;D:天冬氨酸;F:苯丙氨酸。
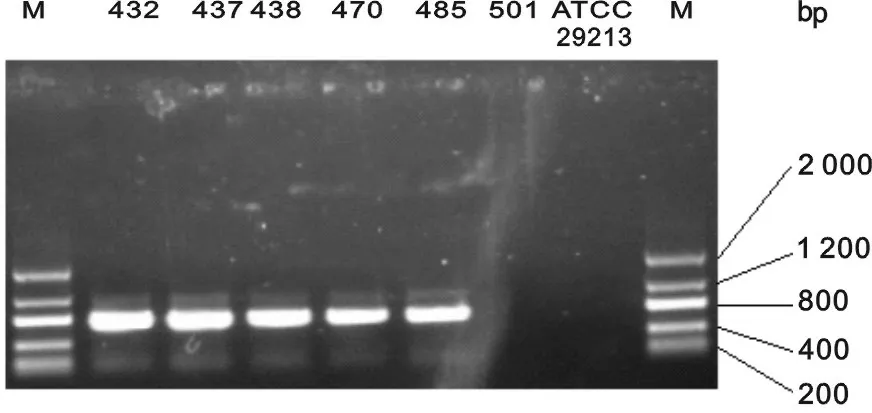
M:分子量Marker;ATCC29213:阴性对照。
2.3 柯氏葡萄球菌PFGE分型结果 见图2。5株柯氏葡萄球菌PFGE分型共分为2型,分别定义为A型和B型,菌株432和485为A型,437,438和470为B型。
3讨论利奈唑胺2007年在中国上市,主要用于治疗多重耐药革兰阳性球菌;耐药监测数据显示,我国第一株利奈唑胺耐药革兰阳性球菌出现在2009年[5]。利奈唑胺通过与50S核糖体亚基23Sr RNA的V功能区结合,阻止50S与30S亚基组合成70S核糖体,抑制细菌蛋白质合成从而发挥抗菌作用。现在已知的利奈唑胺耐药机制包括:23SrRNA V结构区的点突变,以G2576T为主,还包括U2500A,G2505A,G2512T,T2504C,C2610G,T2505A及G2766T等,这些突变影响利奈唑胺与靶位的结合从而减弱利奈唑胺抗菌活性[6];此外,有学者报道[7]核糖体蛋白L3或L4突变与利奈唑胺抗菌活性下降相关,菌株通过核苷酸片段的缺失、序列改变、替换以及插入修饰编码核糖体蛋白L4,L3的rpl/D,rpl/C基因序列,从而影响肽酰转移酶的空间构象,降低抑制利奈唑胺的抗菌活性,从而达到耐药,这种突变多发生于细菌染色体上,故不易造成细菌间耐药性的横向传播;第三种已知耐药机制是菌株通过获得cfr耐药基因而达到耐药[8],首次报道于临床分离的MRSA菌株中。cfr基因可甲基化转录后的rRNA(A2503),从而使其构象改变以影响利奈唑胺与抗菌靶位的结合而引起耐药,大量文献显示:cfr耐药基因可通过质粒在不同种属细菌间进行水平传播,而引起医院内的暴发流行[9]。此外,cfr耐药基因还可介导对氯霉素及林可霉素的交叉耐药,由此可见cfr基因是利奈唑胺耐药菌株医院内暴发流行的潜在危险因素。
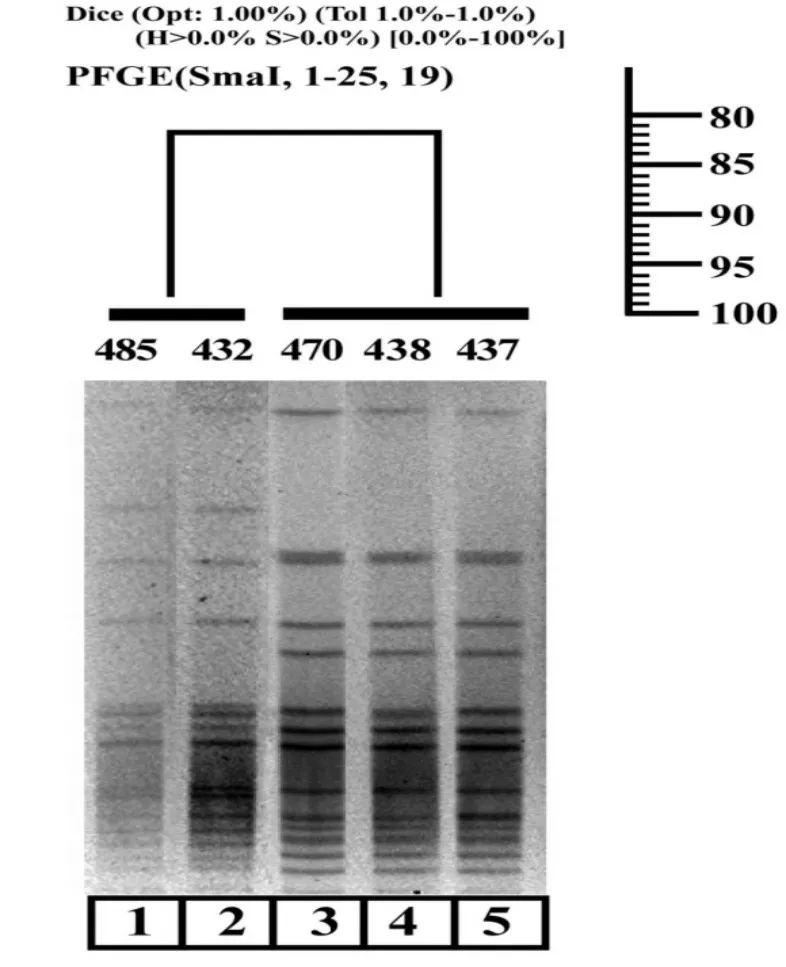
注:菌株485,432:PFGE A型;菌株470,438,437:PFGE B型。
我们的研究中利奈唑胺耐药凝固酶阴性葡萄球菌经鉴定全部为柯氏葡萄球菌,其它凝固酶阴性葡萄球菌中未发现利奈唑胺耐药,5株菌均来自患者无菌部位并伴随感染症状,鉴定其均为感染菌;5株柯氏葡萄球菌耐药分子机制均表现为cfr基因阳性伴随L3的158位及159位突变,未见23SrRNA突变及L4的突变;cfr基因多见于质粒,容易引起医院内播散;L3突变最近报道较多,但在利奈唑胺耐药中cfr基因及L3突变同时存在时其分别所起的作用及程度还需要在以后研究中明确,这也是我们下一步研究的目标。而利奈唑胺耐药粪肠球菌分离自患者尿标本,耐药由23SrRNA的G2576T点突变引起,以往研究显示:粪肠球菌中,编码23S rRNA的基因有4个相同的片段(拷贝),其突变的数量与耐药水平呈量效关系,粪肠球菌(菌株号501)的23SrRNA第5功能区的PCR扩增片段测序2576位为单一峰,显示其为一致性的G到T的点突变,此株粪肠球菌未检测出cfr基因及L3和L4的突变。
在分子流行病学研究中我们应用PFGE技术对5株柯氏葡萄球菌进行了亲缘性研究,结果显示:菌株432和485为同一分子克隆(A型),它们来自同一病房(ICU)的病人,且485被分离前病人未应用过利奈唑胺抗生素,提示菌株有播散的可能;另外三株菌(437,438和470)为PFGE分型的B型,病人在分离出利奈唑胺耐药菌株前均应用过利奈唑胺药物,分子遗传背景相同提示其存在院内传播可能。
近年利奈唑胺耐药的革兰阳性球菌已在国内多家医院临床标本中检测出[10],其为革兰阳性球菌的有效抗感染治疗带来了困难;临床微生物室应加强利奈唑胺耐药革兰阳性球菌的监测,加强合理应用抗生素的宣教,以减少多重耐药菌的出现。
[1] Tsiodras S,Gold HS,Sakoulas G,et al.Linezolid resistance in a clinical isolate ofStaphylococcusaureus[J].Lancet,2001,358(9277):207-208.
[2] Mendes RE,Deshpande LM,Farrell DJ,et al.Assessment of linezolid resistance mechanisms amongStaphylococcusepidermidiscausing bacteraemia in Rome,Italy[J].The Journal of Antimicrobial Chemotherapy,2010,65(11):2329-2335.
[3] Toh SM,Xiong L,Arias CA,et al.Acquisition of a natural resistance gene renders a clinical strain of methicillin-resistantStaphylococcusaureusresistant to the synthetic antibiotic linezolid[J].Molecular Microbiology,2007,64(6):1506-1514.
[4] Kehrenberg C,Schwarz S.Distribution of florfenicol resistance genes fexA and cfr among chloramphenicol-resistantStaphylococcusisolates[J].Antimicrobial Agents and Chemotherapy,2006,50(4):1156-1163.
[5] Zhao C,Sun H,Wang H,et al.Antimicrobial resistance trends among 5 608 clinical Gram-positive isolates in China:results from the Gram-Positive Cocci Resistance Surveillance program (2005~2010)[J].Diagnostic Microbiology and Infectious Disease,2012,73(2):174-181.
[6] LaMarre J,Mendes RE,Szal T,et al.The genetic environment of the cfr gene and the presence of other mechanisms account for the very high linezolid resistance ofStaphylococcusepidermidisisolate 426-3147L[J].Antimicrobial Agents and Chemotherapy,2013,57(3):1173-1179.
[7] Locke JB,Hilgers M,Shaw KJ.Mutations in ribosomal protein L3 are associated with oxazolidinone resistance instaphylococciof clinical origin[J].Antimicrobial Agents and Chemotherapy,2009,53(12):5275-5278.
[8] Liu Y,Wang Y,Schwarz S,et al.Transferable multiresistance plasmids carrying cfr inEnterococcusspp.from swine and farm environment[J].Antimicrobial Agents and Chemotherapy,2013,57(1):42-48.
[9] Morales G,Picazo JJ,Baos E,et al.Resistance to linezolid is mediated by the cfr gene in the first report of an outbreak of linezolid-resistantStaphylococcusaureus[J].Clinical Infectious Diseases,2010,50(6):821-825.
[10] 蔡加昌,周宏伟,胡燕燕,等.耐甲氧西林凝固酶阴性葡萄球菌对利奈唑胺耐药机制及分子流行病学研究[J].中华微生物学和免疫学杂志,2012,32(6):532-536.
Cai JC,Zhou HW,Hu YY,et al.Linezolid resistance mechanisms and molecular epidemiology of clinical isolates of methicillin-resistant coagulase-negative staphylococci[J].Chin J Microbiol Immunol,2012,32(6):532-536.
