精液脱落细胞检测在无精子症中的应用价值*
2016-01-11袁长巍曹兴午北京国卫生殖健康专科医院北京0008卫生部中日友好医院男科北京0009
袁长巍,曹兴午(.北京国卫生殖健康专科医院,北京 0008;.卫生部中日友好医院男科,北京 0009)
在全国血液、体液形态检验诊断学术会议上,专家大声疾呼,在充分发挥现代自动化检验技术优势的同时,不应忽视以传统人工显微镜检查为主要手段的细胞形态学检查的重要价值。重高精尖、轻基本功锤炼的倾向已严重阻碍了细胞形态学的研究和发展。精液脱落细胞学在诊断男性不育,评价睾丸生殖功能方面有着重要价值。由于多方面原因使此项检验和研究长期处于被忽视和弱化状态,几乎成为“被遗忘的角落”,已经成为多数医院检验科的短板。曹兴午教授在显微镜下经过30余年的不懈努力,为此学科的建设和发展奠定了夯实基础,并进一步促进了精液脱落细胞学在临床的推广和应用。
1 精液脱落细胞学概述
精液中有形成分是睾丸的代谢产物,是直接反映睾丸生殖功能状况的具体表现,其检出内容主要包括精子形态学、生精细胞学和非生精细胞成分3部分,统称为 “精液脱落细胞学”。其细分可包括精子、生精细胞(精原细胞、初级精母细胞、次级精母细胞、精子细胞)、粒细胞、红细胞、吞噬细胞、线索细胞、支持细胞骨架(微管、微丝)、结晶、细菌、包涵体及其它有形成分。精液中所有的有形成分,都可以作为考证睾丸生殖功能状况和病理性损伤的有效指标,绝不应轻视和忽略任何睾丸的代谢成分,甚至精液中的残渣都应该作为检测指标[1]。精液脱落细胞学的变化是反映睾丸功能损伤的重要标志物,虽然多数实验室已具备形态学检测能力,但较精子形态而言,生精细胞及非生精细胞成分的辨别及诊断仍略显滞后。
2 关于精液染色方法
关于精液的染色方法,目前常用的有巴氏染色法、瑞氏-姬姆萨染色法、Shorr染色法、Diff-Quik染色法等。精子形态学WHO推荐巴氏染色法,由于巴氏染色法步骤繁多、耗时较长、染色配制繁琐、试剂成本较高,从而限制了该染色方法在实验室中的常规应用和普及。基于不同染色方法对精子形态的影响,各实验室可根据自身的经验及状况(准确性好、稳定性高、操作简易、试剂成本等因素)选择合适的染色方法。瑞氏-姬姆萨染色是血液涂片、骨髓涂片及脱落细胞常用染色方法,是实验室常备染色剂,简单易行,可检出精液全部有形成分。由于细胞着色是染料透入被染物并存留其内部的一种过程,此过程既有物理吸附作用,又有化学亲和作用。各种细胞及细胞的各种成分由于其化学性质不同,对瑞氏-姬姆萨染色液中酸性染料(曙红)和碱性染料(亚甲蓝)亲和力也不一样。所以细胞受染后,各类细胞呈现不同的着色,细胞颜色都较适中,胞核、胞浆及其中之颗粒显色较为清晰,从而达到辨别其形态特征的目的,其效果要明显优于其它染色方法。
做好精液涂片和正确染色,是精液脱落细胞学检测的重要步骤,涂片和染色的质量将直接决定检验结果,看似简单的操作环节都至关重要,不容小觑。无精子症患者精液标本需将全部精液进行离心(3 000 r/min,15 min),弃上清液,将沉淀物充分混匀后,取5~10 μl涂片,干燥后染色。好的精液涂片片膜薄厚适宜,细胞分布较均匀。粘稠的精液标本可适当拉薄,避免涂片厚而不均。涂片过厚,冲洗时容易脱片,还会造成细胞间相互重叠,影响着色而不宜分辨。涂片过薄会导致细胞数量过少,不利于细胞计数。在进行瑞-姬氏染色时,滴加 A液数滴于涂片上,并让染液覆盖整个精膜区,染色1~2 min。依据精膜区面积滴加A液,液量要充足,避免染液蒸发干燥,染料沉于涂片,滴加B液于A液上面(2倍于A液),用洗耳球吹出微风使液面产生涟漪状使两液充分混合,染色3~5 min,洗耳吹打液面时要轻柔,避免用力过猛使液面脱离片膜,液面一定要充分混合,防止着色不均匀;冲洗时不能先倒掉染液,应直接以流水冲洗,以防止有沉渣在标本上,水流不宜过大,以防冲掉片膜;干燥后镜检,低倍镜下选择合适视野,油镜观察。
3 关于“圆形细胞”
精液中的白细胞、生精细胞、前列腺细胞及泌尿生殖道上皮细胞统称为“圆形细胞”。各类细胞在未经染色状态下难以正确分辨,由于精液中细胞成分较为复杂,多数检测报告并未对精液中的白细胞、生精细胞及其它细胞进行有效区分。检验人员将精液中的“圆形细胞”报告为白细胞已经形成了固有的惯性模式,误诊误治的同时也给患者带来了精神和心理上的负担。精液中各类细胞的检出,直接或间接地反映了睾丸生殖功能、感染及免疫状态,临床必须要考虑并给予重视,否则就失去了精液细胞学的检测意义。可惜检验人员仍然不进行分类,冠冕堂皇以“圆形细胞”报告,临床上如此应用,实在遗憾。明确区分精液中的各细胞成分,在临床治疗上起关键作用,同时也是检验人员的基本责任。
精液白细胞过氧化物酶染色和白细胞群酶免组化浓度检测,是WHO推荐的诊断白细胞精子症的实验诊断指标。采用过氧化物酶染色法,可以用于鉴别精液中多形核白细胞与不含过氧化物酶的多核精子细胞,但不能检测到已经激活并释放其颗粒的多形核白细胞和不含有过氧化物酶的白细胞类型,如淋巴细胞、巨噬细胞和单核细胞[2]。单克隆抗体技术主要以白细胞特异性抗原存在为基础,可区分淋巴细胞、巨噬细胞和单核细胞,但该方法操作复杂、试剂成本较高,适合标准校正及科研。采用我国传统的细胞学染色方法基础具备的瑞氏-姬姆萨染色,能清楚地观察细胞形态,并将白细胞、生精细胞及其他细胞有效地区分开来,但需要一定的细胞学基本功和生精细胞鉴别能力,特别在多核精子细胞与凋亡或退化的多形核细胞观察上极易混淆,应加以鉴别。见图1,2。

图1 中性粒细胞(凋亡) 图2 精子细胞(凋亡)
精液弹性硬蛋白酶浓度测定与精液白细胞(过氧化物酶法检测)呈良好相关性,可结合精液中的白细胞数量作为生殖道感染的诊断及愈后监测指标。过多的白细胞可能与感染和精子质量下降有关,应进一步确定其来源,并进行微生物学检测以证实有无附性腺感染的可能。如果诊断为生精细胞,则根据主体细胞的类别进行睾丸生殖功能评估,为分析睾丸损伤病因提供客观指标。精液生精细胞的检测比计数白细胞数量更有临床意义,无精子症患者中,单纯提倡过氧化物酶染色并不能解决根本问题。
4 结合精浆生化作为梗阻性无精子症(OA)与非梗阻性无精子症(NOA)的鉴别
由于OA与NOA两者的病因、病理、诊断、治疗及预后选择上均不同,故鉴别诊断尤为重要。随着精液细胞学在临床应用的渐趋成熟,为解决上述问题提供了鉴别方法和诊断指标,对预测睾丸内精子的发生、发展提供科学依据。
精液中生精细胞及支持细胞的检出是无精子症鉴别、诊断的有效指标。精液中没有精子并不代表没有生精细胞,检出生精细胞或支持细胞则说明输精管道通畅,病因是由于睾丸生精功能障碍引起。如果精液中未发现生精细胞或支持细胞及支持细胞骨架成分,则要考虑输精管道异常或因睾丸生精功能出现严重障碍,细胞脱落枯竭并呈空化期状况。如果患者睾丸体积、生殖激素水平在正常范围,则高度怀疑输精管道异常,便可结合精液量、pH,精浆果糖及a-葡糖苷酶(NAG)等检测指标进行鉴别及梗阻位置的确定,按笔者拟定图3所示。精液生精细胞检查结合精浆附属性腺测定可鉴别OA和NOA,并可反映睾丸的生精功能,可有效避免对入体有侵袭性的输精管造影带来的不便和痛苦。

图3 无精子症实验诊断流程图
5 睾丸生殖功能评估
生精细胞在健康人精液中按数量、比例有序排出、常态脱落,如果生精细胞脱落的数量、比例及形态出现异常,将有可能引起精液质量改变,导致不育。根据生精细胞的有无、数量、形态及其它有形成分的检测,可作为衡量睾丸生殖功能的有效指标。
5.1 生精细胞存在异常 在无精子症精液标本中,生精细胞存在异常对了解和预判睾丸生殖功能具有重要意义。根据生精细胞检出数量的多寡可分为生精细胞缺乏型和生精细胞存在型。精液中未检出生精细胞(缺乏型),则要通过其它相关指标进一步确定无精子症类型。精液中的生精细胞在早期、中期可有少量生精细胞脱落,精液中的精子数量正常或减少;随着时间的延长,睾丸损伤进一步发展,生精细胞脱落进入高峰期,见图4,图5,精液中发现大量凋亡、胀亡的初级精母细胞及精子细胞脱落,精子数量会继续减少;随着时间的再延长,精子细胞及精母细胞的检出几率逐渐减少,经常会发现精原细胞脱落,并出现无精子状态,说明睾丸功能出现严重障碍,生精细胞脱落进入亚空化期;随着睾丸再进一步损伤,生精细胞脱落进入空化期,生精细胞脱落枯竭,精液中无或偶见形态欠佳的生精细胞,最终呈现唯支持细胞综合征结局[3]。生精细胞的异常脱落是导致成熟精子生成受阻的敏感信号,生精细胞的脱落持续时间越长,生精细胞的检出率就越低,睾丸损伤程度就越重,最终治疗的可能性和可行性就越差,提前干预和控制可有效避免睾丸生精功能的进一步损伤。
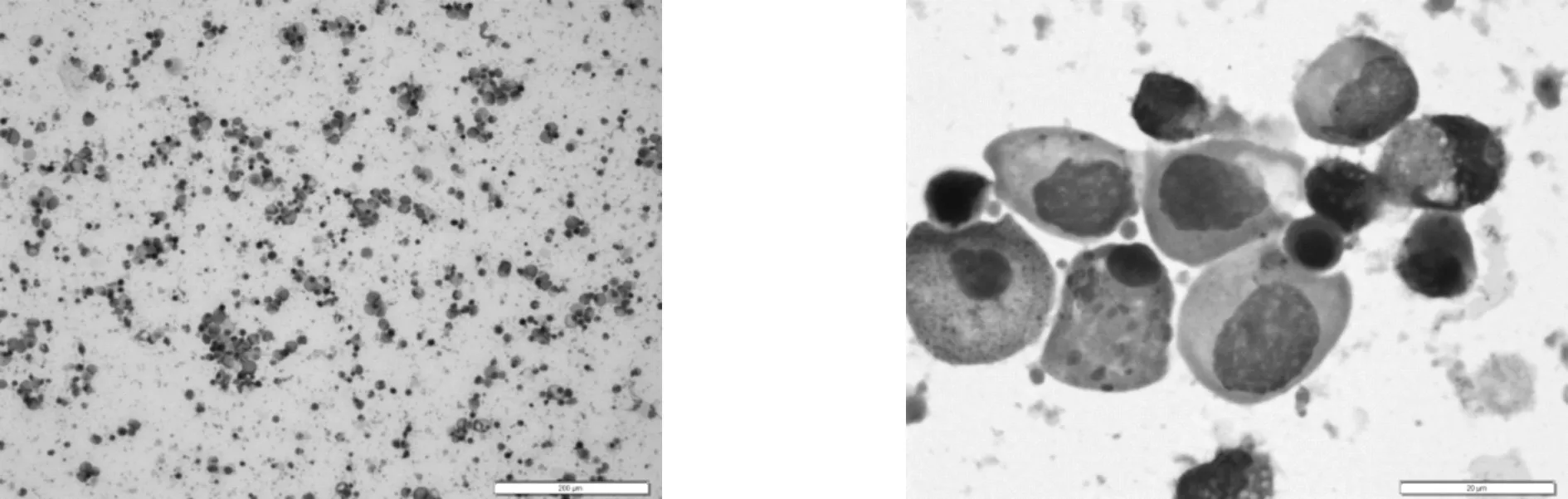
图4 生精细胞大量脱落 图5 生精细胞大量脱落
睾丸受到各种不同有害因素的影响,可引发睾丸生殖功能障碍,导致生精小管中各个细胞的生理性改变向病理性发展[4]。睾丸生殖功能受损必然有一个过程,由于受损程度、受损时间及致受损的因素不同,其生精细胞发生病理性改变及脱落状况也不尽相同。生精小管内各个生精细胞的发育周期并非均衡一致,对既往表现为无精子症的患者,通过精液细胞学检查仍有15.98%的患者检出精子,考虑有两方面原因:一是无精子症精液标本经离心、涂片、染色后,提高了精子的检出率,可能与镜下观察的细致程度及精子染色后更易辨别有关。二是考虑睾丸本身生精状态不尽均衡、存在局灶性精子发生的现象,导致精液中的精子时有时无。精子由生精细胞逐级演变而来,精液中各级生精细胞的检出对了解睾丸生殖功能有重要意义。
5.2 生精细胞比例异常 精子发生是一个十分复杂的过程,大致可分为三个阶段:精原细胞有丝分裂阶段、精母细胞减数分裂阶段和精子细胞成熟变形阶段[5]。生精细胞在精子发生的任何阶段出现成熟障碍,将会导致精子数量异常,临床表现多为少精子症或无精子症[3]。精液中四种生精细胞比例出现失常,其中一种或两种生精细胞的比例增加,尤以发生在减数分裂的终末期,初级精母细胞的粗线期阶段最为常见。精子发育过程中大多数阻滞在初级精母细胞和精子细胞阶段水平,少数阻滞在精原细胞阶段[6]93~94。通过精液脱落细胞学分析,确定生精细胞阻滞阶段,进而分析生精障碍的类型与原因,为临床提供诊疗依据、观察疗效和治疗结果。
5.3 生精细胞形态异常型 精液中的生精细胞,不仅在数量和比例上显示异常,更主要表现在细胞形态上的异常。精液中不仅可以检出常态(典型)的生精细胞,还可以看到异常的生精细胞,往往这些异常的生精细胞更具有临床意义,见图6~10。
生精细胞形态学变化正是反映生精细胞的发展趋势,对观察睾丸损伤机制具有重要作用。细胞凋亡和胀亡是细胞死亡两种不同的表现类型。细胞凋亡在精子发生的生理、病理过程中充当了重要的角色,它可能是人体清除剩余或缺陷生精细胞的正常的生理机制,也可能是引起不育的病理环节。生精细胞对内外各种因素影响的敏感性很高,使得细胞发生突变的频率也很高。这些变性的生精细胞通过凋亡机制被清除掉,可以保证优良精子的保存[6]382。
细胞凋亡的形态特征为细胞体积变小,胞质浓缩,核染色质固缩于边缘,DNA降解,最后形成多个凋亡小体而被吞噬。细胞胀亡由多种原因造成,是以细胞肿胀、核溶解为特征的被动性细胞死亡,其包括缺血性和凝固性坏死的细胞死亡前主要变化,即细胞浊肿或水样变[7]。在光学显微镜下,胀亡细胞的体积增大,胞浆疏松化并出现致密颗粒,内质网肿胀[8],细胞核肿胀,核内染色质分散,凝集在核膜、核仁周围,有时聚集成团块,后期常表现为核溶解[9]。细胞凋亡和胀亡可出现在同一份精液标本中,由于在不同的损伤因素、毒物浓度及病理情况下,生精细胞凋亡和胀亡所发生的比例不同。细胞凋亡和胀亡有一定的分布特征,血供相对充足部位凋亡多见,血供缺乏的区域细胞胀亡多见[10]。细胞胀亡是低耗能或不耗能的被动过程,由同一种刺激引起的细胞死亡,在ATP供应充足时细胞发生凋亡,缺少ATP时细胞发生胀亡。在补充ATP后,细胞胀亡可转为凋亡[11]。生精细胞形态学观察,对病因及发生机制的研究提供了理论依据。
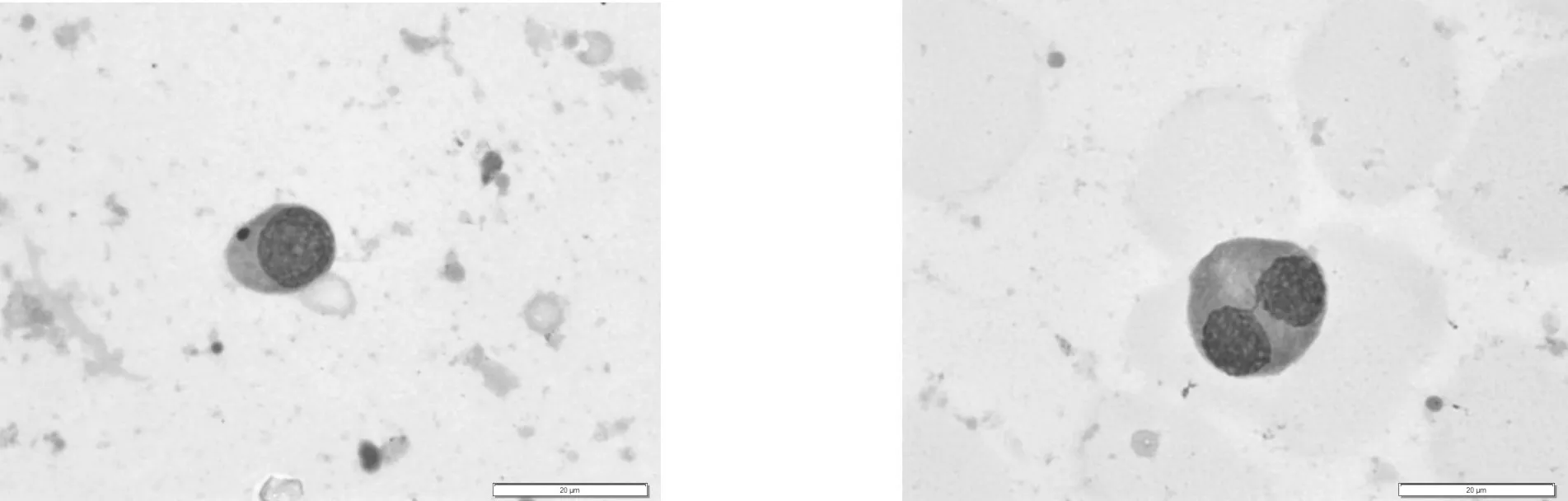
图6 常态(典型)初级精母细胞 图7 常态(典型)次级精母细胞
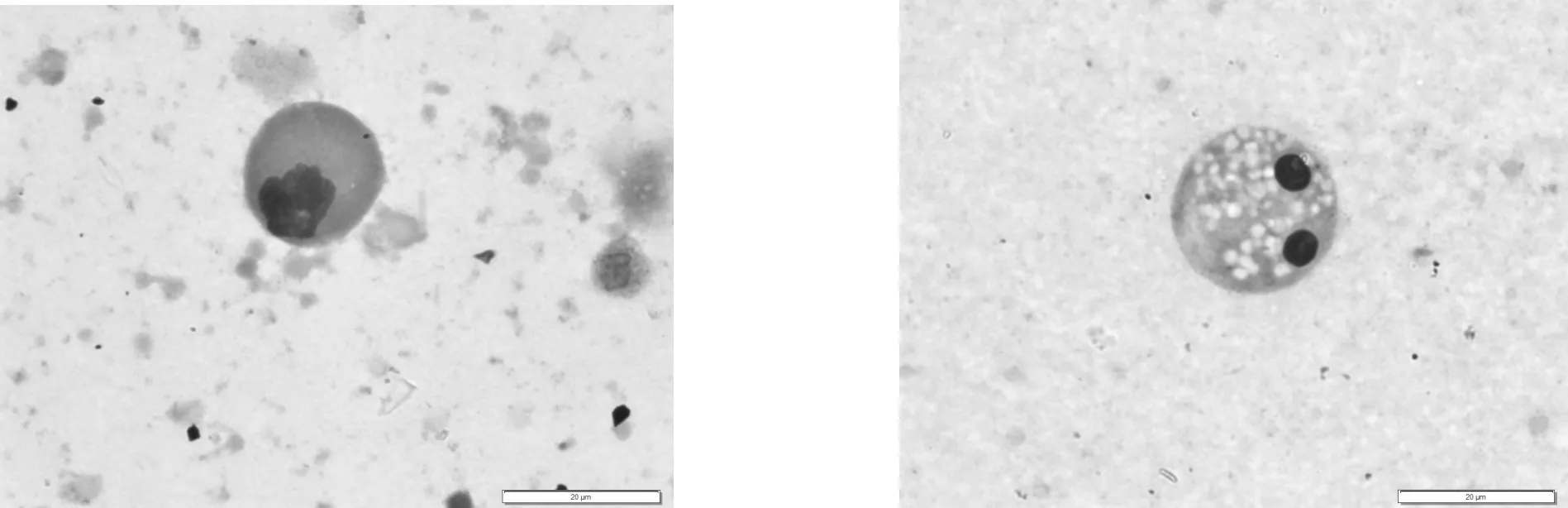
图8 初级精母细胞(凋亡) 图9 精子细胞(凋亡)
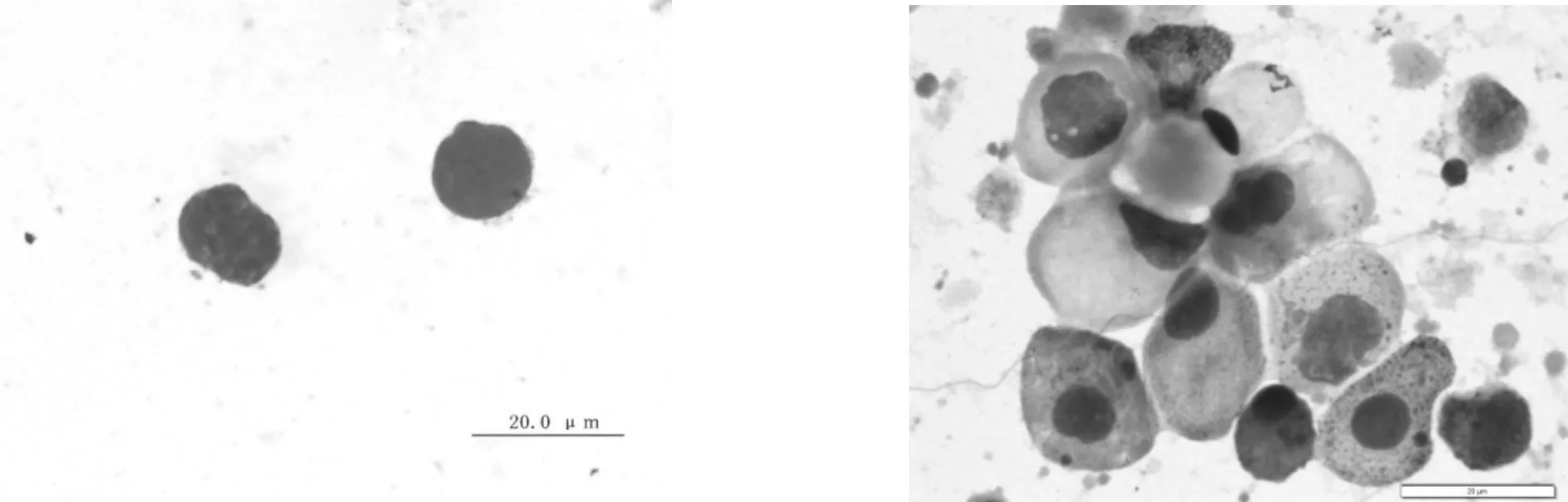
图10 初级精母细胞(胀亡) 图 11 大量初级精母细胞(凋亡)
5.4 支持细胞及支持细胞骨架检出 支持细胞生长在生精小管的内表面,是生精上皮中惟一与生精细胞接触的细胞,各级生精细胞都按成熟程度自生精小管基底部向管腔排列,靠近管腔的血-睾屏障,外管腔侧的生精细胞,必须通过支持细胞来获取营养[ 12,13]。支持细胞在睾丸生精细胞诱发性凋亡中的作用,除去发生自发性凋亡外,还能被多种内源性和外源性因素诱发产生凋亡,如促性腺激素及睾酮减少、化学药物和毒素、高温、辐射、环境污染以及睾丸的急性缺血-再灌注损伤等,它们通过多种途径影响生精细胞凋亡,其中支持细胞结构及功能的改变扮演了重要角色[14]。支持细胞受有害因素刺激后,易使支持细胞骨架发生断裂,睾丸受到影响,损伤后的支持细胞必然会随着精液排出体外,在精液中可以看到损伤和脱落的支持细胞及骨架成分[13]。精液中检出支持细胞及支持细胞骨架,说明睾丸微环境受累,损伤已威胁到支持细胞功能,其功能的优劣将直接决定生精细胞的分化程度及精子的生成,见图12,13。支持细胞的检出对睾丸生精功能的深入研究提供了新手段和新依据。

图12 支持细胞(片状脱落) 图13 支持细胞骨架
5.5 临床应用
5.5.1 患者,男,23岁,婚育1年,男性特征发育正常,性生活1~3次/周。睾丸大小:双侧均12#,双侧轻度VC。生殖激素水平未见异常。多次精液检查,无精子症。染色体检查:46XY,Y染色体未见缺失;既往史:肺结核史,曾口服抗结核药物利福平和异烟肼;患者拒绝睾丸活检,特来我院行精液脱落细胞学检查。
5.5.2 精液量:3.2 ml;pH:7.5;离心镜检:无精子;精液脱落细胞学检查:精原细胞1%,初级精母细胞78%,次级精母细胞13%,精子细胞7%,中性粒细胞0%,吞噬细胞1%。
5.5.3 根据精液脱落细胞评估睾丸功能:睾丸生殖功能障碍,无精子症;检出支持细胞骨架,考虑睾丸内环境受累,支持细胞功能减弱;生精细胞脱落属于高峰期,检出各级生精细胞,初级精母细胞阶段发育阻滞(粗线期),凋亡显著(核固缩、核边聚),导致精子细胞生成减少,无精子生成。生精细胞形态分类(100个):常态生精细胞15%,凋亡69%,胀亡13%,退化3%。生精细胞内可见包涵体,考虑原体或病毒感染。
5.5.4 临床印象:考虑药物因素引起睾丸生精阻滞在精母细胞阶段,但不排除精索静脉曲张及其它有害因素影响。治疗建议:该患者精液中存在常态(典型)生精细胞,并检出精子细胞,通过药物治疗改善睾丸内的微环境,促进生精细胞继续发育是可行的。根据精液细胞学检测结果,动态观察各级生精细胞的发育状况。经过3个月有效治疗后,精液中检出9个精子(畸形),见表1。建议继续治疗,并咨询辅助生殖技术。
生精细胞的形态学特征,是判断精子能否产生的重要前提条件,研究表明:常态生精细胞的存在较凋亡及胀亡等形态在治疗上更具有优越性,见表2。
5.5.5 精液检出脱落生精细胞:见图14~17。
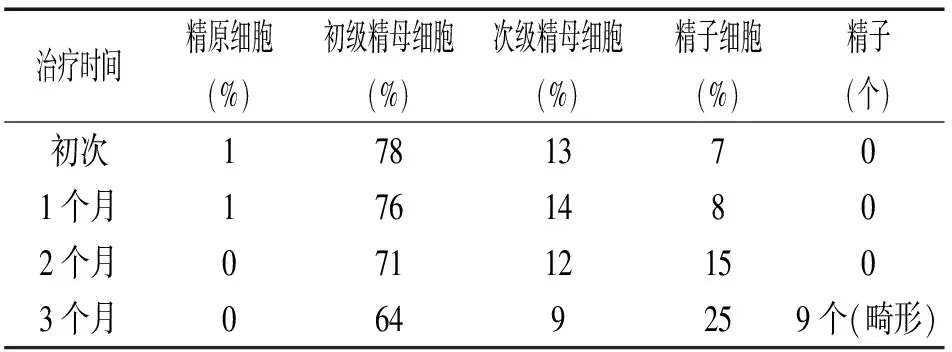
表1 精液中各级生精细胞及精子检出率列表

表2 生精细胞形态学分类及其变化(%)
常态(典型)生精细胞的存在是精子能否正常发生的重要保障,理论上常态生精细胞较凋亡或胀亡的细胞在治疗上也更具有预测性。NOA精液中典型生精细胞的检出,也为临床提供了治疗的可行性和可能性,生精细胞的动态变化,可作为疗效观察和判断预后的重要指标,即使有一线希望也不应该放弃。非典型生精细胞(凋亡或和胀亡)的检出,将有助于了解睾丸功能障碍的严重程度及发展趋势。通过精液生精细胞形态学分类,明确常态、凋亡及胀亡生精细胞的比例,对探索生精细胞死亡所发生的病因、途径、机制有重要意义。
6 某种程度可代替睾丸活检
睾丸活检是无精子症患者诊断和治疗的重要手段,多年来已被临床所接受。单次睾丸活检可能难以全面、完整反映睾丸的生精功能,同时多点或多次的手术取材反而会加重对睾丸功能的损伤。精液脱落细胞学检测能够依据睾丸的代谢物,更全面、准确地了解睾丸功能,提高对睾丸生精功能评估的准确性。近年来通过检测精液脱落细胞学、血清FSH,T/LH,抑制素B及精浆果糖和中性a-葡糖苷酶,逐渐取代了具有侵袭性的睾丸活检这一传统方法。
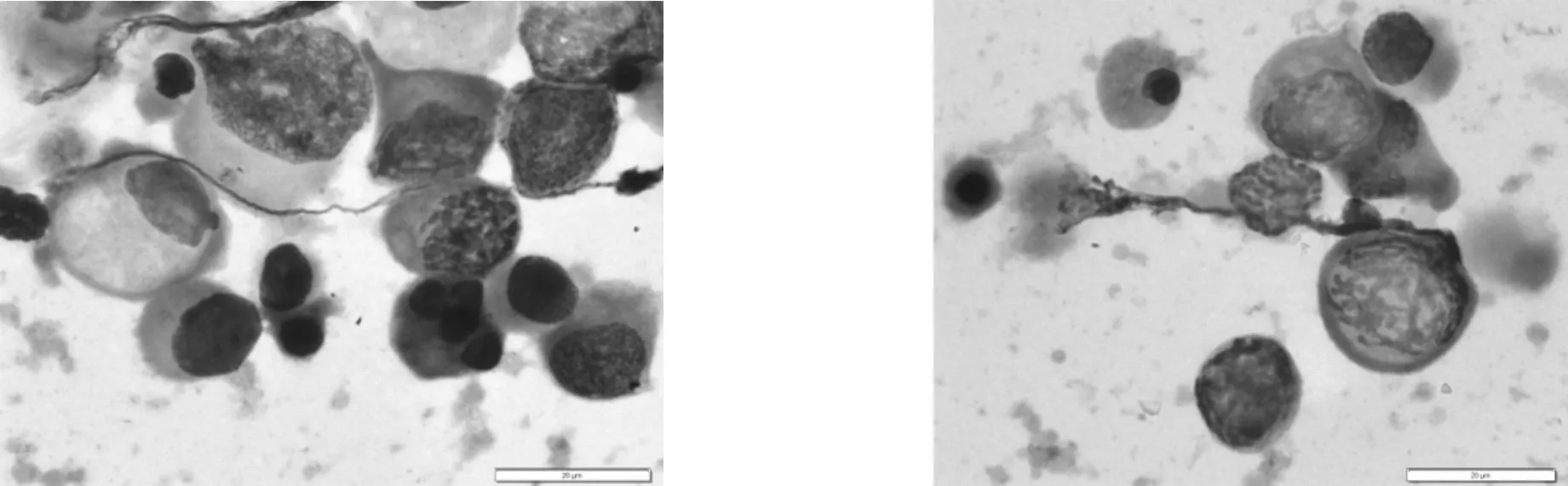
图14 生精细胞大量脱落,凋亡显著(初次) 图15 生精细胞脱落明显,凋亡显著(治疗1个月后)

图16 精子细胞脱落增多,多核,凋亡(治疗2个月后) 图17 畸形精子(治疗3个月后)
7 辅助生殖参考指标
随着辅助生殖技术的迅速发展和广泛应用,已让更多的OA及部分NOA患者有了获得子代的机会。NOA患者能否从睾丸内获取可利用的精子行辅助生殖技术是关键因素,如何通过有效、无创的手段来判断睾丸内精子的发生将具有重要意义。精液生精细胞可否作为睾丸显微取精前的参考指标,依据生精细胞的数量、形态来预测睾丸内精子的发生状况是否可行,仍需进一步研究。精液脱落细胞学作为一种考量方法,与辅助生殖技术的应用价值,将是实验室与临床协作的目标。
[1] 曹兴午,王立红,袁长巍.精液病理学检测与临床意义[J].现代检验医学杂志,2013,28(3):1-8.
Cao XW,Wang LH,Yuan CW,et al.Semen pathology detector and clinical significance[J].Journal of Modern Laboratory Medicine,2013,28(3):1-8.
[2] WHO.人类精液检查与处理实验室手册[M].谷翊群,陈振文,卢文红,等译.5版.北京:人民卫生出版社,2011:87.
WHO.Laboratory manual ror the examination and processing of human semen(5ht edition)[M].Gu YQ,Chen ZW,Lu WH,et al,traslated.5th Ed.Beijing:People’s Medical Publishing House,2011:87.
[3] 袁长巍,杨海英,刘敬平,等.精液脱落细胞学在少、无精子症中的应用[J].中国性科学,2015,24(1):8-10.
Yuan CW,Yang HY,Liu JP,et al.Application value of semen exfoliative cytology in oligospermia & azoospermia[J].Chinese Journal of Human Sexuality,2015,24(1):8-10.
[4] 曹兴午.我是协和人-65年践行转化医学的轨迹[J].现代检验医学杂志,2014,29(5):1-22,27.
Cao XW.65th practice of translational medicine at Peking Union Medical College[J].Journal of Modern Laboratory Medicine,2014,29(5):1-22,27.
[5] Russel LD,Ettlin RA,Sinha-Hikkim AP,et al.Histological and histopathological evaluation of the testis[J].International Journal of Andrology,1993,16(1):83.
[6] 杨建华.现代男性不育诊疗学[M].上海:上海科学技术文献出版社,2007:93-94,382.
Yang JH.Diagnostics of modem male’s infertility[M].Shanghai:Shanghai Science and Technology Literature Press,2007:93-94,382.
[7] Levin S.Apoptosis,necrosis,or oncosis:what is your diagnosis? a report from the cell death nomenclature committee of the society of toxicologic path ologists[J].Toxicol Sci,1998,41(2):155-156.
[8] Van Cruchten S,Van Den Broeck W.Morphological and biochemical aspects of apoptosis,oncosis and necrosis[ J].Anat Histol Embryol,2002,31(4):214-223.
[9] Elsasser A,Suzuki K,Schaper J.Unresolved issues regarding the role of apoptosis in the pathogenesis of ischemic injury and heart failure[J].J Mol Cell Cardiol,2000,32(5):711-724.
[10] 曹兴午,林 凯,李翠英,等.细胞胀亡在精液脱落细胞学的形态特征与机制的探讨[J].现代检验医学杂志,2011,26(4):1-8.
Cao XW,Lin K,Li CY,et al.Discussionon on the mechanism cell oncosis in semen exfoliative cytologic of morphological character[J].Journal of Modern Laboratory Medicine,2011,26(4):1-8.
[11] Hein S,Arnon E,Kostin S,et al.Progression from compensated hypertrophy to failure in the presgsureoverloaded human heart:structural deterioration and compensatory mechanilms[J].Circulation,2003,107(7):984-991.
[12] 曹兴午,李宏军,白文俊.精液脱落细胞学与睾丸组织病理学[M].北京:北京大学医学出版社,2012:4-7,73-76,149-158.
Cao XW,Li HJ,Bai WJ.Semen exfoliative cytology and testicle histopathology[M].Beijing:Beijing University Medical Press,2012:4-7,73-76,149-158.
[13] 曹兴午.睾丸支持细胞骨架的研究[J].中华男科学杂志,2008,14(8):675-679.
Cao XW.Progress in the research of sertoli cell cytoskeleton of the testis[J].National Jounal of Andrology,2008,14(8):675-679.
[14] Kim ED,Barqawi AZ,Seo JT,et al.Apoptosis:its importance in spermatogenic dysfunction[J].Urol Clin North Am,2002,29(4):755-765.
