miR-205在ITP患者外周血单个核细胞中的表达及意义*
2016-01-11邓顺江黄韦华吴林洪李腾达龙曙萍邓安梅
邓顺江,黄韦华,吴林洪,张 蕾,叶 辛,刘 鹏,李腾达,龙曙萍,钱 琤,邓安梅
(1.第二军医大学附属长海医院,上海 200433;2.第二军医大学,上海 200433;3.第二军医大学附属长征医院,上海 200003;4.解放军第100医院,江苏苏州 215007)
原发性免疫性血小板减少症(primary immune thrombocytopenia,ITP)被认为是一种由自身抗体介导的血小板破坏增加以及生成减少引起的疾病,临床上以血小板计数减少和皮肤黏膜出血为特点[1]。但研究发现其发病机制非常复杂,目前认为ITP的发病是一个多步骤的过程,各种免疫细胞包括T,B细胞、抗原递呈细胞以及相关的细胞因子在ITP的发病中发挥重要作用[2~6]。
Micro-RNA(miRNA)是一种长度大约为22个核苷酸的微小非编码RNA,它在转录后水平调控基因的表达[7],因而参与体内多种生理病理过程。miRNA与多种疾病的发生发展密切相关,最近有研究发现,miRNA在ITP的发病中也发挥了重要的作用[8~10]。例如,miR-155在ITP患者的外周血单个核细胞(PBMC)中表达上调,而在治疗后表达下调[11];miR-302c-3p,miR-483-5p等miRNA在ITP儿童患者的血浆中表达水平升高。然而,ITP患者中具体有哪些miRNA表达异常目前还有待进一步研究,miRNA在ITP的发生发展中的具体作用机制至今还未阐明。
我们前期通过基因芯片的实验发现miR-205在ITP患者中表达明显上调,此次研究通过实时定量PCR的方法检测患者PBMC中miR-205的表达水平,并分析其与患者血小板计数之间的相关性,为后续研究提供新线索。
1 材料和方法
1.1 标本来源 选取长海医院2014~2015年收治的ITP患者外周抗凝全血43例,其中男性21例,女性22例,年龄为22~63岁,诊断标准符合“成人原发免疫性血小板减少症诊治的中国专家共识(修订版)”[12],且均未接受过相关治疗。同时选取体检中心健康对照组38例,其中男性20例,女性18例,年龄为20~62岁,每例标本大约2 ml。ITP组和健康对照组在年龄和性别上差异无统计学意义(P>0.05)。此研究通过医院伦理委员会的批准,受试者均签署知情同意书。
1.2 试剂和仪器 反转录试剂盒,PCR试剂盒(购自takara公司);Trizo试剂(Invitrogen life technologies);淋巴细胞分离液,氯仿(国药集团化学试剂有限公司);无水乙醇,异丙醇(国药集团化学试剂有限公司);DEPC水,dd水,红细胞裂解液,2 ml EP管,200 μl EP管,Centrifuge 5417 R低温高速离心机,纯水仪,紫外分光光度计(ND-1000,Nanodrop Technologies),梯度PCR仪(ABI),PCR仪(ABI7500)。
1.3 检测方法 外周血PBMC的分离和总RNA的提取:用淋巴细胞分离液从EDTA-K2抗凝的2 ml静脉中分离PBMC,用Trizol提取细胞的总RNA,用紫外分光光度计(ND-1000,Nanodrop Technologies)检测所提取RNA的浓度及纯度。
CDNA的合成以及Real-timePCR反应miR-205以及U6的特异引物由上海赛百胜公司设计和合成,用反转录试剂盒进行反转录,用定量PCR试剂盒进行核酸扩增,试剂盒购自Takara公司,反转录和PCR条件严格按照试剂盒说明书进行操作。
1.4 ITP患者分组标准 选取的未经治疗的ITP患者归为初诊组(naive ITP group),ITP患者的治疗符合国内标准[12],经过标准治疗后:血小板>100×109/L且病情稳定的患者归完全缓解组(Complete remission group,CR group),共14例;血小板<100×109/L的患者或治疗有效但复发的患者归不完全缓解组(incmplete remission group,IR group),共29例。
1.5 统计学分析 采用GraphPad Prism6进行统计分析,组间均值比较采用独立样本t检验(Studentttests),相关性分析采用Pearson相关。P<0.05为差异具有统计学意义。
2 结果
2.1 ITP患者外周血单个核细胞(PBMC)miR-205的表达 与38例正常对照组相比,43例ITP初诊患者(Naive ITP)PBMC miR-205的表达水平更高(1.81±0.48 vs 0.92±0.25),差异有统计学意义(t=10.31,P<0.01);治疗后不完全缓解组(IR group)和初诊患者相比,miR-205的表达水平差异无统计学意义(P=0.112),与正常对照组相比,则表达升高(1.63±0.65 vs 0.92±0.25),差异有统计学意义(t=7.2,P<0.01);14例治疗后完全缓解组(CR group)治疗后(After treatment)PBMC miR-205的表达低于治疗前(Before treatment)的表达水平(1.07±0.43 vs 1.91±0.34),差异有统计学意义(t=5.68,P<0.01)。
2.2 相关性分析 ITP患者PBMC miR-205与血小板计数的相关性分析结果显示,ITP患者PBMC miR-205与血小板计数呈负相关(r=-0.069 6,P<0.05),见图1。
3 讨论
MicroRNA是一种微小(19~23个核苷酸)的单链非编码RNA,通过结合mRNA的3’非翻译序列区(3’untranslated sequence region,3’-UTR)而使mRNA降解或者抑制相关蛋白质的翻译,从而在转录后水平对基因的表达进行调控,一个microRNA可能结合多个mRNA,一个mRNA也可能被多个microRNA所调节[13]。研究发现microRNA在多种疾病状态下存在异常的表达,提示其参与了人体的发病过程。miR-205的编码基因LOC642587定位于染色体1q32.2区,miR-205的前体位于LOC642587的第二个内含子和第三个外显子链接的区域,是一个高度保守的microRNA,在多种疾病中都表现出异常的表达,比如Duan等[14]研究发现,miR-205通过调节其靶基因SMAD2而抑制了神经胶质瘤细胞的侵袭能力,在神经胶质瘤组织中,miR-205的表达低于癌旁组织。有研究[15,16]发现miR-205抑制其靶基因MLL-AF4的mRNA和蛋白质的表达,而MLL-AF4是一种可以引起急性白血病的致癌基因,miR-205高表达的最终结果是抑制细胞的增殖,这给急性白血病的治疗找到了新的突破口。Hu等[17]的研究发现,高表达的miR-205通过抑制其靶基因VEGFA和FGF2从而增加了乳腺癌细胞对化疗药物的敏感度。
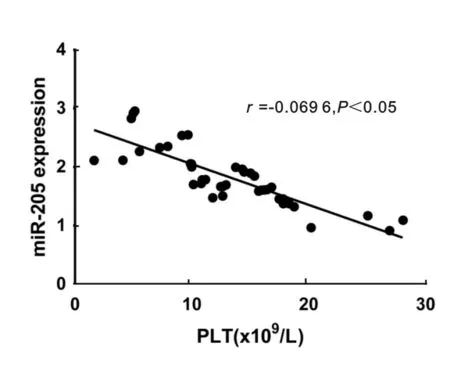
图1 原发性血小板减少症(ITP)患者PBMC miR-205表达水平与血小板计数结果的相关性
ITP是临床上常见的由血小板减少和破坏增多而引起的自身免疫性血液系统疾病。血小板的数量在一定程度上反映了TIP的严重程度,患者血小板计数结果越低,表明患者病情越重,反之则病情相对较轻。本次研究通过实时荧光定量PCR的方法,发现ITP患者PBMC中miR-205表达显著高于健康对照组,并且miR-205的表达水平与患者外周血血小板计数呈负相关,这提示miR-205可能参与了ITP的发病,并且可能与ITP 的严重程度密切相关,症状越严重的患者,其miR-205的表达水平也越高。另外我们对43例ITP初诊患者进行了跟踪调查,发现29例未完全缓解组miR-205的表达水平和初诊时相比基本未改变,而14例完全缓解组治疗后miR-205的表达水平与治疗前相比,显著降低,这也提示了miR-205与ITP的发生发展及预后密切相关。但miR-205是如何影响血小板的数量的,是作用于哪个靶基因以及通过什么信号通路而参与到ITP的发病与预后还有待进一步探索。
[1] Wang T,Wang Z,Yang R.Thrombopoietic growth factors in the treatment of immune thrombocytopenic purpura[J].Crit Rev Oncol Hematol,2011,77(3):172-183.
[2] Hu Y,Li H,Zhang L,et al.Elevated profiles of Th22 cells and correlations with Th17 cells in patients with immune thrombocytopenia[J].Hum Immunol,2012,73(6):629-635.
[3] Cao J,Chen C,Li L,et al.Effects of high-dose dexamethasone on regulating interleukin-22 production and correcting Th1 and Th22 polarization in immune thrombocytopenia[J].J Clin Immunol,2012,32(3):523-529.
[4] Wang T,Zhao H,Ren H,et al.Type 1 and type 2 T-cell profiles in idiopathic thrombocytopenic purpura[J].Haematologica,2005,90(7):914-923.
[5] Li X,Zhong H,Bao W,et al.Defective regulatory B-cell compartment in patients with immune thrombocytopenia[J].Blood,2012,120(16):3318-3325.
[6] 叶 辛,石 磊,谷明莉,等.原发性免疫性血小板减少症患者颗粒溶素、颗粒酶B、穿孔素的表达及临床意义[J].现代检验医学杂志,2014,29(1):20-23.
Ye X,Shi L,Gu ML,et al.Expression of granzyme B,granulysin and perforin from patients with primary immune thrombocytopenia[J].J Mod Lab Med,2014,29(1):20-23.
[7] Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[8] Sui T,Ma L,Li X,et al.Plasma microRNA profile in immune thrombocytopenia:screening and verification[J].National Medical Journal of China,2014,94(14):1083-1086.
[9] Bay A,Coskun E,Oztuzcu S,et al.Plasma microRNA profiling of pediatric patients with immune thrombocytopenic purpura[J].Blood Coagul Fibrinolysis,2014,25(4):379-383.
[10] Jernás M,Nookaew I,Wadenvik H,et al.MicroRNA regulate immunological pathways in T-cells in immune thrombocytopenia (ITP)[J].Blood,2013,121(11):2095-2098.
[11] Qian BH,Ye X,Zhang L,et al.Increased miR-155 expression in peripheral blood mononuclear cells of primary immune thrombocytopenia patients was correlated with serum cytokine profiles[J].Acta Haematol,2015,133(3):257-263.
[12] 中华医学会血液分会血栓与止血学组.成人原发免疫性血小板减少症诊治的中国专家共识(修订版)[J].中华血液学杂志,2011,32(3):214-216.
Hemostasis and Thrombosis Group,Hematology Society,Chinese Medical Association.Consensus of Chinese experts on diagnosis and treatment of adult primary immune thromboaytopenia[J].Chinese Journal of Hematology,2011,32(3):214-216.
[13] Griffiths-Jones S,Saini HK,van Dongen S,et al.miRBase:tools for microRNA genomics[J].Nucleic Acids Res,2008,36(Database issue):D154-158.
[14] Duan Y,Chen Q.TGF-beta1 regulating miR-205/miR-195 expression affects the TGF-beta signal pathway by respectively targeting SMAD2/SMAD7[J].Oncology Reports,2016,36(4):1837-1844.
[15] Dou L,Li J,Zheng D,et al.MicroRNA-205 downregulates mixed-lineage-AF4 oncogene expression in acute lymphoblastic leukemia[J].Onco Targets and Therapy,2013,6(1):1153-1160.
[16] Dou L,Zheng D,Li J,et al.Methylation-mediated repression of microRNA-143 enhances MLL-AF4 oncogene expression[J].Oncogene,2012,31(4):507-517.
[17] Hu Y,Qiu Y,Yague E,et al.miRNA-205 targets VEGFA and FGF2 and regulates resistance to chemotherapeutics in breast cancer[J].Cell Death & Disease,2016,7(6):e2291.
