PI3K/Akt和JAK2/STAT3信号转导通路在SO2抗大鼠肢体缺血再灌注致急性肺损伤中的作用
2016-01-11赵彦瑞,刘洋,王东等
PI3K/Akt和JAK2/STAT3信号转导通路在SO2抗大鼠肢体缺血再灌注致急性肺损伤中的作用*
赵彦瑞,刘洋,王东,单磊,周君琳△
(首都医科大学附属北京朝阳医院骨科,北京 100020)
[摘要]目的: 探讨PI3K/Akt和JAK2/STAT3信号转导通路在二氧化硫(SO2)抗肢体缺血再灌注(I/R)致急性肺损伤中的作用。方法: 应用双大腿根部绑扎止血带复制大鼠双后肢缺血再灌注肺损伤模型。在再灌注前20 min腹腔注射Na2SO3/NaHSO3;在再灌注前1 h静脉注射Stattic或LY294002。应用TUNEL、ELISA、Western blot等方法检测细胞凋亡、细胞因子表达及相关信号通路蛋白表达的情况。结果: 与对照组相比,I/R组的MDA及MPO含量、肺系数、细胞凋亡指数、细胞因子表达以及p-STAT3、p-Akt蛋白的水平均显著增高;当应用Na2SO3/NaHSO3后,上述反映肺损伤的各项指标均下降。Western blot检测结果显示I/R后,肺组织中p-STAT3和p-Akt蛋白的水平均明显增加。而应用Na2SO3/NaHSO3后,p-Akt蛋白的水平继续增加,但p-STAT3蛋白的水平却减少(P<0.05)。结论: JAK2/STAT3和PI3K/Akt信号通路都参与了SO2抗肢体缺血再灌注致急性肺损伤的作用。JAK2/STAT3通路的活化,能够使I/R损伤加重;相反,PI3K/Akt信号通路的活化,可以使I/R损伤减弱。此外,JAK2/STAT3和PI3K/Akt信号通路之间存在交互作用。
[关键词]PI3K/Akt信号通路; JAK2/STAT3信号通路; 二氧化硫; 缺血再灌注; 急性肺损伤
[中图分类号]R363[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.025
[文章编号]1000-4718(2015)11-2083-07
[收稿日期]2015-04-28[修回日期] 2015-07-09
[基金项目]*国家自然科学基金资助项目(No. 81471973);广东省社会发展领域科技计划 (No.2013B021800043; No.2014A020212212);广东省自然科学基金资助项目(No. S2013010016736)
通讯作者△Tel: 020-85221165; E-mail: thshg@126.com
Roles of PI3K/Akt and JAK2/STAT3 signaling pathways in protection of SO2against limb ischemia/reperfusion-induced acute lung injury in ratsZHAO Yan-rui, LIU Yang, WANG Dong, SHAN Lei, ZHOU Jun-lin
(DepartmentofOrthopedics,BeijingChaoyangHospital,CapitalMedicalUniversity,Beijing100020,China.E-mail:zhoujunlin@medmail.com.cn)
ABSTRACT[]AIM: To investigate the role of PI3K/Akt and JAK2/STAT3 pathways in the protection of sulfur dioxide (SO2) against limb ischemia/reperfusion (I/R)-induced acute lung injury (ALI) in rats. METHODS: ALI was induced by limb I/R in the SD rats. Na2SO3(0.54 mmol/kg, ip)/NaHSO3 (0.18 mmol/kg, ip) as SO2 donor was injected at 20 min before reperfusion. The inhibitors of JAK2/STAT3 and PI3K/Akt pathways, Stattic (3 mg/kg, iv) and LY294002 (40 mg/kg, iv), respectively, were injected at 1 h before reperfusion. Peripheral blood and lung tissues were collected for determining the contents of the cytokines, the protein levels of the molecules related to the signaling pathways, apoptosis and histopathologic changes by ELISA, TUNEL and Western blot. RESULTS: Compared with control group, the content of MDA, the activity of MPO, lung coefficient, apoptotic index, cytokine expression, and the protein levels of p-Akt and p-STAT3 in I/R group all increased significantly, and administration of Na2SO3/NaHSO3 attenuated the damage in the lung. Besides, the results of Western blot showed that the rat lung tissues expressed p-STAT3 protein and p-Akt protein. After I/R, the protein levels of p-STAT3 and p-Akt were increased. After using Na2SO3/NaHSO3, p-Akt was increased, but p-STAT3 was decreased (P<0.05). CONCLUSION: Both JAK2/STAT3 and PI3K/Akt pathways are likely involved in the protective effect of SO2 against limb I/R-induced ALI in rats. The activation of JAK2/STAT3 signaling pathway increases I/R injury. Reversely, the activation of PI3K/Akt signaling pathway reduces I/R injury. Besides, JAK2/STAT3 and PI3K/Akt signaling pathways may have crosstalk during I/R-induced ALI and JAK2/STAT3 pathway may have an impact on the P13K/Akt pathway.
[KEY WORDS]PI3K/Akt signaling pathway; JAK2/STAT3 signaling pathway; Sulfur dioxide; Ischemia/reperfusion; Acute lung injury

PI3K/Akt和JAK2/STAT3分子信号转道通路是重要的细胞信号转导通路。它们参与调节机体细胞活化、凋亡、炎症反应和趋化等多种病理生理学过程[12-13]。许多研究报道这2条信号转导通路均参与了多种干预措施的心肌保护作用[14-15]。这2条信号转导通路是否参与了SO2抗大鼠肢体缺血再灌注致急性肺损伤尚有待研究。因此,本研究拟应用PI3K/Akt和JAK2/STAT3信号通路的特异性抑制剂LY294002和Stattic探讨这2条信号通路在SO2抗肢体缺血再灌注致急性肺损伤中的作用。
材料和方法
1材料
健康雄性Sprague-Dawley(SD)大鼠,体重180~230 g,由中国医学科学院医学实验动物研究所提供;Na2SO3/NaHSO3,分析纯,购于北京康普汇维科技有限公司;髓过氧化物酶(myeloperoxidase,MPO)比色法活性检测试剂盒及丙二醛(malondialdehyde,MDA)测定试剂盒购自南京建成生物有限公司;细胞凋亡TUNEL检测试剂盒和Bradford蛋白测定试剂盒购自碧云天公司;Stattic(STAT3抑制剂)和LY294002(Akt抑制剂)购自Selleck;STAT3、Akt、GAPDH、p-STAT3和p-Akt抗体购自恩晶生物公司;II抗购自于上海研卉生物有限公司;5% 牛血清白蛋白封闭液购自北京索莱宝公司;蛋白酶抑制剂混合物和蛋白磷酸酶抑制剂混合物购自北京普利莱公司;大鼠IL-1、IL-6、TNF-α 和IL-10 ELISA试剂盒购自达科为公司。
2动物模型
按照Cohen等[16]提供的方法复制肢体I/R致ALI动物模型。健康雄性SD大鼠应用苯巴比妥钠(40 mg/kg,ip)麻醉。分离左侧颈外静脉及右侧颈总动脉插管用予补液(乳酸林格氏液2 mL/h)、给药及采血。用橡皮止血带绑扎双后肢根部造成肢体缺血,4 h后松开止血带使肢体血流再灌注2 h。应用激光多普勒(PERIMED)探测血流以确认肢体的缺血和再灌注。
3实验分组
将40只SD大鼠随机分为对照组、I/R组、I/R+SO2组、I/R+SO2+ LY294002组和I/R+SO2+Stattic组。对照组动物给予同样的麻醉和操作,只是不造成肢体缺血;I/R组动物双后肢缺血4 h再灌注2 h;I/R+SO2组于再灌注前20 min给予SO2供体Na2SO3(0.54 mmol/kg, ip)/NaHSO3(0.18 mmol/kg, ip);I/R+SO2+LY294002组和I/R+SO2+Stattic组除了给予SO2外,在再灌注前1 h分别给以抑制剂LY294002 (40 mg/kg,iv)及Stattic(3 mg/kg,iv)。实验结束时,麻醉处死大鼠。留取血样并离心(4 000 r/min,10 min,0~4 ℃),血浆储存在-80 ℃冰箱用于日后检测细胞因子IL-1β、IL-6、IL-10和TNF-α。肺组织取出称重后一部分固定于10%甲醛中,用于病理切片;剩余肺组织保存于-80 ℃冰箱,用于日后检测MDA含量和MPO活性,细胞因子IL-1β、IL-6、IL-10和TNF-α的表达,信号通路分子STAT3、Akt、p-STAT3和p-Akt蛋白的水平。
4检测指标和方法
4.1组织学检查及细胞凋亡情况检测肺组织取出后,一部分固定于10%甲醛中,常规石蜡包埋、切片及HE染色,光镜下观察肺组织形态学变化。我们应用TUNEL技术进行细胞凋亡情况检测。按照公司提供的试剂盒说明书所述方法进行操作。凋亡细胞胞核经TUNEL染色呈绿色,未凋亡细胞胞核DAB复染后呈蓝色。随机计数5个高倍镜下的凋亡细胞数。每张片子至少观察500个细胞,计算每100个细胞内的阳性细胞,即凋亡指数(apoptotic index,AI)。
4.2肺系数检测自气管分叉以上第5及第6软骨环之间剪断气管,将肺组织完整取出,用滤纸吸干肺组织表面的血污后称重。肺系数=全肺湿质量(g)/体质量(kg)。
4.3肺组织中MDA含量和MPO活性的检测应用MDA和MPO试剂盒,按照公司说明进行操作检测肺组织匀浆中MDA和MPO的含量变化。
4.4血清及肺组织中IL-1β、IL-6、IL-10和TNF-α水平的测定使用ELISA试剂盒测定血清及肺组织中IL-1β、IL-6、IL-10和TNF-α的浓度,按试剂公司说明书进行操作。以检测IL-1β为例步骤如下:首先,将IL-1β标准品按梯度稀释后加入标准品孔,检测样品加入样品孔。然后加入biotinylated antibody,混匀后,盖上封板膜,37 ℃温育90 min。温育后,扣去孔内液体,加入1×washing buffer洗板,停留1 min后弃去孔内液体;重复4 次,每一次在滤纸上扣干。再加入稀释后的streptavidin-HRP,盖上封板膜,37 ℃温育30 min。按上述方法再次洗板4次。加入TMB进行显色,37 ℃避光温育5~30 min之间。最后迅速加入stop solution终止反应。终止后10 min内,应用酶标仪在波长450 nm处进行检测。绘制出标准曲线,计算样品IL-1β的浓度。应用同样的方法对IL-6、IL-10和TNF-α进行检测。
4.5Western blot检测STAT3、Akt、p-STAT3和P-Akt的蛋白水平将肺组织解冻,切成小块后,采用电子天平称量大约20 mg,按照每10 mg组织加入200 μL蛋白裂解液的比例加入预冷的总蛋白抽提试剂,同时加入50×蛋白酶抑制剂和100×蛋白磷酸酶抑制剂。在冰上进行研磨匀浆,直至充分裂解。将组织匀浆转移至预冷的1.5 mL的EP管中,置于冰上15 min充分裂解。裂解后放置在预冷的离心机中离心(12 000 r/min、4 ℃、10 min),取上清液,-20 ℃保存备用。上清液依次进行蛋白定量、聚丙烯酰胺凝胶电泳、转膜、封闭之后,采用兔抗大鼠I抗孵育,4 ℃过夜。用TBST洗膜3次,每次10 min。采用5% BSA封闭液稀释的山羊抗兔IgG II抗抗体孵育2 h。孵育结束后,应用TBST再次洗膜3次,每次10 min。随后进行化学发光、显影定影和图像分析。
5统计学处理
数据以均数±标准差(mean±SD)表示,应用SPSS 17.0统计软件分析。组间比较采用单因素方差分析(方差齐的应用LSD或S-N-K法,方差不齐的应用Dunnett’s T3或Dunnett’s C法),以P<0.05为差异有统计学意义。
结果
1肺组织形态学和肺系数的变化
光镜下观察可见大鼠肢体缺血4 h再灌注2 h后,肺组织出现间质水肿、肺泡增厚及PMN浸润的组织学变化。应用Na2SO3/NaHSO3后肺组织学改变明显减轻;应用Stattic抑制剂后,肺组织学改变也明显减轻;应用LY294002抑制剂后,肺组织学改变减轻,但不如应用Na2SO3/NaHSO3和Stattic明显。与对照组相比,I/R组肺系数显著增大(P<0.01);与I/R组相比,I/R+SO2组明显变小(P<0.01);与I/R+SO2组比较,I/R+SO2+LY294002组的肺系数增大,而I/R+SO2+Stattic组则进一步减小(P<0.05),见图1、表1。

Figure 1.Lung morphological changes in limb I/R-induced ALI rats with different treatments.
图1不同实验组肺组织病理学的改变
2肺组织中MDA含量和MPO活性的变化
各组大鼠MDA含量和MPO活性的变化趋势一致。与对照组相比,I/R组明显增高(P<0.01),与I/R组相比,I/R+SO2组明显减少(P<0.01);与I/R+SO2组比较,I/R+SO2+LY294002组增加,然而I/R+SO2+Stattic组进一步减少(P<0.05),见表1。
3TUNEL结果
对照组中仅见少量凋亡细胞,凋亡指数为1.45%。与对照组相比,I/R组的凋亡细胞明显增加,凋亡指数达17.2%;与I/R组相比,当应用Na2SO3/NaHSO3后,凋亡细胞明显减少,凋亡指数降到6.5%;在I/R+SO2+Stattic组,凋亡细胞也明显减少,凋亡指数为5.5%;但在I/R+SO2+LY294002组,凋亡细胞减少不明显,凋亡指数为10.33%,见图2。
表1肺组织中MDA、MPO及肺系数变化情况
Table 1.The changes of MPO activity, MDA content and lung coefficient in the lung of limb I/R-induced ALI rats with different treatments (Mean±SD.n=8)

GroupMDA(μmol/L)MPO(U/g)LW/BW(g/kg)Control36.62±1.782.43±0.364.86±0.16I/R49.78±1.84**4.98±0.89**6.02±0.29**I/R+SO244.87±0.96##3.39±0.41##5.24±0.15##I/R+SO2+LY29400247.74±1.30†3.94±0.14†5.45±0.14†I/R+SO2+Stattic43.34±1.03†2.90±0.31†5.05±0.15†
**P<0.01vscontrol group;##P<0.01vsI/R group;†P<0.05vsI/R+SO2group.

Figure 2.Apoptosis analysis of the lung tissues in limb I/R-induced ALI rats with different treatments. Mean±SD.n=8.**P<0.01vscontrol group;##P<0.01vsI/R group;△P<0.05vsI/R+SO2group.
图2肺组织细胞凋亡TUNEL染色结果及凋亡指数变化
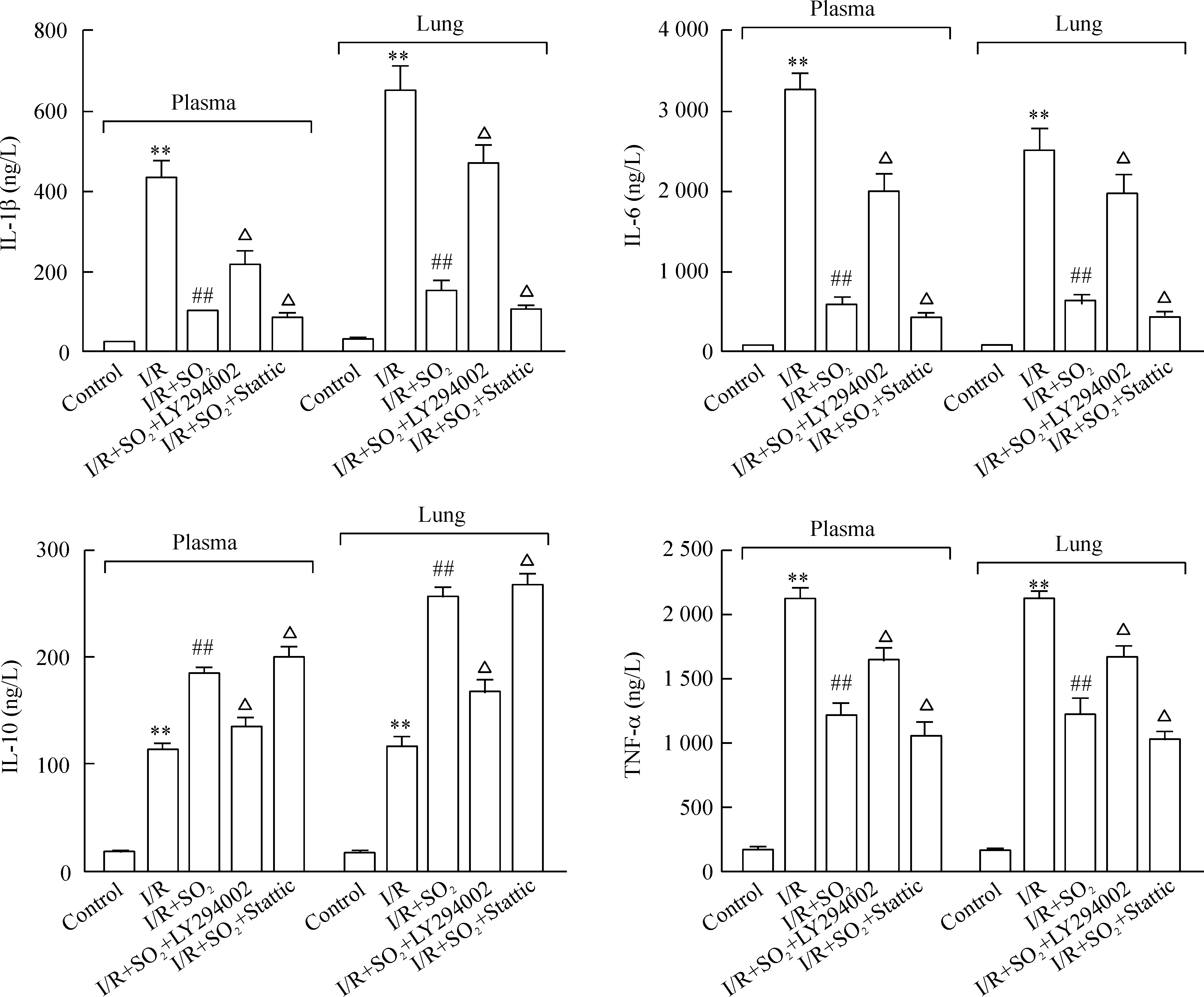
Figure 3.The contents of IL-1β, IL-6, IL-10 and TNF-α in the plasma and lung tissues from limb I/R-induced ALI rats with different treatments. Mean±SD.n=8.**P<0.01vscontrol group;##P<0.01vsI/R group;△P<0.05vsI/R+SO2group.
图3肺组织及血浆中细胞因子IL-1β、IL-6、IL-10和TNF-α的含量
4肺组织及血浆中细胞因子含量的变化
和对照组相比,I/R组肺组织及血浆中的IL-1β、IL-6、IL-10和TNF-α的含量均明显增加(P<0.01)。与I/R组相比,I/R+SO2组肺组织及血浆中的IL-1β、IL-6和TNF-α含量明显减少,但IL-10的含量却明显增加(P<0.01)。与I/R+SO2组比较,I/R+SO2+LY294002组肺组织及血浆中的IL-1β、IL-6和TNF-α含量增加(P<0.05),IL-10的含量无明显变化;然而,I/R+SO2+Stattic组肺组织及血浆中的IL-1β、IL-6和TNF-α含量却减少(P<0.05),IL-10含量无明显变化,见图3。
5肺组织中STAT3、p-STAT3、Akt和p-Akt蛋白水平的变化
Western检测结果显示大鼠肺组织中存在p-STAT3蛋白(36.22%)及p-Akt蛋白(39.12%)。和对照组相比,I/R组肺组织中p-STAT3和p-Akt的蛋白水平均明显增加,分别为82.27%和61.60%(P<0.01)。与I/R组相比,I/R+SO2组肺组织中p-Akt蛋白水平增加达82.56%,但p-STAT3蛋白水平却减少为52.56% (P<0.01)。与I/R+SO2组比较,I/R+SO2+LY294002组肺组织中p-Akt水平明显减少(P<0.05),p-STAT3蛋白水平无明显变化(P>0.05);I/R+SO2+Stattic组肺组织中p-STAT3蛋白水平明显减少(P<0.05),p-Akt却增加至92.13% (P<0.05),见图4。
讨论
JAK2/STAT3信号通路是近年来研究较多的一条信号转导途径。STAT3信号通路可将细胞膜感受到的信号直接传递至核内,激活靶基因的转录,环节少而简洁。许多细胞因子(CNTF、IL-2、IL-6等)和生长因子(PDGF、EGF、CSF等)都利用该信号转导途径

Figure 4.The protein levels of Akt, p-Akt, STAT3 and p-STAT3 in the lung tissues of limb I/R-induced ALI rats with different treatments determined by Western blot. Mean±SD.n=8.**P<0.01vscontrol group;##P<0.01vsI/R group;△P<0.05vsI/R+SO2group.
图4肺组织中STAT3、p-STAT3、Akt和p-Akt蛋白水平的变化
诱导细胞的分化、增殖或凋亡,它们在免疫功能调节、肿瘤的发生以及造血细胞生成中发挥着特异、多效的生物学功能。有研究显示[7],A9490(一种STAT3通路抑制剂)具有心血管保护作用,能减轻心肌缺血再灌注损伤。Macchi等[17]报道STAT3通路参与磺达肝癸(fondaparinux,FDX)诱导的心脏保护效应。
PI3K属于定位于肌醇环D3位置的磷酸化磷脂酰肌醇磷脂激酶家族,PI3K家族的一级结构参与细胞外信号转导,其反应产物为第二信使,其靶基因为丝氨酸/苏氨酸激酶。Akt位于PI3K下游,通过细胞外刺激激活PI3K,Akt从胞浆转移至胞膜,在胞膜Akt的2个残基(苏氨酸308和丝氨酸473)磷酸化,使Akt完全激活。Akt通路可以抑制细胞凋亡,促进细胞生长。Zhao等[18]报道PI3K/Akt通路参与调节SO2预处理能减轻大鼠心肌缺血损伤。
为了探索JAK2/STAT3和PI3K/Akt信号通路在SO2抗肢体缺血再灌注致急性肺损伤中的作用。我们应用其特异性阻滞剂Stattic及LY294002进行研究。结果显示,与I/R组比较,I/R+SO2组p-Akt的蛋白水平增加,肺组织中MDA、MPO的含量表达减少,肺系数变小,肺组织及血浆中IL-1β、IL-6和TNF-α表达减少。与I/R+SO2组比较,I/R+SO2+LY294002组肺组织中p-Akt表达明显减少,而肺组织中MDA、MPO含量表达增加,肺系数增大,肺组织及血浆中IL-1β、IL-6和TNF-α表达也增加。这表明抑制PI3K/Akt信号通路,减弱了SO2对肢体缺血再灌注致急性肺损伤的拮抗作用。与I/R+SO2组比较,I/R+SO2+Stattic组肺组织中p-STAT3的蛋白水平明显减少,肺组织中MDA、MPO含量表达减少,肺系数变小,肺组织及血浆中IL-1β、IL-6和TNF-α的含量也减少。这表明抑制JAK2/STAT3信号通路,增强了SO2对肢体缺血再灌注致急性肺损伤的拮抗作用。也就是说,JAK2/STAT3和PI3K/Akt信号通路都参与了SO2抗肢体缺血再灌注致急性肺损伤的作用;JAK2/STAT3通路的活化,加重了I/R损伤;PI3K/Akt信号通路的活化,减弱了I/R损伤。
Western blot的结果显示,大鼠肺组织中存在p-STAT3蛋白及p-Akt蛋白。当I/R后,肺组织中p-STAT3和p-Akt的蛋白水平均明显增加,而应用Na2SO3/NaHSO3后,肺组织中p-Akt的蛋白水平增加,但p-STAT3的蛋白水平却减少。说明p-STAT3蛋白加重肺损伤,而p-Akt蛋白可减轻肺损伤。因此,我们推测SO2通过抑制JAK2/STAT3信号通路减少p-STAT3的蛋白水平,通过活化PI3K/Akt信号通路促进Akt蛋白磷酸化来实现对肢体缺血再灌注致急性肺损伤的拮抗作用。
与I/R+SO2组比较,当应用LY294002抑制剂后,肺组织中p-Akt的蛋白水平明显减少,p-STAT3的蛋白水平却无明显变化;但当应用Stattic抑制剂后,除了p-STAT3的蛋白水平明显减少外,p-Akt的蛋白水平进一步增加。这表明JAK2/STAT3和PI3K/Akt信号通路之间存在交互作用。我们推测JAK2/STAT3信号通路可以影响PI3K/Akt信号通路,但PI3K/Akt信号通路却不能影响JAK2/STAT3信号通路。Stattic通过抑制JAK2/STAT3信号通路促进了p-Akt蛋白的生成,进而达到肺保护的作用。Suleman等[19]研究报道,JAK2/STAT3和PI3K/Akt通路间也存在交互作用。Goodman等[20]在研究心肌缺血预处理时,也发现RISK通路(包括Akt)和SAFE(包括STAT)通路之间存在交互作用。
总之,SO2对肢体缺血再灌注致急性肺损伤具有拮抗作用,JAK2/STAT3和PI3K/Akt信号通路都参与了这一过程当中。JAK2/STAT3通路的活化能够加重I/R损伤;相反,PI3K/Akt信号通路的活化可以减弱I/R损伤。另外,JAK2/STAT3和PI3K/Akt信号通路之间存在交互作用,JAK2/STAT3信号通路可以影响PI3K/Akt信号通路。抑制剂Stattic通过抑制JAK2/STAT3信号通路促进了Akt的磷酸化,进而达到肺保护作用。然而,确切的机制需要我们进一步研究。
[参考文献]
[1]周君琳,凌亦凌,苏庆军,等.外源性一氧化碳抗大鼠肢体缺血再灌注所致肺损伤的实验研究[J].中国病理生理杂志,2006,22(2):303-306.
[2]Atabai K, Matthay MA. The pulmonary physician in critical care·5: acute lung injury and the acute respiratory distress syndrome: definitions and epidemiology [J]. Thorax, 2002, 57(5):452-458.
[3]Meng Z. Oxidative damage of sulfur dioxide on various organs of mice: sulfur dioxide is a systemic oxidative damage agent[J]. Inhal Toxicol, 2003, 15(2):181-195.
[4]Meng Z, Liu Y. Cell morphological ultrastructural changes in various organs from mice exposed by inhalation to sulfur dioxide[J]. Inhal Toxicol, 2007, 19(6-7):543-551.
[5]Mitsuhashi H, Ikeuchi H, Yamashita S, et al. Increased levels of serum sulfite in patients with acute pneumonia[J]. Shock, 2004, 21(2):99-102.
[6]Zhang B, Nie A, Bai W, et al. Effects of aluminum chloride on sodium current, transient outward potassium current and delayed rectifier potassium current in acutely isolated rat hippocampal CA1 neurons[J]. Food Chem Toxicol, 2004, 42(9):1453-1462.
[7]Meng Z, Qin G, Zhang B, et al. DNA damaging effects of sulfur dioxide derivatives in cells from various organs of mice[J]. Mutagenesis, 2004, 19(6):465-468.
[8]Ubuka T, Yuasa S, Ohta J, et al. Formation of sulfate from L-cysteine in rat liver mitochondria[J]. Acta Med Okayama, 1990, 44(2):55-64.
[9]Jin HF, Du SX, Zhao X, et al. Effects of endogenous sulfur dioxide on monocrotaline induced pulmonary hypertension in rats[J]. Acta Pharmaeol Sin, 2008, 29(10):1157-1166.
[10]Huang XL, Liu Y, Zhou JL, et al. Role of sulfur dioxide in acute lung injury following limb ischemia/reperfusion in rats[J]. J Biochem Mol Toxicol, 2013, 27(8):389-397.
[11]黄新莉,周君琳,黎宁,等.二氧化硫对大鼠肢体缺血再灌注所致肺损伤的影响及其作用机制[J].中国病理生理杂志,2013,29(10):1747-1752.
[12]Gerits N, Kostenko S, Moens U.Invivofunctions of mitogen-activated protein kinases: conclusions from knock-in and knock-out mice[J]. Transgenic Res,2007, 16(3):281-314.
[13]Cargnello M, Roux PP. Activation and function of the MAPKs and their substrates, the MAPK-activated protein kinases[J]. Microbiol Mol Biol Rev, 2011, 75(1):50-83.
[14]Bolli R, Stein AB, Guo Y, et al. A murine model of inducible, cardiac-speeifie deletion of STAT3: its use to determine the role of STAT3 in the upregulation of cardioprotective proteins by ischemic preconditioning[J]. J Mol Cell Cardiol, 2011, 50(4):589-597.
[15]Tian Y, Zhang W, Xia D, el a1. Postconditioning inhibits myocardial apoptosis during prolonged reperfusion via a JAK2/STAT3-Bcl-2 pathway[J]. J Biomed Sci, 201l, 18:53.
[16]Cohen SM, Siddiqi FA, Darakchiev B, et al. Attenuation of acute lung injury caused by hind-limb ischemia-reperfusion injury by butyrolactone anti-inflammatory agent FL1003[J]. J Trauma, 1997, 43(2):247-252.
[17]Macchi L, Moussa WB, Guillou S, et al. The synthetic pentasaccharide fondaparinux attenuates myocardial ischemia-reperfusion injury in rats via STAT-3[J]. Shock, 2014, 41(2):166-171.
[18]Zhao MM, Yang JY, Wang XB, et al. The PI3K/Akt pathway mediates the protection of SO2preconditioning against myocardial ischemia/reperfusion injury in rats[J]. Acta Pharmacol Sin, 2013, 34(4):501-506.
[19]Suleman N, Somers S, Smith R, et al. Dual activation of STAT-3 and Akt is required during the trigger phase of is-chaemic preconditioning [J]. Cardiovasc Res, 2008, 79(1):127-133.
[20]Goodman MD, Koch SE, Fuller-Biter GA, et al. Regulating RISK: a role for JAK/STAT signaling in postconditioning[J]. Am J Physiol Heart Circ Physiol, 2008, 295(4): H1649-H1656.
(责任编辑: 林白霜, 罗森)

▲并列第1作者
