BARF1表达下调通过活化caspase依赖的线粒体通路诱导EBV阳性胃癌细胞凋亡
2016-01-11刘俊,张雪林,任永生等
BARF1表达下调通过活化caspase依赖的线粒体通路诱导EBV阳性胃癌细胞凋亡
刘俊1,张雪林2,任永生3,郑新1△
(1湖北医药学院附属东风医院胃肠外科,湖北 十堰 442008; 湖北医药学院2护理学院,3基础医学院,湖北 十堰 442000)
[摘要]目的: 研究BARF1表达下调对EBV阳性胃癌细胞凋亡的影响,以及BARF1基因沉默介导细胞凋亡的分子机制。方法: siRNA和NCsiRNA分别转染NUGC3和SNU719细胞,运用Western blot测定细胞中BARF1、Bcl-2、Bax、细胞色素C、caspase 3和caspase 9的蛋白表达;RT-PCR测定BARF1、Bcl-2和Bax mRNA的表达;台盼蓝染色法测定细胞存活率;Annexin V-FITC/PI染色法和流式细胞仪测定细胞凋亡;细胞凋亡因子抗体芯片分析细胞中凋亡相关蛋白的表达;线粒体膜电位检测试剂盒测定线粒体膜电位;免疫共沉淀检测细胞中Apaf-1和caspase 9的相互作用。结果: 与空白对照组和阴性对照组相比, BARF1基因沉默显著诱导NUGC3和SNU719细胞凋亡,而线粒体膜电位显著降低。BARF1沉默基因能促进促凋亡蛋白的表达并抑制抗凋亡蛋白的表达,Bcl-2/Bax比例显著降低;而caspase抑制剂能抑制由BARF1基因沉默介导的细胞凋亡。在siRNA转染的细胞中,caspase 3和caspase 9蛋白发生裂解,细胞色素C的浓度显著高于阴性对照组,Apaf-1蛋白与caspase 9蛋白在细胞质中能够发生相互作用。结论: BARF1基因沉默通过线粒体途径调节Bcl-2和Bax蛋白的表达进而诱导NUGC3和SNU719细胞凋亡,并呈caspase通路依赖关系。
[关键词]BARF1; EB病毒; 胃癌; 细胞凋亡; 线粒体通路
[中图分类号]R730.23[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.008
[文章编号]1000-4718(2015)11-1979-07
[收稿日期]2015-04-28[修回日期] 2015-07-14
通讯作者△Tel: 0472-2178435; E-mail: xbkld@163.com
Down-regulated BARF1 expression induces EBV-positive gastric carcinoma cell apoptosis via activating caspase-dependent mitochondrial pathwayLIU Jun1, ZHANG Xue-lin2, REN Yong-sheng3, ZHENG Xin1
(1DepartmentofGastrointestinalSurgery,TheAffiliatedDongfengHospital,HubeiUniversityofMedicine,Shiyan442008,China;2CollegeofNursing,3CollegeofBasicMedicine,HubeiUniversityofMedicine,Shiyan442000,China.E-mail:Zhengxin19740912@163.com)
ABSTRACT[]AIM: To investigate the effects of BARF1 down-regulation on EBV-positive gastric carcinoma cell apoptosis, and the molecular mechanisms by BARF1 silencing-mediated apoptosis. METHODS: After NUGC3 and SNU719 cells were transfected with NCsiRNA and siRNA, respectively, the protein levels of BARF1, Bcl-2, Bax, cytochrome C, caspase 3 and capase 9 were detected by Western blot, and the mRNA expression of BARF1, Bcl-2 and Bax was determined by RT-PCR. The cell viability was measured by the method of Trypan blue exclusion and the cell apoptosis was analyzed by flow cytometry analysis with Annexin V-FITC/PI staining. The expression of the apoptosis-related proteins in the cells transfected with siRNA and NCsiRNA was examined by human apoptosis antibody arrays. Mitochondrial membrane potential was determined by flow cytometry. The interaction between Apaf-1 and caspase 9 was confirmed by immunoprecipitation. RESULTS: Compared with untreated and NCsiRNA groups, BARF1 gene silencing significantly inhibited the cell viability, induced apoptosis, and reduced the mitochondrial membrane potential in the NUGC3 and SNU719 cells transfected with siRNA. BARF1 gene silencing up-regulated the expression of pro-apoptotic proteins and down-regulated the expression of anti-apoptotic proteins, and the Bcl-2/Bax ratio was significantly decreased. In BARF1 gene silencing cells, the caspase inhibitor z-VAD-fmk inhibited BARF1 silencing-mediated apoptosis, and significantly increased the levels of cleaved caspase 3 and caspase 9. The concentration of cytochrome C significantly increased as compared with NCsiRNA group, and Apaf-1 interacted with caspase 9 in the cytoplasm. CONCLUSION: BARF1 silencing induces apoptosis via the mitochondrial pathway through regulating the expression of Bcl-2 and Bax proteins in a caspase-dependent manner in the NUGC3 and SNU719 cells.
[KEY WORDS]BARF1; Epstein-Barr virus; Gastric carcinoma; Apoptosis; Mitochondrial pathway
EB病毒(Epstein-Barr virus,EBV)属于癌症病毒家族,由于EBV与多种恶性肿瘤的发生密切相关而备受关注[1]。EBV编码的LMP1癌基因和BARF1癌基因在调控关键基因表达以及参与EBV介导的肿瘤发生中具有重要作用[2]。研究发现,在B细胞淋巴瘤和鼻NK/T细胞淋巴瘤中能检测到BARF1的表达[3-4]。此外,BARF1在鼻咽癌细胞、EBV相关胃癌细胞以及EBV阳性永生化表皮细胞中高表达[5-6]。
大量研究表明,BARF1基因高表达能够诱导鼠成纤维细胞和人EBV阴性B细胞的恶性转化[7]。携带BARF1基因的EBV重组体感染的EBV阴性细胞对裸鼠的致瘤能力显著增强,但细胞中Bcl-2的表达无变化[8]。有研究发现纯化的BARF1蛋白具有很高的促有丝分裂原活性,BARF1能促进鼠成纤维细胞和EBV阴性人B细胞中抗凋亡蛋白Bcl-2的表达,提示BARF1具有抗凋亡作用[9-10]。另有研究发现,BARF1通过增加Bcl-2和Bax的比例抑制胃癌细胞凋亡[11]。BARF1能促进多种癌细胞增殖,其可能作为一种促癌因子并能够抑制细胞凋亡通路进而抑制细胞凋亡[12]。但是,BARF1抑制胃癌细胞凋亡的分子机制仍不完全清楚。因此,本文以EBV阳性胃癌细胞系NUGC3和SNU719细胞为研究对象,体外研究BARF1抗细胞凋亡的分子机制。
材料和方法
1细胞株和材料
EBV阳性胃癌细胞系NUGC3和SNU719细胞购自ATCC;胎牛血清、胰蛋白酶和RPMI-1640培养基(Gibco);双抗购自北京鼎国昌盛生物技术有限责任公司;DMSO和MTT购自Sigma;脂质体2000、RT-PCR试剂盒、TRIzol试剂和Annexin V-FITC/PI试剂盒购自Invitrogen;BCA蛋白浓度检测试剂盒购自Thermo;抗体(BARF1、Bcl-2、Bax、PARP、caspase 9、caspase 3、细胞色素C和Apaf-1)购自CST;GAPDH抗体和Ⅱ抗IgG购自北京中杉金桥生物技术有限公司;APO LOGIX JC-1线粒体膜电位检测试剂盒购自上海博升生物科技有限公司;RayBio®人细胞凋亡因子抗体芯片试剂盒购自广州瑞博奥生物科技有限公司;其它试剂均为国产分析纯。
2主要方法
2.1细胞培养NUGC3和SNU719细胞培养于含10%胎牛血清、1%青霉素和1%链霉素的RPMI-1640 培养基中,置于37 ℃、5% CO2及饱和湿度的培养箱内。待细胞融合度达到80%~90%时进行细胞传代,按细胞密度转到相应细胞培养瓶中正常培养。
2.2siRNA合成从GenBank获得BARF1基因序列(GenBank:V01555),针对BARF1基因开放阅读框序列的3个不同位置 (189-207、409-427和545-563 bp),运用Ambion公司的网上在线软件(http://www.ambion.com/techlib/misc/siRNA_finder.html)筛选获得3条不同的siRNA序列,由上海生工合成。通过实验筛选能显著干扰BARF1 mRNA表达的siRNA序列,即针对BARF1基因序列409~427 bp区间的siRNA序列,见表1,同时设计阴性对照siRNA(negative control siRNA,NCsiRNA)序列。
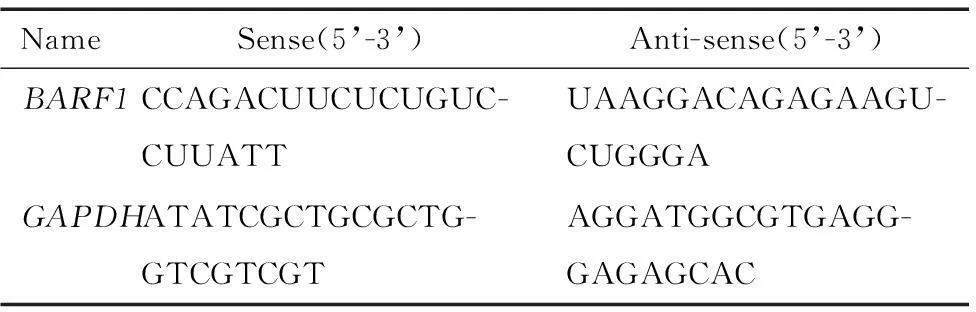
表1 BARF1基因的siRNA序列
2.3siRNA转染通过siRNA干扰NUGC3和SNU719细胞中BARF1基因表达,观察BARF1基因沉默对细胞活力和细胞凋亡的影响。将生长良好的NUGC3细胞和SNU719细胞消化计数后,以细胞密度为2.5×105cells/well接种到6孔板中,置于37 ℃、5% CO2及饱和湿度的培养箱中,待细胞融合度达到80%~90%时按照脂质体2000说明书进行siRNA转染。转染的细胞培养4 h后换成完全培养基,以转染NCsiRNA为阴性对照,未转染(untreated)的细胞为空白对照,细胞置于培养箱中培养用于后续实验。
2.4RT-PCR转染的细胞经消化,离心后收集细胞,按照TRIzol试剂说明书提取总RNA,分光光度计测定其吸光度(A)值,A260/A280的比值在1.8~2.0之间表示RNA纯度满足实验需求,通过电泳验证RNA的完整性,RNA保存于-80 ℃。按照RT-PCR试剂盒说明书合成cDNA,反应条件为42 ℃ 1 h;70 ℃ 5 min;4 ℃放置10 min,合成的cDNA置于-80 ℃保存。取1 μL cDNA进行PCR反应,Bcl-2、Bax和GAPDH引物见表2。PCR反应条件为94 °C 5 min; 94 ℃ 30 s,56 ℃ 40 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。PCR产物进行凝胶电泳,拍照,运用Quantity-One软件进行结果分析,Bcl-2和Bax的表达量经GAPDH标准化表示。
表2Bcl-2、Bax和GAPDH的RT-PCR扩增引物
Table 2. The primers of Bcl-2, Bax and GAPDH for RT-PCR amplification
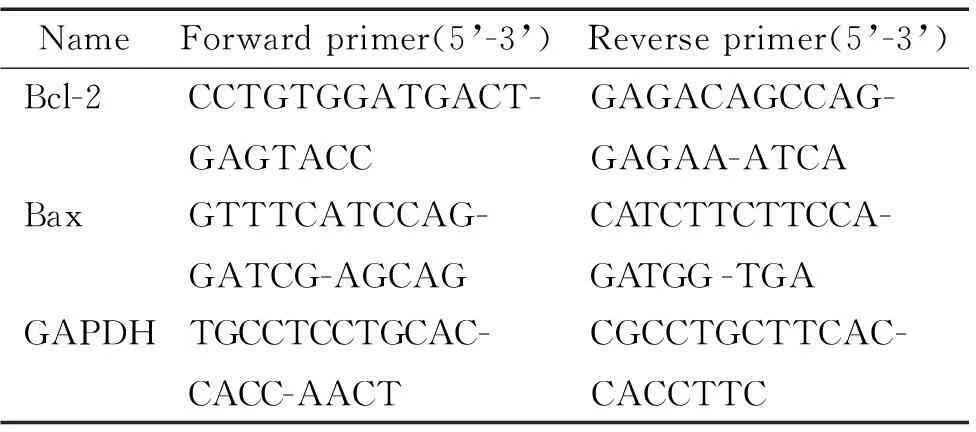
NameForwardprimer(5’-3’)Reverseprimer(5’-3’)Bcl-2CCTGTGGATGACT-GAGTACCGAGACAGCCAG-GAGAA-ATCABaxGTTTCATCCAG-GATCG-AGCAGCATCTTCTTCCA-GATGG-TGAGAPDHTGCCTCCTGCAC-CACC-AACTCGCCTGCTTCAC-CACCTTC
2.5台盼蓝染色计数法转染的细胞分别在0 h、48 h和72 h进行台盼蓝染色后计数。细胞经消化离心后加入PBS制成细胞悬液,取50 μL细胞悬液加入450 μL 0.4%台盼蓝轻轻混匀,室温染色5 min。取10 μL染色后的细胞悬液加入到细胞计数板,选择3个不同区域计数。按照下列公式计算细胞存活率:细胞存活率(%)=平均活细胞数/平均总细胞数×100%。
2.6流式细胞术检测细胞凋亡为了研究BARF1表达下调是否通过激活caspase通路诱导细胞凋亡,选择caspase抑制剂z-VAD-fmk处理经siRNA转染的胃癌细胞,观察细胞凋亡情况。转染的细胞培养72 h后弃掉培养基,PBS洗涤,细胞经无EDTA的胰酶消化收集细胞,加入PBS制成细胞悬液。按照Annexin V试剂盒说明书操作,先加入500 μL的binding buffer重悬细胞,再加入5 μL FITC标记的Annexin V和5 μL PI混匀,室温下避光孵育15 min,运用流式细胞术检测细胞凋亡。
2.7Western blot检测蛋白水平转染的细胞培养72 h后经胰酶消化,离心收集细胞,加入RIPA细胞裂解液重悬细胞,超声破碎、12 000 r/min,4 ℃离心10 min,按照BCA试剂盒说明书测定总蛋白浓度。按照线粒体分离试剂盒说明书分离细胞中的线粒体,并提取线粒体中的总蛋白;收集细胞培养液,5 000 r/min,4 ℃离心10 min去除细胞碎片,PBS洗涤;加入10 mL无血清培养基轻轻吹打混匀,超滤浓缩至10 μL,测定总蛋白浓度。每个样本取50 μg进行10% SDS-PAGE,转移到硝酸纤维素膜上,5%脱脂奶粉室温封闭1 h,分别孵育Ⅰ抗(BARF1、Bcl-2、Bax、PARP、caspase 9、caspase 3、细胞色素C和Apaf-1),以GAPDH为内参照,4 ℃过夜。洗膜,分别孵育AP偶联或HRP偶联的Ⅱ抗,室温孵育1 h。AP偶联的膜经KPL显影后扫描,HRP偶联的膜经ECL显影后扫描,蛋白相对表达量经内参照归一化后经Quantity One软件分析。
2.8线粒体膜电位变化的测定线粒体膜电位变化能激活细胞凋亡通路使细胞发生凋亡,因此运用线粒体膜电位测定试剂盒和流式细胞仪测定NUGC3和SNU719细胞中BARF1表达下调对线粒体膜电位的影响。JC-1阳离子荧光染料与线粒体结合呈红色(线粒体膜电位减小),与凋亡细胞的细胞质结合呈绿色(线粒体膜电位升高)。按照APO LOGIX JC-1线粒体膜电位检测试剂盒说明书测定细胞中线粒体膜电位。细胞经胰酶消化,离心收集细胞,加入1× JC-1溶液重悬细胞,轻轻混匀;细胞悬液置于37 ℃、5% CO2培养箱中孵育15 min,5 000 r/min,离心5 min收集细胞;加入2 mL 1×buffer溶液,轻轻混匀,离心后弃上清;加入1 mL 1×buffer溶液,轻轻混匀后立即用流式细胞仪进行测定分析。FL2通道检测正常细胞中红色JC-1标记的线粒体,FL1通道检测凋亡细胞中绿色JC-1标记的线粒体。
2.9细胞凋亡因子抗体芯片实验为了研究胃癌细胞中BARF1表达下调对细胞凋亡相关蛋白表达的影响,将NCsiRNA和siRNA分别转染NUGC3和SNU719细胞后运用RayBio®人细胞凋亡因子抗体芯片试剂盒测定细胞中与细胞凋亡相关蛋白的表达。按照RayBio®人细胞凋亡因子抗体芯片试剂盒说明书测定胃癌细胞中细胞凋亡相关因子的表达变化,该试剂盒能检测细胞中至少43种不同的细胞凋亡相关蛋白和GAPDH蛋白,灵敏度达到ng/L。采用G2505C微列阵扫描仪(安捷伦科技公司)对激发Cy3绿色荧光信号的玻片载体进行扫描,运用6.1.0.4 版本GenePix®微阵列采集分析软件(安捷伦科技公司)对图片和数据进行分析,使用背景校正法对原始强度值进行分析。生物素标记的蛋白能发出荧光作为检测信号,通过荧光信号强弱比较不同孔板之间细胞凋亡蛋白的相对表达量,阳性对照为生物素标记的抗体。生物素标记的IgG直接结合在玻片芯片载体上,如果芯片上的变量相同,则阳性对照的荧光强度相等。运用RayBio抗体列阵分析工具对图片和数据进行背景校正和标准化。
2.10免疫共沉淀实验将siRNA转染NUGC3和SNU719细胞后,运用caspase 9 抗体免疫共沉淀caspase 9蛋白,随后用Apaf-1抗体检测细胞凋亡蛋白复合体。收集细胞,并提取细胞总蛋白,向蛋白浓度为400 μg的溶液中加入caspase 9抗体和20 μL的Protein A凝胶将caspase 9蛋白免疫共沉淀出来。沉淀物经蛋白提取试剂洗涤5次,PBS洗涤1次;加入1×样品缓冲液(50 mmol/L Tris,pH 6.8, 100 mmol/L溴酚蓝,10%甘油)重悬,混匀后90 °C水浴5 min,之后进行SDS-PAGE,除 I 抗是Apaf-1抗体外,后续步骤同2.8。
3统计学处理
应用SPSS 17.0统计软件进行相关数据分析,结果用均数±标准差(mean±SD)表示,2组之间的比较采用t检验,多组间的比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结果
1siRNA沉默NUGC3和SNU719细胞中BARF1的表达
RT-PCR结果显示,NCsiRNA和siRNA转染细胞72 h后,与NCsiRNA和untreated组比较,siRNA转染细胞中BARF1 mRNA的表达量显著降低(P<0.01);而NCsiRNA转染细胞和空白细胞中BARF1的mRNA表达量无统计学差异。Western blot结果显示,NUGC3和SNU719细胞中内源性表达BARF1蛋白,而siRNA下调BARF1蛋白表达,NCsiRNA转染细胞中BARF1蛋白表达无明显变化。在细胞培养上清中没有检测到BARF1蛋白的表达。研究结果表明,siRNA显著降低NUGC3和SNU719细胞中BARF1的mRNA和蛋白表达,见图1。

Figure 1.siRNA-mediated BARF1 down-regulation in the NUGC3 cells and SNU719 cells transfected with NCsiRNA and siRNA. Mean±SD.n=6.**P<0.01vsuntreated and NCsiRNA groups.
图1siRNA介导NUGC3 和SNU719细胞中BARF1 mRNA和蛋白表达下调
2BARF1表达下调抑制胃癌细胞存活
运用台盼蓝染色法测定siRNA转染NUGC3和SNU719细胞后的细胞存活率。结果显示,与空白对照和阴性对照组比较,细胞存活率显著降低(P<0.05),并呈时间依赖关系,见图2。

Figure 2.Down-regulation of BARF1 inhibited the viability of NUGC3 and SNU719 cells. Mean±SD.n=3.*P<0.05,**P<0.01vsuntreated and NCsiRNA groups.
图2BARF1表达下调抑制NUGC3和SNU719细胞活力
3BARF1表达下调诱导胃癌细胞凋亡
利用流式细胞术检测发现,siRNA转染的NUGC3和SNU719细胞凋亡率显著高于阴性对照组和空白对照组细胞(P<0.01),转染72 h的细胞凋亡率NUGC3细胞为43.62%,SNU719细胞为40.96%,空白对照组和阴性对照组之间的细胞凋亡率无显著差异。进一步观察NUGC3和SNU719细胞中BARF1表达下调后对典型的细胞凋亡生物标志物PARP蛋白表达的影响,结果显示,siRNA转染的细胞中PARP蛋白发生裂解,明显观察到116 kD和89 kD两条带,而空白对照组和阴性对照组细胞中PARP蛋白未发生裂解。研究结果表明,NUGC3和SNU719细胞中BARF1的低表达诱导细胞凋亡,见图3。
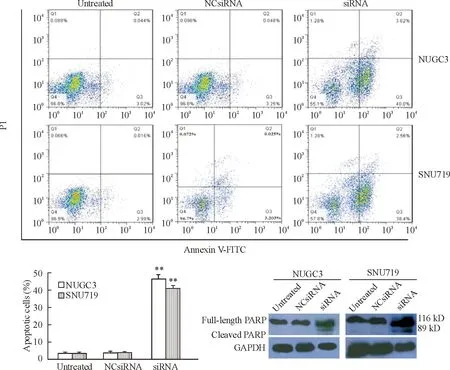
Figure 3.Silencing ofBARF1 expression induced apoptosis in the NUGC3 cells and SNU719 cells. Mean±SD.n=3.**P<0.01vsuntreated group and NCsiRNA group.
图3沉默BARF1表达诱导NUGC3细胞和 SNU719 细胞凋亡
4BARF1表达下调改变线粒体膜电位诱导胃癌细胞凋亡
线粒体膜电位检测结果如图4所示。siRNA转染的NUGC3和SNU719细胞中红色JC-1化合物浓度显著低于空白对照和阴性对照组细胞(P<0.01),提示细胞中线粒体膜电位降低。siRNA转染的细胞凋亡率(JC-1荧光强度)分别为81.8%(NUGC3细胞)和79.6%(SNU719细胞),显著高于空白对照组和阴性对照组(P<0.01)。研究结果表明, BARF1表达下调导致NUGC3和SNU719细胞线粒体膜电位减小,进而诱导细胞凋亡。
5BARF1表达下调能促进促凋亡蛋白和抑制抗凋亡蛋白的表达
与NCsiRNA转染组细胞比较,siRNA转染的细胞中Bax、caspase 3、p21和p27的表达增高,而Bcl-2、cIAP-2和survivin的表达降低。蛋白定量分析发现,NUGC3和SNU719细胞中Bax的表达量分别增加2.24倍和2.11倍,而Bcl-2的表达量分别增加2.25倍和2.56倍。RT-PCR结果显示,siRNA转染的细胞中Bax的mRNA表达量增加,而Bcl-2的mRNA表达量降低,空白对照组和阴性对照组细胞中Bax 和Bcl-2 mRNA的表达量无明显变化;Bcl-2/Bax mRNA比分别为41.4%(NUGC3细胞)和32.8%(SNU719细胞),显著低于阴性对照组(P<0.01)。Western blot结果进一步表明,siRNA转染细胞中Bax蛋白表达增加,而Bcl-2蛋白表达降低,空白对照组和阴性对照组细胞中Bax 和Bcl-2 蛋白表达量无明显变化;Bcl-2/Bax 蛋白比分别为21.4%(NUGC3细胞)和34.3%(SNU719细胞),显著低于阴性对照组(P<0.01),见图5。
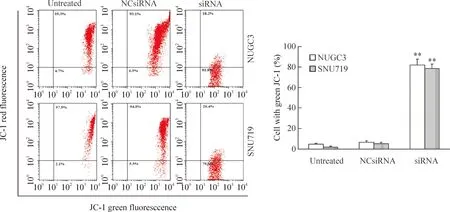
Figure 4.The effects of down-regulated BARF1 expression on mitochondrial membrane potential in the NUGC3 cells and SNU719 cells. Mean±SD.n=3.**P<0.01vsuntreated group and NCsiRNA group.
图4BARF1表达下调对NUGC3和SNU719细胞线粒体膜电位的影响
6BARF1表达下调激活caspase通路诱导胃癌细胞凋亡
siRNA转染的细胞线粒体膜电位降低,细胞凋亡率显著高于阴性对照组;当加入z-VAD-fmk后,siRNA+z-VAD-fmk组的细胞凋亡率显著低于siRNA转染细胞(P<0.01),提示z-VAD-fmk能抑制由BARF1表达下调诱导的细胞凋亡。以上结果表明, BARF1表达下调诱导的胃癌细胞凋亡具有caspase通路依赖性,见图6。
7BARF1表达下调促进细胞色素C从线粒体释放到细胞质中形成细胞凋亡复合体
运用Western blot测定BARF1表达下调诱导胃癌细胞凋亡过程中caspase 3和caspase 9的表达模式。结果如图7所示,BARF1表达下调的NUGC3和SNU719细胞中caspase 3和caspase 9蛋白发生裂解,其裂解程度显著高于阴性对照组。Western blot测定线粒体和细胞质中细胞色素C的表达量,结果显示siRNA转染组细胞质中的细胞色素C浓度显著高于阴性对照组,而线粒体中的细胞色素C浓度显著低于阴性对照组。将siRNA转染NUGC3和SNU719细胞后,运用caspase 9抗体免疫共沉淀caspase 9蛋白,随后用Apaf-1抗体检测细胞凋亡蛋白复合体,结果发现,Apaf-1抗体能与caspase 9蛋白共沉淀,且siRNA转染细胞中Apaf-1 蛋白的表达量显著高于阴性对照,提示有细胞凋亡蛋白复合体形成。
讨论
研究表明EBV编码的BARF1基因在NPC、EBV相关胃癌细胞、B细胞淋巴瘤和鼻NK/T细胞淋巴瘤中表达,因此被视为一种癌基因[13]。BARFl能够诱导原代猴肾上皮细胞的恶性转化和人B细胞的永生化[14]。已有研究表明分泌型BARF1蛋白能够促进细胞增殖,通过促进抗凋亡蛋白Bcl-2和抑制促凋亡蛋白Bax的表达从而抑制细胞凋亡[15]。然而,BARF1蛋白抑制细胞凋亡的分子机制仍不完全清楚。因此,本研究运用siRNA沉默BARF1基因表达对EBV阳性胃癌细胞系NUGC3和SNU719细胞凋亡的影响,探讨BARF1基因沉默诱导胃癌细胞凋亡的分子机制。
本研究结果显示,NUGC3和SNU719细胞内源性表达BARF1蛋白,而siRNA转染能够有效沉默BARF1 mRNA和蛋白的表达。但是,在细胞培养液中没有检测到分泌型BARF1的表达,其可能的原因在于用于实验的细胞培养液较少、浓缩倍数小(1 000倍),远远低于文献报道[16]的浓缩倍数(6 000倍)。本研究利用台盼蓝染色发现,NUGC3和SNU719细胞中BARF1表达下调显著抑制细胞存活率,与文献[16]报道一致。磷脂酰丝氨酸外翻是细胞凋亡的早期事件,而caspase介导的PARP蛋白裂解是细胞凋亡的主要特征[17]。本研究同时利用流式细胞术和PARP蛋白裂解结果也证实,BARF1基因沉默使BARF1表达下调能够诱导NUGC3和SNU719细胞凋亡。

Figure 5.The effect of BARF1 down-regulation on the expression of apoptosis-related proteins in the NUGC3 cells and SNU719 cells transfected with NCsiRNA and siRNA. A: the expression of pro-apoptotic and anti-apoptotic proteins was analyzed using human apoptosis antibody arrays; B: the mRNA expression of Bcl-2 and Bax was determined by RT-PCR; C: Western blot analysis of Bcl-2 and Bax protein expression. Mean±SD.n=3.**P<0.01vsuntreated group and NCsiRNA group.
图5BARF1表达下调对NUGC3和SNU719细胞中细胞凋亡相关蛋白表达的影响
经典的细胞凋亡途径包括死亡受体通路和线粒体通路,研究证实线粒体在细胞凋亡过程中发挥着重要作用,线粒体膜电位降低是线粒体介导细胞凋亡的主要原因[18]。而本研究中发现BARF1表达下调能够导致NUGC3和SNU719细胞线粒体膜电位显著降低,说明BARF1表达下调诱导NUGC3和SNU719细胞凋亡可能通过线粒体途径发挥作用。bcl-2基因家族是细胞凋亡通路重要的调节子,在线粒体介导的细胞凋亡事件中,bcl-2基因家族与线粒体协同作用促进细胞色素C从线粒体向细胞质释放[19]。以往的研究表明,bcl-2基因家族中的促凋亡蛋白(Bax、Bak和Bim)和抗凋亡蛋白(Bcl-2和Bcl-xL)参与了线粒体介导的细胞凋亡过程,而Bcl-2/Bax比值是判断细胞凋亡的重要依据[20]。本研究中发现在NUGC3和SNU719细胞中BARF1表达下调后, Bcl-2/Bax比值显著降低,说明BARF1表达下调能促细胞凋亡是通过抑制线粒体途径bcl-2基因家族中抗凋亡蛋白表达、促进促凋亡蛋白表达而发挥作用的。
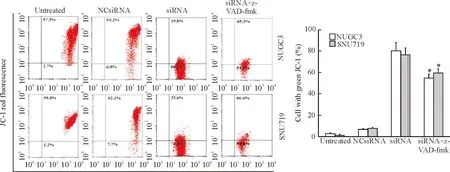
Figure 6.Caspase pathway activated byBARF1 gene silencing induced apoptosis of the NUGC3 cells and SNU719 cells. Mean±SD.n=3.*P<0.05vssiRNA group.
图6BARF1基因沉默激活caspase通路诱导NUGC3和SNU719细胞凋亡
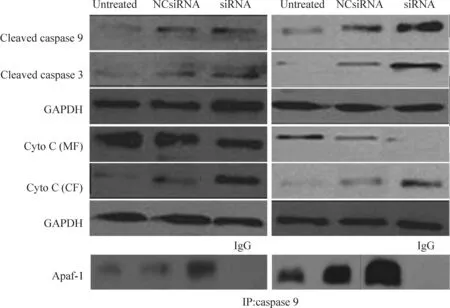
Figure 7.Silencing ofBARF1 expression induced the formation of apoptotic complex. IgG was added to the cell lysates as a negative control.
图7沉默BARF1表达诱导细胞凋亡复合体的形成
本研究发现,caspase抑制剂z-VAD-fmk处理siRNA转染的NUGC3和SNU719细胞,其细胞凋亡率显著低于阴性对照组,说明BARF1表达下调诱导的细胞凋亡具有caspase依赖关系。线粒体膜电位降低说明线粒体膜受到损伤,线粒体中细胞色素C释放到细胞质中,进而与Apaf-1和 caspase 9结合形成细胞凋亡蛋白复合体[21]。Western blot结果显示,BARF1表达下调能够促进caspase 3 和caspase 9 的表达,Apaf-1抗体能够将caspase 9 共沉淀出来,说明BARF1表达下调促进细胞凋亡复合体的形成。
综上所述,本研究发现siRNA能够有效抑制EBV阳性胃癌细胞系NUGC3和SNU719细胞中BARF1的表达;并首次证实BARF1表达下调通过线粒体途径调节促凋亡蛋白Bcl-2和抗凋亡蛋白Bax的表达进而诱导胃癌细胞凋亡,且具有caspase通路依赖关系。但是,本研究目前仅限于体外研究,BARF1表达下调介导的细胞凋亡和涉及相关的信号通路是否存在于机体内有必要进一步研究。
[参考文献]
[1]陈江, 朱冠保. EBV 感染与胃癌关系的研究进展[J]. 世界华人消化杂志, 2011, 19(29): 3040-3045.
[2]胡波, 陈忠城, 王东宁, 等. 原核表达和制备 EB 病毒 GST/BFRF3 融合蛋白用于鼻咽癌的诊断筛查[J]. 中国病理生理杂志, 2013, 29(6):1147-1152.
[3]Zhang Y, Ohyashiki JH, Takaku T, et al. Transcriptional profiling of Epstein-Barr virus (EBV) genes and host cellular genes in nasal NK/T-cell lymphomaand chronic active EBV infection[J]. Brit J Cancer, 2006, 94(4):599-608.
[4]Seto E, Yang L, Middeldorp J, et al. Epstein-Barr virus (EBV)-encodedBARF1 gene is expressedin nasopharyngeal carcinoma and EBV-associated gastric carcinoma tissues in the absence of lytic gene expression[J]. J Med Virol, 2005, 76(1):82-88.
[5]李淑英, 李劲涛, 杜海军, 等. EB 病毒BARF1基因对人胃上皮细胞恶性转化的作用[J]. 第三军医大学学报, 2011, 33(19): 2025-2028.
[6]Zur Hausen A, Brink AATP, Craanen ME, et al. Unique transcription pattern of Epstein-Barr virus (EBV) in EBV-carrying gastric adenocarcinomas: expression of the transformingBARF1 gene[J]. Cancer Res, 2000, 60(10):2745-2748.
[7]Danve C, Decaussin G, Busson P, et al. Growth transformation of primary epithelial cells with a NPC-derived Epstein-Barr virus strain[J]. Virology, 2001, 288(2): 223-235.
[8]Sheng W, Decaussin G, Sumner S, et al. N-terminaldomain ofBARF1 gene encoded by Epstein-Barr virus is essential for malignant transformation of rodent fibroblasts and activation of BCL-2[J]. Oncogene, 2001, 20(10):1176-1185.
[9]Seto E, Ooka T, Middeldorp J, et al. Reconstitution of nasopharyngeal carcinoma-type EBV infection induces tumorigenicity[J]. Cancer Res, 2008, 68(4):1030-1036.
[10]Jiang R, Cabras G, Sheng W, et al. Synergism of BARF1 with Ras induces malignant transformation in primary primate epithelial cells and human nasopharyngeal epithelialcells[J]. Neoplasia, 2009, 11(9):964-973.
[11]Houali K, Wang X, Shimizu Y, et al. A new diagnostic marker for secreted Epstein-Barr virus-encoded LMP1 and BARF1 oncoproteins in the serum and saliva of patients with nasopharyngeal carcinoma[J]. Clin Cancer Res, 2007, 13(17):4993-5000.
[12]Sheng W, Decaussin G, Ligout A, et al. Malignant transformation of Epstein-Barr virus-negative Akata cells by introduction of theBARF1 gene carried by Epstein-Barr virus[J]. J Virol, 2003, 77(6):3859-3865.
[13]尹志华, 蒋卫红, 李峰, 等. 鼻咽癌组织中 EB 病毒潜伏相关基因的表达[J]. 中国病理生理杂志, 2008, 23(12): 2374-2378.
[14]Wang Q, Tsao SW, Ooka T, et al. Anti-apoptotic role of BARF1 in gastric cancer cells[J]. Cancer Lett, 2006, 238(1):90-103.
[15]Brunelle JK, Letai A. Control of mitochondrial apoptosis by the Bcl-2 family[J]. J Cell Sci, 2009, 122(4):437-441.
[16]Chang MS, Kim DH, Roh JK, et al. Epstein-Barr virus-encoded BARF1 promotes proliferation of gastric carcinoma cells through regulation of NF-κB[J]. J Virol, 2013, 87(19):10515-10523.
[17]Chaitanya GV, Steven AJ, Babu PP. PARP-1 cleavage fragments: signatures of cell-death proteases in neurodegeneration[J]. Cell Commun Signal, 2010, 8: 31.
[18]Fulda S, Debatin KM. Extrinsic versus intrinsic apoptosis pathways in anticancer chemotherapy[J]. Oncogene, 2006, 25(34): 4798-4811.
[19]Czabotar PE, Lessene G, Strasser A, et al. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy[J]. Nat Rev Mol Cell Biol, 2014, 15(1):49-63.
[20]Martinou JC, Youle RJ. Mitochondria in apoptosis: Bcl-2 family members and mitochondrial dynamics[J]. Dev Cell, 2011, 21(1):92-101.
[21]Ledgerwood EC, Morison IM. Targeting the apoptosome for cancer therapy[J]. Clin Cancer Res, 2009, 15(2):420-424.
(责任编辑: 陈妙玲, 罗森)

