GLP-1受体激动剂对肥胖小鼠脂肪组织的脂解作用及机制探讨
2016-01-11林倍思,许海霞,梁华等
GLP-1受体激动剂对肥胖小鼠脂肪组织的脂解作用及机制探讨*
林倍思,许海霞,梁华,曾可静,艾鹤英,翁建平,徐芬△
(中山大学附属第三医院内分泌科,广东省糖尿病防治重点实验室,广东 广州 510630)
[摘要]目的: 探讨胰高血糖素样肽1(GLP-1)受体激动剂艾塞那肽(exendin-4)对肥胖小鼠脂肪组织的作用及机制。方法: 8周龄C57BL/6J小鼠高脂喂养12周后随机分为艾塞那肽组和生理盐水对照组,另设正常饮食组。取附睾旁脂肪检测sirtuin 1(SIRT1)、脂肪甘油三酯脂酶(ATGL)、肿瘤坏死因子α(TNF-α)及脂联素mRNA的表达。Exendin-4或联合SIRT1激动剂/抑制剂处理3T3-L1脂肪细胞24 h;小鼠胚胎成纤维细胞(MEF)诱导成脂肪细胞后exendin-4干预24 h;检测SIRT1、ATGL和激素敏感性脂酶(HSL)的蛋白表达水平。结果: 与生理盐水对照组相比,艾塞那肽组小鼠附睾旁脂肪量、空腹血糖及血甘油三酯水平降低(均P<0.05),体重减轻,血TNF-α水平降低。艾塞那肽干预后,肥胖小鼠脂肪组织SIRT1、ATGL和脂联素 mRNA表达明显上调,TNF-α mRNA表达明显下调(P<0.05)。Exendin-4剂量依赖性促进3T3-L1脂肪细胞SIRT1、ATGL和HSL脂解相关蛋白的表达。联合SIRT1激动剂后,脂滴数量减少,上述脂解相关蛋白的表达上调。联合SIRT1抑制剂后上述作用减弱。敲除SIRT1后MEF脂肪细胞内脂滴增大,数量增多,exendin-4促进脂解的作用消失。结论: 艾塞那肽通过激活SIRT1促进肥胖小鼠脂肪组织脂解作用。
[关键词]胰高血糖素样肽1; Sirtuin 1; 脂解作用; 肥胖
[中图分类号]R589.2; R363.2[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.016
[文章编号]1000-4718(2015)11-2027-06
[收稿日期]2015-04-30[修回日期] 2015-06-05
[基金项目]*国家自然科学基金资助项目(No. 81100275)
通讯作者△Tel: 023-63693332; E-mail: sunnyzhangx@gmail.com
Effect of GLP-1 receptor agonist on lipolysis in adipose tissue of obese mice and its underlying mechanismLIN Bei-si, XU Hai-xia, LIANG Hua, ZENG Ke-jing, AI He-ying, WENG Jian-ping, XU Fen
(DepartmentofEndocrinology,ThirdAffiliatedHospital,SunYat-senUniversity,GuangdongProvincialKeyLaboratoryofDiabetology,Guangzhou510630,China.E-mail:xufen3@mail.sysu.edu.cn)
ABSTRACT[]AIM: To investigate the effects of glucagon-like peptide-1 (GLP-1) receptor agonist exendin-4 on white adipose tissue (WAT) and the underlying mechanisms. METHODS: Male C57BL/6J mice (8 weeks) were challenged by high-fat diet for 12 weeks, and were randomly divided into saline group and exendin-4 group. The mRNA expression of sirtuin 1 (SIRT1), adipose triglyceride lipase (ATGL), TNF-α and adiponectin of WAT was detected by real-time PCR. 3T3-L1 adipocytes or mouse embryonic fibroblasts cells were treated with exendin-4 for 24 h. The protein levels of SIRT1, ATGL and hormone-sensitive lipase (HSL) were determined by Western blot.RESULTS: Exendin-4 significantly decreased epididymal fat weight, fasting blood glucose and serum triglyceride levels (P<0.05), and reduced body weight and serum TNF-α level. The mRNA expression of SIRT1, ATGL and adiponectin in WAT was all significantly up-regulated by exendin-4, which were contrary to the down-regulation of TNF-α mRNA expression (P<0.05). Exendin-4 promoted the protein expression of SIRT1, ATGL, and HSL in 3T3-L1 adipocytes in a dose-dependent manner. Less lipid droplets with up-regulation of lipolytic protein expression were observed when combined with SIRT1 agonist treatment, which were suppressed by SIRT1 inhibitor. Deletion of SIRT1 led to larger adipocytes with more lipid droplets, and the effect of exendin-4 on the lipolysis disappeared when SIRT1 was deficient.CONCLUSION: Exendin-4 promotes lipolysis in WAT of obese mice via activation of SIRT1.
[KEY WORDS]Glucagon-like peptide-1; Sirtuin 1; Lipolysis; Obesity
艾塞那肽(exendin-4,Exe)是一种胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)受体激动剂,近来研究发现,这类药物不仅具有葡萄糖依赖性促胰岛素分泌等降糖作用,在调控脂质代谢方面也发挥了重要作用。研究表明,GLP-1受体激动剂在减少体重指数(body mass index,BMI)、腰围、腰臀比和腹脂含量的同时,还可改善外周组织的脂质代谢及胰岛素敏感性[1]。作为体内最大的脂肪储存器官,在肥胖状态下,脂肪组织过度增生肥大,使其功能受损并导致全身脂质代谢紊乱,参与并加速肥胖并发症病理过程[2]。然而,关于GLP-1对脂肪组织的作用目前尚存在争议。因此,本研究拟通过构建高脂饮食诱导的肥胖小鼠模型及3T3-L1脂肪细胞模型,探讨艾塞那肽对脂肪组织脂代谢的影响及其可能的分子机制。
材料和方法
1动物模型的建立及干预方法
8周龄雄性C57BL/6J小鼠15只(南京动物模式研究所),根据体重按随机数字表法分组为正常饮食组(5只)和高脂饮食组(10只),分别给予普通饲料(58%碳水化合物,13%脂肪,29%蛋白质)和高脂饲料(26%碳水化合物,58%脂肪,16%蛋白质)喂养。高脂饮食喂养12周诱导肥胖模型后,艾塞那肽干预组腹腔注射艾塞那肽(24 nmol/kg,Lilly)4周,正常饮食组及生理盐水组腹腔注射生理盐水对照。动物行麻醉后处死, ELISA法测血甘油三酯(trigly-ceride,TG)和TNF-α水平。以上实验经中山大学实验动物伦理委员会的批准。
23T3-L1前脂肪细胞的诱导分化及干预
参考Anil等[3]方法,将3T3-L1前脂肪细胞诱导分化成3T3-L1脂肪细胞。分为正常对照组、exendin-4(Sigma)组、exendin-4联合sirtuin 1(SIRT1)激动剂白黎芦醇(resveratrol,Res;Sigma)组和exendin-4联合SIRT1抑制剂sirtinol(Selleck)组,干预24 h。
3实验方法
3.1原代小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEF)分离培养及干预 取13.5 d小鼠胚胎,去除胎鼠头、尾巴、四肢及内脏,余下胚胎躯干部分充分剪碎,加入3 mL胰酶于37 ℃水浴振荡12 min后,加入胎牛血清终止消化。 4 ℃离心10 min,弃上清,用PBS漂洗2次后,将重悬的细胞接种于10 cm培养皿,传代2次后接种于6孔板,诱导分化为成熟脂肪细胞[4]。取头部组织提取DNA,用PCR扩增目的条带进行小鼠基因型的鉴定。每种基因型(野生型和SIRT1-/-纯合子型)均设正常对照组和exendin-4组,干预24 h。
3.2检测mRNA表达提取小鼠附睾旁脂肪组织总RNA,逆转录成cDNA扩增。Real-time PCR扩增体系为SYBR Premix Ex Taq(2×)10 μL,SIRT1、脂肪甘油三酯脂酶(adipose triglyceride lipase,ATGL)、TNF-α 及脂联素上、下游引物(具体序列见表1)各0.4 μL,cDNA 2 μL,加单蒸水7.5 μL至总体积20 μL。扩增条件为95 ℃30 s;95 ℃5 s,60 ℃20 s,40循环;65 ℃15 s,40 ℃30 s。用2-ΔΔCt比较法计算目的基因的转录水平。

表1 引物序列
F: forward; R: reverse.
3.3Western blot法检测蛋白表达提取3T3-L1脂肪细胞或MEF诱导分化后脂肪细胞总蛋白,测蛋白浓度后取40 μg蛋白总量上样电泳,110 V恒压转膜90 min,室温下5%脱脂奶粉封闭1 h,分别加入SIRT1、ATGL和激素敏感性脂酶(hormone-sensitive lipase,HSL) (CST) I 抗4 ℃过夜。 TBST缓冲液洗膜3次,加入 II 抗室温孵育1 h,再用 TBST洗膜3次,用Odyssey红外荧光成像系统扫描并灰度分析,计算目的蛋白与内参蛋白相对灰度值,每组重复实验次数≥3次。
3.4油红染色及定量分析将3T3-L1细胞株或原代MEF细胞诱导分化为成熟脂肪细胞后,PBS冲洗后用10%中性甲醛溶液室温下固定30 min,再用避光过滤后的油红工作液染色1 h,用显微镜观察并拍照(ZEISS)。拍照结束每孔加125 μL的异丙醇室温下10 min以萃取脂滴中的油红,将萃取液转移至96孔板于490 nm处测定吸光度值。
4统计学处理
应用SPSS 13.0软件进行统计学分析。计量资料以均数±标准差(mean±SD)或均数±标准差误(mean±SEM)表示,多组定量资料比较用单因素方差分析,多组间均数两两比较用Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结果
1艾塞那肽对肥胖小鼠脂肪量及血生化指标影响
与正常对照组小鼠相比,高脂组小鼠体重及附睾旁脂肪量显著增加,空腹血糖、血清甘油三酯及炎症指标TNF-α明显升高(P<0.05)。艾塞那肽干预后,高脂组小鼠附睾旁脂肪量、空腹血糖及血甘油三酯水平降低(P<0.05),体重减轻,血TNF-α水平降低,见表2。
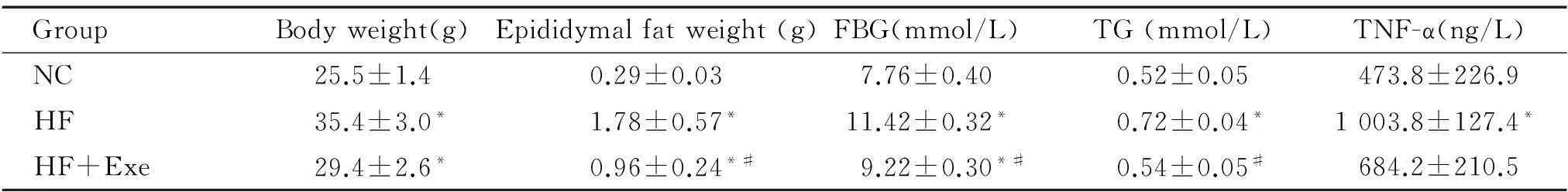
表2 艾塞那肽对肥胖小鼠脂肪量及血生化指标的影响
*P<0.05vsNC group;#P<0.05vsHF group.
2艾塞那肽对肥胖小鼠脂肪组织各目标基因mRNA表达的影响
与正常对照组相比,高脂组小鼠脂肪组织SIRT1、ATGL和脂联素的mRNA表达下调,TNF-α的mRNA表达明显上调。艾塞那肽干预后,高脂组小鼠脂肪组织SIRT1、ATGL和脂联素的mRNA表达上调,TNF-α的mRNA表达明显下调(P<0.05),见表3。

表3 艾塞那肽对肥胖小鼠脂肪组织各目标基因mRNA表达的影响
*P<0.05vsNC group;#P<0.05vsHF group.
3Exendin-4对3T3-L1脂肪细胞干预结果
3.1形态学观察3T3-L1前脂肪细胞诱导分化为成熟脂肪细胞后,胞质内脂滴油红染色后镜下观察显示为红色。Exendin-4干预24 h后,脂肪细胞内脂滴生成减少。Exendin-4联合SIRT1激动剂白黎芦醇后,上述作用更加明显。而exendin-4联合SIRT1抑制剂sirtinol处理后,与exendin-4单独处理组相比,脂肪细胞内脂滴生成明显增多。定量分析结果与形态学一致,见图1。
3.2蛋白检测结果分析随着exendin-4浓度升高,3T3-L1脂肪细胞的脂解相关指标SIRT1、ATGL和HSL的蛋白表达量呈现剂量依赖性递增的趋势。联合SIRT1激动剂后,上述脂解指标的蛋白表达量升高更加明显;而exendin-4联合SIRT1抑制剂后,与exendin-4单独处理组相比,上述脂解指标的蛋白表达量下降,见图1、2。
4Exendin-4对分化后MEF脂肪细胞干预结果
4.1形态学观察将原代分离MEF细胞诱导为脂肪细胞,胞质内脂滴油红染色后镜下观察显示为红色。Wild-type组exendin-4干预后胞质内脂滴生成减少。SIRT1-/-组脂滴生成明显增多。SIRT1-/-组exendin-4干预后,脂滴生成未见明显变化。定量分析结果与形态学一致,见图3。
4.2蛋白检测结果分析Wild-type组exendin-4干预后脂解相关指标SIRT1、ATGL和HSL的蛋白表达量升高。在敲除SIRT1后,exendin-4促进脂解指标蛋白表达的作用消失,见图3。
讨论
最早发现肠道在口服营养物质的刺激下能够产生各种内分泌因子,后者可通过促进胰岛素分泌达到降糖作用。GLP-1被证明为其中的一种内分泌因子。由于天然GLP-1半衰期极短,仅为1~2 min,因此衍生出GLP-1相关类药物。作为最早上市的GLP-1受体激动剂,越来越多的研究发现,艾塞那肽除了有降低血糖的作用外,还可显著降低肥胖人群的体重及脂代谢紊乱[5]。此外,在高脂诱导的肥胖动物模型上,艾塞那肽可显著改善外周组织如肝脏、肌肉的脂质沉积,改善胰岛素敏感性[6-7]。然而,关于艾塞那肽对白色脂肪组织的研究却相对较少,尚存在争议。早期研究发现,在分离的原代人和大鼠脂肪细胞上,GLP-1呈现cAMP依赖性的脂解作用,当联合GLP-1受体拮抗剂后,上述脂解作用消失[8]。然而,Bertin 等[9]通过将含有GLP-1的林格氏溶液灌注人皮下脂肪组织发现,GLP-1对脂肪组织的脂质合成及脂解作用并无影响。因此,对于GLP-1相关药物对脂肪组织脂质代谢的影响及机制探讨仍有待进一步研究。
SIRT1是一种NAD+依赖性的组蛋白脱乙酰化酶,可参与调控多种生物学功能,如糖脂代谢,能量利用和癌症等。早期研究发现,SIRT1可通过抑制脂肪细胞中过氧化物酶体增殖物激活受体γ的表达,减少脂质合成[10]。进一步研究发现,激活SIRT1可改善高脂喂养肥胖小鼠全身脂代谢紊乱[11]。此外,在分化成熟的3T3-L1脂肪细胞模型上发现,SIRT1可增加FOXO1去乙酰化水平,激活ATGL,促进脂肪细胞的脂质分解[12]。这些研究提示,SIRT1在参与全身脂质代谢的调控中扮演了重要角色。
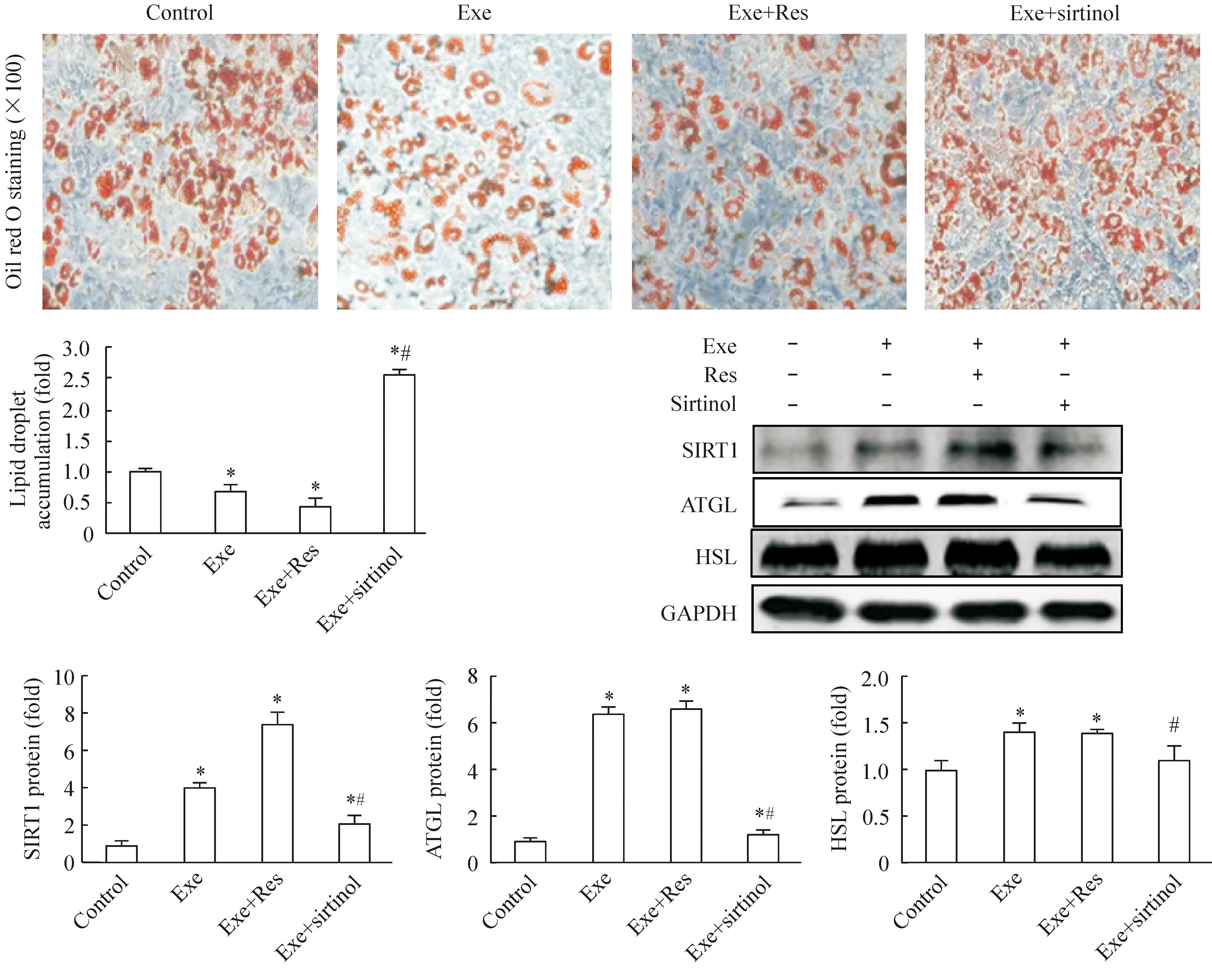
Figure 1.The effects of exendin-4 (Exe) on the morphological changes and the protein expression of SIRT1, ATGL and HSL in 3T3-L1 adipocytes, either combined with SIRT1 agonist or SIRT1 inhibitor. Mean±SEM.n=3.*P<0.05vscontrol group;#P<0.05vsExe group.
图1Exendin-4或联合SIRT1激动剂/SIRT1抑制剂对3T3-L1脂肪细胞形态学及SIRT1、ATGL和HSL蛋白表达的影响
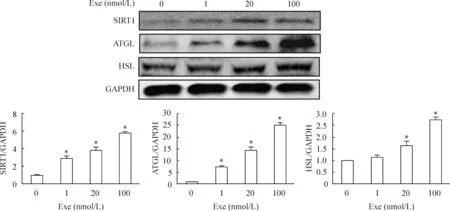
Figure 2.The effects of exendin-4 (Exe) on the protein expression of SIRT1, ATGL and HSL in 3T3-L1 adipocytes.Mean±SEM.n=3.*P<0.05vs0 nmol/L group.
图2Exendin-4对3T3-L1脂肪细胞SIRT1、ATGL和HSL蛋白表达的影响
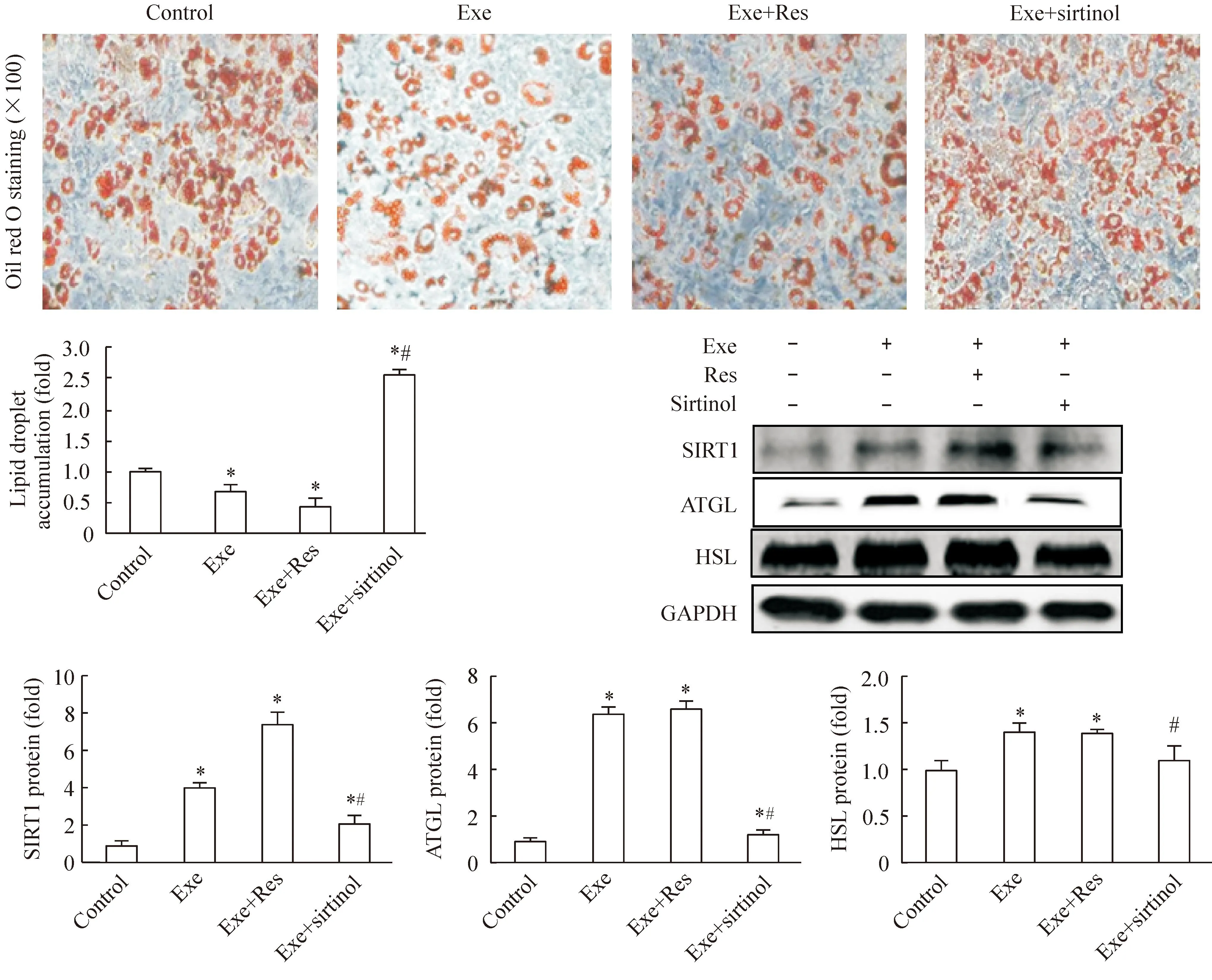
Figure 3.The effects of exendin-4 (Exe) on the morphological changes and the protein expression of SIRT1, ATGL and HSL in MEF after induced into adipocytes. Mean±SEM.n=3.*P<0.05vswild-type control group;#P<0.05vsSIRT1-/-control group;△P<0.05vsSIRT1-/-Exe group.
图3Exendin-4对分化后MEF形态学及SIRT1、ATGL和HSL蛋白表达的影响
ATGL及HSL是甘油三酯水解步骤中的关键酶,其主要作用是促进脂肪细胞中甘油三酯逐步水解为甘油单酯及游离脂肪酸,后者释放入血,为外周组织提供能量供应。在3T3-L1脂肪细胞中过表达ATGL可使培养基中甘油及游离脂肪酸含量增加,同时胞内脂滴大小显著下降。相反,在脂肪细胞中沉默ATGL后,细胞内脂滴的体积显著增加[13]。此外,在ATGL敲除及HSL敲除的小鼠模型上均发现,敲除后小鼠脂肪水解能力被破坏,表现为小鼠脂肪组织的体积增大,并在外周多个脏器中发现异位脂质沉积,进而引发多器官代谢障碍,使小鼠存活率下降[14],这说明脂肪细胞的脂质代谢失衡与全身代谢紊乱密切相关。
肥胖人群脂肪组织过度增生不仅可引起全身脂代谢紊乱,还可导致脂肪组织间质的炎症浸润,以及分泌炎症因子释放入血,使全身胰岛素敏感性下降。研究发现,在分化成熟的3T3-L1脂肪细胞上,GLP-1受体激动剂可以通过激活蛋白激酶A,促进脂肪细胞分泌脂联素,从而提高胰岛素的敏感性[15]。此外,GLP-1受体激动剂还可减少2型糖尿病人群脂肪组织中巨噬细胞浸润,从而减轻脂肪组织的炎症状态,并且这种作用是不依赖于GLP-1受体激动剂降糖降脂的作用的[16]。
本研究发现,GLP-1受体激动剂艾塞那肽可促进脂肪组织脂解作用,并且这种作用依赖SIRT1介导。在抑制SIRT1表达或敲除SIRT1基因后,艾塞那肽上述脂解作用减弱或消失。此外,艾塞那肽在促进脂肪组织脂解的同时,还可改善肥胖小鼠全身糖脂代谢紊乱及胰岛素抵抗,减轻炎症状态。相信随着对GLP-1受体激动剂作用研究的深入,我们对这类药物改善脂质代谢的作用机制将有更深入的了解,也为伴有肥胖的2型糖尿病患者的用药提供新的理论依据。
[参考文献]
[1]Bi Y, Zhang B, Xu W, et al. Effects of exenatide, insulin, and pioglitazone on liver fat content and body fat distributions in drug-naive subjects with type 2 diabetes[J]. Acta Diabetol, 2014, 51(5):865-873.
[2]Xu H, Barnes GT, Yang Q, et al. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance[J]. J Clin Invest, 2003, 112(12):1821-1830.
[3]Anil KK, Marita AR. Troglitazone prevents and reverses dexamethasone induced insulin resistance on glycogen synthesis in 3T3 adipocytes[J]. Br J Pharmacol, 2000, 130(2):351-358.
[4]Xu F, Burk D, Gao Z, et al. Angiogenic deficiency and adipose tissue dysfunction are associated with macrophage malfunction in SIRT1-/-mice[J]. Endocrinology, 2012, 153(4):1706-1716.
[5]Dushay J, Gao C, Gopalakrishnan GS, et al. Short-term exenatide treatment leads to significant weight loss in a subset of obese women without diabetes[J]. Diabetes Care, 2012, 35(1):4-11.
[6]Xu F, Li Z, Zheng X, et al. SIRT1 mediates the effect of GLP-1 receptor agonist exenatide on ameliorating hepatic steatosis[J]. Diabetes, 2014, 63(11):3637-3646.
[7]Sakai T, Kusakabe T, Ebihara K, et al. Leptin restores the insulinotropic effect of exenatide in a mouse model of type 2 diabetes with increased adiposity induced by streptozotocin and high-fat diet[J]. Am J Physiol Endocrinol Metab, 2014, 307(8):E712-E719.
[8]Vendrell J, El BR, Peral B, et al. Study of the potential association of adipose tissue GLP-1 receptor with obesity and insulin resistance[J]. Endocrinology, 2011, 152(11):4072-4079.
[9]Bertin E, Arner P, Bolinder J, et al. Action of glucagon and glucagon-like peptide-1-(7-36) amide on lipolysis in human subcutaneous adipose tissue and skeletal muscleinvivo[J]. J Clin Endocrinol Metab, 2001, 86(3):1229-1234.
[10]Picard F, Kurtev M, Chung N, et al. Sirt1 promotes fat mobilization in white adipocytes by repressing PPAR-gamma[J]. Nature, 2004, 429(6993):771-776.
[11]Pfluger PT, Herranz D, Velasco-Miguel S, et al. Sirt1 protects against high-fat diet-induced metabolic damage[J]. Proc Natl Acad Sci U S A, 2008, 105(28):9793-9798.
[12]Chakrabarti P, English T, Karki S, et al. SIRT1 controls lipolysis in adipocytes via FOXO1-mediated expression of ATGL[J]. J Lipid Res, 2011, 52(9):1693-1701.
[13]Smirnova E, Goldberg EB, Makarova KS, et al. ATGL has a key role in lipid droplet/adiposome degradation in mammalian cells[J]. EMBO Rep, 2006, 7(1):106-113.
[14]Haemmerle G, Lass A, Zimmermann R, et al. Defective lipolysis and altered energy metabolism in mice lacking adipose triglyceride lipase[J]. Science, 2006, 312(5774):734-737.
[15]Kim Chung Le T, Hosaka T, Yoshida M, et al. Exendin-4, a GLP-1 receptor agonist, directly induces adiponectin expression through protein kinase A pathway and prevents inflammatory adipokine expression[J]. Biochem Biophys Res Commun, 2009, 390(3):613-618.
[16]Hogan AE, Gaoatswe G, Lynch L, et al. Glucagon-like peptide 1 analogue therapy directly modulates innate immune-mediated inflammation in individuals with type 2 diabetes mellitus[J]. Diabetologia, 2014, 57(4):781-784.
(责任编辑: 林白霜, 罗森)

