三种不同脊髓机械性损伤对大鼠继发性神经细胞凋亡的影响研究①
2016-01-08贺桂琼汪克建
毛 敏 张 婷 刘 滢 贺桂琼 汪克建
(重庆医科大学附属第一医院血液内科,重庆430016)
[摘 要] 目的:探讨脊髓挫伤、脊髓横断及持续性占位损伤对大鼠继发性神经细胞凋亡的影响作用。方法:选取健康雄性Wistar大鼠66只,进行编号后采用随机数字表法分为A(18只,脊髓挫伤)、B(18只,脊髓横断)、C(18只,持续性占位)、D(6只、假手术组)、E(6只、对照组)五组,分别观察伤后1、4、7d 各组大鼠的神经细胞凋亡指数、脊髓组织中Bcl-2、Bax、caspase-3蛋白的表达情况。结果:A、B、C三组大鼠在造模后第1天均出现脊髓灰质和白质染色阳性标记,且三组大鼠的灰质、白质神经细胞凋亡指数差异具有统计学意义(P<0.05);在造模后第4、7天三组大鼠的灰质、白质区域脊髓凋亡细胞指数均呈现出增高趋势(P<0.05);在造模后第1、4、7天C组大鼠的脊髓灰质、白质区域凋亡细胞指数显著高于A组、B组,B组显著高于A组且差异均具有统计学意义(P<0.05)。造模后第1、4、7天A、B、C、D、E组五组大鼠的Bcl-2、Bax、caspase-3蛋白表达差异均具有统计学意义(P<0.05),造模后第1、4、7天A、B、C 三组大鼠的Bcl-2、Bax、caspase-3蛋白表达显著高于D组和E组(P<0.05)。结论:大鼠脊髓损伤后神经细胞继发性凋亡显著,严重程度与损伤类型有关。
[关键词] 脊髓挫伤;脊髓挫伤;持续性占位损伤;继发性神经细胞凋亡
doi:10.3969/j.issn.1000-484X.2015.11.005
三种不同脊髓机械性损伤对大鼠继发性神经细胞凋亡的影响研究①
毛敏张婷②刘滢②贺桂琼②汪克建②
(重庆医科大学附属第一医院血液内科,重庆430016)
[摘要]目的:探讨脊髓挫伤、脊髓横断及持续性占位损伤对大鼠继发性神经细胞凋亡的影响作用。方法:选取健康雄性Wistar大鼠66只,进行编号后采用随机数字表法分为A(18只,脊髓挫伤)、B(18只,脊髓横断)、C(18只,持续性占位)、D(6只、假手术组)、E(6只、对照组)五组,分别观察伤后1、4、7d 各组大鼠的神经细胞凋亡指数、脊髓组织中Bcl-2、Bax、caspase-3蛋白的表达情况。结果:A、B、C三组大鼠在造模后第1天均出现脊髓灰质和白质染色阳性标记,且三组大鼠的灰质、白质神经细胞凋亡指数差异具有统计学意义(P<0.05);在造模后第4、7天三组大鼠的灰质、白质区域脊髓凋亡细胞指数均呈现出增高趋势(P<0.05);在造模后第1、4、7天C组大鼠的脊髓灰质、白质区域凋亡细胞指数显著高于A组、B组,B组显著高于A组且差异均具有统计学意义(P<0.05)。造模后第1、4、7天A、B、C、D、E组五组大鼠的Bcl-2、Bax、caspase-3蛋白表达差异均具有统计学意义(P<0.05),造模后第1、4、7天A、B、C 三组大鼠的Bcl-2、Bax、caspase-3蛋白表达显著高于D组和E组(P<0.05)。结论:大鼠脊髓损伤后神经细胞继发性凋亡显著,严重程度与损伤类型有关。
[关键词]脊髓挫伤;脊髓挫伤;持续性占位损伤;继发性神经细胞凋亡
doi:10.3969/j.issn.1000-484X.2015.11.005
中图分类号①本文为重庆市自然科学基金(cstc2011jjA0139)和国家自然科学基金(No.81371221)。;②重庆医科大学基础医学院神经科学研究中心,重庆430016。
作者简介:毛敏(1982年-),女,主管护师,主要从事基础研究和临床护理工作,同时供职于重庆医科大学基础医学院神经科学研究中心,重庆430016。
通讯作者及指导教师:汪克建(1971年-),男,博士,主要从事神经生物学、大体解剖学研究,E-mail:wangkejianjj@163.com。
[Abstract]Objective:To study the spinal cord injury,spinal cord transection and persistent placeholder damage on the influence of secondary neural cell apoptosis in rats.Methods: Select 60 healthy male Wistar rats,numbered after using the random number table method is divided into A (18,spinal cord contusion),B (18,spinal cord transection),C (18,continuous placeholder),D (6,control),E (6,the control group only) groups of five,were observed at the 1,4,7 D after 5 group of rats nerve cell apoptosis index,spinal cord tissue Bcl-2,the expression of Bax,caspase 3 protein.Results: A,B,C three groups of rats after building 1 d are gray and white matter positive markers,and the gray matter and white matter of three groups of rats nerve cell apoptosis index differences statistically significant (P<0.05);4 d,7 d after building gray matter and white matter of three groups of rats tend to place increased apoptotic cells in the spinal cord index (P<0.05);in building 1,4,7 d group C after rat spinal cord grey matter and white matter of apoptotic cell index was significantly higher than that of group A and group B,group B were significantly higher in group A and the differences were statistically significant (P<0.05).1,4,7 d after building A,B,C,D,E five group rats the Bcl-2,Bax,caspase-3 protein expression differences were statistically significant (P<0.05),1,4,7 d after building A,B,C the Bcl-2 of three groups of rats,Bax,caspase-3 protein expression was significantly higher than that of group D and group E (P<0.05).Conclusion: Secondary rats after spinal cord injury of nerve cells apoptosis,apoptosis time,severity,and damage type and severity.
Different spinal cord damage on apoptosis of rat secondary impact study
MAOMin,ZHANGTing,LIUYing,HEGui-Qiong,WANGKe-Jian.DepartmentofHematology,FirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing430016,China
[Key words]Spinal cord contusion;Spinal cord contusion;Persistent placeholder damage;Secondary neural cell apoptosis
脊髓机械性损伤与车祸、坠落、重物砸压以及工伤有关,发病患者极易出现下肢体功能障碍,严重影响患者健康。已有研究显示,脊髓机械性损伤后患者存在明显的神经细胞凋亡情况,这可能是脊髓损伤后继发性病理改变的重要机制[1]。细胞凋亡是人体生理活动的重要内容,但如凋亡细胞比例过大或出现凋亡延迟情况,患者脊髓继发性损伤将加重。脊髓机械性损伤类型不同,患者临床症状也不同,但患者脊髓细胞凋亡程度是否也不同,临床尚无统一结论。为此,笔者选取60只健康雄性Wistar大鼠进行了脊髓挫伤、脊髓横断及持续性占位损伤造模,旨在分析三种脊髓机械性损伤对大鼠继发性神经细胞凋亡的影响。
1材料与方法
1.1实验动物选取健康雄性Wistar大鼠66只,体重250~280 g,平均体重(260±15)g,饲养于室温25℃、光照12 h的环境中自由进食进水(华中科技大学同济医学院动物实验中心提供,动物许可证编号SCX20140016);进行编号后采用随机数字表法分为A(18只,脊髓挫伤)、B(18只,脊髓横断)、C(18只,持续性占位)、D(6只、假手术组)、E(6只、对照组)五组。
1.2建立动物损伤模型给予大鼠水合氯醛麻醉后,固定于手术台,常规消毒铺巾,于背部正中切口,咬除T12、T11椎板,暴露脊髓,脊髓挫伤组大鼠选用金属棒(直径2.0 mm,重15 g,尾端为球状)经10 cm引导管自由下滑打击T12段脊髓3次;脊髓横断组大鼠选用弧形刀片将脊髓横形切断;持续性占位组大鼠选用无菌硬质塑料管(直径为0.5 mm)插入T12段硬膜外间隙,直至椎管后方;假手术组仅行脊髓暴露操作。所有大鼠术后具常规缝合,并消毒包扎。正常喂食饮水。
1.3取材方法于伤后第1、4、7天水合氯醛麻醉处死大鼠,每次随机处死6只,记录大鼠处死时间并以此分组,取出完整脊髓,选用PBS及多聚甲醛溶液固定,将样本常规石蜡包埋切片,置于4℃温箱内待检。
1.4实验方法选用原位末端标记法(TUNEL标记)检测脊髓神经细胞凋亡情况,试剂由Boohringer Mannbein公司提供,将样本常规脱蜡、水化后,选用蛋白酶K(上海研域商贸有限公司,CAS号码:102925-54-2)消化20 min,PBS洗涤,滴入TUNEL反应激孵化60 min,孵化结束后镜检,证实阳性结果。选用缓冲液终止反应,滴入AP-anti-Dig稀释液孵化20 min,BAD染色,核固红衬染,PBS终止显色,烤箱烘干,封片,镜检。
1.5采用Western blot法检测Bcl-2、Bax、caspase-3蛋白将样本置于12%分离胶内,并选用4%浓缩胶灌胶,电泳,电压为80 V,转膜,置于5%脱脂奶粉溶液内,室温静置2 h,按1∶500、1∶200、1∶500比例进行Bcl-2、Bax、caspase-3一抗,转膜与一抗共同孵化,过夜,二抗,TBS-T洗涤,选用ECL化学发光显色液进行显色,摄片,选用Labworks软件对图像进行灰度分析。
1.6统计学分析所有统计分析在SPSS17.0统计软件中进行。计量资料以±s表示,凋亡细胞TUNEL标记呈棕黄色,每张切片随机选取5个400倍的视野,计数阳性细胞数所占总细胞的百分比(凋亡指数),多组件比较采用重复测量的方差分析。P<0.05表示差异具有统计学意义。
2结果
2.15组大鼠的神经细胞凋亡指数比较组织学HE染色显示E组大鼠(对照组)的脊髓组织灰质和白质界限清楚,灰质内神经细胞体大,核仁清晰,白质内部神经纤维排列紧密有序(图1A,HE染色×40);损伤后第1天的C组大鼠脊髓横断面可见广泛出血、脊髓结构被破坏、损伤中心部位可见大量神经细胞溶解死亡,出血坏死区大量空泡(图1B,HE染色,×40);荧光显微镜下观察C组大鼠损伤后第1天,可检测到较强的绿色荧光信号(图1C,荧光表达,×100);C组大鼠在损伤后第1天,TUNEL标记显示阳性细胞呈棕褐色,分布于脊髓灰质和白质中,白质中累及范围较广,可见细胞坏死形成较多的空泡区域(图1D,×200,左上角为×40)。
D组和E组的凋亡细胞检测中,均出现阳性着色,所以表1仅列出三组实验大鼠的神经细胞凋亡指数数据进行分析;A、B、C三组大鼠在造模后第1天均出现脊髓灰质和白质染色阳性标记,且三组大鼠的灰质、白质神经细胞凋亡指数差异具有统计学意义(P<0.05);在造模后第 4、7天三组大鼠的灰质、白质区域脊髓凋亡细胞指数均呈现出增高趋势(P<0.05);在造模后第1、4、7天C组大鼠的脊髓灰质、白质区域凋亡细胞指数显著高于A组、B组,B组显著高于A组且差异均具有统计学意义(P<0.05)。详见表1。
表1 三组大鼠造模后不同时间的神经细胞凋亡指数(%,±s)Tab.1 Apoptotic index of different time of three groups of rats(%,±s)

表1 三组大鼠造模后不同时间的神经细胞凋亡指数(%,±s)Tab.1 Apoptotic index of different time of three groups of rats(%,±s)
GroupsProject1d4d7dAgroup(n=18)GrayMatter4.42±1.122)3)11.30±3.081)2)3)6.51±1.201)2)3)Whitematter4.36±1.092)3)8.61±2.941)2)3)12.37±4.081)2)3)Bgroup(n=18)GrayMatter9.18±2.362)14.17±3.141)2)13.85±2.961)2)Whitematter10.08±4.112)13.53±4.121)2)12.64±3.721)2)Cgroup(n=18)GrayMatter12.07±2.4317.62±3.551)9.17±2.641)Whitematter13.21±2.0616.74±4.131)15.93±3.471)
Note:Compared with the 1 day,1)P<0.05;compared with group C,2)P<0.05;compared with group B,3)P<0.05.
表2 造模后不同时间5组大鼠的Bcl-2蛋白表达(%,±s)Tab.2 Expression of Bcl-2 protein in 5 groups of rats at different time after modeling(%,±s)
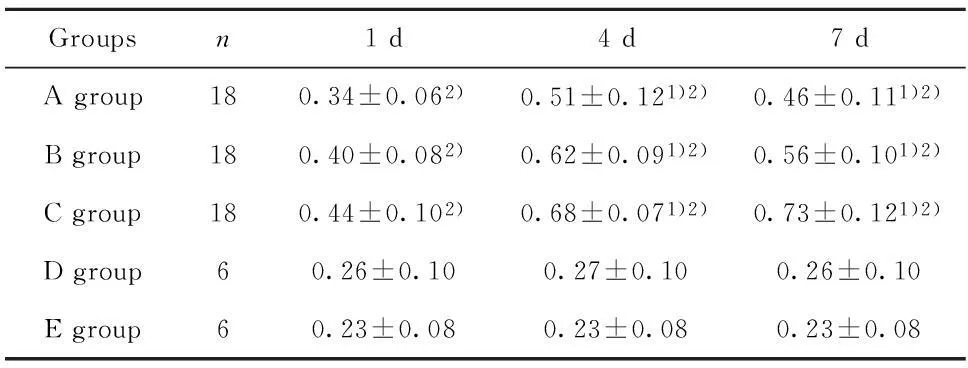
表2 造模后不同时间5组大鼠的Bcl-2蛋白表达(%,±s)Tab.2 Expression of Bcl-2 protein in 5 groups of rats at different time after modeling(%,±s)
Groupsn1d4d7dAgroup180.34±0.062)0.51±0.121)2)0.46±0.111)2)Bgroup180.40±0.082)0.62±0.091)2)0.56±0.101)2)Cgroup180.44±0.102)0.68±0.071)2)0.73±0.121)2)Dgroup60.26±0.100.27±0.100.26±0.10Egroup60.23±0.080.23±0.080.23±0.08
Note:Compared with the 1 day,1)P<0.05;compared with group D,E,2)P<0.05.
表3 造模后不同时间5组大鼠的Bax蛋白表达(%,±s)Tab.3 Expression of Bax protein in 5 groups of rats at different time after modeling(%,±s)

表3 造模后不同时间5组大鼠的Bax蛋白表达(%,±s)Tab.3 Expression of Bax protein in 5 groups of rats at different time after modeling(%,±s)
Groupsn1d4d7dAgroup180.72±0.162)1.08±0.211)2)0.97±0.171)2)Bgroup180.87±0.152)1.24±0.261)2)1.15±0.191)2)Cgroup180.98±0.142)1.37±0.191)2)1.35±0.181)2)Dgroup60.51±0.150.51±0.150.51±0.15Egroup60.49±0.130.49±0.130.49±0.13
Note:Compared with the 1 day,1)P<0.05;compared with group D,E,2)P<0.05.
表4 造模后不同时间5组大鼠的caspase-3蛋白表达(%,±s)Tab.1 The expression of caspase-3 protein in the 5 groups of rats at different time after modeling(%,±s)

表4 造模后不同时间5组大鼠的caspase-3蛋白表达(%,±s)Tab.1 The expression of caspase-3 protein in the 5 groups of rats at different time after modeling(%,±s)
Groupsn1d4d7dAgroup180.34±0.082)0.49±0.091)2)0.42±0.071)2)Bgroup180.43±0.112)0.63±0.151)2)0.57±0.151)2)Cgroup180.53±0.132)0.78±0.161)2)0.76±0.151)2)Dgroup60.24±0.070.24±0.070.24±0.07Egroup60.22±0.060.22±0.060.22±0.06
Note:Compared with the 1 day,1)P<0.05;compared with group D,E,2)P<0.05.
2.2造模后不同时间5组实验大鼠的脊髓组织中Bcl-2、Bax、caspase-3蛋白表达情况造模后第1、4、7天A、B、C、D、E组五组大鼠的Bcl-2、Bax、caspase-3蛋白表达差异均具有统计学意义(P<0.05),造模后第1、4、7天A、B、C 三组大鼠的Bcl-2、Bax、caspase-3蛋白表达显著高于D组和E组(P<0.05);D组和E组大鼠的Bcl-2、Bax、caspase-3蛋白表达差异不显著(P<0.05)。见表2~4。
3讨论
细胞凋亡是基因及其他因素调控的组织细胞活性的自我消亡过程,也是细胞生理性自动死亡方式之一[2]。当机体遭受严重创伤时,局部组织内细胞将因内外环境的紊乱而出现病理性细胞凋亡情况,这将诱发或加重局部组织的继发性病理损伤[3]。脊髓损伤后神经凋亡是脊髓病理改变的重要机制,患者凋亡神经细胞越少,脊髓症状越轻,修复机会越高,反之亦然[4]。脊髓挫伤、脊髓横断及持续性占位损伤是临床常见的脊髓机械性损伤类型,为分析该三种机械损伤对脊髓细胞凋亡的影响,我们动物模型模拟三种损伤类型,并对比检测了大鼠继发性病理改变后脊髓神经凋亡情况。
我们研究发现,A、B、C三组大鼠在造模后第1天均出现脊髓灰质和白质染色阳性标记,且三组大鼠的灰质、白质神经细胞凋亡指数差异具有统计学意义;在造模后第4、7天三组大鼠的灰质、白质区域脊髓凋亡细胞指数均呈现出增高趋势 。脊髓挫伤即脊髓撞击损伤,病理改变与“对冲伤”有关,白质侧壁损伤是本类损伤的重要特征[5]。我们的研究中选用金属棒经引导管自由下滑打击大鼠T12段脊髓来进行脊髓挫伤造模。同时选用弧形刀片将脊髓横形切断以及无菌硬质塑料管插入T12段硬膜外间隙来进行脊髓横断及持续性占位损伤造模。脊髓白质主要由上下纵向连接的传导纤维构成,这些传导纤维主要通过神经纤维胶质连接成一体。脊髓白质含有大量的髓神经纤维[6]。脊髓灰质则含有大量的神经元,主要由无髓纤维及少量有髓纤维构成,因此,脊髓损伤后出现的继发性脱髓鞘可能是脊髓神经细胞凋亡的重要影响因素。持续性占位损伤组大鼠凋亡细胞主要集中与背侧束区,这与脊髓挫伤组明显不同。已有研究证实,脊髓神经细胞凋亡程度与损伤程度、损伤位置有关,还与缺血后再灌注、NO改变、凋亡基因、氧自由基等有关[7]。我们的研究中发现造模后第1、4、7天C组大鼠的脊髓灰质、白质区域凋亡细胞指数显著高于A、B组,而B组显著高于A组,提示持续性占位损伤大鼠脊髓神经细胞凋亡数显著高于其余两组,这可能与大鼠脊髓病理改变持续存在有关,神经细胞凋亡诱因一直存在[8]。脊髓横断性损伤大鼠存在脊髓解剖结构连续性丧失情况,大鼠神经递质、神经营养因子传递中断,这导致大鼠早期存在大量神经细胞凋亡情况。我们发现B组大鼠的脊髓灰质、白质区域凋亡细胞指数显著高于A组,低于C组,这可能与脊髓断端下侧健康下轴突的持续低频冲动作用消失、白质、灰质背景张力消失,神经细胞更易凋亡有关。
Bcl-2蛋白是细胞存活促进因子的一种,可阻断线粒体释放细胞色素C到细胞质内,进而抑制细胞凋亡。Bax基因归属于Bcl-2基因家族,可与Bcl-2构成异二聚体,对Bcl-2具有阻滞效用[9]。caspase-3是机体细胞凋亡过程中的重要蛋白酶,是多种凋亡途径的下游效应物,也是细胞凋亡蛋白酶级联反应的必要物质[10]。本次研究结果表明造模后第1、4、7天A、B、C、D、E组五组大鼠的Bcl-2、Bax、caspase-3蛋白表达差异均具有统计学意义,造模后第1、4、7天A、B、C 三组大鼠的Bcl-2、Bax、caspase-3蛋白表达显著高于D组和E组,这表明三种损伤模型大鼠存在明显神经细胞凋亡情况,提示造模成功。
综上所述,大鼠脊髓损伤后神经细胞继发性凋亡时间、凋亡程度与损伤类型、损伤严重程度相关,提示在脊髓急性损伤后,临床需根据患者损伤类型、损伤严重程度来确定最佳治疗时间及方案,以提高修复成功率。
参考文献:
[1]李刚,范仲凯,贾志强,等.选择性线粒体分裂抑制剂抑制大鼠急性脊髓损伤后的细胞凋亡[J].基础医学与临床,2014,34(11):645-649.
[2]胡凌云,张建英,苟林,等.蛋白激酶信号级联Akt在大鼠脊髓损伤后的诱导表达[J].重庆医学,2014,1(06):644-647.
[3]郑力恒,林宏生,李锦聪,等.脊髓损伤后急性期甲基强的松龙干预对脊髓神经细胞凋亡的影响[J].中国脊柱脊髓杂志,2012,22(05):452-458.
[4]严根福,王健,贾玉柱,等.川芎嗪对急性脊髓损伤大鼠神经细胞早期凋亡的影响[J].浙江中医杂志,2012,47(09):666-668.
[5]Liu SX,Zhang Y,Wang YF.Upregulation of heme oxygenase-1 expression by hydroxysafflor yellow A conferring protection from anoxia/reoxygenation-induced apoptosis in H9c2 cardiomyocytes[J].Int J Cardiol,2012,160(2):95-101.
[6]梅红军,刘洋,田红敏,等.白藜芦醇对脊髓损伤大鼠神经细胞凋亡的抑制作用[J].武汉大学学报(医学版),2013,34(06):832-835.
[7]Fan LH,Dang XQ,Shi ZB.Hydroxysafflor yellow A protects PC12 cells against the apoptosis induced by oxygen and glucose deprivation[J].Cell Mol Neur,2011,31(8):1187-1194.
[8]张继东,夏群,吉宁,等.术中椎间盘造影辅助确定无骨折脱位型颈脊髓损伤的责任节段[J].中华创伤杂志,2013,29(1):25-29.
[9]林海泓,龚辉.重组人促红细胞生成素在体外抑制H2O2诱导的骨髓间充质干细胞凋亡[J].中华器官移植杂志,2012,33(8):470-473.
[10]焦伟东,李延辉,季爱玉,等.海藻纤维膜片促进大鼠损伤坐骨神经的再生[J].中国组织工程研究,2014,25(1):3973-3979.
[收稿2015-02-05修回2015-03-07]
(编辑许四平)
