沉默NRP-1 基因对人T细胞白血病Jurkat细胞株增殖与凋亡的影响①
2016-01-08王红梅徐振媛杜秀平李滔涛韩正祥
王红梅 徐振媛 杜秀平 李滔涛 韩正祥
(徐州医学院附属医院肿瘤科,徐州221000)
[摘 要] 目的:探讨RNAi沉默NRP-1基因对人T细胞白血病细胞株增殖与凋亡的影响。方法:将我们前期构建好的pLB-NRP-1/shRNA重组慢病毒质粒,感染至Jurkat细胞中,用CCK-8法检测各组细胞的增殖情况及化疗药物表柔比星(EPI)处理后细胞增殖情况;用AV/PI法结合流式细胞仪检测细胞凋亡、细胞周期。结果:细胞增殖结果:在48、72、96 h时间点NRP-1/shRNA干扰组的OD值均低于相应对照组,差异有统计学意义(P<0.05),而阴性对照组与空白对照组差异无统计学意义(P>0.05);细胞凋亡率结果:与对照组比较,NRP-1/shRNA干扰组细胞的凋亡率明显升高,差异有统计学意义(P<0.05);对化疗药物表柔比星(EPI)敏感性检测结果:EPI浓度为0.025、0.05、0.1、0.2、0.4 μg/ml时, NRP-1/shRNA干扰组的细胞生长抑制率较相应对照组高,差异皆有统计学意义(P<0.05),并且选择IC50进行EPI诱导后,NRP-1/shRNA干扰组的细胞凋亡率明显升高,与对照组比较差异有统计学意义(P<0.05);WB结果显示:与对照组相比,NRP-1/shRNA干扰组Bcl-2蛋白的表达水平明显下降, Bax的表达水平明显升高,差异均具有统计学意义(P<0.05);细胞周期结果:与对照组比较,NRP-1/shRNA干扰组G0/G1期细胞的比例增高,S期细胞的比例明显降低,差异均有统计学意义(P<0.05)。结论:RNAi沉默NRP-1基因可抑制Jurkat细胞增殖,促进其凋亡,提高对化疗药物的敏感性,其机制可能涉及Bcl-2/Bax途径的调节;并可将细胞周期阻滞在G0/G1期,降低细胞的增殖水平,诱导细胞进入凋亡期。
[关键词] NRP-1;RNA干扰;慢病毒载体;T细胞白血病;增殖;凋亡;细胞周期;化疗药物敏感性
doi:10.3969/j.issn.1000-484X.2015.11.002
·基础免疫学·
沉默NRP-1 基因对人T细胞白血病Jurkat细胞株增殖与凋亡的影响①
王红梅徐振媛杜秀平李滔涛②韩正祥
(徐州医学院附属医院肿瘤科,徐州221000)
[摘要]目的:探讨RNAi沉默NRP-1基因对人T细胞白血病细胞株增殖与凋亡的影响。方法:将我们前期构建好的pLB-NRP-1/shRNA重组慢病毒质粒,感染至Jurkat细胞中,用CCK-8法检测各组细胞的增殖情况及化疗药物表柔比星(EPI)处理后细胞增殖情况;用AV/PI法结合流式细胞仪检测细胞凋亡、细胞周期。结果:细胞增殖结果:在48、72、96 h时间点NRP-1/shRNA干扰组的OD值均低于相应对照组,差异有统计学意义(P<0.05),而阴性对照组与空白对照组差异无统计学意义(P>0.05);细胞凋亡率结果:与对照组比较,NRP-1/shRNA干扰组细胞的凋亡率明显升高,差异有统计学意义(P<0.05);对化疗药物表柔比星(EPI)敏感性检测结果:EPI浓度为0.025、0.05、0.1、0.2、0.4 μg/ml时, NRP-1/shRNA干扰组的细胞生长抑制率较相应对照组高,差异皆有统计学意义(P<0.05),并且选择IC50进行EPI诱导后,NRP-1/shRNA干扰组的细胞凋亡率明显升高,与对照组比较差异有统计学意义(P<0.05);WB结果显示:与对照组相比,NRP-1/shRNA干扰组Bcl-2蛋白的表达水平明显下降, Bax的表达水平明显升高,差异均具有统计学意义(P<0.05);细胞周期结果:与对照组比较,NRP-1/shRNA干扰组G0/G1期细胞的比例增高,S期细胞的比例明显降低,差异均有统计学意义(P<0.05)。结论:RNAi沉默NRP-1基因可抑制Jurkat细胞增殖,促进其凋亡,提高对化疗药物的敏感性,其机制可能涉及Bcl-2/Bax途径的调节;并可将细胞周期阻滞在G0/G1期,降低细胞的增殖水平,诱导细胞进入凋亡期。
[关键词]NRP-1;RNA干扰;慢病毒载体;T细胞白血病;增殖;凋亡;细胞周期;化疗药物敏感性
doi:10.3969/j.issn.1000-484X.2015.11.002
中图分类号①本文为国家自然科学基金青年基金(No.30901753)和江苏省“六大人才高峰”B类资助项目(No.2014-WSW-040)。;②徐州工程兵学院门诊部,徐州221000。
作者简介:王红梅(1981年-),女,讲师,主治医师,主要从事肿瘤分子靶向治疗及内科治疗研究,E-mail:wanghongmei8179@126.com。
通讯作者及指导教师:韩正祥(1974年-),男,博士,教授,副主任医师,硕士生导师,主要从事肿瘤分子靶向治疗及内科治疗,E-mail:cnhzxyq@163.com。
[Abstract]Objective:To investigate the effect on proliferation and apoptosis of T-cell leukemia cells by silencing NRP-1(Jurkat cells). Methods: The lentivirus plasmid which expresses NRP1 gene specific shRNA was constructed in our preliminary experimental.We transfected the lentivirus plasmid to human T-cell Lymphoma cells.The proliferation of Jurkat cells different groups and effect on cell proliferation after chemotherapy drug EPI-treated were found by CCK-8 kit.The proliferation level and apoptosis rate of the cells were detected by flow cytometry and Annexin-V-FITC/PI method. Results: The proliferation level of NRP -1 /shRNA interference group was decreased significantly in 48 h,72 h,96 h,which was compared with the control groups.The apoptosis rate of the NRP-1/shRNA interference group was increased compared with control groups.The chemotherapy drug sensitivity of epirubicin(EPI) test results showed that EPI concentration was 0.025,0.05,0.1,0.2,0.4 μg/ml,the NRP-1/shRNA interference group of cell growth inhibition rate was increased,the corresponding control group difference had statistical significance(P<0.05).We choose the drug concentration of the EPI IC50 for next experiments.NRP-1/shRNA interference group cell apoptosis rate increased significantly after induction,compared with the control groups difference was statistically significant(P<0.05).Compared with control group,the expression level of Bcl-2 protein was decreased and the expression level of bax protein was increased significantly after EPI induction.The percentage of cells at G0/G1 phase increased significantly,while those at S phase decreased significantly .Conclusion: Plasmid shRNA-NRP1 inhibited the expression of NRP1 in Jurkat cells and decreased the proliferation level of Jurkat cells and promote their apoptosis and enhance their drug sensitivity;the molecular mechanism may relate to down-regulation of Bcl-2 and up-regulation of Bax.and arrested the cell cycle at G0/G1 phase.
Effects on proliferation and apoptosis of T-cell leukemia cells by silencing NRP-1
WANGHong-Mei,XUZhen-Yuan,DUXiu-Ping,LITao-Tao,HANZheng-Xiang.DepartmentofOncology,AffiliatedHospitalXuzhouMedicalCollege,Xuzhou221000,China
[Key words]Neuropilin1(NRP1);RNA interference;Lentivirus;T-cell leukemia;Cell proliferation;Cell apoptosis
神经纤毛蛋白(Neuropilins,NRPs)为跨膜糖蛋白,不仅是semaphorins 的主要受体;还是血管内皮生长因子(Vascular endothelial growth factor,VEGF)的非酪氨酸激酶受体[1]。NRPs家族有两个成员,分别是NRP1 和NRP2。NRP-1在脊椎动物胚胎的神经和心血管系统发育中发挥了重要作用,NRP-1在多种肿瘤组织中呈高表达,以独立或者依赖VEGFR-2的方式调节肿瘤血管的形成及肿瘤细胞的增殖、凋亡和迁移,促进多种实体瘤及血液系统肿瘤的发生和发展,并且与肿瘤患者的预后密切相关[2]。已有研究表明NRP-1在白血病细胞中有表达,急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL)中NRP-1的表达较急性髓性白血病(Acute myloid leukemia,AML)中表达更多见,NRP-1的表达水平或可指示白血病的严重程度和进展[3-6]。而NRP-1作为新的VEGF受体在T细胞白血病中的表达及作用研究较少。我们前期实验成功构建了NRP-1/shRNA慢病毒表达载体,体外感染人T细胞白血病Jurkat细胞株后显著抑制靶基因NRP-1 mRNA和蛋白的表达。本研究检测NRP-1/shRNA慢病毒表达载体对Jurkat细胞增殖、凋亡、化疗药物敏感性及细胞周期的影响。现报道如下。
1材料与方法
1.1材料本研究中pLB-NRP-1/shRNA慢病毒表达载体系我们课题组前期实验构建成功并经过验证,通过WB及RT-PCR筛选出对靶基因-NRP-1沉默效率最高的慢病毒表达载体;Jurkat细胞株购于上海中科院细胞库;Annexin Ⅴ-FITC/PI细胞凋亡试剂盒以及细胞周期测定试剂盒购于南京凯基生物公司;CCK-8试剂盒购于日本同仁化学研究所;RPMI1640培养基购于Gibco公司;胎牛血清购于杭州四季青公司;表柔比星(EPI)由美国辉瑞制药有限公司提供;抗兔bcl-2、bax多克隆抗体购于英国Abcam公司;抗β-actin鼠单克隆抗体以及碱性磷酸酶标记山羊抗兔IgG、碱性磷酸酶标记马抗小鼠IgG、BCIP/NBT试剂均购于北京中杉金桥公司。
1.2方法
1.2.1细胞培养人T细胞白血病细胞株Jurkat细胞常规培养(在含10%胎牛血清的RPMI1640培养基,37℃、5%CO2饱和湿度的培养箱中培养),每2~3 d传代,取对数生长期细胞用于实验。
1.2.2细胞转染及实验分组实验分三组:空白对照组:未做特殊处理的Jurkat细胞组;阴性对照组:感染非特异性shRNA慢病毒载体的Jurkat细胞组;实验组(NRP-1/shRNA干扰组):感染了NRP-1/shRNA慢病毒载体(系前期实验筛选出NRP-1/shRNA1对NRP-1沉默效率最高)的Jurkat细胞组;每组均设3个复孔。取对数生长期Jurkat细胞,按照感染复数(MOI)为20加入浓缩的慢病毒颗粒(各设3个复孔),并加入聚凝胺至终浓度为8 μg/ml,置于37℃、5%CO2及饱和湿度的培养箱中培养,于病毒感染24、48 h后荧光显微镜下观察GFP表达,感染后的阳性细胞扩大培养,流式细胞仪分选GFP阳性细胞,分选后重新扩大培养,获得稳定抑制NRP-1基因表达的Jurkat细胞模型。
1.2.3CCK-8法检测RNAi沉默NRP-1基因对细胞增殖取对数生长期细胞,调整细胞密度为5×104ml-1,接种于96孔板中(每孔100 μl),每组设3个复孔,按前述方法常规培养,分别于培养后24、48、72、96 h加入CCK-8试剂10 μl,继续培养3 h后,于酶标仪波长450nm测OD值。
1.2.4RNAi沉默NRP-1基因对化疗药物EPI敏感性的影响取对数生长期细胞,将细胞密度为2.5×105ml-1的各组细胞,接种于96孔板(每孔100 μl),按前述方法常规培养,培养24 h后,加入含有2.5、5、10、20、40、80 μg/ml表柔比星EPI的无血清RPMI1640培养基各1 μl,使其终浓度为以此为0.025、0.05、0.1、0.2、0.4、0.8 μg/ml,每组每一浓度平行设3个复孔。加药后置于37℃、5%CO2及饱和湿度的培养箱中继续培养24 h,每孔加入CCK-8试剂10 μl,继续培养3 h,于酶标仪波长450nm测OD值。细胞生长抑制率=[(1-干扰组0D值)/对照组OD值]×100%。
1.2.5流式细胞仪检测RNAi沉默NRP-1基因对细胞凋亡的影响(Annexin V-FITC/PI标记)取对数生长期细胞,调整细胞密度为2×104ml-1,接种于六孔板中,常规培养24 h,1 000 r/min离心收集细胞,用PBS溶液洗涤细胞两次后弃上清,用500 μl Binding Buffer重悬细胞,先加入5 μl Annexin V-FITC充分混匀,再加入 5 μl PI充分混匀,在室温下避光孵育15 min,流式细胞仪检测细胞凋亡情况。
取对数生长期细胞,将细胞密度为2×105ml-1的各组细胞,接种于六孔板,常规中培养24 h,加入用无血清RPMI1640培养基稀释的表柔比星溶液,使其终浓度为0.23 μg/ml,每组均设3个复孔,置于37℃、5%CO2及饱和湿度的培养箱中继续培养24 h后,采用Annexin V-FITC/PI测定细胞凋亡率,方法同上。
1.2.6Western blot检测 EPI处理后细胞内凋亡相关基因Bcl-2、Bax蛋白表达取对数生长期的细胞,将细胞密度为2×105ml-1的各组细胞,接种于六孔培养板中,常规培养24 h后,用PBS溶液洗涤后加入用无血清RPMI1640培养基稀释的表柔比星溶液,使其终浓度为0.23 μg/ml,每组均设3个复孔,继续培养24 h后,离心收集细胞提取总蛋白。将等量蛋白样品点于SDS-聚丙烯酰胺凝胶小孔进行电泳。电泳后半干转膜,将转好的NC膜用洗涤后,将NC膜浸入封闭液进行封闭,然后根据预染Marker所指示大小,将内参条带与目的条带剪开,分别加入一抗(1∶1 000抗兔bcl-2多克隆抗体;1∶1 000抗兔bax多克隆抗体;1∶5 000抗β-actin鼠单克隆抗体),4℃过夜,取出NC膜洗涤后,加入羊抗兔及羊抗鼠二抗(1∶2 000)孵育,将NC膜置于BCIP/NBT试剂中反应约1 min,置于Image Quant 4000 mini显像仪中显像,结果用bcl-2、bax与内参吸光度比值表示各样本中目的蛋白的相对含量。
1.2.7流式细胞仪RNAi沉默NRP-1基因对细胞周期的影响取对数生长期细胞,将细胞密度为2×105ml-1的各组细胞,接种于六孔板中,常规培养24 h后离心收集细胞,并用PBS溶液洗涤一次,将细胞密度调整为2×106ml-1,用预冷的70%乙醇固定,置于4℃冰箱过夜,用PBS洗去固定液,加入100 μl RNase A 37℃水浴30 min,再加入400 μl PI充分混匀,4℃避光孵育30 min,流式细胞仪检测细胞周期。
2结果
2.1细胞增殖检测CCK-8法检测细胞增殖结果显示:Jurkat细胞NRP-1/shRNA干扰组于48、72、96 h测得的OD值分别为0.242±0.033、0.415±0.028、0.806±0.064,与对照组比较,差异有统计学意义(P<0.05),而空白对照组与阴性对照组比较差异无统计学意义(P>0.05),说明干扰NRP-1基因能抑制Jurkat细胞的增殖(表1、图1)。
2.2细胞凋亡率的检测Annexin V-FITC/PI结合流式细胞仪检测凋亡率,结果显示:空白对照组、阴性对照组、NRP-1/shRNA干扰组的细胞凋亡率分别为(4.5±0.2)%、(4.1±0.4)%、(34.1±1.9)%,与对照组比较,NRP-1/shRNA干扰组的凋亡率明显增高,差异有统计学意义(P<0.05)。而空白对照组和阴性对照组比较差异无统计学意义(P>0.05)(表2、图2)。
2.3化疗药物敏感性的检测CCK-8法检测干扰沉默NRP-1基因对化疗药物敏感性的影响,结果显示:选取化疗药物表柔比星(EPI)进行检测,结果显示在0.01~10 μg/ml的浓度范围内,随着EPI药物浓度的升高,其对细胞生长抑制作用逐渐增强,其中在0.025~1 μg/ml的范围内最明显。对照组细胞在EPI浓度为0.2 μg/ml时,细胞生长抑制率为(48.83±1.46)%,IC50约为0.23 μg/ml;而NRP-1/shRNA干扰组在EPI浓度为0.1 μg/ml时细胞生长抑制率达(44.27±1.25)%,IC50约为0.15 μg/ml,比对照组的IC50低;EPI浓度为0.025、0.05、0.1、0.2、0.4 μg/ml时,与对照组比较,NRP-1/shRNA干扰组的细胞生长抑制率高,差异有统计学意义(P<0.05)(表3、图3)。

图1 各组细胞增殖水平Fig.1 Cell proliferation levels of different groups
表2 各组细胞的凋亡率(%,±s,n=3)Tab.2 Cell apoptosis levels of different groups(%,±s,n=3)
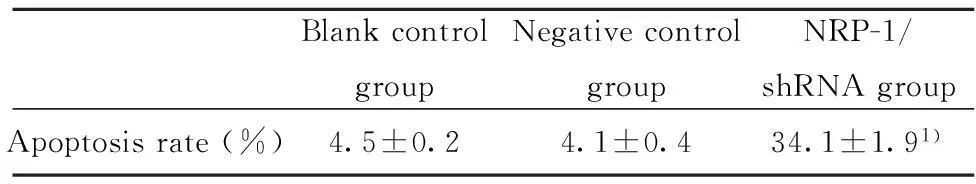
表2 各组细胞的凋亡率(%,±s,n=3)Tab.2 Cell apoptosis levels of different groups(%,±s,n=3)
BlankcontrolgroupNegativecontrolgroupNRP-1/shRNAgroupApoptosisrate(%)4.5±0.24.1±0.434.1±1.91)
Note:1)P<0.05 vs negative control group.
表1 CCK-8法检测干扰NRP-1基因对Jurkat细胞增殖的影响(±s,n=3)Tab.1 Inhibitory effect of NRP-1/shRNA on proliferation of Jurkat cells by CCK-8(±s,n=3)

表1 CCK-8法检测干扰NRP-1基因对Jurkat细胞增殖的影响(±s,n=3)Tab.1 Inhibitory effect of NRP-1/shRNA on proliferation of Jurkat cells by CCK-8(±s,n=3)
Groups24h(OD)48h(OD)72h(OD)96h(OD)Blankcontrolgroup0.217±0.0130.444±0.0060.732±0.0211.607±0.137Negativecontrolgroup0.197±0.0490.478±0.0190.800±0.0541.634±0.140NRP-1/shRNAgroup0.122±0.0080.242±0.0331)0.415±0.0281)0.806±0.0641)
Note:1)P<0.05,vs negative control group.
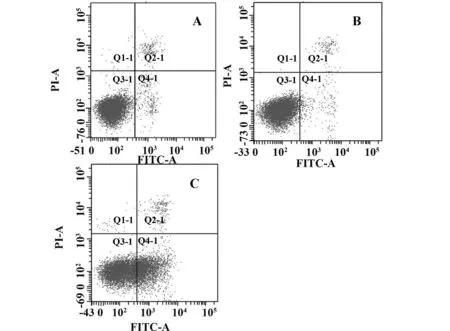
图2 流式细胞仪检测各组Jurkat细胞的凋亡率Fig.2 Cell apoptosis levels of different groups by FCMNote: A.Blank control group;B.Negative control group;C.NRP-1/shRNA group.
2.4EPI诱导的细胞凋亡率检测根据2.3实验结果,Jurkat细胞EPI IC50约为0.23 μg/ml,故本实验EPI浓度选择0.23 μg/ml。采用Annexin V-FITC/PI结合流式细胞仪检测凋亡率,结果显示:对照组、NRP-1/shRNA干扰组的细胞凋亡率分别为(17.9±2.46)%、(47.4±2.16)%,与对照组比较,NRP-1/shRNA干扰组的凋亡率明显增高,差异有统计学意义(P<0.05)(表4、图4)。
2.5EPI处理后细胞内凋亡相关基因Bcl-2、Bax蛋白表达水平的变化WB结果显示:与对照组相比,NRP-1/shRNA干扰组抗凋亡基因Bcl-2蛋白的表达水平下降,为对照组1/3;与对照组相比,NRP-1/shRNA干扰组促凋亡基因Bax的表达水平升高,升高约2倍,差异均有统计学意义(P<0.05);提示NRP-1基因干扰后增加细胞对表柔比星敏感性的机制可能涉及Bcl-2/Bax途径的调节(表5、图5)。
表3 不同浓度的EPI处理后对各组Jurkat细胞增殖的影响(±s,n=3)Tab.3 Effect on cell proliferation of different groups after chemotherapy drug EPI-treated(±s,n=3)

表3 不同浓度的EPI处理后对各组Jurkat细胞增殖的影响(±s,n=3)Tab.3 Effect on cell proliferation of different groups after chemotherapy drug EPI-treated(±s,n=3)
EPIconcentration(μg/ml)0.0250.050.10.20.40.8Negativecontrolgroup1.37±0.196.78±0.2720.13±1.4648.83±1.4672.19±3.0291.36±4.45NRP-1/shRNAgroup7.50±0.571)21.57±1.451)44.27±1.251)69.66±2.271)87.22±1.761)96.06±1.70
Note:1)P<0.05 vs negative control group.

图3 EPI处理后各组Jurkat细胞生长抑制曲线Fig.3 Growth-inhibitory curves of different groups after chemotherapy drug EPI-treated
表4 EPI处理后Jurkat细胞的凋亡率(%,±s,n=3)Tab.4 Apoptosis rate of Jurkat cells of different groups after chemotherapy drug EPI-treated(%,±s,n=3)

表4 EPI处理后Jurkat细胞的凋亡率(%,±s,n=3)Tab.4 Apoptosis rate of Jurkat cells of different groups after chemotherapy drug EPI-treated(%,±s,n=3)
NegativecontrolgroupNRP-1/shRNAgroupApoptosisrate(%)17.9±2.4647.4±2.161)
Note:1)P<0.05 vs.negative control group.

图4 流式细胞仪检测EPI处理后Jurkat细胞的凋亡率Fig.4 Apoptosis rate of Jurkat cells of different groups after EPI-treated by FCMNote: A.Negative control group after EPI-treated;B.NRP-1/shRNA group after EPI-treated.
表5 EPI处理后细胞内凋亡相关基因蛋白的表达(±s,n=3)Tab.5 Protein expression of apoptotic related genes protein after EPI-treated(±s,n=3)

表5 EPI处理后细胞内凋亡相关基因蛋白的表达(±s,n=3)Tab.5 Protein expression of apoptotic related genes protein after EPI-treated(±s,n=3)
BlankcontrolgroupNegativecontrolgroupNRP-1/shRNAgroupBcl-21.000±0.0560.946±0.0910.324±0.0821)Bax1.000±0.0681.031±0.0712.032±0.2371)
Note:1)P<0.05 vs.negative control group.

图5 EPI处理后细胞内凋亡相关基因蛋白的表达情况Fig.5 Protein expression of apoptotic related genes protein after EPI-treated
表6 干扰NRP-1基因对Jurkat细胞的细胞周期的影响(%,±s,n=3)Tab.6 Effects on Jurkat cells of cell cycle(%,±s,n=3)

表6 干扰NRP-1基因对Jurkat细胞的细胞周期的影响(%,±s,n=3)Tab.6 Effects on Jurkat cells of cell cycle(%,±s,n=3)
GroupsG0/G1cycle(%)Scycle(%)G2/Mcycle(%)Negativecontrolgroup51.19±5.6241.01±1.018.00±0.77NRP-1/shRNAgroup61.70±2.021)30.91±0.911)8.00±0.55
Note:1)P<0.05 vs.negative control group.

图6 干扰NRP-1基因对Jurkat细胞的细胞周期的影响Fig.6 Effects on Jurkat cells of cell cycleNote: A.Negative control group;B.NRP-1/shRNA group.
2.6细胞周期的检测采用检测细胞DNA含量的方法检测细胞周期,结果如下:与对照组比较,NRP-1/shRNA干扰组G0/G1期细胞的比例增高,S期细胞的比例明显降低,差异均有统计学意义(P<0.05),说明干扰NRP-1基因能将细胞进程阻滞在G0/G1期(表6、图6)。
3讨论
NRP1基因表达广泛,在多种肿瘤细胞中表达升高,与肿瘤的发生发展密切相关,与VEGF-A、B、E 及胎盘生长因子相互作用[7,8],不仅可以增强VEGF 与VEGFR-2 结合引起的生物活性,而且可以单独表达在内皮、肿瘤、基质细胞上,独立介导促血管生成作用以及抗凋亡作用[9,10]。Russo等[11]报道某些不表达VEGFR,而表达NRP1 的肿瘤细胞中,NRP1 也可与VECF 结合诱导肿瘤细胞增殖,在肿瘤血管新生及侵袭转移中发挥作用。
细胞的增殖和凋亡异常与肿瘤的发生密切相关,本实验研究结果显示RNAi 沉默NRP-1 基因不仅能促进细胞凋亡,更可以抑制细胞增殖。Li 等[12]应用RNAi 沉默NRP-1 基因能显著抑制人脑胶质瘤细胞的增殖,促进其凋亡。Bachelder等[13]研究发现,NRP-1 在转移性乳腺癌中表达,而在非转移性乳腺癌中无表达;而转染了NRP-1基因的非转移性MDA-MB-453 乳腺癌细胞的缺氧性凋亡明显减少,提示NRP-1对促进乳腺癌细胞生长、抑制其凋亡有特殊作用。 Meyerson等[5]发现VEGF165能够诱导髓细胞白血病-1(Myeloid cell leukemia-1,MCL-1)mRNA的表达,是通过NRP-1与c-MET的结合实现在VEGF165上调MCL-1 表达。此外NRP-1能够强化人胶质瘤、胰腺癌中c-MET 活化[14,15];而这种VEGF165-NRP-1-c-MET信号传导在前列腺癌的MCL-1 上调中也发挥重要作用[16]。Lu等[4]报道显示应用siRNA沉默NRP-1能显著降低AML细胞的增殖和迁移能力。这些研究结果提示NRP-1通过介导不同生长因子的信号转导,在肿瘤的发生发展过程中发挥复杂多样的作用。而NRP-1 在外周NK/T细胞淋巴瘤(Peripheral NK/T-cell lymphoma,PTCL)发生和发展中的作用机制尚待深究。
本研究前期实验,构建靶向NRP-1基因的干扰质粒,以慢病毒为载体,将NRP-1/shRNA整合到Jurkat 细胞中,沉默NRP-1基因,下调NRP-1 蛋白表达。而本实验结果显示,RNAi沉默NRP-1基因可抑制Jurkat细胞增殖,促进其凋亡,提高化疗药物敏感性;并可将细胞周期阻滞在G0/G1期,能增强EPI的抗肿瘤作用,其机制可能涉及Bcl-2/Bax途径的调节。为后续研究NRP-1在PTCL发生发展中的作用提供有效的实验模型,也为寻找PTCL有效治疗靶点方面提供新思路。NRP-1可能成为淋巴瘤分子治疗的靶点。
参考文献:
[1]Russo TA,Johnson JR.Proposal for a new inclusive designation for extraintestinal pathogenic isolates of Escherichia coli:ExPEC[J].Infect Dis,2000,181(5):1753-1754.
[2]Benja min B,Gregory D,Steven G,etal.A vascular niche and a VEGF-Nrp1 loop regulate the initiation and stemness of skin tumours[J].Nature,2011,478:399-403.
[3]Younana S,Elhoseinyb S,Hammamb A,etal.Role of Neuropilin-1 and its expression in Egyptian Acute Myeloid and Acute Lymphoid Leukemia patients[J].Leukemia Res,2012,36:169-173.
[4]Lu L,Zhang L,Xiao ZJ,etal.Neuropilin-1 in acute myeloid leukemia :Expression and role in proliferation and migration of leukemia cells[J].Leukemia and Lymphoma,2008,49(2):331-338.
[5]Meyerson HJ,Blidaru G,Edinger A,etal.NRP-1/CD304 Expression in Acute Leukemia[J].Hematopathology,2012,137:39-50.
[6]Grandelement C,Borg C.Neuropilins:A new target for cancer therapy[J].Cancers,2011,3:1899-1928.
[7]Gupta K,Hooton TM,Stamm WE. Increasing antimicrobial resistance and the management of uncomplicated community-acquired urinary tract infections[J].Ann Intern Med,2001,135(1):41-50.
[8]Bekal S,Brousseau R,Masson L,etal. Rapid identification of Escherichia coli pathotypes by virulence gene detection with DNA microarrays[J].Clin Microbiol,2003,41(5):2113-2125.
[9]Bauer RJ,Zhang L,Foxman B,etal. Molecular epidemiology of 3 putative virulence genes for Escherichia coli urinary tract infection-usp,iha,and iroN (E. coli)[J].Infect Dis,2002,185 (10):1521-1524.
[10]Fantin A,Vieira JE,Plein A,etal.NRP-1 acts cell autonomously in endothelium to promote tip cell function during sprouting angiogenesis[J].Blood,2013,121(12):2352-2362.
[11]Russo TA,Carlino UB,Mong A,etal. Identification of genes in an extraintestinal isolate of Escherichia coli with increased expression after exposure to human urine [J].Infect Immun,1999,67 (10):5306-5314.
[12]Li XY,Tang T,Zhou HG,etal.RNA interference targeting NRP-1 inhibits human glioma cell proliferation and enhances cell apoptosis[J].Mol Med Reports,2011,4:1261-1266.
[13]Bachelder RE,Crago A,Chung J,etal. Vascular endothelial growth factor is an autoc rine survival factor for neuropilin-expressing breast carcinoma cells[J].Cancer Res,2001,61(15):5736-5740.
[14]Matsushita A,Gotzq T,Korc M.Hepatocyte growth actor-mediated cell in pancreatic cancer cells is dependent on neuropilin-1[J].Cancer Res,2007,67:10309-10316.
[15]Hu B,Guo P,Bar-Joseph I,etal.Neuropilin-1 promotes human glioma progression through potentiating the activity of the HGF/SF autocrine pathway[J].Oncogene,2007,26:5577-5586.
[16]Zhang S,Zhau H,Osunkoya AO,etal.Vascular endothelial growth factor regulates myeloid cell leukemia-1 expression through neuropilin-1-dependent activation of c-MET signaling in human prostate cancer cells[J].Mol Cancer,2010,9(9):9-24.
[收稿2015-05-07修回2015-06-15]
(编辑张晓舟)
