非酒精性脂肪性肝病肠源性内毒素血症形成机理及其作用
2015-12-31王书会韩继武
王书会,韩继武
哈尔滨医科大学附属第四医院消化内科,黑龙江 哈尔滨150001
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种由于肝细胞内的脂质积累太多引起肝细胞损伤、间质炎症和纤维化的临床病理综合征。其常与中心性肥胖、高血压、高血脂及2 型糖尿病相伴行[1-2]。研究[3]结果表明:很多肝脏相关疾病患者(肝癌、急慢性肝炎等)都伴有肠源性内毒素血症(intestinal endotoxemia,IETM)。但近年来一些研究表明,肠道环境的变化和IETM 可能参与上述疾病[4-5],本研究通过高脂饲料喂养大鼠,建立NAFLD 模型,探讨大鼠NAFLD 导致IETM 的机制及IETM 在NAFLD 中的作用。
1 材料与方法
1.1 动物与试剂 成年雄性Wistar 大鼠50 只,体质量150 ~250 g,购自青岛派特福德白鼠公司。检测巨噬细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)试剂盒购自美国Santa Cruz 公司。所有生化试剂购自BECHMAN 公司。
1.2 NAFLD 模型的建立 取动物适应性喂养7 d。50 只大鼠随机分为正常组和实验组,每组25 只。正常组采取普通饲料喂养,实验组采取高脂饲料(81.3%普通饲料、10%猪油、2%胆固醇、0.2%甲基硫氧嘧啶和0.5%胆盐)喂养。两组大鼠分别喂养56 d,各取5 只大鼠解剖,取肝组织行病理学检查。轻度脂肪肝:低倍镜下肝细胞脂肪变占肝小叶1/3 ~1/2;中度脂肪肝:占肝小叶1/2 ~3/4;重度脂肪肝:占肝小叶3/4 以上或肝细胞弥漫性变性呈渔网状。
1.3 相关指标检测
1.3.1 血清指标的检测:大鼠在喂养第16 周经麻醉后,在无菌条件下采集右心室血3 ml,测定C 反应蛋白(c-reactive protein,CRP)、脂多糖(lipopolysaccharide,LPS)、巨噬细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、游离脂肪酸(free fatty acids,FFA)及血浆D-乳酸。切取肝、脾组织、淋巴结和5 cm回肠(取肠内容物)进行细菌培养和脂多糖检测。并对肝脏和回肠行病理学检查。
1.3.2 标本检测:血浆和回肠内容物的内毒素测定:应用鲎试剂反应动浊法;血浆TNF-α 检测:应用免疫组织化学方法进行检测;血浆D-乳酸检测:绘制标准曲线,用分光光度法进行测定;肠道细菌定量培养:取0.1 g 回肠内容物加1 ml 0.9% NaCl 溶液,放置在旋涡混合器振荡成匀浆液,继而应用0.9% NaCl 溶液连续10 倍稀释匀浆液,取稀释液50 μl 于培养基上进行肠道细菌定量培养;用无菌0.9% NaCl 溶液将肝、脾及淋巴结组织冲洗干净并吸干,取0.1 g 制成10%的组织匀浆液,取50 μl 匀浆液进行细菌培养,方法同上进行肠道细菌移位的观察。
1.3.3 病理学检查:将经处理的肝脏组织及空肠组织制成常规石蜡切片,行苏木精-伊红染色(H-E)进行病理学检测。
1.4 统计学处理 采用SPSS 19.0 软件进行数据分析,计量资料用±s 表示,采用t 检验,P <0.05 为差异有统计学意义。
2 结果
2.1 两组大鼠基本情况 两组大鼠在实验结束前均无死亡。实验组大鼠有不同程度的精神萎靡、反应迟钝及饮食减少等,而正常组大鼠精神和饮食情况均良好。
2.2 两组大鼠血清LPS、FFA 及NAFLD 相关炎症介质水平比较 实验组大鼠血清LPS、FFA、TNF-α、CRP、MCP-1 和血浆D-乳酸水平均明显高于正常组,两组相比,差异有统计学意义(P <0.05,见表1)。
表1 两组血清指标变化的比较(±s)Tab 1 Comparison of serum markers between two groups (±s)

表1 两组血清指标变化的比较(±s)Tab 1 Comparison of serum markers between two groups (±s)
只数LPS(U/L)FFA(mmol/L)TNF-α(μg/L)CRP(μg/L)MCP-1(ng/L)血浆D-乳酸(mg/L)正常组 25 0.08 ±0.03 407.41 ±41.16 1.03 ±0.21 1.45 ±0.85 4.82 ±0.43 6.53 ±1.22实验组 25 0.62 ±0.08 874.93 ±163.41 2.13 ±0.23 3.17 ±0.63 25.32 ±0.45 8.79 ±1.92 t 值 31.6011 13.8718 17.6594 8.1284 164.6812 4.96 74 P 值 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05
2.3 两组大鼠血浆和回肠内毒素水平比较 与正常组比,实验组大鼠血浆和回肠内毒素水平明显增多,组间比较,差异有统计学意义(P <0.05,见表2)。
表2 两组大鼠血浆和回肠内毒素水平比较(Eu/ml,±s)Tab 2 Comparison of endotoxin in rat plasma and ileal between two groups(Eu/ml,±s)
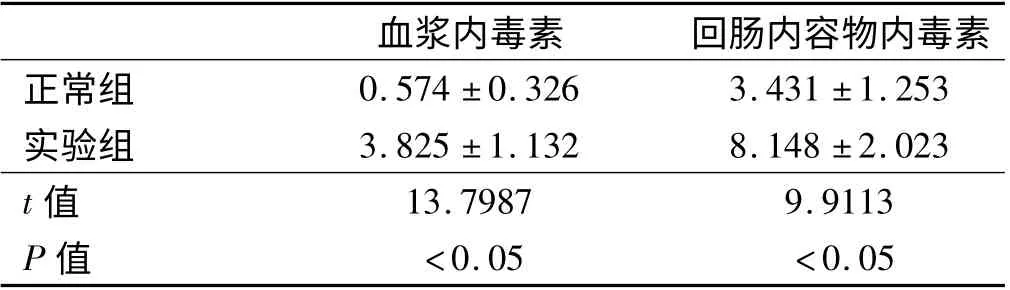
表2 两组大鼠血浆和回肠内毒素水平比较(Eu/ml,±s)Tab 2 Comparison of endotoxin in rat plasma and ileal between two groups(Eu/ml,±s)
血浆内毒素 回肠内容物内毒素正常组0.574 ±0.326 3.431 ±1.253实验组 3.825 ±1.132 8.148 ±2.023 t 值13.7987 9.9113 P 值 <0.05 <0.05
2.4 肝、脾、淋巴结细菌生长情况 正常组大鼠除在淋巴结中培养出细菌外,其他组织未培养出细菌,细菌移位率为25.23%;实验组大鼠在所有检查组织中均培养出细菌,但以淋巴结组织移位率最高,为81.74%,肝组织移位率为53. 67%,脾脏组织移位率为43.94%。经对培养细菌进行革兰氏染色分析,发现97%以上细菌为革兰阴性杆菌,在少数组织中培养出革兰阳性肠球菌(见表3)。
表3 肠道细菌培养结果(lg/g,±s)Tab 3 Bacterial culture results (lg/g,±s)
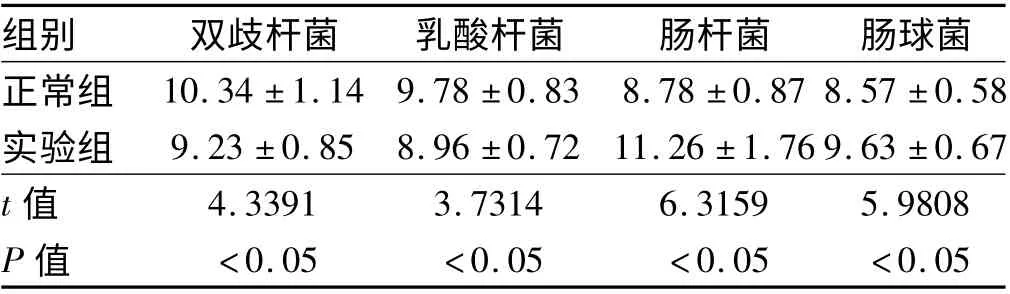
表3 肠道细菌培养结果(lg/g,±s)Tab 3 Bacterial culture results (lg/g,±s)
组别 双歧杆菌 乳酸杆菌 肠杆菌 肠球菌正常组10.34 ±1.14 9.78 ±0.83 8.78 ±0.87 8.57 ±0.58实验组 9.23 ±0.85 8.96 ±0.72 11.26 ±1.76 9.63 ±0.67 t 值4.3391 3.7314 6.3159 5.9808 P 值<0.05 <0.05 <0.05 <0.05
2.5 肝脏和回肠黏膜改变 光镜观察结果:实验组大鼠肝细胞呈弥漫性大片坏死,中央静脉和汇管区炎性细胞浸润,且肝窦的正常结果也被破坏(见图1);正常组可见排列整齐的肝细胞,结构完整清晰的肝窦(见图2);实验组大鼠肠黏膜上皮细胞变性脱落、变薄,且淋巴细胞增加(见图3);而正常组回肠黏膜上皮结构完整,排列整齐(见图4)。
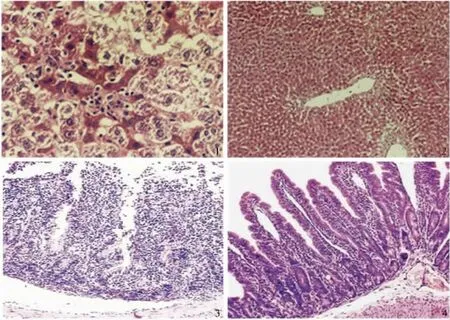
图1 实验组肝脏病理变化(HE 200 ×);图2 正常组肝脏病理变化(HE 200 ×);图3 实验组肠黏膜病理变化(HE 200 ×);图4正常组肠黏膜病理变化(HE 200 ×)Fig 1 Liver pathological changes in the experimental group (HE 200 ×);Fig 2 Liver pathological changes in the normal group(HE 200 ×);Fig 3 Pathological changes of intestinal mucosa in the experimental group (HE 200 ×);Fig 4 Pathological changes of intestinal mucosa in the normal group (HE 200 ×)
3 讨论
内毒素主要存在于革兰氏阴性细菌细胞壁外膜中,主要成分为LPS[6]。在正常情况下,肠道中的内毒素仅有少量被肠道吸收,经门静脉进入肝脏后迅速被Kupffer 细胞清除。当肝脏功能受到损害时,大量的内毒素不能完全清除,使循环系统中内毒素浓度增高,此外,肠道屏障功能的破坏致使过量的内毒素发生移位,最终导致IETM 形成[7-9]。
内毒素可激活肠上皮细胞上的腺苷环酶,引起肠上皮细胞发生自溶和变性坏死;内毒素还可以通过激活补体系统、凝血系统和巨噬细胞白介素活化而直接或间接导致肠黏膜屏障损伤[10-11]。研究[12]表明:细菌代谢产物LPS,主要通过对新生肠上皮细胞迁移的抑制和削弱细胞修复因子修复的作用,导致肠黏膜局部破坏,继而内毒素侵入,触发炎症连锁反应,最终导致肠缺血坏死,肠屏障功能损害。内毒素不仅对肝细胞有直接损害作用[13],还可通过激活Kupffer 细胞,促进TNF-α 等细胞因子和炎性介质的释放,从而使内毒素的作用逐渐放大[14]。在NAFLD 时,产生大量的IL、NO、IFN 等促炎症细胞因子相互作用致使肠道黏膜屏障功能受损的同时也使得肠上皮细胞通透性增加[15-17]。总之,在NAFLD 形成的过程中,因肠道细菌过度生长和菌群移位等因素导致循环系统中内毒素增高,从而使肝窦的Kupffer 细胞被激活,使大量炎症因子及炎症介质大量合成和释放,使肝脏损害进一步加重,造成不良循环,不断加重疾病的进展,最终使肝脏病变向肝纤维化和肝硬化等方向发展[18-20]。
本实验结果表明:造模成功的实验组大鼠血浆回肠内毒素表达水平较正常组明显升高,说明已经形成了IETM;肠道细菌培养结果表明,正常的肠道内占绝对优势的细菌为厌氧菌,并对肠道微环境的维护起重要作用。在NAFLD 时肠道菌群就会出现显著失调。本实验检测回肠内毒素的表达实验组高于正常组,表明随着G 阴性肠道杆菌的大量繁殖,肠道内毒素的含量也不断增加,致使细菌和内毒素发生移位。实验组大鼠血浆D-乳酸的表达水平较正常组高,说明实验组的肠道通透性较正常组明显增高。同样病理学检测结果也表明了实验组大鼠的肠道黏膜出现了损伤、肠黏膜通透性升高,从而为肠道细菌的移位创造了条件。肝脾组织及淋巴结细菌培养结果显示正常组在肝脾组织中未见细菌,只在淋巴结中检测到细菌。然而实验组大鼠肝脾及淋巴结中均检测到细菌,经G 染色显示,检测的细菌中以G 阴性菌为主,而G 阳性球菌则少见,与肠道菌群相似,充分说明肠道细菌发生了移位。肝脏病理学检测所示肝细胞大量坏死,肝窦结构破坏,说明内毒素进入体循环后直接或间接造成了肝细胞的破坏。IETM 形成后,内毒素即可激活肝内单核细胞系统及Kupffer 细胞释放大量的促炎症性介质,其中TNF-α 是最为重要的一个。TNF-α 既可以直接也可以通过微循环障碍导致肝细胞坏死。它在内毒素刺激下同其他炎症介质相互作用,爆发瀑布效应,使肝损害逐渐加重。本实验结果表明,TNF-α 和血浆内毒素的增加呈正相关,说明内毒素可刺激机体产生和释放TNF-α,并 通 过TNF-α 诱 导 肝 损 伤。本 实 验 证 实NAFLD 存在小肠黏膜屏障损伤,内毒素水平明显升高并形成IETM。
总之,因为IETM 可导致NAFLD 的发生,所以经肠道着手治疗脂肪肝病具有很大的可能性。选择合适的医疗方式降低IETM,对预防脂肪性肝病的发生和进展有着极大意义。
[1] Shen F,Fan JG. A clinical interpretation of 2012 American guideline on the diagnosis and management of nonalcoholic fatty liver disease[J]. Chinese Journal of Practical Internal Medicine,2012,32(9):676-679.沈峰,范建高. 2012 年美国非酒精性脂肪性肝病诊疗指南解读[J].中国实用内科杂志,2012,32(9):676-679.
[2] Cao HX,Fan JG. Fatty liver disease:a growing public health problem worldwide[J]. J Dig Dis,2011,12(9):1-2.
[3] Wang Z,Klipfell E,Bennett BJ,et a1. Gut flora metablism of phosphatidylchoine promotes cardivascular disease[J]. Nature,2011,472(7431):57-63.
[4] Loria P,Adinolfi LE,Bellentani S,et al. Practice guidelines for the diagnosis and management of nonalcoholic fatty liver disease. A decalogue from the Italian Association for the Study of the Liver(AISF)Expert Committee[J]. Dig Liver Dis,2010,42(4):272-282.
[5] Chalasani N,Younossi Z,Lavine JE,et al. The diagnosis and management of non-alcoholic fatty liver disease:practice Guideline by the American Association for the Study of Liver Diseases,American College of Gastroenterology,and the American Gastroenterological Association[J]. Hepatology,2012,55(6):2005-2023.
[6] Sakaguchi S,Furusawa S,Yokota K,et al. The enhancing effect of tumor necrosis factor-apha on oxidative stress in endotoxemia [J]. Pharmalol Toxicol,1996,79(5):259-265.
[7] Visschers RG,Luyer MD,Schaap FG,et al. The gut-liver axis[J].Curr Opin Clin Nutr Metab Care,2013,16(5):576-581.
[8] Pijls KE,Jonkers DM,Elamin EE,et al. Intestinal epithelial barrier function in liver cirrhosis:an extensive review of the literature[J].Liver Int,2013,33(10):1457-1469.
[9] Chassaing B,Etienne-Mesmin L,Gewirtz AT. Microbiota-liver axisinhepaticdisease[J]. Hepatology,2014,59(1):328-339.
[10] Shao B,Munford RS,Kitchens R,et al. Hepatic uptake and deacylation of the LPS in bloodborne LPS-lipoprotein complexes[J]. Innate Immun,2012,18(6):825-833.
[11] Nolan JP. The role of intestinal endotoxin in liver injury:a long and evolving history[J]. Hepatology,2010,52(5):1829-1835.
[12] Pijls KE,Jonkers DM,Elamin EE,et al. Intestinal barrier function in liver cirrhosis:an extensive review of the literature[J]. Liver Int,2013,33(10):1457-1469.
[13] Minter RM,Fan MH,Sun J,et al. Altered Kupffer cell function in biliar obstruction[J]. Surgery,2005,138(12):236-245.
[14] Farid AS,Jimi F,Inagaki-Ohara K,et al. Increased intestinal endotoxin absorption during enteric nematode but not protozoal infections through a mast cell-mediated mechanism[J]. Shock,2008,29(6):709-716.
[15] Shen DZ. A target role for mast cell in the prevention and therapy of hepatic fibrosis[J]. Med Hypotheses,2008,70(4):760-764.
[16] Pereira IV,Stefano JT,Oliveira CP. Microsomal triglyceride Ansfer protein and nonalcoholic fatty liver disease[J]. Expert Rev Gastroenterol Hepato,2011,5(2):245-251
[17] Carulli L,Canedi I,Rondinella S,et al. Genetic polymorphisms in non-alcoholic fatty liver disease:interleukin-6-174G/C polymorphismis associated with non-alcoholic steatohepatitis[J]. Dig Liver Dis,2009,41(11):823-828.
[18] Chiasson JL,Rabasa-Lhoret R. Prevention of type 2 diabetes:insulin resistance and beta-cell function[J]. Diabetes,2004,53 (Suppl 3):S34-S38.
[19] Nathan DM,Buse JB,Davidson MB,et al. Management of hyperglycaemia in type 2 diabetes:a consensus algorithm for the initiation and adjustment of therapy. A consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes[J]. Diabetologia,2006,49:1711-1721.
[20] DeSouza C,Fonseca V. Therapeutic targets to reduce cardiovascular disease in type 2 diabetes[J]. Nat Rev Drug Discov,2009,8:361-367.
