盐水溶液中离子与丙氨酸极性基团间的作用对丙氨酸缔合的影响:密度泛函理论与分子动力学模拟
2015-12-29易海波李会吉曹治炜
王 莹 易海波 李会吉 代 倩 曹治炜 路 洋
(湖南大学化学化工学院,化学生物传感与计量学国家重点实验,长沙410082)
盐水溶液中离子与丙氨酸极性基团间的作用对丙氨酸缔合的影响:密度泛函理论与分子动力学模拟
王 莹 易海波*李会吉 代 倩 曹治炜 路 洋
(湖南大学化学化工学院,化学生物传感与计量学国家重点实验,长沙410082)
采用密度泛函理论和经典分子动力学模拟研究了盐水溶液中Na+、Cu2+、Zn2+、Cl-与丙氨酸分子间的相互作用对丙氨酸分子缔合的影响.密度泛函理论的计算结果显示丙氨酸分子与Na+、Cu2+、Zn2+、Cl-之间的相互作用可增强其电荷分离.经典分子动力学模拟结果显示在水溶液中两性离子形式的丙氨酸存在三种缔合结构.盐水溶液中,阳离子、阴离子与丙氨酸间的相互作用均能一定程度上减弱丙氨酸分子的缔合.但是阳离子与丙氨酸间的相互作用明显受离子水合作用的影响.由于Cu2+水合作用较强,虽在气相中Cu2+与丙氨酸分子之间相互作用明显比Na+强,但是在水溶液中则情况刚好相反.在ZnCl2稀溶液中,Zn2+与丙氨酸间的相互作用被其第一水合壳层隔开.但这种相互作用仍能明显影响丙氨酸分子的缔合,这与Zn2+的水合壳层特征有关.另外,离子与丙氨酸之间的相互作用,不仅会削弱丙氨酸的缔合,也可导致丙氨酸分子间的缔合结构发生转变.离子浓度也会影响其与丙氨酸分子间的缔合形式以及丙氨酸的缔合结构.
两性离子;阳离子;水合;缔合;分子间相互作用
1 引言
在所有已知的蛋白质中,几乎有一半包含金属辅助因子,其中生理学情况下键合到蛋白质上最常见的是Na+、K+、Mg2+、Ca2+、Zn2+、Cu2+、Fe3+、Co3+和Mn2+等离子.金属离子广泛参与生命过程,发挥各种重要的生物学功能.1-5目前临床上难治愈的疾病大多数也与氨基酸以及一些金属离子的异常结合有关,6-12但是一些药理作用的机制问题仍然没有解决.生命过程中氨基酸与金属离子间的作用通常发生在水环境中,需考虑水合作用的影响.因此,探讨水溶液中氨基酸与金属离子之间的相互作用对进一步研究多肽、蛋白质,进而解释生命现象具有重要的意义.另外,有研究也表明,氨基酸溶液中加入电解质后其溶解度明显改变,不同阳离子和阴离子对氨基酸的分离效果有较大影响.13
中性条件下,氨基酸主要有两性离子和中性分子两种结构形式,在气相和水溶液中氨基酸的结构存在明显差异.气相中,氨基酸主要以中性结构存在,附近电荷的存在可以稳定氨基酸的两性离子形式.14-17水溶液中,水分子优先稳定氨基酸的两性离子形式结构.18-20因此,水溶液中电荷分离的氨基酸分子缔合与水合易受到阳离子、阴离子的影响. Tomé21等以及Carta和Tola22的研究进一步表明,不同种类的阳离子和阴离子对氨基酸的影响也有所不同.盐水溶液中阳离子、阴离子与氨基酸之间的相互作用虽然得到了较广泛的研究,23-27但其作用机理仍没有给出较明确的解释.以往的工作主要侧重于研究盐水溶液中氨基酸溶解度的变化,但是很少有研究从离子水合、离子与氨基酸各极性基团之间相互作用的角度探讨溶液中阳离子、阴离子对氨基酸的缔合特征和溶解性的影响.气相中,二价阳离子,如Cu2+、Zn2+与氨基酸羧基间的相互作用很强,但水溶液中二价阳离子的水合能力也很强.28,29在水溶液中,这两种作用存在相互竞争,它们将如何影响氨基酸分子的缔合呢?目前,尚无这方面的具体研究.另外,Harris30和Pye31等的研究表明在ZnCl2稀溶液中,Zn2+与Cl-间可形成较稳定的溶剂共享离子对(SSIP)结构,说明Zn2+对处于其第二壳层的Cl-仍存在较明显的束缚作用.在水溶液中,Zn2+的这种水合以及其与Cl-相互缔合的特征是否也会影响氨基酸分子的缔合?因此,有必要在考虑离子水合与缔合特征的基础上讨论一些阳离子、阴离子对氨基酸分子间缔合作用的影响.
本文采用量子化学计算方法研究丙氨酸(Ala)与离子间的相互作用以及离子的水合作用,并采用经典分子动力学模拟研究不同浓度的NaCl、CuCl2和ZnCl2盐水溶液中丙氨酸分子的缔合与水合情况.基于水溶液中两性离子形式的丙氨酸较稳定,因而本文中所提丙氨酸分子均为两性离子形式结构.结合量子化学计算与经典分子动力学模拟结果,分别分析在稀、浓盐水溶液中阳离子、阴离子与丙氨酸各极性基团之间的相互作用对丙氨酸分子缔合的影响.
2 计算方法
采用密度泛函理论(DFT)研究丙氨酸与阳离子、阴离子间的相互作用和水合作用.考虑到丙氨酸两性离子的结构形式存在电荷分离,丙氨酸与缔合结构以及离子的水合结构的几何优化和能量的计算均采用长程校正的杂化交换相关泛函CAMB3LYP32与aug-cc-pVDZ(缩写为aVDZ)基组.所有优化的结构都在同一计算水平进行了振动频率计算与分析,以确保所得结构为能量极小点的结构.相互作用能与离子水合能的计算都进行了基组重叠误差校正.基组重叠误差校正和自然键轨道(NBO)电荷布居分析也都采用与结构优化相一致的方法和基组.所有DFT计算均采用Gaussian09软件包.33采用经典分子动力学模拟方法研究丙氨酸在盐水溶液中的缔合与水合行为,研究体系为加入NaCl、CuCl2和ZnCl2的三种丙氨酸盐水溶液.模拟的周期性立方体盒子中包含20个两性离子形式的丙氨酸分子,1600个水分子(丙氨酸的饱和溶解度为1600个水分子溶解~53个丙氨酸分子),稀、浓盐水溶液中无机盐的浓度分别为0.17和6.18mol·kg-1.稀盐水浓度对应的是生理盐水浓度.在稀溶液Zn2+与丙氨酸羧基之间无直接缔合,为了研究阳离子与羧基间直接缔合作用对丙氨酸分子缔合的影响,考虑了较高浓度的浓盐水溶液.所有经典分子动力学模拟计算均采用DL_POLY_4.03软件包34完成.模拟选择CHARMM力场,SPCE水分子模型,非键截断距离设定为1.20nm.采用Verletvelocity算法35对每一步的运动方程进行求解,积分步长设定为1fs.为确保溶液模拟的收敛,对一些样本体系的模拟结果进行了势能、温度与压力等参数波动变化的分析,并根据粒子扩散系数估算分子动力学模拟需要的平衡时间(相关体系需约0.5ns的平衡).所有模拟均先在等温等压(NPT)系综中进行2ns的模拟,模拟温度为298.15K,压力为105Pa.通过Nosé-Hoover方法36-38控制温度和压力.然后在正则系综(NVT)下进行6ns模拟,其中后4ns用于数据分析.温度同样也采用Nosé-Hoover方法控制.温度和压力控制的时间间隔分别为0.5和1ps.

图1 丙氨酸分子的两种缔合结构Fig.1 Two associated structuresof alanines B:bidentate,D:double

表1 丙氨酸结构的能量参数aTable1 Energy parametersof alanine structuresa
3 结果与讨论
3.1丙氨酸的结构参数
采用CAM-B3LYP/aVDZ方法进行几何结构优化,得到两种丙氨酸分子的缔合结构,进行频率分析确保所得到结构为能量局域极小点的结构.密度泛函理论(DFT)得到两种丙氨酸分子间的缔合结构:两个氨酸分子的氨基和羧基以单齿形式两两缔合(用D表示)、一分子丙氨酸的氨基与另一分子丙氨酸的羧基以双齿形式单缔合(用B表示)(图1).
由表1列出的结合能计算结果可知,Na+、Cu2+和Zn2+与丙氨酸羧基以双齿形式缔合的结构更稳定,这一结论与乔龙光等39的结论相一致.Cl-则是与氨基的氢原子形成离子氢键(iHB).在气相中,丙氨酸分子的氨基与Cl-之间缔合为单齿形式(Ala-Cl--M,M代表单齿),这可能是由于氮原子与Cl-之间排斥作用的缘故.表1中数据表明,丙氨酸与阳离子、阴离子间的相互作用均强于丙氨酸分子间的缔合作用,即气相中丙氨酸分子更倾向于与其周围的阳离子、阴离子发生相互作用,尤其是与二价金属离子Cu2+、Zn2+间的相互作用更为显著,这与Jensen和Gordon14的结论相一致.丙氨酸与Cl-间的作用相对弱一些,但是仍强于丙氨酸分子间的缔合作用.综上所述,离子或分子与丙氨酸相互作用的强弱顺序是:X2+>Na+>Cl-≈Ala(X2+=Zn2+,Cu2+),这一结论与El-Dossoki40的实验结果以及Bush等41计算的红外光谱结果相一致.
水溶性的氨基酸在中性水溶液中的结构多为两性离子形式,这意味着,氨基酸分子的电荷分离形式有利于氨基酸分子的水合作用与氨基酸的溶解.42NBO电荷布居分析结果显示,丙氨酸分子间的缔合使得其各基团上的电荷重新分布,氨基上的正电荷更多,羧基部位负电荷也相应增加,如表2所示.阳离子、阴离子与丙氨酸间的结合也均导致丙氨酸各基团的电荷发生相应变化.丙氨酸与Cu2+发生相互作用,使得其羧基上的负电荷量明显减少,而氨基与甲基、亚甲基上的正电荷量则均明显增加,金属离子所带的正电荷量也有所降低.亦即,二价金属阳离子与羧基之间存在电荷转移,尤其是Cu2+更为明显.这一作用影响到了氨基、甲基与亚甲基等基团上的电荷分布,将会增强这些基团的水合作用.与金属离子相比,Cl-对氨基的电荷分布影响较小,氨基上的正电荷量只有轻微的降低,而羧基上负电荷则明显增加,这对羧基与金属离子之间的相互作用起到一定的促进作用.

表2 丙氨酸和各结构中基团的电荷(e)aTable2 Charges(e)on somegroupsof alanine and some structuresa

图2 CAM-B3LYP/aVDZ方法计算得到的阳离子与阴离子的水合能(ΔEb)Fig.2 Hydration energies(ΔEb)of cationsand anion obtained at CAM-B3LYP/aVDZ level

图3 两个丙氨酸分子中两个α-C的径向分布函数图Fig.3 Radialdistribution functionsbetween twoα-C of two alaninemolecules
电荷布居分析结果显示阳离子、阴离子与丙氨酸之间的相互作用均增强了丙氨酸两性离子结构的电荷分离,这将促进丙氨酸各极性基团的水合作用.但是溶液中阳离子、阴离子与丙氨酸之间的相互作用情况,还需考虑离子水合作用的竞争,尤其是阳离子的水合作用.如图2所示,CAM-B3LYP/ aVDZ方法的计算结果显示,金属阳离子的水合作用较强,二价阳离子尤为显著.在稀溶液与浓溶液中,阳离子、阴离子水合作用的竞争对氨基酸的缔合与水合作用影响应有所不同,因此需进一步结合经典分子动力学方法研究盐水溶液中丙氨酸分子的缔合情况.
3.2水溶液中丙氨酸的缔合结构
由图3中α-C的径向分布函数(RDF)结果可知,在0.69mol·kg-1丙氨酸水溶液中丙氨酸分子间存在相互缔合的现象.RDF图在0.39-0.64nm范围内有两个峰,且峰的宽度较大.结合CAM-B3LYP/aVDZ方法的计算结果可知,在水溶液中,丙氨酸分子间缔合结构除了(Ala)2-B和(Ala)2-D两种形式以外,还存在一种单齿形式的单缔合结构(表示为:(Ala)2-M),如图4所示.在气相中,因没考虑水合作用,阳离子与羧基(―COO-)的两个氧原子之间可同时存在较强的相互作用,因而单齿缔合结构很不稳定.但是在盐水溶液中由于存在极性基团的水合作用以及其与离子之间的相互作用,使得丙氨酸分子间的缔合可以存在单齿形式,(Ala)2-M.由RDF中两个α-C之间的位置关系可知,溶液中丙氨酸分子间缔合结构以(Ala)2-D、(Ala)2-B形式为主,这与气相中CAM-B3LYP/aVDZ方法计算的丙氨酸缔合情况基本一致.在经典分子动力学模拟结果中,(Ala)2-B和(Ala)2-D结构的两个α-C之间的距离与CAMB3LYP/aVDZ方法的计算结果略有不同,这可能是水溶液中丙氨酸的水合作用导致这两种的缔合结构与气相中的缔合结构存在一定程度上的差异.
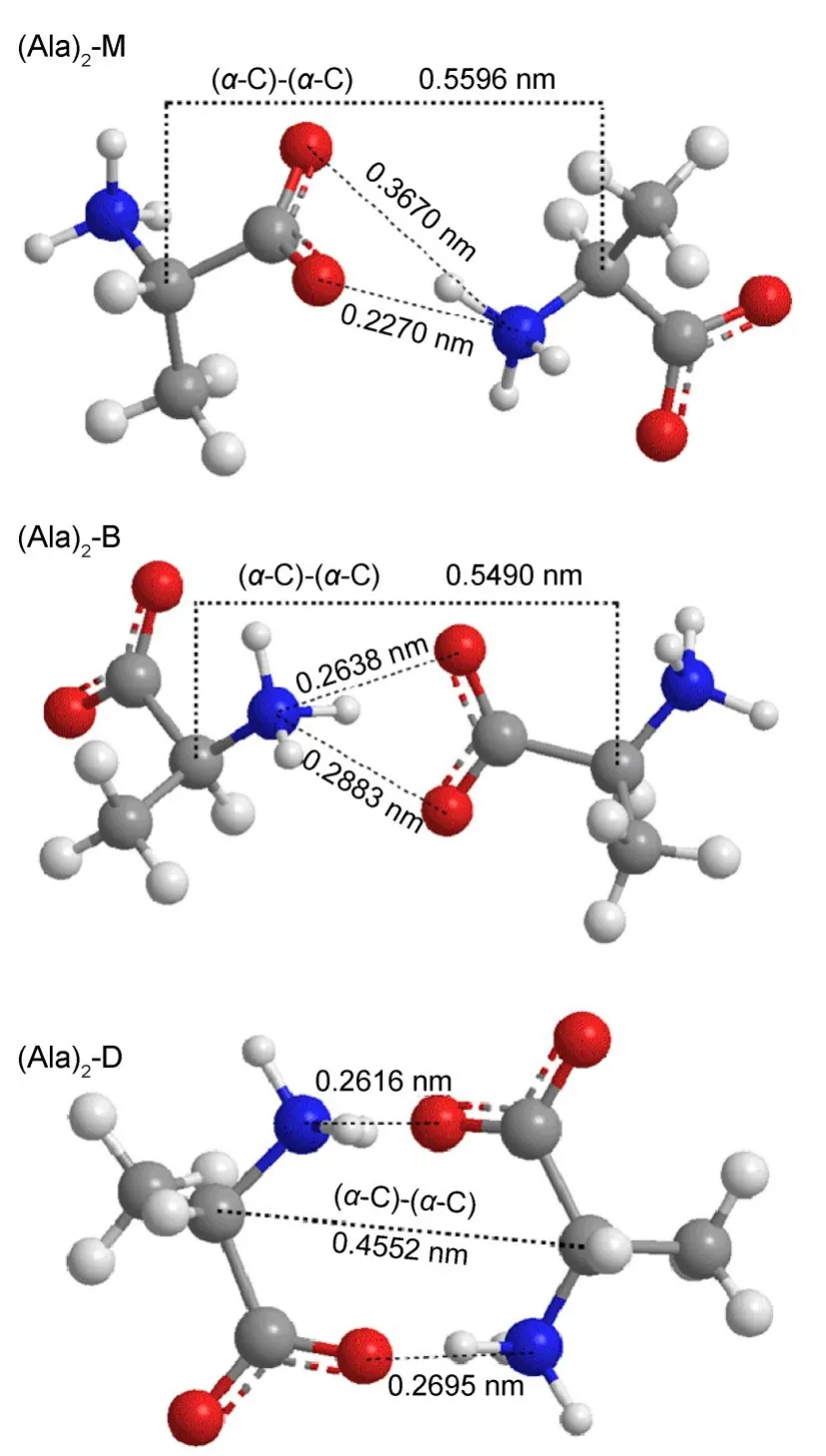
图4 由经典分子动力学模拟结果获得的在水溶液中丙氨酸分子的三种典型缔合结构Fig.4 Three typicalassociated structuresof alanine in aqueoussolution obtained from classicalmolecular dynam icssimulation results

表3 盐水溶液中丙氨酸α-C原子之间径向分布数据Table 3 Data of radialdistribution forα-C atom sof the alanine in saline solutiona
如图3所示,丙氨酸水溶液中加入少量NaCl、CuCl2或ZnCl2时,丙氨酸分子缔合程度均降低,但不同盐水溶液中,丙氨酸分子的缔合方式存在差异.结合图4可知,溶液中加入少量NaCl、ZnCl2时,丙氨酸分子间的缔合结构更倾向于(Ala)2-M形式.但少量CuCl2存在时,溶液中丙氨酸分子间的缔合结构变化并不明显,这可能是由于Cu2+与羧基间的相互作用较弱.与稀溶液中的情况不同,浓盐水溶液中丙氨酸分子间的缔合程度受到其周围阳离子、阴离子的影响更显著.三种浓盐水溶液中,丙氨酸分子间缔合结构的选择性较强.在NaCl或CuCl2浓盐水溶液中,丙氨酸分子的缔合结构倾向于(Ala)2-M构型,在ZnCl2浓盐水溶液时,丙氨酸分子的缔合结构则是以(Ala)2-B形式为主.表3中列出了与图3相对应的各体系丙氨酸α-C原子间的相互作用情况.
在稀盐水溶液中,离子水合与丙氨酸水合之间的竞争对丙氨酸分子间缔合的影响不大,但在浓盐水溶液中则是不可忽略的因素.不同金属阳离子对丙氨酸分子缔合作用的影响程度各不同,这可能与阳离子的水合以及离子的缔合强弱有关.以下部分,将具体分析阳离子、阴离子水合作用以及其与丙氨酸极性基团间的相互作用对丙氨酸分子缔合的影响.
3.3 丙氨酸与阳离子间的相互作用
3.3.1 羧基与金属阳离子([COO--Xn+])的相互作用
CAM-B3LYP/aVDZ计算结果显示,气相中丙氨酸分子与金属离子均是以双齿形式相互作用.但在盐水溶液中,由于阳离子的水合作用以及不同阳离子的水合作用存在差异,导致其与丙氨酸分子间的相互作用结构有所不同.由图5显示,在稀盐水溶液中,Na+、Cu2+与羧基氧原子发生直接相互作用,而Zn2+与羧基氧原子之间并不存在直接相互作用.羧基氧原子与Zn2+在0.4275nm处存在较明显的峰.经典分子动力学路径文件的团簇分析结果显示,溶液中存在羧基与Zn2+间的溶剂共享离子对结构(见图6),这意味着Zn2+与处于其第二壳层的丙氨酸羧基之间仍然存在较明显相互作用.Mohammed43和Bock44等在其量子力学/分子力学(QM/MM)的分子动力学模拟研究中也提到,Zn2+的第一水壳层比Cu2+紧凑,且在其20ps的模拟时间内,Zn2+的第一、二水壳层之间不存在水分子交换,其第二水壳层中氢键较规则,这都间接地证明了Zn2+对其第二水壳层的束缚仍较明显.在稀ZnCl2水溶液中,Zn2+与处于其第二壳层的丙氨酸羧基之间的这种间接相互作用仍导致丙氨酸分子缔合程度的降低(见图3).但是在浓ZnCl2水溶液中,丙氨酸分子则是直接与Zn2+发生相互作用,如图5所示,这可能是水溶液中丙氨酸与阳离子的水合竞争使Zn2+水合不完全导致的.团簇分析结果显示,与丙氨酸水溶液相比,在稀ZnCl2盐水溶液中,丙氨酸分子缔合结构的数目有所减少,游离丙氨酸分子数目则明显增多,如图7所示.
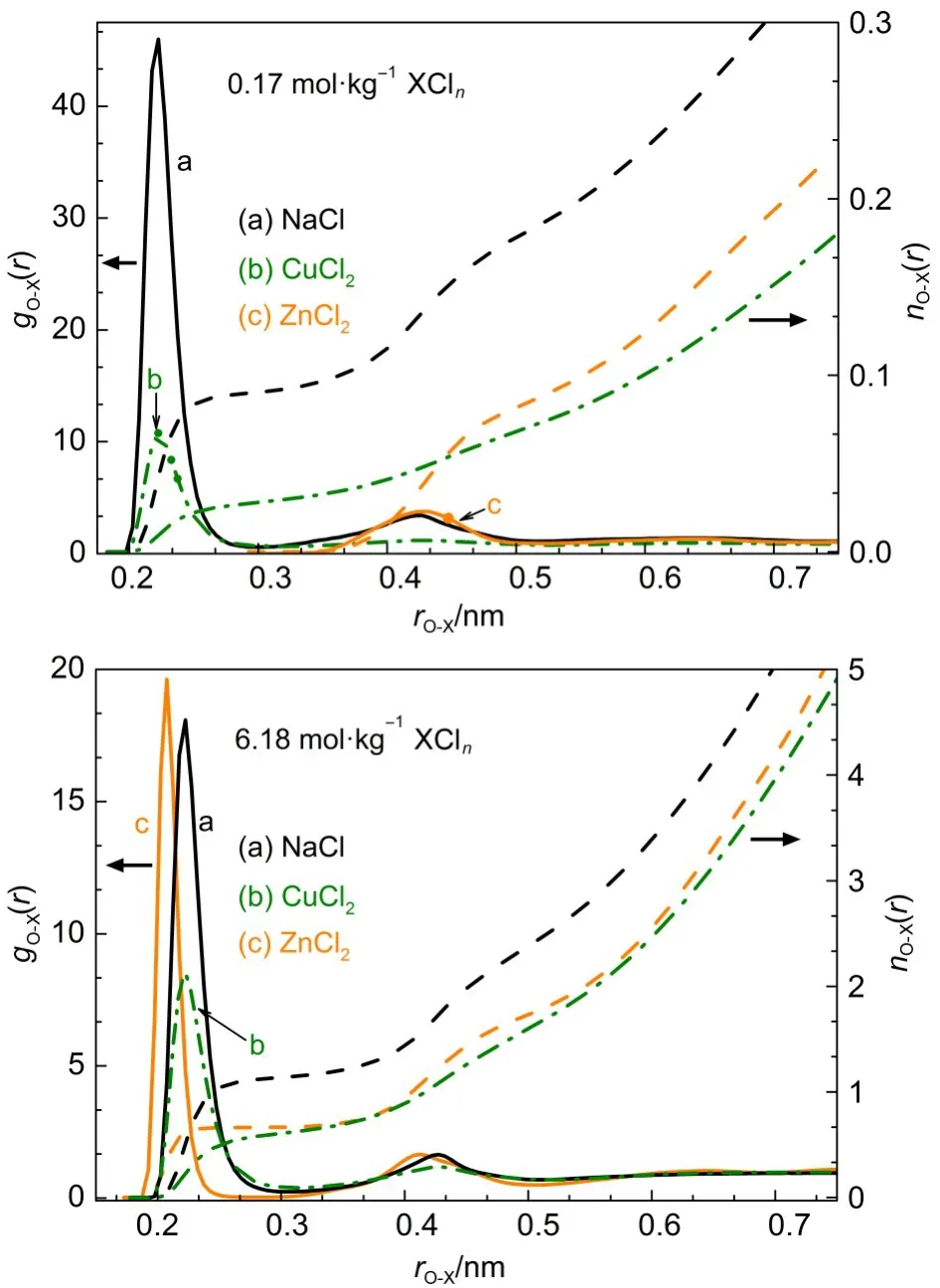
图5 丙氨酸羧基氧原子与金属离子相互作用的径向分布图Fig.5 Radialdistribution curves for interaction between oxygen atomsof alanine carboxylandmetal ions
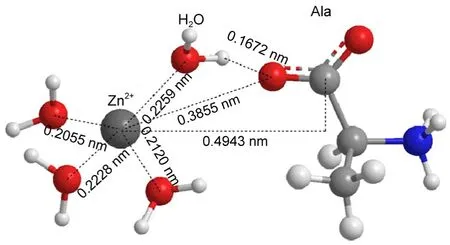
图6 ZnCl2稀溶液中丙氨酸与Zn2+的相互作用结构(溶剂共享缔合形式)Fig.6 Interaction structure(solventshared associated form)between alanine and Zn2+in ZnCl2dilute solution
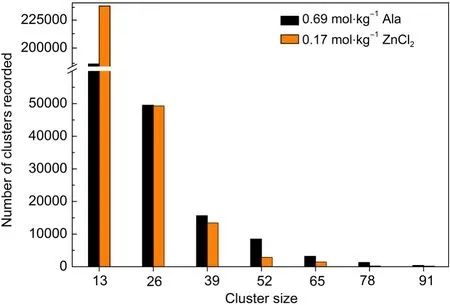
图7 丙氨酸纯水溶液与丙氨酸-ZnCl2稀溶液中各团簇的数目Fig.7 Number of different typesof clusters in alanine purewater solution and its ZnCl2dilute solution
由图8可知,稀盐水溶液中,羧基碳原子与金属离子间的[C(COO-)-Na+]径向分布函数在0.2575和0.3275nm处出现两个峰,说明Na+与羧基存在单齿、双齿两种相互作用形式.由于第一峰更明显,可知双齿作用形式更稳定,两种结构如图9所示.Cu2+与羧基α-C原子间的径向分布函数在0.2575nm处的峰较明显,而与单齿结构相对应的峰则不明显,由此可知主要以双齿结构为主.浓盐水溶液中,三种金属离子与羧基氧原子之间的相互作用形式则基本趋于一致,两种相互作用结构都存在,但均以双齿结构为主.值得一提的是在丙氨酸的ZnCl2浓溶液中,Zn2+与羧基碳原子相互作用的两个径向分布峰较窄且区分较明显,说明两者之间形成的单、双齿结构存在明显区别.Zn2+与羧基碳原子的径向分布图相互作用在0.4500nm处还存在一个较明显的峰,对应的结构为羧基与Zn2+间的溶剂共享缔合结构(见图6).如图8所示,在稀ZnCl2与浓ZnCl2溶液中丙氨酸羧基与Zn2+间均存在这种溶剂共享缔合结构.
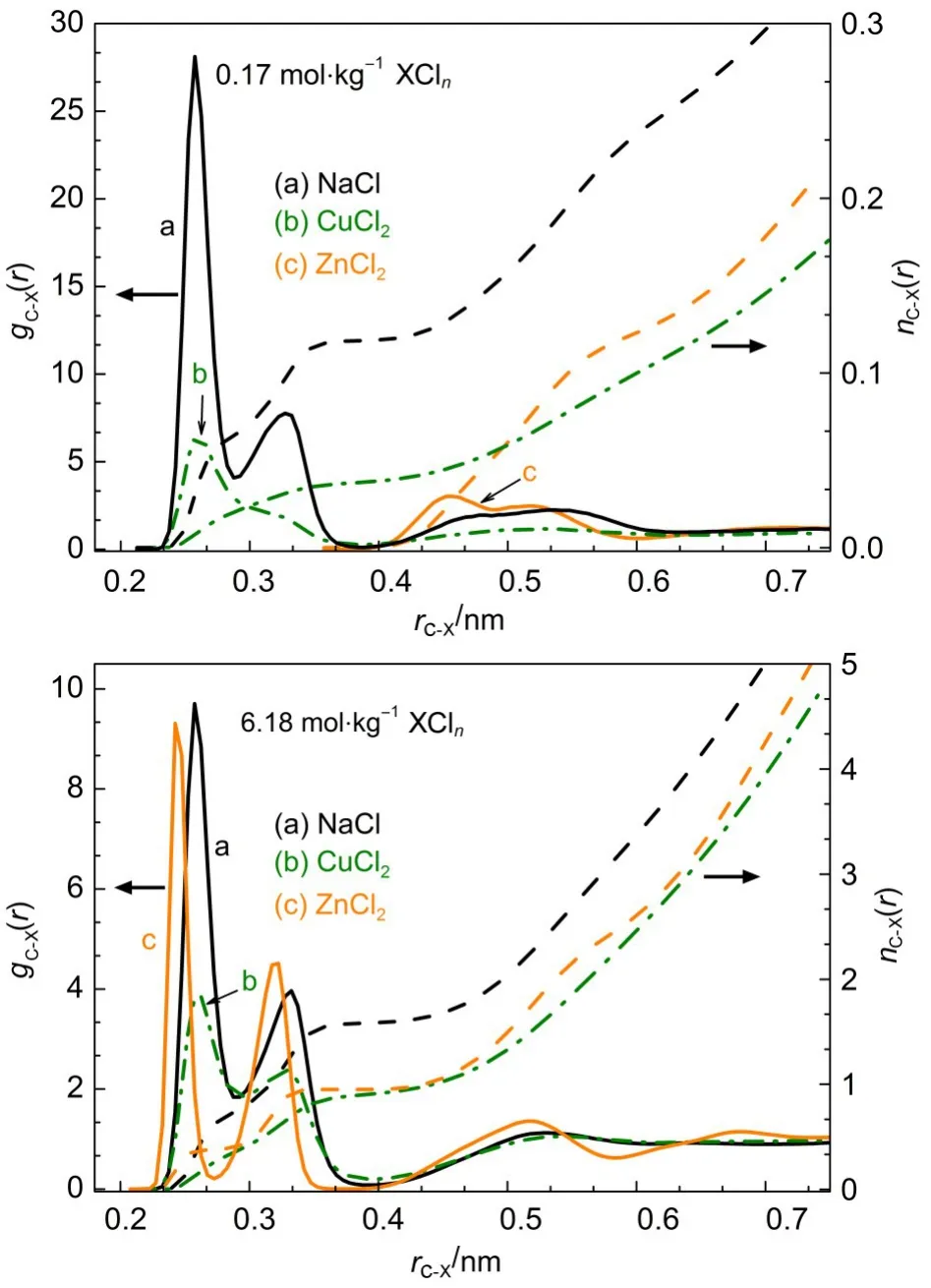
图8 羧基碳原子与金属离子间相互作用的径向分布图Fig.8 Radialdistribution curves for interaction between the carbon atom of carboxyland metal ions
图9 丙氨酸与Na+的两种缔合结构(单,双齿结构)
Fig.9 Two associated structuresof alanine and Na+(monodentateand bidentate)
3.3.2 金属离子水合作用的影响
由图10可知,Na+、Cu2+和Zn2+三种金属离子水合性质存在一定差异.Zn2+的第一、二水壳层径向分布峰间隔清晰,存在较明显的第二壳层,说明Zn2+对第二壳层水分子的束缚作用仍较强,这也与Mohammed43和Bock44等的结论相一致.Mohammed等43以及Schwenk与Rode45的研究结果显示,Zn2+对第一水壳层束缚比Cu2+强.与Zn2+相同,Na+的水合壳层包含6个水分子,但其水合作用较Zn2+弱.44由于Jahn-Teller效应,Cu2+的水合壳层可能包含5个或6个水分子.46另外,Zn2+与羧基氧原子的径向分布峰位于0.4275nm处(见图5),而Zn2+与水分子中氧原子的径向分布峰也是在同一位置处出现较强的峰(见图10).这也进一步说明,当丙氨酸出现在Zn2+的第二壳层时,Zn2+与羧基之间仍存在较强的相互作用.与二价离子相比,Na+水合作用较弱,因而在稀溶液和浓溶液中Na+与羧基间的相互作用均较强.Na+与羧基之间这种较强的相互作用,一方面降低丙氨酸分子间缔合结构的缔合程度,另一方面也可使得丙氨酸分子间缔合结构倾向于缔合程度较低(Ala)2-M结构.
在水溶液中,离子水合和丙氨酸水合之间是相互竞争关系,金属阳离子与丙氨酸间的相互作用会受到金属阳离子水合或其他缔合作用的制约.稀盐水溶液中离子的水合与丙氨酸分子水合的竞争对丙氨酸分子缔合的影响较小,因而影响丙氨酸分子缔合的主要因素为阳离子、阴离子与丙氨酸极性基团间的相互作用.溶液中Cu2+的水合能远高于Na+(见图2),这不利于Cu2+与丙氨酸分子间的相互作用,因而稀溶液中Cu2+对丙氨酸分子间相互作用的影响比Na+小.另外,Xia等46和Marcus47的研究结果也表明Cu2+与Cl-间存在较强的缔合作用,这也会阻碍Cu2+与丙氨酸的相互作用.与加入CuCl2相比,丙氨酸水溶液中加入NaCl后,Na+与羧基间的相互作用较明显,丙氨酸分子缔合作用也降低更显著,如图5和图8中RDF图所示.

图10 盐水溶液中金属离子水合作用的径向分布图Fig.10 Radialdistribution curves for interaction between m etal ionsand waterm olecule in saline solution OW:oxygen atom inwatermolecules

图11 氨基氮原子与Cl-相互作用的径向分布图Fig.11 Radialdistribution curves for interaction between nitrogen atom of am ino group and Cl-
浓盐水溶液中必须考虑金属离子水合作用对丙氨酸分子间缔合以及丙氨酸与离子相互作用的影响.一方面,大量阳离子、阴离子的水合作用与丙氨酸极性基团的水合作用之间存在明显的竞争,这将有利于丙氨酸分子的缔合;另一方面,当阳离子与阴离子的浓度较高时,其与丙氨酸极性基团之间的相互作用也随之增强,这又不利于丙氨酸分子的缔合,两方面作用相结合共同影响水溶液中丙氨酸分子缔合.在浓盐水溶液中,因为Cu2+水合受限而水合不完全,导致Cu2+与羧基间的相互作用对丙氨酸分子缔合程度的影响不再弱于Na+.因而与NaCl浓溶液相比,CuCl2浓溶液中丙氨酸分子缔合减弱程度更高,有别于稀盐溶液中的情形.同样地,在ZnCl2浓溶液中,Zn2+的水合作用也受限,Zn2+可与羧基直接相互作用(见图8和图10),这也就导致ZnCl2浓溶液中丙氨酸分子的缔合程度大为降低,如图3所示.
3.4 氨基与阴离子(Cl-)的相互作用
水溶液中Cl的水合作用较弱,21,46因此Cl-与氨基的相互作用不可忽略.图11中的氨基氮原子与Cl-间的径向分布函数,在0.3125nm处存在明显的峰,可知Cl-与氨基之间存在明显的相互作用.图3和表3的数据表明,与NaCl稀溶液相比,ZnCl2稀溶液中丙氨酸分子的缔合程度减弱更为明显.但是稀溶液中Na+与羧基之间存在直接相互作用,而Zn2+与羧基之间只存在间接相互作用(见图5与图6).这可能是因为ZnCl2溶液中Cl-的浓度是NaCl溶液的两倍,且Cl-与氨基间的相互作用对丙氨酸分子的缔合也起到了一定的阻碍作用.Cl-与氨基的相互作用影响丙氨酸分子缔合的观点与Tomé等48得出的相关结论存在一定分歧,但是其研究侧重于讨论Cl-与链端疏水甲基的相互作用,而没有分析Cl-与氨基的相互作用.丙氨酸分子的疏水链较短,链端甲基距离两个极性基团较近,因而影响丙氨酸分子缔合程度的主要因素为具有较强亲水性的羧基或氨基与离子间的作用.另外,与NaCl稀溶液相比,CuCl2稀溶液中Cl-浓度是NaCl稀溶液中的两倍,但是在CuCl2溶液中丙氨酸分子间的缔合程度减弱仍较小.由此可推知,相对于金属阳离子与羧基的相互作用而言,Cl-与氨基间的相互作用对丙氨酸分子缔合的影响较小.
4 结论
结合DFT方法与经典分子动力学模拟,研究了水溶液中丙氨酸分子间的缔合以及一些阳离子、阴离子的存在对其缔合作用的影响.NBO电荷布居分析结果显示阳离子、阴离子与丙氨酸之间的相互作用均增强了丙氨酸两性离子结构的电荷分离,非极性基团上的电荷也发生相应的变化,这将增强丙氨酸分子的水合作用.DFT与经典分子动力学的研究结果表明,丙氨酸在水溶液中存在单齿、双齿形式的缔合结构.盐水溶液中的阳离子、阴离子均会影响丙氨酸分子的缔合程度与缔合结构形式.稀盐水溶液中,影响丙氨酸分子缔合的主要因素是阳离子、阴离子与丙氨酸极性基团之间相互作用.在丙氨酸溶液中离子浓度较低时,Cu2+与Na+与羧基均存在直接相互作用.但是Cu2+水合作用强而导致其与羧基的相互作用弱,因而与比Na+相比,Cu2+对丙氨酸分子相互作用程度影响较小.在稀ZnCl2水溶液中,Zn2+与羧基并无直接相互作用,但是Zn2+与处于其第二壳层的丙氨酸羧基之间仍有较强的相互作用,这一种间接相互作用仍能阻碍丙氨酸分子间的缔合.另外,Cl-与氨基的相互作用对丙氨酸分子间缔合的影响相对较小但也不可忽略.在浓盐水溶液中,大量阳离子的水合与丙氨酸极性基团的水合之间存在明显竞争,这将有利于丙氨酸分子的缔合.但是大量阳离子、阴离子与丙氨酸极性基团相互作用,又将阻碍丙氨酸分子间的缔合.因此,尽管在浓盐水溶液中离子水合与丙氨酸水合之间的竞争不可忽略,但阳离子、阴离子与丙氨酸极性基团之间的相互作用对丙氨酸分子缔合的影响可能仍起主导作用.
(1)Heaton,A.L.;Bowman,V.N.;Oomens,J.;Steill,J.D.; Armentrout,P.B.J.Phys.Chem.A 2009,113(19),5519.doi: 10.1021/jp9008064
(2)Armentrout,P.B.;Armentrout,E.I.;Clark,A.A.;Cooper,T.E.; Stennett,E.M.S.;Carl,D.R.J.Phys.Chem.B 2010,114(11), 3927.doi:10.1021/jp911219u
(3)Dunbar,R.C.;Steill,J.D.;Polfer,N.C.;Oomens,J.J.Phys. Chem.B 2009,113(31),10552.doi:10.1021/jp905060n
(4)O'Brien,J.T.;Prell,J.S.;Steill,J.D.;Oomens,J.;Williams,E. R.J.Phys.Chem.A 2008,112(43),10823.doi:10.1021/ jp805787e
(5)Prell,J.S.;Demireva,M.;Oomens,J.;Williams,E.R.J.Am. Chem.Soc.2009,131(3),1232.doi:10.1021/ja808177z
(6)Frossard,E.;Bucher,M.;Mächler,F.;Mozafar,A.;Hurrell,R. J.Sci.Food Agric.2000,80,861.
(7)Wang,C.Y.;Guo,J.S.;Tian,J.;Cui,W.L.J.Jilin Medical College 2009,30(2),99. [王春艳,郭景森,田 晶,崔万丽.吉林医药学院学报,2009,30(2),99.]
(8)Wingenfeld,K.;Hellhammer,D.H.;Schmidt,I.;Wagner,D.; Meinlschm idt,G.;Heim,C.J.Psychosom.Obstet.Gynaecol. 2009,30(4),282.doi:10.3109/01674820903254732
(9)Komoroski,R.A.;Pearce,J.M.Magn.Reson.Med.2008,60, 21.doi:10.1002/m rm.v60:1
(10)Dong,X.Y.;Du,W.J.;Liu,F.F.Acta Phys.-Chim.Sin.2012, 28(11),2735. [董晓燕,都文婕,刘夫锋.物理化学学报, 2012,28(11),2735.]doi:10.3866/PKU.WHXB201207162
(11)Zhao,Y.P.;Ai,H.Q.;Chen,J.P.;Yang,A.B.;Qi,Z.N.Acta Phys.-Chim.Sin.2010,26(12),3322.[赵永平,艾洪奇,陈金鹏,杨爱彬,齐中囡.物理化学学报,2010,26(12),3322.]doi: 10.3866/PKU.WHXB20101215
(12)Zhu,Y.C.;Wang,E.Q.;Ma,G.L.;Kang,Y.B.;Zhao,L.H.; Liu,Y.Z.Acta Phys.-Chim.Sin.2014,30(1),1.[朱云城,王二琼,马国林,康彦彪,赵林泓,刘扬中.物理化学学报,2014, 30(1),1.]doi:10.3866/PKU.WHXB201311263
(13)Eyal,A.M.;Bressler,E.Biotechnol.Bioeng.1993,41(3),287.
(14)Jensen,J.H.;Gordon,M.S.J.Am.Chem.Soc.1995,117(31), 8159.doi:10.1021/ja00136a013
(15)Hu,C.H.;Shen,M.Z.;Schaefer,H.F.,III.J.Am.Chem.Soc. 1993,115(7),2923.doi:10.1021/ja00060a046
(16)Qin,P.H.;Lü,W.C.;Qin,W.;Zhang,W.;Xie,H.Chem.Res. Chin.Univ.2014,30(1),125.doi:10.1007/s40242-014-3303-z
(17)Gordon,M.S.;Jensen,J.H.AccountsChem.Res.1996,29(11), 536.doi:10.1021/ar9600594
(18)Qiu,X.M.;Lei,Q.F.;Fang,W.J.;Lin,R.S.Acta Chim.Sin. 2009,67(7),607.[邱晓梅,雷群芳,方文军,林瑞森.化学学报,2009,67(7),607.]
(19)Wyttenbach,T.;Bushnell,J.E.;Bowers,M.T.J.Am.Chem. Soc.1998,120(20),5098.doi:10.1021/ja9801238
(20)Kushwaha,P.S.;M ishra,P.C.J.Mol.Struct.-Theochem 2001, 549,229.doi:10.1016/S0166-1280(01)00423-7
(21)Tomé,L.I.N.;Pinho,S.P.;Jorge,M.;Gomes,J.R.B.; Coutinho,J.A.P.J.Phys.Chem.B 2013,117,6116.
(22)Carta,R.;Tola,G.J.Chem.Eng.Data 1996,41(3),414.doi: 10.1021/je9501853
(23)Marino,T.;Russo,N.;Toscano,M.J.Inorg.Biochem.2000,79, 179.doi:10.1016/S0162-0134(99)00242-1
(24)Pulkkinen,S.;Noguera,M.;Rodríguez-Santiago,L.;Sodupe, M.;Bertran,J.Chem.-Eur.J.2000,6(23),4393.doi:10.1002/ 1521-3765(20001201)6:23<4393::AID-CHEM 4393>3.0.CO;2-H
(25)Apse,M.P.;Aharon,G.S.;Snedden,W.A.;Blumwald,E.Science 1999,285,1256.doi:10.1126/science.285.5431.1256
(26)Xu,J.H.;Hu,C.W.Acta Chim.Sin.2006,64(16),1622.[徐建华,胡常伟.化学学报,2006,64(16),1622.]
(27)Khoshkbarchi,M.K.;Vera,J.H.Ind.Eng.Chem.Res.1997,36 (6),2445.doi:10.1021/ie9606395
(28)Xia,F.F.;Yi,H.B.;Zeng,D.W.J.Phys.Chem.A 2009,113 (51),14029.doi:10.1021/jp909092p
(29)Bryantsev,V.S.;Diallo,M.S.;Goddard,W.A.,III.J.Phys. Chem.B 2008,112(32),9709.doi:10.1021/jp802665d
(30)Harris,D.J.;Brodholt,J.P.;Harding,J.H.;Sherman,D.M. Mol.Phys.2001,99(10),825.doi:10.1080/ 00268970010015588
(31)Pye,C.C.;Corbeil,C.R.;Rudolph,W.W.Phys.Chem.Chem. Phys.2006,8,5428.doi:10.1039/b610084h
(32)Yanai,T.;Tew,D.P.;Handy,N.C.Chem.Phys.Lett.2004,393, 51.doi:10.1016/j.cplett.2004.06.011
(33)Frisch,M.J.;Trucks,H.B.;Schlegel,G.E.;etal.Gaussian 09, Revision A.1;Gaussian Inc.:Wallingford,CT,2009.
(34)Todorov,I.T.;Smith,W.;Trachenko,K.;Dove,M.T.J.Mater. Chem.2006,16,1911.doi:10.1039/b517931a
(35)Adcock,S.A.;M cCammon,J.A.Chem.Rev.2006,106(5), 1589.doi:10.1021/cr040426m
(36)Nosé,S.Mol.Phys.1984,52,255.doi:10.1080/ 00268978400101201
(37)Hoover,W.G.Phys.Rev.A 1985,31,1695.doi:10.1103/ PhysRevA.31.1695
(38)Martyna,G.J.;K lein,M.L.;Tuckerman,M.E.J.Chem.Phys. 1992,97(4),2635.doi:10.1063/1.463940
(39)Qiao,L.G.;Fan,J.F.;Yang,C.H.Acta Chim.Sin.2007,65 (17),1751.[乔龙光,樊建芬,杨春红.化学学报,2007,65 (17),1751.]
(40)El-Dossoki,F.I.J.Solution Chem.2010,39,1311.doi:10.1007/ s10953-010-9580-3
(41)Bush,M.F.;Oomens,J.;Saykally,R.J.;W illiams,E.R.J.Am. Chem.Soc.2008,130(20),6463.doi:10.1021/ja711343q
(42)Meng,X.J.Acta Phys.-Chim.Sin.2006,22(1),98.[孟祥军.物理化学学报,2006,22(1),98.]doi:10.3866/PKU. WHXB20060120
(43)Mohammed,A.M.;Loeffler,H.H.;Inada,Y.;Tanada,K.; Funahashi,S.J.Mol.Liq.2005,119,55.doi:10.1016/j. molliq.2004.10.008
(44)Bock,C.W.;Markham,G.D.;Katz,A.K.;Glusker,J.P.Theor. Chem.Acc.2006,115,100.doi:10.1007/s00214-005-0056-2
(45)Schwenk,C.F.;Rode,B.M.J.Chem.Phys.2003,119, 9523.doi:10.1063/1.1614224
(46)Xia,F.F.;Yi,H.B.;Zeng,D.W.J.Phys.Chem.A 2010,114 (32),8406.doi:10.1021/jp1000804
(47)Marcus,Y.J.Chem.Soc.Faraday Trans.1991,87(18), 2995.doi:10.1039/ft9918702995
(48)Tomé,L.I.N.;Jorge,M.;Gomes,J.R.B.;Coutinho,J.A.P. J.Phys.Chem.B 2010,114(49),16450.doi:10.1021/jp104626w
Effec ts o f In terac tions betw een Ions and A lanine Po lar Groups on A lanine Associations in Saline So lu tion:Density Func tional Theo ry and Mo lecu lar Dynam ics Sim u lation
WANG Ying YIHai-Bo*LIHui-Ji DAIQian CAO Zhi-Wei LU Yang
(State Key Laboratory ofChemo/Biosensing and Chemometrics,College ofChemistry and Chemical Engineering, Hunan University,Changsha 410082,P.R.China)
Density functional theory(DFT)and classicalmolecular dynam ics simulationswere used to study the effects of the interactions between zw itterionic alanine and some ions(Na+,Cu2+,Zn2+,and Cl-)in saline solution on the association of alanine m olecules.The DFT calculation results show that the association of alanine w ith these ions can enhance charge separation ofzw itterionic alanine.Classicalmolecular dynam ics simulation results also show that three associated structures ofzw itterionic alaninemolecules are present in alanine aqueous solution,and the associations can be weakened to a certain extentby the interactions between the cations/anions and alanine polargroups.The interaction between a cation and the carboxylgroup ofalanine can be greatly affected by hydration of the cation in dilute saline solution.The interaction between Cu2+and alanine ismuch stronger than thatbetween Na+and alanine in the gas phase,but the situation is reversed in dilute aqueous solution,because the hydration ofCu2+ismuch stronger than thatofNa+.In dilute ZnCl2aqueous solution,the interaction between Zn2+and the carboxylgroup of the alaninemolecule is less direct,because of the first hydration shell of Zn2+.However,indirect interactions between Zn2+and alanine still lead to adecreased association among alaninemolecules.In addition,the interactions of cations/anions w ith alanine notonly weaken the association between alanine molecules,butalso result in transformation between two typical conformations of associated alanine m olecules.The ion concentration affects the conformations of associated cation/anion-alanine species,and associated alaninem olecules.
Zw itterion;Cation;Hydration;Association;Intermolecular interaction
O641
icle]
10.3866/PKU.WHXB201504031www.whxb.pku.edu.cn
Received:January 22,2015;Revised:April2,2015;Published onWeb:April3,2015.
∗Corresponding author.Email:hbyi@hnu.edu.cn;Tel:+86-13574869952.
The projectwas supported by the National Natural Science Foundation of China(21073056,J1210040)and Students Innovation Training Project in Hunan Province,China(2012).
国家自然科学基金(21073056,J1210040)与湖南省“大学生创新训练计划”项目(2012)资助
©Editorialofficeof Acta Physico-Chim ica Sinica