一元强碱滴定一元弱酸溶液的林邦滴定曲线方程及其应用
2015-12-28乔成立
乔成立
(齐齐哈尔大学应用技术学院 黑龙江齐齐哈尔 161006)
一元强碱滴定一元弱酸溶液的林邦滴定曲线方程及其应用
乔成立
(齐齐哈尔大学应用技术学院黑龙江齐齐哈尔 161006)
摘要以林邦副反应思想为基础,用质子条件式PBE、物料平衡式MBE、滴定分数和条件稳定常数等知识推导出一元强碱滴定一元弱酸溶液的林邦滴定曲线方程,并用滴定曲线方程讨论了滴定开始至化学计量点时任意一点pH的计算。
关键词林邦方程副反应系数条件稳定常数
The Ringbom Equation for Titration of Monoprotic Acids
and Its Application
Qiao Chengli
(SchoolofAppliedTechnology,QiqiharUniversity,Qiqihar161006,Heilongjiang,China)
AbstractThe Ringbom equation for titration of monoprotic acids was derived based on proton condition equation, mass balance equation, titrated fraction as well as the conditional stability constant. The developed Ringbom equation was applied to calculation of pH at any titrated fraction before reaching the stoichiometry point.
Key WordsRingbom equation; Side-reaction coefficient; Conditional stability constant
一元强碱滴定一元弱酸溶液的林邦滴定曲线方程是描述被滴定体系H+浓度变化的曲线[1-7],所以用一元强碱滴定一元弱酸溶液的林邦滴定曲线方程求酸碱滴定过程中的pHa是“顺理成章”的。然而,文献[1-3]仍然用体积计算法计算化学计量点时的pHsp。有的虽然给出了一元强碱滴定一元弱酸溶液的林邦滴定曲线方程,却没有用其求滴定过程中的任意一点的pHa,这是不理想的。
为此,本文建立了一元强碱滴定一元弱酸溶液的林邦滴定曲线方程,并用其讨论了任意一点pHa的计算。
1副反应系数及条件稳定常数
1.1 H+的副反应系数
假设用浓度为c0(NaOH)的NaOH标准溶液滴定体积为V(HA)的同浓度一元弱酸HA溶液,终点时滴入NaOH标准溶液体积为V(NaOH)。
当H+和OH-进行反应时,HA分解为A-和H+,其中H+和A-的反应可以看做是主反应(OH-+H+=H2O)之外H+发生的副反应[4-7]:

(Ⅰ)
如果用αH(HA)表示H+副反应系数的精确式,即用αH(HA)表示未与OH-结合的H+的总浓度[H′]是[H+]的倍数,即:

(1)
因为[H′]=[H+]+[HA],所以有:

(2)


(3)


(4)
如果忽略式(3)中的1,且用αH01(HA)表示滴定开始至化学计量点时H+副反应系数的近似式,则有:

即滴定开始至化学计量点时H+副反应系数的近似式为:

(5)


(6)
1.2 条件平衡常数
当H+和OH-没有发生副反应时,滴定反应OH-+H+=H2O的稳定常数为:
当H+和A-发生副反应时,滴定反应如反应式(Ⅰ)所示,且主反应条件稳定常数为:

(7)
将αH(HA)、αH01(HA)、αH1(HA)分别代入式(7),得主反应条件稳定常数的精确式为:

(8)
滴定开始至化学计量点时,主反应条件稳定常数的近似式为:

(9)
化学计量点时,主反应条件稳定常数的近似式为:

(10)
当csp(HA)≫Ka,化学计量点时,主反应条件稳定常数的最简式为:

(11)
2林邦滴定曲线方程
化学计量点时,体系是NaOH和A-的混合体,所以体系的PBE为:
[Na+]+[H+]=[OH-]+[A-]
设滴定分数为:

(12)
将c0(NaOH)V(NaOH)=c(NaOH)(V(NaOH)+V(HA))和c0(HA)V(NaOH)=c(HA)(V(NaOH)+V(HA))代入式(12),整理得:



因为[Na+]=c(NaOH)=ac(HA),所以PBE变为ac(HA)+[H+]=[OH-]+[A-]。
在滴定过程中同时存在以下计量关系:
c(HA)=[A-]+[HA];[H′]=[H+]+[HA];ac(HA)+[H+]=[OH-]+[A-]


(13)

3林邦滴定曲线方程的应用sp的计算
3.1 化学计量点时pH
在化学计量点时,a=1,式(13)变为,整理并将其两边取负对数,得:
(14)

(15)
当csp(HA)≫Ka时,在化学计量点计算pHsp的最简式为:

(16)


(17)
3.2 化学计量点前任意一点pHa的计算
当系统中只有HA分解为H+和A-的反应是主反应中H+发生的副反应时,一元强碱滴定一元弱酸溶液的林邦滴定曲线方程为:
(13′)
解得:

(18)
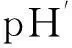
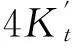


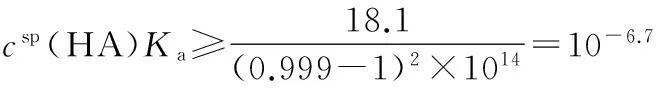
csp(HA)Ka≥10-6.7
(19)


(20)



(21)


(22)
3.3 化学计量点后任意一点pHa的计算
在化学计量点后,一元弱酸HA已经反应完,溶液的碱性是由过量的NaOH决定的,故可先计算pOHa,再用pHa+pOHa=14计算pHa。
在化学计量点后,[OH-]=c(HA)(a-1),即pHa=14-pOHa=14+lg(c(HA)(a-1))。
即化学计量点后任意一点pHa的计算式为:
pHa≈14+lg(c(HA)(a-1))
(23)
4结论
本文用林邦滴定曲线方程推导出一元强碱滴定一元弱酸溶液任意一点pHa的计算公式,为利用林邦滴定曲线方程解决一元强碱滴定一元弱酸溶液的理论问题,做了一点尝试。
参考文献
[1]武汉大学.分析化学.第5版.北京:高等教育出版社,2005
[2]彭崇慧,冯建章,张锡瑜,等.定量分析化学简明教程.第2版.北京:北京大学出版社,1997
[3]华中师范大学,东北师范大学,陕西师范大学,等.分析化学.第3版.北京:高等教育出版社,2002
[4]孟凡昌,蒋勉.分析化学中的离子平衡.北京:科学出版社,1999
[5]王园朝,包海峰.大学化学,2013,28(3):82
[6]岳宣峰,张延妮,漆红兰,等.大学化学,2010,25(5):47
[7]乔成立,丁言伟.高师理科学刊,2003,23(4):46
中图分类号O6;G64
doi:10.3866/pku.DXHX20150264
