左旋肉碱在人角膜缘上皮细胞的转运特性
2015-12-28李宝全毕建成安翠平李延峰许顺江
李宝全,毕建成,安翠平,李延峰,许顺江
(1.河北省石家庄市第一医院检验科,河北石家庄050011;2.河北省中医院检验科,河北石家庄050011;3.河北医科大学第一医院中心实验室,河北石家庄050031)
左旋肉碱在人角膜缘上皮细胞的转运特性
李宝全1,毕建成2,安翠平1,李延峰1,许顺江3*
(1.河北省石家庄市第一医院检验科,河北石家庄050011;2.河北省中医院检验科,河北石家庄050011;3.河北医科大学第一医院中心实验室,河北石家庄050031)
目的检测左旋肉碱(L-carnitine,LC)在人角膜缘上皮(human corneal limbal epithelia,HCLE)细胞的转运特性,为进一步阐明HCLE细胞对LC的转运机制提供实验依据。方法 采用放射摄入实验检测HCLE细胞对[3H]-L-carnitine的转运功能,并利用米氏方程(Michaelis-Menten equation)分析计算其动力学参数。结果HCLE细胞对LC的转运过程具有饱和性和时间依赖性,并且反应体系中需要Na+的存在。Eadie-Hofstee作图提示HCLE细胞存在高亲和力和低亲合力2个肉碱转运系统。非标记LC和乙酰化左旋肉碱可竞争性抑制[3H]-L-carnitine的转运过程。结论HCLE细胞可通过主动转运过程将泪液中的左旋肉碱摄入细胞内,发挥其生物学功能。
左旋肉碱;上皮,角膜;胞吞转运
左旋肉碱(L-carnitine,LC)具有促进长链脂肪酸的β-氧化、转运能量、抗氧化与清除自由基等多种重要生理功能[1-3]。人眼泪中可以检测到游离及乙酰化LC存在[4]。国外有研究[5]将LC作为细胞的渗透压保护剂添加于人工泪液中,用来治疗干眼症,可显著改善患者的临床症状,但其作用机制尚未阐明,特别是泪液中的LC是通过什么途径被转运入眼表上皮细胞内及其转运特性如何尚未见报道。本研究采用放射摄入实验检测人角膜缘上皮(Human corneal limbal epithelia,HCLE)细胞对[3H]-L-carnitine的转运功能,并利用米氏方程分析计算其动力学参数,旨在为进一步阐明LC在HCLE细胞的转运机制以及临床应用LC治疗干眼症提供实验基础和理论依据。
1 材料与方法
1.1 试剂与仪器 无血清角质细胞培养基(keratinocyte serum-free medium,K-SFM)、表皮生长因子(epidermal growth factor,EGF)、DMEM/F12培养基(Invitrogen-Gibco公司,美国);[3H]-L-carnitine(GE Healthcare公司,英国);其余试剂(Sigma公司,美国)。CO2培养箱(Heraeus公司,德国);LS-6500型多功能液体闪烁计数器(贝克曼公司,美国)。
1.2 细胞培养 本研究所用HCLE细胞(美国波士顿Schepens眼科研究所Ilene Gipson教授惠赠)按文献报道方法培养[6]。将复苏传代的HCLE细胞用无血清K-SFM培养基悬浮,接种于100 m L培养瓶中(2×104/cm2),加入25 mg/L牛垂体浸膏、0.2μg/L EGF和0.4 mmol/L CaCl2,置37℃、5%的CO2培养箱内培养至50%汇合时,更换为1∶1混合培养基(K-SFM和低钙的DMEM/F12)继续培养至满汇合备用。
1.3 放射摄入实验 将HCLE细胞接种于24孔培养板上,每孔5×105个细胞,培养细胞至80%~90%汇合。吸去培养液,在37℃环境下加入摄取缓冲液(含25 mmol/L Tris/HEPES,140 mmol/L NaCl,5.4 mmol/L KCl,1.8 mmol/L CaCl2,0.8 mmol/L MgSO4和5 mmol/L葡萄糖,p H 7.4)予孵育细胞1 h;然后加入不同浓度的[3H]-L-carnitine(0、100、200、300、400、500 nmol/L)和(或)非标记LC;非特异性摄入管加入含有过量(100倍以上)非标记LC(25 mmol/L)的摄取缓冲液;各管总放射性减去非特异性摄取管的放射性即为特异性摄取值。孵育结束后吸掉摄取缓冲液,迅速用冰冷的PBS洗涤细胞3次,每次30 s,以终止摄入反应。将剩余PBS吸干净,加入0.2 m L细胞裂解缓冲液(含0.1 mol/L Na OH和0.1%Triton X-100)充分裂解细胞,振荡混匀。取10μL用于蛋白定量。另取100μL加入10 m L闪烁液,在液体闪烁计数器上测定细胞内放射性强度,计算HCLE细胞摄取[3H]-L-carnitine的量。该实验共分7组,每组做3个平行管,整个实验重复4次。
HCLE细胞对LC的转运特性和相关参数根据下列米氏方程,采用Eadie-Hofstee和Lineweaver-Burk(双倒数)作图法分析计算。v=Vmax1×[s]/(Km1+[s])+Vmax2×[s]/(Km2+[s])。v为摄入反应速率,Vmax为最大反应速率,Km为米氏常数,[s]为底物浓度。
1.4 孵育时间和Na+对HCLE细胞摄取[3H]-L-carnitine的影响 按上述方法准备2板HCLE细胞,其中一板应用含有Na+的孵育缓冲液,另一板应用不含Na+的孵育缓冲液(将摄取缓冲液中的Na+替换为相同浓度的胆碱)。每板24孔细胞,共分8组,每组3孔。在反应体系中加入12 nmol/L的[3H]-L-carnitine,分别孵育0、10、20、40、60、90、120、180 min。在每个时间点结束时,迅速吸出孵育缓冲液,并加入冰冷的PBS终止反应,其他细胞继续孵育。全部时间点孵育完毕后收获细胞,其余操作同前。
1.5 竞争抑制实验 按上述方法准备2板HCLE细胞,其中一板用于LC抑制实验,另一板用于乙酰化左旋肉碱(acetyl-L-carnitine,ALC)抑制实验。每板24孔细胞,共分8组,每组3孔。在反应体系中加入12 nmol/L[3H]-L-carnitine和不同浓度(0、0.05、0.1、0.5、1、500、1 000、25 000μmol/L)的非标记LC或ALC,孵育30 min,收获细胞。其余操作同前。测量结束后,以非标记LC或ALC浓度的对数值为横坐标,以[3H]-L-carnitine摄入量占对照组的百分比为纵坐标,做抑制曲线,并计算各自的半数抑制浓度(50%inhibitory concen traton,IC50)值。
1.6 统计学方法 应用SPSS16.0统计学软件进行数据分析,计量资料以±s表示,组间比较采用Student非配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 孵育时间和Na+对HCLE细胞摄取[3H]-L-carnitine的影响 在反应体系中加入12 nmol/L[3H]-L-carnitine,孵育不同时间后,HCLE细胞对[3H]-L-carnitine的摄取随着孵育时间的延长逐渐增多,二者在90 min以内呈良好的线性关系。如果将摄取缓冲液中的Na+替换为相同浓度的胆碱,HCLE细胞对[3H]-L-carnitine的摄取在各时间点均有所下降(P<0.01,图1)。因此,后续实验我们采用在Na+存在的条件下孵育细胞30 min。
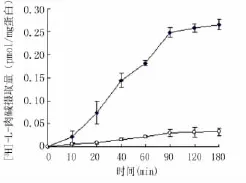
图1 孵育时间和Na+对人眼角膜上皮细胞转运左旋肉碱的影响Figure 1 Time course and Na+dependence of[3H]-L-carnitine uptake by HCLE cells
2.2 HCLE细胞摄取[3H]-L-carnitine的动力学特征 HCLE细胞对[3H]-L-carnitine的摄取具有浓度依赖性,当底物浓度>400 nmol/L时,即达到饱和程度(图2A)。根据米氏方程,Eadie-Hofstee作图提示在HCLE细胞对[3H]-L-carnitine的摄取过程中,存在高亲合力和低亲合力2个转运系统(图2B)。采用Lineweaver-Burk(双倒数)作图法分别对高亲和力和低亲合力转运进行分析计算(图2C,2D),高亲和力转运的米氏常数(Km)和最大摄取速率(Vmax)分别为(9.48±2.7)μmol/L和(0.48±0.09)pmol·h-1·mg-1蛋白;低亲合力转运的Km和Vmax分别为(363.64±34.4)μmol/L和(5.1±0.3)pmol·h-1·mg-1蛋白。
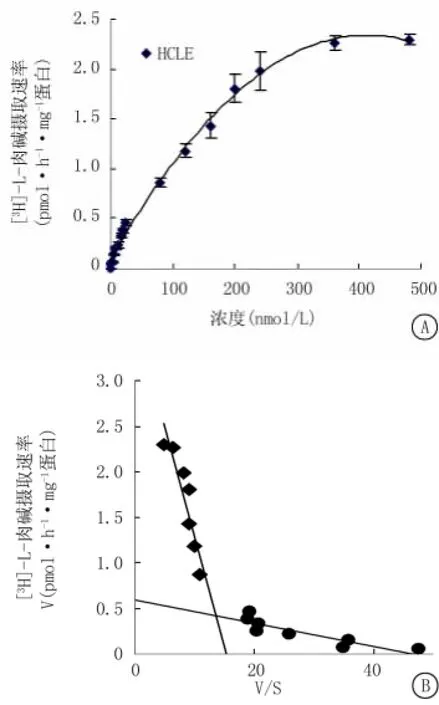

图2 左旋肉碱在人角膜上皮细胞的转运特性A.饱和曲线;B.Eadie-Hofstee作图;C.Lineweaver-Burk(双倒数)作图法分别对高亲和力转运进行分析;D.Lineweaver-Burk(双倒数)作图法分别对低亲合力转运进行分析Figure 2 Characteristics of the kinetics of[3H]-L-carnitine uptake in HCLE cells
2.3 LC和ALC对HCLE细胞摄取[3H]-L-carnitine的竞争性抑制作用 在反应体系中加入不同浓度的LC或ALC,孵育30 min后,HCLE细胞对[3H]-L-carnitine的摄取被显著抑制,且呈浓度依赖性(图3)。LC和ALC的IC50值分别为(1.17± 0.27)μmol/L和(345.7±37.9)μmol/L。
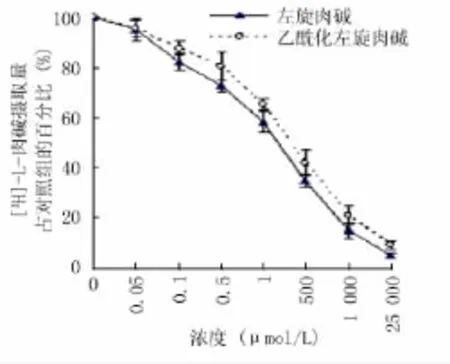
图3 不同浓度的左旋肉碱和乙酰化左旋肉碱对[3H]-L-carnitine在人角膜上皮细胞转运的抑制作用Figure 3 Concentration-dependence of the inhibitory effects of L-carnitine and acetyl-L-carnitine on the uptake of[3H]-L-carnitine by HCLE cells
3 讨 论
干眼症又称角结膜干燥症,是眼科的常见病,可引起上皮干燥和角膜刺激征,严重影响患者的生活质量。引起干眼症的关键因素之一是眼表渗透压升高导致眼表上皮细胞皱缩甚至死亡。为缓解眼内高渗状态,人们在人工泪液中加入多种可溶性物质,平衡眼内渗透压,有助于眼表组织细胞的生存[5]。有报道[7]认为LC具有调节渗透压作用,可作为治疗干眼症的可溶性物质之一。临床研究发现干眼症患者局部应用LC可以迅速、持久地改善眼部症状[5]。这些结果表明LC除了有助于长链脂肪酸易化入线粒体形成乙酰化肉碱酯类进行β-氧化以外,对保持眼内局部渗透压的稳定具有重要作用。但左旋肉碱分子在HCLE细胞的转运机制至今未明。
文献[8]报道有机阳离子转运蛋白(organic cation transporter,OCTN)可转运肉碱进入细胞内,故又称肉碱/有机阳离子转运蛋白。OCTN包括OCTN1、OCTN2和OCTN3亚型,其中OCTN3仅在小鼠体内表达[9]。OCTN1和OCTN2属于新型有机阳离子转运体超家族成员,是与LC具有高亲和力的运输蛋白[9-10]。本研究结果表明,HCLE细胞对LC的摄取具有时间依赖性和浓度依赖性。在一定范围内,随着孵育时间的延长或底物浓度的增加,细胞内摄取的LC含量也逐渐增加,最终达到饱和状态;同时,反应体系中 Na+的存在也是HCLE细胞摄取LC的必要条件。这些特性均符合OCTN1和OCTN2转运LC的特征。另外,本研究依据米氏方程,对实验结果进行非线性回归处理,Eadie-Hofstee作图结果表明在HCLE细胞存在对LC高亲合力和低亲合力2个转运系统,并且利用Lineweaver-Burk作图法分别计算了它们的Km和Vmax值。这些结果表明,HCLE细胞除了通过OCTN1和OCTN2摄取LC外,还可能通过其他低亲合力转运系统缓慢摄取LC。这些低亲合力转运蛋白需要进一步研究证实。最后,本研究的竞争性抑制实验结果表明,非标记LC和ALC均可显著抑制HCLE细胞对标记LC的摄取,且呈浓度依赖性,从而证实了本反应体系的特异性。
总之,HCLE细胞可通过主动转运过程将泪液中的LC摄入细胞内,在此过程中OCTN1和OCTN2发挥主要作用。本研究为进一步阐明LC在HCLE细胞的转运机制以及临床应用LC治疗干眼症提供了实验和理论依据。
[1] Zhang R,Zhang H,Zhang Z,et al.Neuroprotective effects of pre-treament with l-carnitine and acetyl-l-carnitine on ischemic injury in vivo and in vitro[J].Int J Mol Sci,2012,13(2):2078-2090.
[2] 毕建成,安翠平,李宝全,等.肉碱缺乏症的研究进展[J].河北医科大学学报,2014,35(8):989-992.
[3] 张忠霞,崔冬生,王涛,等.乙酰左旋肉碱预处理对低氧低糖诱导PC12细胞凋亡的影响[J].中华麻醉学杂志,2012,32(3):364-366.
[4] Khajavi N,Reinach PS,Skrzypski M,et al.L-carnitine reduces in human conjunctival epithelial cells hypertonic-induced shrinkage through interacting with TRPV1 channels[J].Cell Physiol Biochem,2014,34(3):790-803.
[5] Nebbioso M,Evangelista M,Librando A,et al.Iatrogenic dry eye disease:an eledoisin/carnitine and osmolyte drops study[J].Biomed Pharmacother,2013,67(7):659-663.
[6] Bandamwar KL,Papas EB,Garrett Q.Fluorescein staining and physiological state of corneal epithelial cells[J].Cont Lens Anterior Eye,2014,37(3):213-223.
[7] Chen W,Zhang X,Li J,et al.Efficacy of osmoprotectants on prevention and treatment of murine dry eye[J].Invest Ophthalmol Vis Sci,2013,54(9):6287-6297.
[8] Salsoso R,Guzmán-Gutiérrez E,Arroyo P,et al.Reduced L-carnitine transport in aortic endothelial cells from spontaneously hypertensive rats[J].PLoS One,2014,9(2):e90339.
[9] Tamai I.Pharmacological and pathophysiological roles of carnitine/organic cation transporters(OCTNs:SLC22A4,SLC22A5 and Slc22a21)[J].Biopharm Drug Dispos,2013,34(1):29-44.
[10] Pochin I L,Scalise M,Galluccio M,et al.OCTN cation transporters in health and disease:role as drug targets and assay development[J].J Biomol Screen,2013,18(8):851-867.
(本文编辑:赵丽洁)
Transport of L-carnitine in human corneal epithelial cells
LI Bao-quan1,BI Jian-cheng2,AN Cui-ping1,LI Yan-feng1,XU Shun-jiang3*
(1.Department of Clinical Laboratory,the First Hospital of Shijiazhuan g City,Hebei Province,Shijiazhuang 050011,China;2.Department of Clinical Laboratory,the Traditional Chinese Medicine Hospital of Hebei Province,Shijiazhuan g 050011,China;3.Department of Central Laboratory,the First Hospital of Hebei Medical University,Shijiazhuan g 050031,China)
ObjectiveTo investigate the characteristics of L-carnitine(LC)import into human corneal limbal epithelia(HCLE)cells,and to provide an experimental basis for further study of transport mechanism of LC in human ocular epithelium.MethodsThe transport of[3H]-L-carnitine was determined using the radio uptake assay and the apparent kinetic parameters of carnitine uptake by HCLE were estimated by nonlinear regression curve fitting according to the Michaelis-Menten equation.ResultsThe uptake of LC into HCLE cells was saturable and time-dependent,and it also required the presence of Na+in the external medium.An Eadie-Hofstee plot showed two distinct components:a high-and a low-affinity carnitine transport system in HCLE cells.The unlabelled LC and acetyl-L-carnitine competitively inhibited the uptake of[3H]-L-carnitine by HCLE cells.ConclusionL-carnitine is transported into HCLE cells from tears by an active carrier mediated transport system and exerts its biological function.
L-carnitine;epithelium,corneal;transcytosis
R322.91
A
1007-3205(2015)01-0048-04
2014-08-30;
2014-10-29
河北省医学科学研究重点课题(20130136)
李宝全(1958-),男,山西宁武人,河北省石家庄市第一医院主管检验师,从事医学检验研究。
*通讯作者。E-mail:sjxu66@sina.com
10.3969/j.issn.1007-3205.2015.01.018
