生殖支原体脂质相关膜蛋白通过c-Src/ROS/Nrf2途径诱导胎盘滋养层细胞表达血红素氧合酶
2015-12-28,,,,,,,,
,,,,,,,,
(1.南华大学附属第一医院妇产科,湖南 衡阳 421001;2.南华大学医学院病原生物学研究所,特殊病原体防控湖南省重点实验室;3.南华大学心血管疾病研究所)
·基础医学·
生殖支原体脂质相关膜蛋白通过c-Src/ROS/Nrf2途径诱导胎盘滋养层细胞表达血红素氧合酶
何璐1,2,游晓星2,李国华3,曾焱华2,李冉辉2,朱翠明2,余敏君2,陈忠东1*,吴移谋2
(1.南华大学附属第一医院妇产科,湖南 衡阳 421001;2.南华大学医学院病原生物学研究所,特殊病原体防控湖南省重点实验室;3.南华大学心血管疾病研究所)
目的探讨生殖支原体脂质相关膜蛋白(LAMPs)诱导胎盘滋养层细胞表达血红素氧合酶-1(HO-1)的分子机制。方法用0.5~5 μg/mL生殖支原体LAMPs处理体外培养的胎盘滋养层细胞4~12 h,采用实时定量PCR和Western blot法分别检测HO-1 mRNA和蛋白的表达以及核因子相关因子-2(Nrf2)的核转位;比色法观察HO-1的酶活性;2′,7′-二氯二氢荧光黄二乙酸酯(H2DCFDA)检测活性氧产生。分别采用酪氨酸激酶c-Src抑制剂PP1、活性氧抑制剂N-乙酰半胱氨酸(NAC)和Nrf2 siRNA干预,观察HO-1的表达情况。结果生殖支原体LAMPs能诱导滋养层细胞HO-1 mRNA和蛋白的表达,上调其酶活性。同时,LAMPs也能诱导其产生活性氧,并促使Nrf2核转位。PP1和NAC预处理后,可明显降低HO-1的表达水平以及细胞核内Nrf2含量。采用Nrf2 siRNA转染后,HO-1的表达显著减少。结论生殖支原体LAMPs通过c-Src/ROS/Nrf2途径诱导滋养层细胞表达HO-1。
生殖支原体; 脂质相关膜蛋白; 血红素氧合酶-1; 滋养层细胞
生殖支原体(Mycoplasma genitalium)是Tully等人从男性非淋球菌尿道炎患者体内分离出来的一种病原体。它作为一种病原微生物的观点已被人们接受。生殖支原体黏附至生殖道黏膜后,主要通过其细胞膜中的脂质相关膜蛋白(lipid-associated membrane proteins,LAMPs)发挥致炎作用,从而引起女性多种泌尿生殖系统疾病如盆腔炎、宫颈炎、不育(孕)症,并参与胎膜早破、产褥感染和新生儿肺炎等不良妊娠的发生[1]。胎盘滋养层细胞是母体和胎儿进行物质交换的场所,同时也是母体固有免疫系统的重要组成部分[2]。研究显示,支原体感染后,可诱导胎盘滋养层细胞表达多种细胞因子和炎性相关介质[3]。虽然支原体本身难以通过胎盘屏障,但是其感染导致细胞因子过度分泌,这对滋养层细胞具有毒性作用,也是引起不良妊娠发生的重要因素[4]。因此对于母体而言,如何负调控这些细胞因子的过度分泌,是维持胎儿发育的关键。人工合成的支原体巨噬细胞活化脂肽-2可诱导人单核细胞表达血红素氧合酶-1(heme oxygenase-1,HO-1),从而抑制炎症因子的过度分泌[5]。但对于生殖支原体感染后,胎盘滋养层细胞能否表达HO-1目前仍不清楚。本文旨在观察生殖支原体LAMPs能否诱导滋养层细胞表达HO-1,并探讨其分子机制。
1 材料与方法
1.1材料生殖支原体G37标准株购自ATCC(ATCC®33530DTM)。小鼠抗人HO-1抗体、小鼠抗人核因子相关因子-2(nuclear factor-E2-related factor 2,Nrf2)抗体以及小鼠抗人TATA结合蛋白(TATA-binding protein,TBP)抗体购自Santa Cruz;抗磷酸化c-Src(Tyr416)和抗总c-Src单克隆抗体购自Cell Signaling;酪氨酸激酶c-Src抑制剂PP1,N-乙酰-半胱氨酸(N-acetyl-cysteine,NAC)以及2′,7′-二氯二氢荧光黄二乙酸酯(2′,7′-dichlorodihydrofluorescein diacetate,H2DCFDA)购自Sigma。HO-1活性检测试剂盒购自上海GENMED公司;细胞蛋白提取试剂盒、蛋白浓度测定试剂盒购自Thermo公司;Lipofectamine 2000转染试剂及新霉素(Normocin)购自Invitrogen公司;蛋白酶抑制剂购自Roche。用于分离滋养层细胞的胎盘绒毛组织来自2012年10月~2013年10月南华大学附属第一医院妇产科所收治的患者(孕18~31周)。开展研究前均与患者签署知情同意书,研究内容和方法经过南华大学医学伦理委员会的批准。
1.2方法
1.2.1 生殖支原体培养与LAMPs提取 生殖支原体标准株用SP4培养基于950 mL/L CO2、37 ℃条件下培养。当菌液由玫瑰红变为橙色时,离心获取菌体,根据参考文献提供的方法提取LAMPs[6]。用5 mL Tris缓冲液(pH 8.0的50 mmol/L Tris、0.15 mol/L NaCl、1 mmol/L EDTA)重悬浮支原体沉淀,并加入终浓度为20 mL/L的Triton X-114,4 ℃静置1 h,随后37 ℃孵育30 min以促进相分离。弃上层水相,加入等体积Tris缓冲液后重复上述相分离1次。第2次相分离结束后,弃水相,用Tris缓冲液恢复至初始体积,加入2.5倍体积无水乙醇-20 ℃以沉淀LAMPs。超声处理后测定其浓度备用。
1.2.2 滋养层细胞的分离与培养 按照参考文献提供的方法分离鉴定滋养层细胞[7]。细胞用含100 mL/L胎牛血清以及50 mg/mL新霉素(Normocin)的M199培养基,于37 ℃、50 mL/L CO2的恒温细胞培养箱中培养。实验前将2×105个细胞接种于培养板中培养48 h,随后用0.5~5 μg/mL LAMPs作用细胞4~12 h(视不同的实验目的而定)[6]。
1.2.3 实时定量PCR检测HO-1 mRNA的表达 细胞处理完毕后,用TRIzol试剂提取细胞总RNA,并取3 μg的RNA进行逆转录,将获得的cDNA进行实时定量PCR。本文所用引物如下。HO-1上游引物为5′- ATGGCCTCCCTGTACCACATC-3′,HO-1下游引物为 5′-TGTTGCGCTCAATCTCCTCCT-3′;β-actin上游引物为5′-CATCCTGCGTCTGGACCTGG-3′,β-actin下游引物为:5′-TAATGTCACGCACGATTTCC-3′,在LightCycler96定量PCR仪(Roche)上按以下程序扩增:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,58 ℃ 1 min共40个循环。PCR结束后计算各处理组中HO-1蛋白的相对表达量,计算公式:2-ΔΔCt,ΔΔCt=实验组(CtHO-1-Ctβ-actin)-对照组(CtHO-1-Ctβ-actin)。
1.2.4 HO-1酶活性检测 处理后的细胞加入1.5 mL的试剂A 漂洗细胞,随后加入100 μL裂解液B充分混匀,超声裂解细胞后于4 ℃,10 000 r/min离心15 min,获取20 μL上清置于另一新的EP 管中,分别加入340 μL 缓冲液C、20 μL反应液D、20 μL 底物,混匀,37 ℃温育60 min 。最后加入400 μL终止液终止反应。1 000 rpm 离心5 min。取100 μL绿色相,测量其在464 nm 和530 nm波长的吸光度,并根据待测样品的蛋白浓度计算出HO-1 的活性,单位以每小时单位蛋白(mg)中胆红素浓度(nmol/L)表示。
1.2.5 Western blot法检测HO-1表达及Nrf2核转位 滋养层细胞经LAMPs处理后,用预冷PBS漂洗2次,随后加入含蛋白酶抑制剂的细胞裂解液充分裂解细胞,4 ℃ 12 000 r/min离心10 min。细胞浆和细胞核蛋白提取试剂盒严格根据厂家说明书进行。将获取的蛋白经10%~12%的SDS-PAGE、转膜,放入5%脱脂奶粉中封闭1 h;洗涤后,加入小鼠抗人HO-1或Nrf2抗体(1∶1 000),4 ℃孵育过夜;多次洗涤后,加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠二抗孵育1 h。ECL法发光、显影。
1.2.6 活性氧(reactive oxygen species,ROS)检测 以H2DCFDA为荧光探针检测细胞内ROS水平。其原理是不发荧光的H2DCFDA进入细胞后能被过氧化物、氢过氧化物等氧化分解为二氯荧光黄而产生荧光。孵育结束后,向各管中加入终浓度5 μmol/L的H2DCFDA染液,37 ℃避光孵育30 min。PBS洗细胞3次,重悬细胞,SynergyHT荧光分光光度计(Bio-Tec)检测细胞悬液荧光强度(激发波长485 nm,发射波长530 nm)。
1.2.7 Nrf2的siRNA瞬时转染 将滋养层细胞接种于1.5 mL无血清的培养基的6孔板中,放入培养箱中备用。按LipofectamineTM 2000说明书配制A、B液并充分混合,静置20 min后加入6孔板中,按试剂盒说明书要求,使siRNA终浓度达100 nmol/L,转染4 h后换上完全培养基继续培养。

2 结 果
2.1生殖支原体LAMPs诱导滋养层细胞表达HO-1 mRNA和蛋白在正常情况下,滋养层细胞中HO-1mRNA表达水平很低。用0.5 μg/mL LAMPs处理滋养层细胞12 h后,可明显诱导HO-1 mRNA表达,随着LAMPs浓度的增加,HO-1mRNA表达水平也逐渐升高(图1A)。Western blot检测结果显示HO-1蛋白表达水平与mRNA的变化一致(图1B)。

图1 生殖支原体LAMPs对滋养层细胞HO-1表达的影响A:生殖支原体LAMPs诱导滋养层细胞表达HO-1 mRNA.与对照组(0 μg/mL)相比,*P<0.05,**P<0.01;B:生殖支原体LAMPs诱导滋养层细胞表达HO-1蛋白
2.2生殖支原体LAMPs上调滋养层细胞HO-1酶活性在正常情况下,滋养层细胞中HO-1酶活性水平很低。采用0.5 μg/mL LAMPs处理滋养层细胞12 h后,HO-1酶活性明显增加,随着LAMPs浓度的增高,HO-1酶活性也随着之增强(图2),作用趋势与HO-1的表达趋势相似。

图2 生殖支原体LAMPs对滋养层细胞HO-1酶活性的影响 与对照组(0 μg/mL)相比,*P<0.05
2.3酪氨酸激酶c-Src参与调控滋养层细胞HO-1的表达采用5 μg/mL的LAMPs处理滋养层细胞3 min后,即可诱导酪氨酸激酶c-Src的磷酸化,随着LAMPs处理时间的延长,c-Src的磷酸化水平增加,处理10 min后c-Src的磷酸化水平反而降低(图3A)。而使用10~30 μmol/L酪氨酸激酶c-Src抑制剂PP1预处理滋养层细胞1 h后,HO-1表达水平明显降低(图3B),PP1可以明显抑制HO-1的表达。
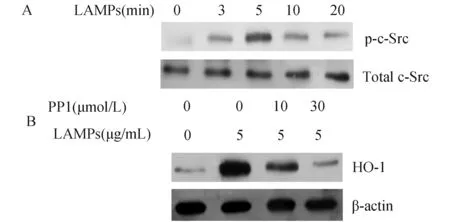
图3 酪氨酸激酶c-Src在生殖支原体LAMPs诱导滋养层细胞HO-1表达中的作用 A:生殖支原体LAMPs诱导滋养层细胞c-Src的磷酸化;B: PP1拮抗生殖支原体LAMPs诱导滋养层细胞HO-1的表达
2.4生殖支原体LAMPs诱导滋养层细胞表达HO-1与ROS的产生有关在正常情况下,滋养层细胞内有少量的ROS存在。生殖支原体LAMPs能明显促使滋养层细胞生成ROS,随着LAMPs的浓度增加,ROS的生成增多,而采用30 μmol/L PP1预处理滋养层细胞1 h后,ROS的生成显著降低(图4A)。生殖支原体LAMPs能显著诱导滋养层细胞表达HO-1,而采用不同浓度的ROS抑制剂NAC预处理滋养层细胞4 h后,HO-1表达降低,NAC能拮抗LAMPs对滋养层细胞HO-1表达的诱导作用(图4B)。
2.5生殖支原体LAMPs诱导滋养层细胞Nrf2核转位在正常情况下,Nrf2可分布在细胞质和细胞核,但主要存在细胞质中。当用5 μg/mL LAMPs处理滋养层细胞1~2 h后,细胞核中Nrf2含量逐渐增多,且胞质中Nrf2含量随之降低,而核蛋白内参TBP的含量保持恒定。而预先用ROS抑制剂NAC孵育后,LAMPs诱导滋养层细胞Nrf2核转位的作用被明显抑制(图5)。
2.6 Nrf2参与调控滋养层细胞HO-1的表达在正常情况下,滋养层细胞中HO-1表达水平很低。5 μg/mL LAMPs能明显诱导滋养层细胞HO-1的表达。而采用特异性siRNA干扰Nrf2表达后(图6A),再用5 μg/mL LAMPs处理滋养层细胞12 h,Western blot检测结果显示,HO-1的表达量明显降低(图6B)。

图4 ROS在生殖支原体LAMPs诱导滋养层细胞表达HO-1中的作用 A:生殖支原体LAMPs诱导滋养层细胞产生ROS.与对照组(0μg/mL LAMPs)相比,*P<0.05,#P<0.05;B:NAC拮抗生殖支原体LAMPs诱导滋养层细胞表达HO-1

图5 生殖支原体LAMPs对滋养层细胞Nrf2核转位的影响

图6 沉默Nrf2表达对滋养层细胞HO-1表达的影响 A:Nrf2 siRNA干扰效果;B:siRNA干扰沉默Nrf2表达后下调滋养层细胞HO-1的表达
3 讨 论
LAMPs是生殖支原体重要的致炎物质,可诱导胎盘组织分泌多种炎性相关介质从而参与局部炎症反应[9]。因此对于母体而言,支原体感染后必然存在某种负性调控机制以抑制过度的炎症反应,从而维持胎儿的正常发育[9]。HO-1是催化血红素降解为胆红素、一氧化碳和Fe2+的限速酶。HO-1除了其固有的降解血红素活性外,对炎症反应也具有一定的调控作用[10]。本文LAMPs可显著诱导滋养层细胞HO-1 mRNA和蛋白的表达,并上调其酶活性,而酪氨酸激酶c-Src抑制剂PP1明显抑制HO-1的表达。HO-1的表达增加被认为是宿主细胞免受免疫病理损伤或应激损伤的一种适应性保护机制。由于血红素是重要的促炎物质,HO-1促进血红素的降解无疑是其调控细胞因子分泌的重要机制。此外,HO-1催化血红素降解产物胆红素、一氧化碳和Fe2+对炎症介质的表达也具有一定程度的抑制作用。
本文同时也显示LAMPs可显著诱导ROS产生。ROS虽然有利于清除病原体,但其过度生成对宿主细胞DNA和蛋白具有毒性作用。在哺乳动物体内,ROS可反馈性激活Nrf2核转录因子,从而诱导HO-1等多种抗氧化相关蛋白的表达[11]。生理条件下Nrf2定位于细胞质中,在各种外源性刺激作用后,如感染,可引起细胞内ROS增多,随后诱导Nrf2转位至细胞核,与靶基因启动子结合从而启动其表达,参与调控细胞的抗氧化应激损伤以及炎症反应[12]。LAMPs处理养层细胞60 min后,可显著增加细胞核内Nrf2含量,并持续至2 h以上。这表明LAMPs可激活滋养层细胞内Nrf2。为了研究Nrf2的激活是否受ROS调控,本实验采用ROS清除剂NAC处理滋养层细胞后,结果发现LAMPs诱导Nrf2核转位的作用受到明显抑制。同时,NAC也可抑制HO-1的表达,沉默Nrf2基因后,HO-1表达几乎消失。以上结果表明LAMPs可能通过ROS/Nrf2途径诱导滋养层细胞表达HO-1。但ROS激活Nrf2的机制目前仍不完全清楚,可能机制是当细胞内ROS浓度增高时,可促使Nrf2的抑制蛋白Keap1与其解离,从而使其转移至细胞核,随后Nrf2结合至靶基因的抗氧化反应元件,启动下游保护性基因的转录。
总之,本研究证实生殖支原体LAMPs通过c-Src/ROS/Nrf2途径上调滋养层细胞HO-1的表达。HO-1可能通过多种途径调控炎症介质及细胞因子的产生,最终反馈性调控炎症反应的强度,这可能是机体一种获得性的自我保护机制。
[1] Mobley VL,Hobbs MM,Lau K,et al.Mycoplasma genitalium infection in women attending a sexually transmitted infection clinic:diagnostic specimen type,coinfections,and predictors[J].Sex Transm Dis,2012,39(9):706-709.
[2] 王专家,张宇飞,刘淑英.绵羊多核绒毛膜滋养层细胞的分离培养与鉴定[J].细胞与分子免疫学杂志,2014,30(1):82-86.
[3] Mitsunari M,Yoshida S,Shoji T,et al.Macrophage-activating lipopeptide-2 induces cyclooxygenase-2 and prostaglandin E(2) via toll-like receptor 2 in human placental trophoblast cells[J].J Reprod Immunol,2006,72(1-2):46-59.
[4] Griesinger G,Saleh L,Bauer S,et al.Production of pro- and anti-inflammatory cytokines of human placental trophoblasts in response to pathogenic bacteria[J].J Soc Gynecol Investig,2001,8(6):334-340.
[5] 马小华,游晓星,曾焱华,等.支原体巨噬细胞活化脂肽2经MAPKs和Nrf2途径诱导人单核细胞血红素氧合酶-1产生[J].中华微生物学和免疫学杂志,2014,34(4):289-293.
[6] He J,You X,Zeng Y,et al.Mycoplasma genitalium-derived lipid-associated membrane proteins activate NF-kappaB through toll-like receptors 1,2,and 6 and CD14 in a MyD88-dependent pathway[J].Clin Vaccine Immunol,2009,16(12):1750-1757.
[7] Kahlo K,Fill MS,Ignatov T,et al.HO-1 as modulator of the innate immune response in pregnancy[J].Am J Reprod Immunol,2013,70(1):24-30.
[8] Jalali BM,Kitewska A,Wasielak M,et al.Effects of seminal plasma and the presence of a conceptus on regulation of lymphocyte-cytokine network in porcine endometrium[J].Mol Reprod Dev,2014,81(3):270-281.
[9] Sun Q,Chen X,Yu J,et al.Immune modulatory function of abundant immune-related microRNAs in microvesicles from bovine colostrum[J].Protein Cell,2013,4(3):197-210.
[10] Byun SJ,Son Y,Pae HO.Cytoprotective effect of beta-lapachone by inducing heme oxygenase-1 expression and AMP-activated protein kinase activation in human endothelial cells[J].Eur Rev Med Pharmacol Sci,2014,18(7):949-958.
[11] Cuadrado A,Martin-Moldes Z,Ye J,et al.Transcription factors NRF2 and NF-kappaB are coordinated effectors of the Rho family,GTP-binding protein RAC1 during inflammation[J].J Biol Chem,2014,289(22):15244-15258.
[12] Lee IC,Kim SH,Baek HS,et al.The involvement of Nrf2 in the protective effects of diallyl disulfide on carbon tetrachloride-induced hepatic oxidative damage and inflammatory response in rats[J].Food Chem Toxicol,2014,63:174-185.
MycoplasmaGenitalium-derivedLipid-associatedMembraneProteinsInducesPlacentalTrophoblastCellsExpressionofHO-1viaROS/Nrf2
HE Lu,YOU Xiaoxing,LI Guohua,et al
(DepartmentsofGynecology&Obstetrics,theFirstAffiliatedHospital,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo investigate the mechanism of the expression of heme oxygenase-1 (HO-1) in response to Mycoplasma genitalium-derived lipid-associated membrane proteins (LAMPs) in placental trophoblast cells.MethodsPlacental trophoblast cells were cultured in vitro and stimulated by 0.5~5 μg/mL of LAMPs for 4~12h,expression of HO-1 mRNA and protein,and nuclear translocation of nuclear factor erythroid-2 related factor 2 (Nrf2) were detected by real-time PCR and Western blot,respectively.The enzyme activity of HO-1 was detected by colorimetric method.The intracellular formation of reactive oxygen species (ROS) was detected by using the fluorescent probe H2DCFDA.Tyrosine kinase c-Src inhibitor PP1,N-acetyl-cysteine (NAC) and Nrf2 siRNA were used to analyse the function of ROS and Nrf2 in mediating of HO-1 expression.ResultsM.genitalium LAMPs enhanced the expression of HO-1 at mRNA and protein levels as well as the enzyme activity of HO-1 in placental trophoblast cells in a concentration-dependent manner.In the meantime,LAMPs also induced placental trophoblast cells accumulation of ROS and nuclear translocation of Nrf2.PP1 and NAC treatment could inhibit LAMPs-induced HO-1 expression and Nrf2 nuclear translocation,and transfection of Nrf2 siRNA significantly abrogate HO-1 expression.ConclusionM.genitalium LAMPs induced placental trophoblast cells expression of HO-1 through c-Src/ROS/Nrf2 pathways.
mycoplasma genitalium; lipid-associated membrane proteins; heme oxygenase-1; placental trophoblast cells
10.15972/j.cnki.43-1509/r.2015.04.002
2015-04-24;
2015-06-07
国家自然科学基金(31000091,81072418);特殊病原体防控湖南省重点实验室资助项目(湘科计字[2014]5号,湘教通〔2012〕312号).
*通讯作者,E-mail:21615930@qq.com.
R518.9,R392-33,R711.32
A
(此文编辑:蒋湘莲)
