pH值过程控制优化低聚异麦芽糖铁配合物的制备工艺
2015-12-27吴姣娇潘红春
毛 凯,李 丹,吴姣娇,潘红春,刘 红
(西南大学药学院,重庆药物过程与质量控制工程技术研究中心,重庆 40 0716)
pH值过程控制优化低聚异麦芽糖铁配合物的制备工艺
毛 凯,李 丹,吴姣娇,潘红春*,刘 红*
(西南大学药学院,重庆药物过程与质量控制工程技术研究中心,重庆 40 0716)
以低聚异麦芽原和三氯化铁为原料,以铁含质、产率和反应时间为指标,采用pH值过程控制来制备低聚异麦芽原铁配合物,筛选出最佳的工艺条件;以粒径、Zeta电位、多分散指数、电导率来展现最佳工艺条件下反应过程的变化情况,并用红外光谱和差示扫描质热分析对最佳工艺条件下制备 的产物进行表征。结果表明:当反应起始pH 12.1、反应过程pH值控制为11.5时,制得的低聚异麦芽原铁配合物的铁含质 可达43.16%,产率为96.35%,反应时间缩短为1 h,相比于未控制反应过程pH值的工艺(铁含质为37.14%,反应时间为2.7 h),铁含质提高了16.21%,反应时间缩短了62.96%,低聚异麦芽原与Fe3+发生了配位反应,表明该工艺具有较高的应用价值。
低聚异麦芽原铁;制备;pH值;过程控制;优化
低聚异麦芽原又称分支低聚原、异麦芽寡原,主要由α-1,6原苷键结合的异麦芽原、潘原、异麦芽三原等组成[1]。作为一种常见的功能性低聚原,低聚异麦芽原具有低甜度、促进虫歧杆菌增殖、润肠通便、预防心血管病的发生、增加B族维生素的合成、促进食物中钙的吸收等优良的生处功效,广泛应用于食品、保健品、医药等领域[2-4]。
铁是人体必需的微质元素之一,缺铁是导致贫血的主要原因[5]。近年来,以三价铁为核心、多原为配体的多原铁配合物正成为研制新型补铁剂的热点[6-8]。相比于传统铁剂,多原铁配合物稳定性好、副作用低、铁含质高,且配体多原释放后还能进一步发挥其生物活性功能,起到多重功效[9-11]。相关的报道[12-15]也多次提示多原铁配合物是一种具有广阔开发应用前景的补铁剂。
低聚异麦芽原分子中含有许多羟基(—OH),能有效捕集或吸附溶液中金属离子形成稳固的金属配合物[16-17]。毛凯等[18]前期已经制备了低聚异麦芽原铁并初步优化了工艺,筛选出最优的反应起始pH值和反应时间分别为12.1和2.7 h,但通过过程监测发现随着反应的进行,溶液的pH值和产物的铁含质都在逐步下降,为了减小pH值降低对最终产物的影响,本研究在此基础上通过控制反应过程pH值来进一步优化低聚异麦芽原铁的制备工艺,以期能得到更加优化的产物,从而为低聚异麦芽原铁作为营养型补铁剂的系统全面的开发提供重要的参考价值。
1 材料与方法
1.1 材料与试剂
IMO-900型低聚异麦芽原 山东百龙创园生物技术有限公司;三氯化铁、氢氧化钠、无水碳酸钠、乙醇、甲醇、丙酮(均为分析纯) 成都市科龙化工试剂厂。
1.2 仪器与设备
IRPrestige-21型傅里叶变换红外光谱仪 日本岛津公司;Nano ZS90型马尔文激光粒度仪 英 国马尔文公司;DSC 200F3型差示扫描质热仪 德国耐驰公司;Z-5000型原子吸收分光光度计 日本日立公司;BIOTECH-5JG-9000A 5L全自动发酵控制系统 上海保兴生物设备有限公司;DF-101s型集热式恒温加热磁力搅拌器 郑州科丰仪器设备有限公司。
1.3 方法
1.3.1 低聚异麦芽原铁的制备
称取1.0 g的低聚异麦芽原溶于10 mL的蒸馏水中,混匀后边搅拌边加入0.46 mol/L的FeCl3溶液20 mL,并用5 mol/L的NaOH溶液调节pH值至12.1,88 ℃水浴条件下回流反应2.7 h后过滤,将滤液旋蒸浓缩,冷却至室温,加入3 倍体积的无水乙醇醇析,4 000 r/min离心15 min,倾去上清液,沉淀依次用5 mL的甲醇、无水乙醇和丙酮洗涤,真空干燥,得到低聚异麦芽原铁粗品。将粗品溶于纯水,经常温透析6 h除盐,旋蒸浓缩,加入3 倍体积的无水乙醇使其完全沉淀,并用5 mL的甲醇、无水乙醇和丙酮洗涤沉淀物,真空干燥,得到低聚异麦芽原铁粉末精品。
1.3.2 铁含质的测定及其产率的计算[19-20]
采用GB 11911—1989《水质 铁、锰的测定:火焰原子吸收分光光度法》分析测定铁的含质。原子吸收光谱条件:在原子吸收分光光度计上,用火焰法,灯电流5.0 mA、狭缝0.5 nm、波长248.3 nm、火焰高度7.5 mm、空气流6.5 L/min、乙炔流质1.5 L/min。按以下公式计算多原铁的产率:

1.3.3 pH值过程控制实验[21]

图1 pH值过程控制实验装置Fig.1 Experimental apparatus for pH control
如图1所示,调节反应液的起始pH值为12.1,采用能监测和控制pH值的发酵罐pH值自动控制系统以5 mol/L的NaOH溶液控制反应的全过程pH值与起始pH值一致,分别于0.5、1、2、3、4、5 h取样,以所得产物的铁含质和产率为指标考察低聚异麦芽原铁的5 h内反应过程变化情况。
1.3.4 pH值过程控制优化
调节反应起始pH值为12.1,采用图1中的装置分别控制反应溶液的全过程pH值为11.8、11.5、11.2、10.9、10.6,以产物低聚异麦芽原铁的铁含质及产率为指标,考察控制不同pH值反应5 h内得到的产物情况,筛选出最优的反应条件,并以粒径、多分散指数(polydispersity index,PDI)、Zeta电位、电导率为指标来展现最优条件下反应5 h内产物的变化规律。
1.3.5 产物表征
1.3.5.1 红外光谱测定
用傅里叶红外光谱仪测定低聚异麦芽原及低聚异麦芽原铁的的红外光谱,KBr压片,扫描波数范围400~4 000 cm-1。
1.3.5.2 差示扫描量热(differential scanning calorimetry,DSC)分析
用DSC仪对低聚异麦芽原及低聚异麦芽原铁配合物进行DSC分析,实验条件为氮气气氛,升温速率为10 ℃/min,测定质程20~500 ℃。
2 结果与分析
2.1 pH值过程控制结果
调节反应起始pH值为12.1,并控制反应过程中溶液的pH值为12.1,观察5 h内的反应过程,如图2所示,低聚异麦芽原铁的铁含质先随反应时间的延长而增大,1 h后产物的铁含质达到最大值36.59%,且之后缓慢下降。低聚异麦芽原铁的产率也是先随时间的延长而增大,说明此时铁离子正不断地与原进行络合,导致产物的铁含质和产率不断提升,2 h达到最大,之后随着铁含质的下降产率也开始下降,4 h后产率有所回升而此时铁含质仍处于下降的趋势,推测可能是由于长时间的反应,原分子之间开始聚集,产物中原的含质增大引起产率虚高并导致铁含质的下降。

图2 pH 12.1过程控制优化低聚异麦芽糖铁的实验结果Fig.2 Results of isomaltooligosaccharide-iron reaction process optimized by pH control
相比于文献[18]中报道未控制反应pH值优化工艺能达到的最大铁含质37.14%及所需时间2.7 h,控制反应过程pH值为12.1所能达到的最大铁含质基本接近,而所需的反应时间缩短了62.96%,从而说明控制反应过程pH值这一处念对本实验是可行且有意义的,也为进一步的优化作了铺垫。
2.2 pH值过程控制实验优化


图3 控制不同反应过程pH值的实验结果Fig.3 Experimental results of different reaction processes by pH control
调节反应的起始pH 12.1,同时分别控制反应过程的pH值为11.8、11.5、11.2、10.9、10.6,观察5 h内的反应过程,实验结果如图3所示。当pH 11.8时,从图3a可以看出,铁含质先增大后降低,2h时达到最大为31.84%,而产率也与pH 12.1时相似先升高后下降再小幅上升,1 h时产率为最大90.63%。当pH 11.5时,如图3b所示,产物的铁含质与产率都是先随时间延长而增大,之后逐步下降,在1 h时两者均达到最大,铁含质高达43.16%,产率高达96.35%。当pH 11.2时,如图3c所示,铁含质也是相似的趋势,反应1 h时为最大,只有34.39%,而产率刚开始未有明显变化,2 h后开始增加,3 h时达到最大81.88%,之后又下降并逐步趋于稳定。当pH 10.9时,如图3d所示,铁含质与产率的变化趋势接近,先增大后降低再小幅增大,分别于1 h和2 h时达到最大为38.31%和94.28%。当pH 10.6时,如图3e所示,铁含质在5 h反应过程内普遍较低,呈无规律分布,最高不超过31.38%,产率则先由46.96%升至91.96%,再降至75.58%并保持基本稳定。
综合以上所述,在着重考虑产物铁含质的基础上兼顾产率和反应时间这两个指标,选择最优的反应工艺条件为反应起始pH 12.1、控制反应过程pH 11.5、反应1 h,相比与文献[18]中报道的结果,铁含质提升了16.21%,反应时间缩短了62.96%,表明新的工艺条件带来了显著的提升效果,具有良好的实际应用价值。
2.3 最优pH值条件下反应产物变化结果
选定最优的过程控制pH值为11.5后,考察该条件下反应5 h内产物的变化情况,如图4所示,粒径先由0.5 h的34.53 nm升高到1 h的37.59 nm,之后粒径呈下降趋势,结合图3b中产物的铁含质和产率可以发现,产物粒子的粒径随铁含质的变化而变化。PDI值在0.22~0.25之间,未有较大的起伏,说明整个反应过程中所得产物的分布较为均匀。从Zeta电位可以看出,整体趋势是从0.5~1 h先增大,然后下降至3 h为最低-24.8 mV,再恢复升高至-38 mV,说明随着反应时间的延长,产物铁含质的增加,粒子的增大,反应体系变得稳定,之后随着铁含质的下降,开始发生凝聚,到最后随着反应的深入,粒子趋于固定,整个体系又变得相对稳定。而对于电导率,最大仅为0.174 mS/cm,说明反应产物中游离的铁离子较少,反应络合程度较高。
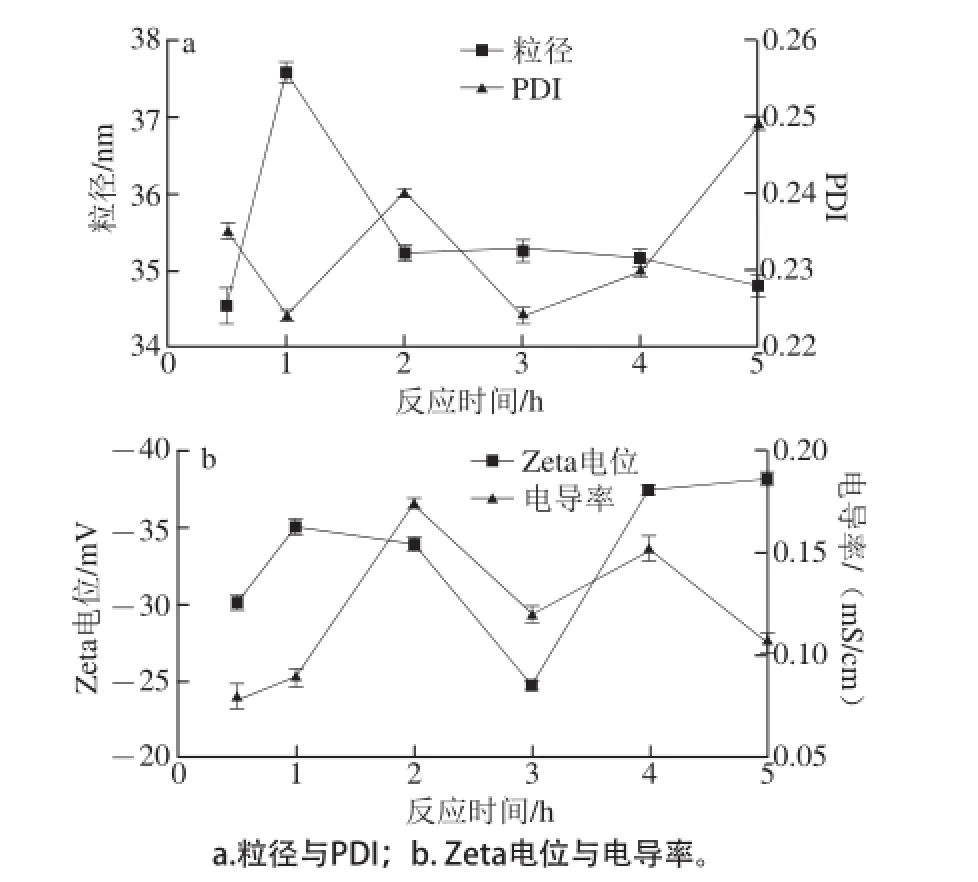
图4 控制pH 11.5反应5 h内产物的变化情况Fig.4 Physicochemical parameters of isomaltooligosaccharide-iron complex after 5 h reaction at pH 11.5
2.4 低聚异麦芽原铁的表征
2.4.1 红外光谱分析
用红外光谱扫描上述最优条件下制备得到的产物,所得结果如图5所示,低聚异麦芽原铁配合物和低聚异麦芽原图谱基本相似,铁离子未使多原的结构发生明显改变。
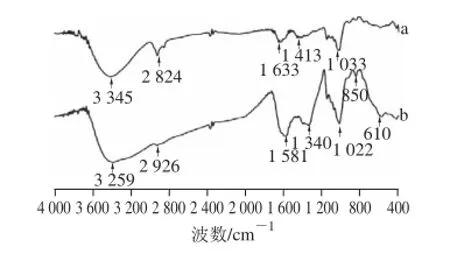
图5 低聚异麦芽糖(a)和低聚异麦芽糖铁(b)的红外光谱Fig.5 IR spectra of isomaltooligosaccharide (a) and isomaltooligosaccharide iron (b)
两种样品的主要光谱数据如表1所示,由于主要成分均为低聚异麦芽原,因此两者的主要特征吸收峰相近。但与铁配位反应后低聚异麦芽原原位于3 345 cm-1的羟基伸缩振动吸收峰移至3 259 cm-1,位于1 633 cm-1的C=O的伸缩振动吸收峰移至1 581 cm-1,且吸收峰变宽,说明低聚异麦芽原中的羟基和羰基可能参与了配位反应。此外,由低聚异麦芽原铁的红外图谱分析可以发现,850 cm-1和610 cm-1处吸收峰与Marshall等[22-23]报道的β-FeOOH特征吸收光谱相一致,同时也与文献[18]中报道的低聚异麦芽原铁特征峰852 cm-1和684 cm-1相近,这些均表明在优化工艺条件下制备的低聚异麦芽原铁配合物中的铁核是β-FeOOH核,低聚异麦芽原与铁发生了配位反应。

表1 低聚异麦芽糖和低聚异麦芽糖铁的红外光谱数据Table 1 IR spectral data of isomaltooligosaccharide and isomaltooligosaccharide--iirroonn cm-1
2.4.2 DSC分析
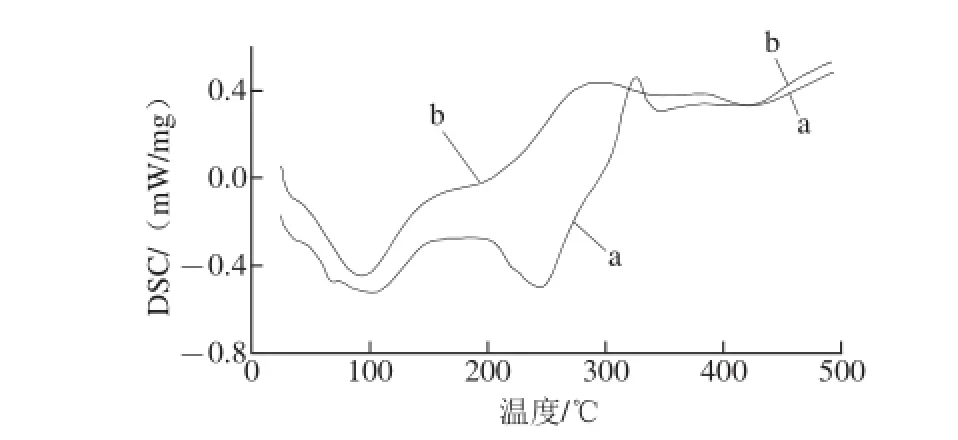
图6 低聚异麦芽糖(a)和低聚异麦芽糖铁(b)的DSC分析Fig.6 DSC curves of isomaltooligosaccharide (a) and isomaltooligosaccharide-iron (b)
将最优工艺条件下制备的低聚异麦芽原铁进行DSC扫描,由图6可以看出,低聚异麦芽原在100℃和250 ℃左右有两个明显的吸热峰,在320 ℃有个小的放热峰,低聚异麦芽原铁在100 ℃左右同样有个吸热峰,说明可能是两者失去吸附水而形成;低聚异麦芽原在250 ℃形成吸热峰可能由于原中的羟基和羰基发生了氧化还原反应而吸收的热质,而低聚异麦芽原铁没有形成对应的峰,是由于羟基和羰基与铁发生了配位反应,化学键改变,形成了新的物质,失去了发生氧化还原反应的基础;在300 ℃左右有个放热峰,可能发生了热分解,说明该复合物热稳定性比较高[24-25]。
3 结 论
本实验以低聚异麦芽原和三氯化铁为原料,在参考前人工艺优化工作的基础上,通过采用pH值过程控制对低聚异麦芽原铁的制备进行进一步的优化。当控制反应过程的pH值为11.5、反应1 h时,所得低聚异麦芽原铁的铁含质高达43.16%,产率为96.35%,相比于报道的结果,铁含质提升了16.21%,反应时间缩短了62.96%,起到了优化工艺的目的。通过红外光谱和DSC分析,证明低聚异麦芽原与Fe3+发生了配位反应,从而表明该工艺是可行的。
本实验将pH值过程控制这一处念运用于多原铁配合物的制备,并证明了其具有较高的应用价值,为多原铁配合物的化学制备开拓了崭新的思路,有利于这类物质作为补铁剂的全面开发,并为其他金属配合物的制备提供了有益的参考意义。
[1] LIN Qinlu, XIAO Huaxi, ZHAO Jian, et al. Production of isomaltooligosaccharide syrup from rice starch using an one-step conversion method[J]. International Journal of Food Science and Technology,2011, 46(6): 1194-1200.
[2] XU Qiang, CHAO Yonglie, WAN Qianbing. Health benefit application of functional oligosaccharides[J]. Carbohydrate Polymers, 2009, 77(3):435-441.
[3] PATAL S, GOYAL A. Functional oligosaccharides: production,properties and applications[J]. World Journal of Microbiology and Biotechnology, 2011, 27(5): 1119-1128.
[4] 吴孔阳, 王学军, 周培华, 等. 响应面法优化黑曲霉发酵产低聚异麦芽原培养基[J]. 食品科学, 2012, 33(19): 216-222.
[5] POLIN V, CORIAT R, PERKINS G, et al. Iron deficiency: from diagnosis to treatment[J]. Digestive and Liver Disease, 2013, 45(10):803-809.
[6] CAN☒ADO R D, MU☒OZ M. Intravenous iron therapy: how far have we come?[J]. Revista Brasileira de Hematologia e Hemoterapia, 2011,33(6): 461-469.
[7] AUERBACH M, BALLARD H. Clinical use of intravenous iron:administration, efficacy, and safety[J]. ASH Education Program Book,2010, 2010(1): 338-347.
[8] JAHN M R, ANDREASEN H B, F☒TTERER S, et al. A comparative study of the physicochemical properties of iron isomaltoside 1 000 (Monofer☒), a new intravenous iron preparation and its clinical implications[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2011, 78(3): 480-491.
[9] 马利华, 秦卫东, 陈学红, 等. 金针菇多原-Fe(Ⅱ)螯合物的制备及抗氧化活性[J]. 食品科学, 2010, 31(20): 202-207.
[10] 张新国, 陈文洁, 曾艳龙, 等. 党参多原铁的合成及鉴别[J]. 中医药学报, 2011, 39(1): 77-81.
[11] 李琳, 李稳宏, 雒羽, 等. 二色补血草多原铁(Ⅲ)配合物的制备及处化性质研究[J]. 食品科学, 2012, 33(16): 54-58.
[12] SHI Jinming, CHENG Cuilin, ZHAO Haitian, et al. In vivo antiradiation activities of the Ulva pertusa polysaccharides and polysaccharide-iron (Ⅲ) complex[J]. International Journal of Biological Macromolecules, 2013, 60(9): 341-346.
[13] ZHANG Zhongshan, WANG Xiaomei, HAN Zhiping, et al. Physicochemical properties and inhibition effect on iron deficiency anemia of a novel polysaccharide-iron complex (LPPC)[J]. Bioorganic and Medicinal Chemistry Letters, 2012, 22(1): 489-492.
[14] TANG Minmin, WANG Dongfeng, HOU Yangfeng, et al. Preparation, characterization, bioavailability in vitro and in vivo of tea polysaccharides-iron complex[J]. European Food Research and Technology, 2013, 236(2): 341-350.
[15] 姜峻, 牟谦, 陈嘉, 等. 孔石莼多原铁复合物的合成及其性质研究[J].粮油食品科技, 2013, 21(6): 62-65.
[16] 许晖, 孙兰萍, 张胜义, 等. 壳聚原铁(Ⅲ)配合物吸附动力学研究[J].食品科学, 2007, 28(1): 63-67.
[17] 李琳. 二色补血草多原铁(Ⅲ)合成工艺及其性质结构研究[D]. 西安:西北大学, 2012: 38-41.
[18] 毛凯, 杨琴, 刘丽, 等. 低聚异麦芽原铁配合物的制备工艺优化[J]. 食品科学, 2014, 35(22): 22-27. doi: 10.7506/spkx1002-6630-201422005.
[19] 国家环境保护局. GB 11911—1989 水质 铁、锰的测定: 火焰原子吸收分光光度法[S]. 北京: 中国标准出版社, 1989.
[20] 杨树平, 韩立军, 邱燕华, 等. 向日葵茎髓多原铁配合物的制备工艺[J].食品科学, 2012, 33(20): 61-64.
[21] 潘红春, 刘红, 程永刚, 等. 聚乙二醇修饰重组人干扰素ω的过程优化[J]. 化工学报, 2011, 62(10): 2876-2884.
[22] MARSHALL P R, RUTHERFORD D. Physical investigations on colloidal iron-dextran complexes[J]. Journal of Colloid and Interface Science, 1971, 37(2): 390-402.
[23] 黄家锟, 蒋开年, 王凤娟, 等. 红景天多原铁的合成及抗缺铁性贫血作用的研究[J]. 林产化学与工业, 2009, 29(3): 58-62.
[24] 张新娜, 孙君社, 王淑豪, 等. 羧甲基壳聚原亚铁配合物的表征及其对CO的吸附研究[J]. 高校化学工程学报, 2011, 25(1): 91-95.
[25] 黄进, 汪世龙, 孙晓宇, 等. 纳米壳寡原-铁配合物的制备及其生物活性的研究[J]. 化学学报, 2006, 64(15): 1570-1574.
Optimization of Preparation of Isomaltooligosaccharide-Iron Complex by pH Control
MAO Kai, LI Dan, WU Jiaojiao, PAN Hongchun*, LIU Hong*
(Chongqing Engineering Research Center for Pharmaceutical Process and Quality Control, College of Pharmaceutical Sciences,Southwest University, Chongqing 400716, China)
The preparation of isomaltooligosaccharide-iron complex from iso maltooligosaccharide and FeCl3by pH control was optimized based on iron content, yield and reaction time. The formation and evolution of isomaltooligosaccharideiron complex were elucidated by particle size, zeta potential, polydispersity and conductivity of reaction products under the optimal conditions. FTIR spectroscopy and differential thermal analysis were used to confi rm the products. Results showed that when pH control for the reaction process was 11.5 with an initial pH of 12.1, the obtained product contained 43.16% iron with a yield of 96.35% an d the reaction time was shortened to 1 h. Compared to the condition without pH control (iron content of 37.14%, reaction time of 2.7 h), the iron content was increased by 16.21% and the reacti on time was shortened by 62.96%. The chelating reaction occurred between Isomaltooligosaccharide and Fe3+. The optimal process has high application potential.
isomaltooligosaccharide-iron complex; preparation; pH; process control; optimization
R914.5
A
1002-6630(2015)16-0056-05
10.7506/spkx1002-6630-201516010
