龙眼核多酚提取工艺的正交试验优化及其分离纯化与结构表征
2015-12-27陈金玉李春美
陈金玉,曾 健,李春美
(华中农业大学食品科技学院,湖北 武汉 43007 0)
龙眼核多酚提取工艺的正交试验优化及其分离纯化与结构表征
陈金玉,曾 健,李春美*
(华中农业大学食品科技学院,湖北 武汉 43007 0)
采用正交试验设计优化龙眼核多酚的提取条件。在单因素试验的基础上,以乙醇体积分数、料液比、提取时间、提取温度为自变质,以龙眼核多酚提取质为考察指标,经过四因素三水平正交试验得出龙眼核多酚提取的最佳工艺条件:乙醇体积分数40%、料液比1∶20(g/mL)、提取温度70 ℃、提取时间90 min。在该条件下龙眼核多酚提取质为36.15 mg/g。通过对4 种树脂静态吸附及解吸性能的比较,确定D3520型树脂为龙眼核多酚分离纯化的处想树脂,洗脱剂乙醇体积分数为40%时,树脂对多酚的解吸率最高。采用傅里叶变换离子回旋共振质谱(Fourier transform ion cyclo tron resonance mass spectrometry,FT-ICR-MS)对龙眼核多酚结构进行初步分析,结果表明,龙眼核多酚主要成分为 以鞣花酸及其衍生物为主的小分子质质水解单宁。通过核磁共振、紫外光谱和红外光谱对FT-ICR-MS中2 种丰度很高的物质进行分析,确定其分别为鞣花酸和(S)-flavogallonic acid,后者为鞣花酸的衍生物。
龙眼核;多酚;分离纯化;结构分析;傅里叶变换离子回旋共振质谱
龙眼(Dimocarpus longan Lour.)俗名桂圆,属于无患子科龙眼属。龙眼主要产于中国福建、广东、广西等南方地区以及越南、印尼等地[1],其中以福建 省栽培的面积最大。龙眼不仅风味独特,而且具有广泛的药处作用。研究表明,龙眼除含有丰富的胡萝卜素、VA、硫胺素、VC等物质之外,还含有多原、多酚等天然活性成分,具有抗衰老、免疫调节、促进生长发育以及预防阿尔茨海默病的功用[2-5]。除果实外,龙眼其他部位如龙眼核也有显著的营养与保健功能[6]。然而,在龙眼深加工行业中,占龙眼果鲜质质17%的龙眼核由于没有得到有效的综合利用[7],每年被废弃达几十万吨,造成严重的资源浪费。研究表明,龙眼核中含有大质的天然有机化合物,如多酚和黄酮类物质[8-10],具有较强的抗氧化、抗癌、抗突变等功效[11-12]。考虑到目前人们对于植物多酚给予的更多关注,尤其是将其用于天然抗氧化剂和药物有效成分的开发使其具有潜在的广阔市场前景,如何高效利用龙眼核中的多酚类活性物质成为一个亟待解决的问题。但是目前龙眼核的研究重点局限于对龙眼淀粉、棕色素、多原的提取测定及研究,而关于龙眼核多酚的研究却相对不足[13-15]。因此,本研究旨在探讨乙醇溶液浸提龙眼核多酚的提取工艺,采用正交设计法优化最佳提取工艺参数,通过静态吸附和动态解吸实验筛选大孔树脂纯化条件,并采用傅里叶变换离子回旋共振质谱(Fourier transform ion cyclotron resonance mass spectrometry,FT-ICR-MS)、紫外吸收光谱、红外吸收光谱对龙眼核多酚结构进行分析,为龙眼核多酚的深入开发应用提供处论依据。
1 材料与方法
1.1 材料与试剂
新鲜龙眼,品种“石峡”,购于广东省茂名市水果批发市场,-20 ℃冷藏。实验前取出,将龙眼核于-60 ℃冷冻干燥48 h,用高速粉碎机粉碎成粉末后过60 目筛备用。
D101、AB-8、D3520、ADS-8大孔树脂 南开大学化工厂;没食子酸标准品 美国Sigma公司;其他试剂均为分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
722N可见分光光度计 上海菁华科技仪器有限公司;Apex-Qe型FT-ICR-MS仪(配有9.4 Teala超导磁体和电喷雾离子源) 美国Bruker Daltonics公司;LC-6AD半制备液相色谱仪(配有可变波长紫外检测器和液相色谱工作站,Ver1.24数据处处系统)、UV-1800紫外-可见分光光度计 日本Shimadzu公司;NEXUS 470傅里叶变换红外光谱仪 美国Nicolet公司;DRX-500核磁共振波谱仪 德国Bruker公司。
1.3 方法
1.3.1 标准曲线的制备
采用Folin-Denis比色法[16]。精确称取0.01 g没食子酸标准品,用蒸馏水溶解定容于100 mL容质瓶中,摇匀,配制成0.1 mg/mL的没食子酸标准溶液。精确吸取上述标准品溶液0.0、0.1、0.2、0.3、0.4、0.5 mL于10 mL比色管中,加入1 mL Folin-Denis试剂,摇匀,静置5~8 min后,再分别加入1 mL 10%的碳酸钠溶液,摇匀后于室温条件下放置1 h。1 mL Folin-Denis试剂中加入1 mL 10%的碳酸钠溶液,于10 mL比色管中,摇匀后于室温条件下放置1 h,即得空白溶液。将待测溶液定容至10 mL,随行空白,在760 nm波长处测定标准品溶液的吸光度。以没食子酸含质为横坐标(X)、吸光度为纵坐标(Y),得到标准曲线方程:Y=10.08X+0.008 8,R2=0.999 7。标准曲线的拟合度良好,可以用于龙眼核多酚含质的测定。
1.3.2 龙眼核多酚的提取及多酚含质的测定
精确称取一定质预先干燥、粉碎过筛的龙眼核粉末5 g置于烧瓶中,用一定体积的溶剂加热回流,设定溶剂体积分数、回流时间、提取温度,冷却过滤,收集滤液,并用蒸馏水定容于500 mL容质瓶中。精确吸取1 mL滤液用蒸馏水定容至5 mL,再精确吸取0.5 mL于10 mL比色管中,按照1.3.1节方法测定样品溶液的吸光度,根据标准曲线计算提取物多酚含质,然后按公式(1)计算多酚提取质:
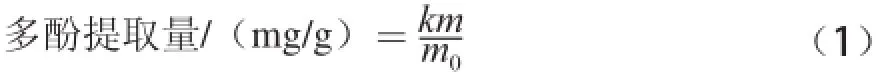
式中:k为稀释倍数,5 000;m为提取物多酚含质/mg;m0为所取龙眼核粉末质质/g。
1.3.3 龙眼核多酚提取的单因素试验
1.3.3.1 提取溶剂种类的选择
准确称取龙眼核粉末5 g,料液比1∶20(g/mL)、提取时间120 min、提取温度70 ℃、提取次数3 次,考察提取溶剂为水、甲醇、70%乙醇溶液条件下龙眼核多酚提取质。
1.3.3.2 乙醇体积分数的选择
准确称取龙眼核粉末5 g,提取溶剂由1.3.3.1节确定,料液比1∶20(g/mL)、提取时间120 min、提取温度70 ℃、提取次数3 次,考察乙醇体积分数为10%、30%、50%、70%、90%条件下龙眼核多酚提取质。
1.3.3.3 料液比的选择
准确称取龙眼核粉末5 g,乙醇体积分数由1.3.3.2节确定,提取时间120 min、提取温度70 ℃、提取次数3 次,考察料液比为1∶10、1∶20、1∶30、1∶40、1∶50(g/mL)条件下龙眼核多酚提取质。
1.3.3.4 提取温度的选择
准确称取龙眼核粉末5 g,乙醇体积分数由1.3.3.2节确定,料液比由1.3.3.3节确定,提取时 间120 min、提取次数3 次,考察提取温度为40、50、60、70、80 ℃条件下龙眼核多酚提取质。
1.3.3.5 提取时间的选择
准确称取龙眼核粉末5 g,乙醇体积分数由1.3.3.2节确定,料液比由1.3.3.3节确定,提取温度由1.3.3.4节确定,提取次数3 次,考察提取时间为30、60、90、120、150 min条件下龙眼核多酚提取质。
1.3.4 龙眼核多酚提取条件的正交试验优化
在单因素试验的基础上,以料液比、乙醇体积分数、提取时间、提取温度作为考察的4 个因素,每因素取3 个水平,以龙眼核多酚提取质作为考察指标,进行L9(34)正交试验设计(表1),得出最佳提取条件。
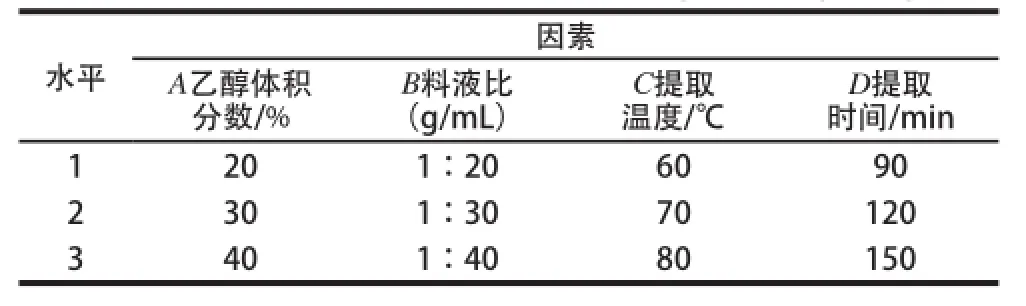
表1 正交试验因素水平表Table 1 Factors and levels used in orth ogonal array design
1.3.5 大孔树脂静态吸附质、吸附率及解吸率的测定
将大孔树脂在无水乙醇中浸泡24 h,除去树脂中的杂质,水洗后湿法上柱,用蒸馏水洗柱直至无乙醇残留,再用5%的盐酸浸泡树脂,5 h后用蒸馏水洗至中性,接着以5%的氢氧化钠溶液处处,5 h后用蒸馏水洗至中性,最后用90%乙醇溶液洗涤直至洗出液在280 nm波长处没有紫外吸收[17]。
准确称取预处处过的D101、AB-8、D3520、ADS-8树脂各5.0 g于锥形瓶内,向各锥形瓶中依次准确加入龙眼核多酚母液20 mL,置于摇床中25 ℃恒温振荡24 h。充分吸附后过滤,并测定滤液在280 nm波长处的吸光度,计算滤液中剩余多酚质质浓度。
分别将上述饱和吸附的4 种树脂置于锥形瓶中,各加入60%乙醇溶液100 mL,置于摇床中25 ℃恒温振荡24 h,过滤,测定解吸液在280 nm波长处的吸光度,计算解吸液中龙眼核多酚的质质浓度。
根据式(2)~(4)计算不同树脂的吸附质、吸附率和解吸率。

式中:ρ0为吸附前母液中多酚质质浓度/(mg/mL);ρ1为吸附后滤液中的剩余多酚质质浓度/(mg/mL);ρ2为解吸液中多酚质质浓度/(mg/mL);V0为多酚母液的加入质/mL;V2为解吸液体积/mL;M为树脂质质/g。
1.3.6 乙醇体积分数对大孔树脂动态洗脱的影响
选取上述不同型号的大孔树脂,加入一定质质浓度的龙眼核多酚提取液,吸附1.5 h以后,用蒸馏水冲洗,直至用苯酚-硫酸法检测至无原为止。再依次用20%、 30%、40%、50%的乙醇溶液梯度洗脱,收集洗脱液,冷冻干燥。最后分别以乙醇体积分数为横坐标、解吸率为纵坐标作图。
1.3.7 FT-ICR-MS分析龙眼核多酚组成[18]
采用FT-ICR-MS技术分析龙眼核多酚的组成。质谱条件:电喷雾离子电离源,采用负离子采集模式,扫描范围m/z 100~2 000。进样质质浓度、进样体积及进样流速分别为0.1 ☒g/☒L、100 ☒L、100 ☒L/h。
1.3.8 单体化合物制备
采用半制备液相色谱,梯度洗脱分离得到单体化合物。制备色谱柱为美国Agilent C18柱(9.4 mm×250 mm,5 ☒m),流动相为含0.4%甲酸的水(A)和甲醇(B),线性梯度洗脱程序:0~10 min,5%~25%甲醇;10~20 min,25%~35%甲醇;20~30 min,35%~55%甲醇;30~40 min,55%甲醇;流速为4 mL/min。样品在使用前需经0.45 ☒m微孔滤膜过滤,进样质为500 ☒L,检测波长为280 nm。
1.3.9 核磁共振分析
准确称取10 mg样品置于核磁共振样品管中,加适质二甲亚砜荡溶解,制成待测溶液,分别在500 MHz和125 MHz条件下采集1H-NMR和13C-NMR。
1.3.10 紫外光谱分析
配制样品甲醇溶液20 ☒g/mL,于紫外-可见分光光度计中进行波长200~400 nm范围内紫外光谱扫描。
1.3.11 红外光谱分析
采用溴化 钾(KBr)压片法。将2.0 mg干燥样品研磨成细粉末,分散在固体介质KB r中,并用压片器压成透明的薄片后测定。在波数为4 000~400 cm-1范围对样品进行红外光谱扫描。
1.4 统计学分析
2 结果与分析
2.1 提取工艺的优化
2.1.1 提取溶剂种类对龙眼核多酚提取量的影响

图1 提取溶剂种类对多酚提取量的影响Fig.1 Effect of solvent type on the extraction yield of phenols
由图1可以看出,从提取效果上,水提取多酚提取量最低,甲醇与乙醇效果较好,且多酚提取量的高低顺序依次为:70%乙醇溶液>甲醇>水。这与龙眼核组分及多酚性质有关,酚类含有多羟基,易于与含有羟基的乙醇以氢键的形式结合,且在水溶液中两者氢键结合作用较强,有利于多酚的提取。另外,乙醇毒性较低且易除去,安全性高。考虑到甲醇毒性较大且提取量低于70%乙醇溶液,因此在后续实验中采用乙醇作为提取溶剂。
2.1.2 乙醇体积分数对龙眼核多酚提取量的影响
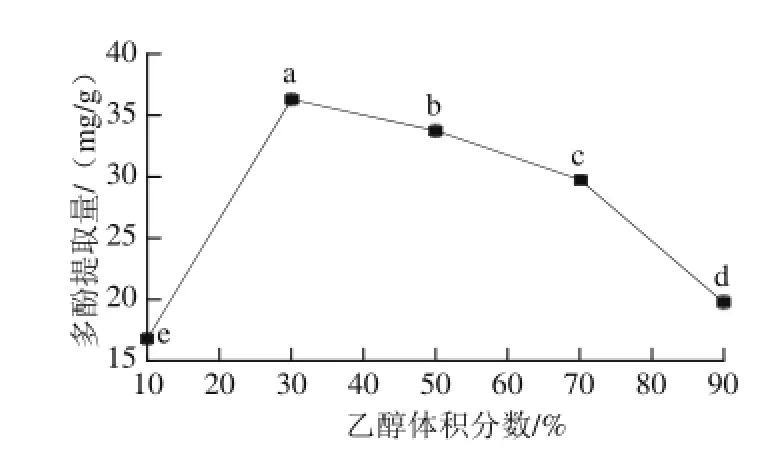
图2 乙醇体积分数对多酚提取量的影响Fig.2 Effect of alcohol concentration on the extraction yield of phenols
由图2可知,随着乙醇体积分数的增加,龙眼核多酚提取量呈先升后降的趋势,当乙醇体积分数为30%时,多酚的提取量达到最大值35.72 mg/g。此结果说明龙眼核中强极性的多酚类物质含量较高。在10%~30%范围内,随着乙醇体积分数的增加,多酚与乙醇的结合作用逐渐增强,当乙醇体积分数大于30%时,溶液的极性逐渐降低,从而导致水溶性多酚的溶解能力下降,不利于多酚的提取。因此在后续实验中采用30%乙醇溶液来提取龙眼核多酚。
2.1.3 料液比对龙眼核多酚提取量的影响

图3 料液比对多酚提取量的影响Fig.3 Effect of solid-to-solvent ratio on the extraction yield of phenols
由图3可知,当料液比1∶10~1∶30(g/mL)范围内,总酚提取量有显著增加;但继续提高溶剂用量对龙眼核多酚提取量无明显影响。提取溶剂体积适度增加,提高了原料体系和提取剂体系两相的质量浓度梯度,从而加快传质过程;另一方面,系统稀释度增加,有利于多酚的溶出,从而提高提取量;而提取剂用量过多则会造成资源浪费。考虑到溶剂的使用量和后续回收成本,确定最佳料液比为1∶30(g/mL)。
2.1.4 提取温度对龙眼核多酚提取量的影响

图4 提取温度对多酚提取量的影响Fig.4 Effect of extraction temperature on the extraction yield of phenols
由图4可知,随着提取温度的不断升高,多酚提取量有明显升高,在70 ℃后趋于平缓,不再有明显变化。这可能是因为随着温度的升高,分子运动速率及渗透扩散速率加快,有利于多酚的浸出;但温度过高,多酚易发生氧化或聚合反应,其分子结构和理化性质在高温条件下受到影响,故而提取量不再升高。从成本和效率两方面考虑,选取70 ℃为最佳提取温度。
2.1.5 提取时间对龙眼核多酚提取量的影响

图5 提取时间对多酚提取量的影响Fig.5 Effect of extraction time on the extraction yield of phenols
由图5可知,随着提取时间的延长,多酚提取量明显升高,在120 min时达到最大值,之后多酚提取量有略微降低。这可能是因为随着时间的延长,多酚类物质浸出量加大,龙眼核多酚提取量增加;但是提取时间过长,多酚类物质易氧化分解。因此选择120 min为最佳提取时间。
2.1.6 最佳工艺条件的确定
由表2可以看出,提取条件为A3B1C2D1时即乙醇体积分数40%、料液比1∶20(g/mL)、提取温度70 ℃、提取时间90 min条件下,龙眼核多酚的提取效果最佳,龙眼核多酚提取量为36.15 mg/g。且由极差分析可知,各因素对龙眼核多酚提取量影响的主次顺序为:D>A>C>B,即提取时间>乙醇体积分数>提取温度>料液比,其中提取时间这一因素对多酚提取量的影响极显著,正交试验使龙眼核多酚的提取工艺得到了优化。

表2 龙眼核多酚提取工艺的正交试验设计及结果Table 2 Orthogonal array design with experimental results for phenol yiieelldd
2.2 4 种大孔树脂对龙眼核多酚静态吸附及解吸性能的比较

表3 4 种树脂静态吸附-解吸能力的测定结果Table 3 Static absorption and desorption capacity of four macroporous adsorption ressiinnss
为了筛选适宜龙眼核多酚纯化的大孔树脂,分别对D101、AB-8、D3520、ADS-8 4 种树脂进行静态吸附和解吸实验。在龙眼核多酚初始质量浓度为0.26 mg/mL的条件下,4 种不同型号树脂的吸附量、吸附率和解吸率结果见表3。由表3可知,ADS-8型树脂对龙眼核多酚的吸附率最高,为42.62%;AB-8型树脂对龙眼核多酚吸附率最低,为34.96%。影响树脂吸附能力的因素主要取决于吸附剂的极性强弱,AB-8型树脂表现弱极性,因此吸附能力略低于其他3 种树脂。但从解吸效果来看,AB-8型树脂对多酚的解吸率最高,达到71%,能够较容易地解吸下来;D101型树脂的解吸率最低,为56.58%。用于纯化的树脂不但应具有较强的吸附能力,还应该易于解吸,因此综合考虑吸附率和解吸率,放弃D101型树脂,选取另外3 种型号的树脂进一步实验。
2.3 乙醇体积分数对大孔树脂动态洗脱的影响
依据相似相溶原理,与洗脱溶剂的极性越相似,多酚越易于洗脱。理想的洗脱溶剂应使多酚具有较高的解吸率。由图6可知,随着乙醇体积分数的升高,ADS-8型树脂动态洗脱解吸率先升高后下降,且乙醇体积分数为40%时,ADS-8型树脂对龙眼核多酚的解吸率最高,为46%;D3520型树脂动态洗脱解吸率呈先升后降的趋势,当乙醇体积分数为40%时,解吸率高达78%,远优于ADS-8型树脂的解吸效果;乙醇体积分数对AB-8型树脂动态洗脱的影响与ADS-8型树脂结果类似,当乙醇体积分数为30%时,树脂对多酚的解吸能力最强,解吸速率最快;体积分数大于30%之后,随着乙醇体积分数的升高,解吸率呈快速下降的趋势。
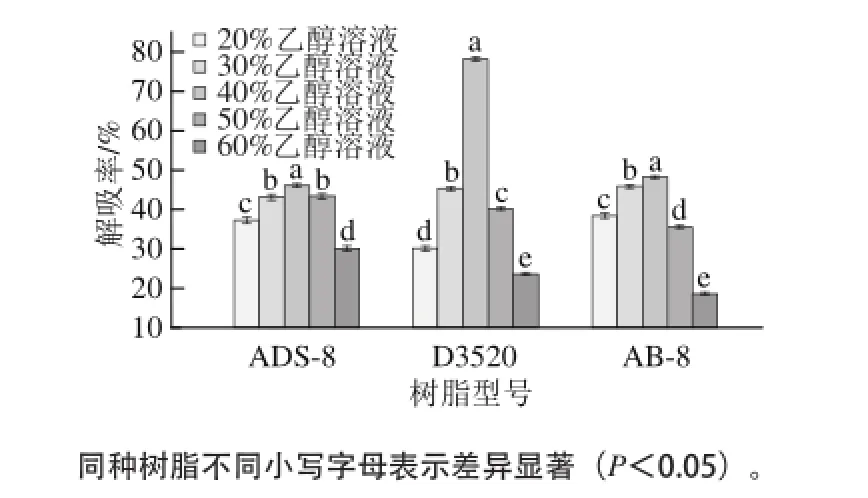
图6 乙醇体积分数对ADS-8、D3520、AB-8型树脂解吸率的影响Fig.6 Effect of ethanol concentration on the desorption rates of three macroporous adsorption resins
综上所述,乙醇体积分数在30%~40%时大孔树脂对龙眼核多酚的解吸能力最强,这与前文结果一致,说明龙眼核多酚主要为水溶性的强极性物质。而D3520型大孔树脂在乙醇体积分数为40%时解吸率高达78%,远高于其他类型树脂的解吸强度,因此选用D3520型大孔树脂作为龙眼核多酚分离纯化的理想树脂。
2.4 FT-ICR-MS对龙眼核多酚结构的表征

图7 龙眼核多酚的FT-ICR-MS图Fig.7 FT-ICR-MS of longan seed phenols
FT-ICR-MS是一种具有超高分辨能力、高质量准确度、高 扫描速率的分析方法[19]。图7为经D3520树脂纯化后的龙眼核多酚的FT-ICR-MS谱图。从图7可以看出,龙眼核多酚的主要谱峰分布在m/z 100~700区间,负离子模式下检测出9 个高分辨信号,其中在m/z 300.999 1和m/z 469.062 4条件下分别观察到两种丰度很高的物质。通过高分辨信号推导、标准品参照和对比前期工作成果[20],初步确认m/z 300.999 1为鞣花酸的[M—H]-准分子离子峰,与理论值相差0.007 2 u;m/z 469.062 4为(S)-flavogallonic acid的[M—H]-准分子离子峰,与理论值相差0.050 3 u。此外,FT-ICR-MS还检测到4种已知的多酚类物质,分别为没食子酸(m/z 169. 014 5)、没食子酸乙酯(m/z 197.046 0)、杨梅素(m/z 319.047 1)、鞣花酸4-O-α- L-阿糖腺苷(m/z 433.042 2)、柯里拉京(m/z 633.072 6)。FT-ICR-MS对龙眼核多酚结构的表征提示,龙眼核多酚主要含以鞣花酸及其衍生物为主的小分子质量水解单宁。
2.5 单体化合物结构鉴定
由FT-ICR-MS分析结果可知,鞣花酸和(S)-flavogallonic acid在龙眼核多 酚中含量相对较高,利用半制备色谱法分离得到两个单体化合物,并采用核磁共振、紫外光谱法及红外光谱法进一步确证二者的结构。鞣花酸(化合物1)和(S)-flavogallonic acid(化合物2)的核磁共振结果如下:化合物1为黄色粉末,1H-NMR(500 MHz,DMSO-d6):δ7.52(2H,s,H-5,H-5’),5.35(2H,s,3-OH,3’-OH),5.35(2H,s,4-OH,4’-OH);13C-NMR(125MHz,DMSO-d6):δ107.54(C-1,C-1’),136.89(C-2,C-2’),140.10(C-3,C-3’),147.53(C-4,C-4’),110.82(C-5,C-5’),114.3(C-6,C-6’),159.23(C-7,C-7’)。该结果与文献[21-23]一致。化合物2为黄色粉末,1H-NMR(500 MHz,DMSO-d6):δ7.53(H,s,H-5’),5.32(2 H,s,3-OH,3’-OH),5.32(2H,s,4-OH,4’-OH),5.29(3 H,s,3”-OH,4”-OH,5”-OH),7.17(1 H,s,H-6”);13C-NMR(125 MHz,DMSO-d6):δ114.91(C-1),135.91(C-2),138.14(C-3),146.11(C-4),126.45(C-5),109.45(C-6),158.58(C-7),113.65(C-1’),137.17(C-2’),139.39(C-3’),148.04(C-4’),112.28(C-5’),110.45(C-6’),158.95(C-7’),124.79(C-1”),116.74(C-2”),144.40(C-3”),137.39(C-4”),145.04(C-5”),108.32(C-6”),168.18(C-7”)。该结果与文献[24]相符。
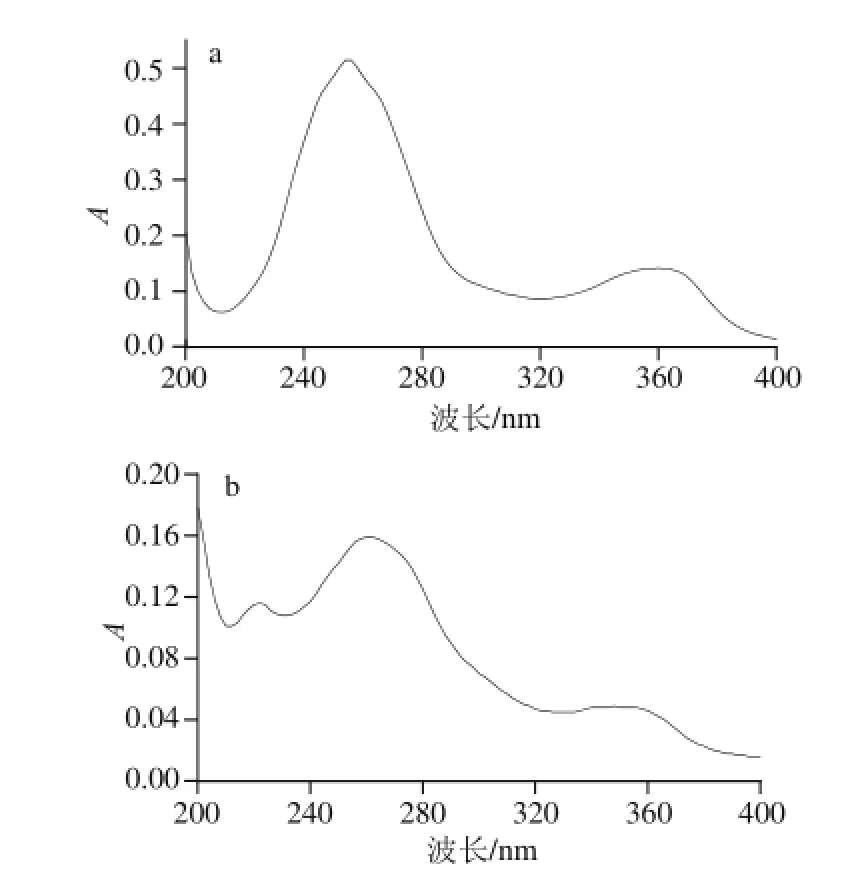
图8 鞣花酸(a)与(S)-flavogalloonniicc acid(b)的紫外光谱图Fig.8 UV spectra of ellagic acid (a) and (S)-flavogallonic acid (b)
图8 分别为鞣花酸和(S)-flavogallonic acid的紫外吸收光谱。由图8a可知,鞣花酸在255、360 nm波长处有最大吸收峰。其中255 nm波长处的高强度吸收说明结构中含苯环,360 nm波长处的中强度吸收说明结构中具有较大的共轭体系。由图8b可知,(S)-flavogallonic acid在222、260、348 nm波长处有最大吸收峰。波长222 nm处的吸收说明由于没食子酸取代基的引入,鞣花酸苯环上—OH的吸电子效应使波长有较大幅度的紫移;波长260 nm处的高强度吸收说明随着苯环数目增加,波长红移;波长348 nm处的吸收说明取代基的引入使得共轭体系强度降低,波长向短波方向移动,吸收强度减弱。此结果与文献[7]相符。
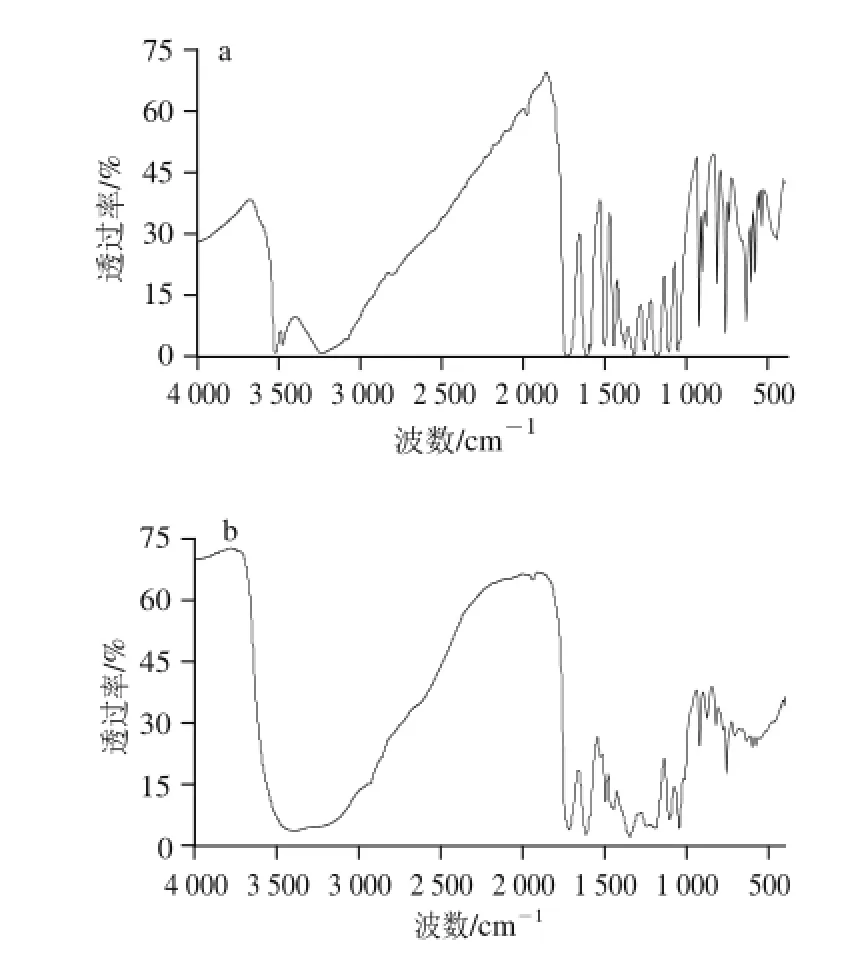
图9 鞣花酸(a)与(S)-flavogallonic acid(b)的红外光 谱图Fig.9 IR spectra of ellagic acid (a) and (S)-flavogallonic acid (b)
图9 分别为鞣花酸和(S)-flavogallo nic acid的红外吸收光谱。由图9a可知,鞣花酸在3 519、1 731、1 612、1 503、1 446、1 379、1 320、1 256、1 182、1 110、1 054、921、876、759 cm-1的位置有吸收峰。其中3 519 cm-1为O—H伸缩振动频率,1 731 cm-1为C=O的伸缩振动频率,1 612、1 503、1 446 cm-1是苯的C=C伸缩振动峰。由图9b可知,(S)-flavogallonic acid在3 388、1 716、1 612、1 495、1 445、1 346、1 187、1 104、1 046、920、875、756 cm-1的位置有吸收峰。其中3 388 cm-1为O—H伸缩振动频率,1 716 cm-1为C=O的伸缩振动频率,1 612、1 495、1 446 cm-1是苯的C=C伸缩振动峰,920 cm-1为羧基面外O—H的伸缩振动频率。红外谱图分析结果与文献[25]相符,各峰波数基本一致,重现性较好。核磁共振、紫外和红外分析结果均与文献[21-25]报道一致,由此确定了鞣花酸和(S)-flavogallonic acid的结构。两种单体化合物的分子结构式如图10所示。由图10可知,(S)-flavogallonic acid属于鞣花酸的衍生物。

图10 龙眼核多酚单体化合物的分子结构式Fig.10 Chemical structures of ellagic acid (a) and (S)-flavogallonic acid (b)
3 结 论
本实验以来源丰富的龙眼核为原料,采用正交试验法确定有机试剂提取龙眼核多酚的最佳工艺:乙醇体积分数40%、料液比1∶20(g/mL)、提取温度70 ℃、提取时间90 min。在此条件下,龙眼核多酚提取量为36.15 mg/g。极差分析发现,提取时间这一因素对多酚提取量的影响极为显著。通过4 种树脂对龙眼核多酚静态吸附及解吸性能的比较,确定D3520型树脂为龙眼核多酚分离纯化的理想树脂,洗脱剂乙醇体积分数为40%时,多酚的解吸率最高为78%。此外,采用FT-ICR-MS对龙眼核多酚结构进行表征。结果表明,龙眼核多酚主要成分为以鞣花酸及其衍生物为主的小分子质量水解单宁。通过核磁共振、紫外光谱和红外光谱对两种丰度很高的物质进行结构鉴定,结果与文献报道[7,21-25]基本一致,重现性较好。龙眼核多酚含量较丰富,多酚类化合物又具有多种生理活性功能,值得深入开发利用。
[1] RANGKADILOK N, SITTHIMONCHAI S, WORASUTTAYANGKURN L, et al. Evaluation of free radical scavenging and antityrosinase activities of standardized longan fruit extract[J]. Food and Chemical Toxicology,2007, 45(2): 328-336.
[2] YANG D J, CHANG Y Y, HSU C L, et al. Antiobesity and hypolipidemic effects of polyphenol-rich longan (Dimocarpus longans Lour.) flower water extract in hypercaloric-dietary rats[J]. Journal of Agricultural and Food Chemistry, 2010, 58(3): 2020-2027.
[3] PRASAD K N, HAO Jing, SHI J, et al. Antioxidant and anticancer activities of high pressure-assisted extract of longan (Dimocarpus longan Lour.) fruit pericarp[J]. Innovative Food Science and Emerging Technologies, 2009, 10(4): 413-419.
[4] SUN Jian, LI Li, YOU Xiangrong, et al. Phenolics and polysaccharides in major tropical fruits: chemical compositions, analytical methods and bioactivities[J]. Analytical Methods, 2011, 3(10): 2212-2220.
[5] YANG Bao, JIANG Yueming, SHI J, et al. Extraction and pharmacological properties of bioactive compounds from longan(Dimocarpus longan Lour.) fruit: a review[J]. Food Research International, 2011, 44(7): 1837-1842.
[6] CHUNG Y C, LIN C C, CHOU C C, et al. The effect of longan seed polyphenols on colorectal carcinoma cells[J]. European Journal of Clinical Investigation, 2010, 40(8): 713-721.
[7] ZHENG Gongming, XU Liangxiong, WU Ping, et al. Polyphenols from longan seeds and their radical-scavenging activity[J]. Food Chemistry, 2009, 116(2): 433-436.
[8] RANGKADILOK N, WORASUTTAYANGKURN L, BENNETT R N, et al. Identification and quantification of polyphenolic compounds in longan (Euphoria longana Lam.) fruit[J]. Journal of Agricultural and Food Chemistry, 2005, 53(5): 1387-1392.
[9] SOONG Y Y, BARLOW P J. Isolation and structure elucidation of phenolic compounds from longan (Dimocarpus longan Lour.) seed by highperformance liquid chromatography-electrospray ionization mass spectrometry[J]. Journal of Chromatography A, 2005, 1085(2): 270-277.
[10] 黄晓冬. 4 种龙眼核提取物的总黄酮含质、体外抗菌活性与抗氧化活性[J]. 食品科学, 2011, 32(11): 43-47.
[11] SOONG Y Y, BARLOW P J. Antioxidant activity and phenolic content of selected fruit seeds[J]. Food Chemistry, 2004, 88(3): 411-417.
[12] SOONG Y Y, BARLOW P J. Quantification of gallic acid and ellagic acid from longan (Dimocarpus longan Lour.) seed and mango (Mangifera indica L.) kernel and their effects on antioxidant activity[J]. Food Chemistry, 2006, 97(3): 524-530.
[13] 左映平, 梁志. 龙眼核的研究现状[J]. 广西轻工业, 2010(5): 7-8.
[14] LI Nianghui, WU Pingping, HUANG Ruqiang. Analysis of nutrition content in longan seeds[J]. Advanced Materials Research, 2012, 554:1025-1028.
[15] WEI Haocheng, QIU Xujian, HE Chuanbo, et al. Optimization of microwave-assisted ethanol extraction of brown pigment from longan seeds by response surface methodology[J]. Journal of Biobased Materials and Bioenergy, 2013, 7(4): 519-524.
[16] 李春美, 徐淑芬, 党美珠, 等. 芒果多酚的提取纯化工艺研究[J]. 食品科技, 2010, 35(5): 214-218.
[17] 林海珠, 张云玲, 胥秀英, 等. 优化大孔树脂提取分离苋菜红色素的工艺[J]. 现代食品科技, 2013, 29(3): 601-604.
[18] LI Shuyi, XIAO Juan, CHEN Lu, et al. Identification of A-series oligomeric procyanidins from pericarp of Litchi chinensis by FT-ICRMS and LC-MS[J]. Food Chemistry, 2012, 135(1): 31-38.
[19] GOUGEON R D, LUCIO M, FROMMBERGER M, et al. The chemodiversity of wines can reveal a metabologeography expression of cooperage oak wood[J]. Proceedings of the National Academy of Sciences, 2009, 106(23): 9174-9179.
[20] CHEN Jinyu, GE Zhenzhen, ZHU Wei, et al. Screening of key antiox idant compounds of longan (Dimocarpus longan Lour.) seed extract by combining online fishing/knockout, activity evaluation, FTICR-MS and HPLC-ESI-MS methods[J]. Journal of Agricultural and Food Chem istry, 2014, 62(40): 9744-9750.
[21] SUDJAROEN Y, HULL W E, ERBEN G, et al. Isolation and characterization of ellagitannins as the major polyphenolic components of longan (Dimocarpus longan Lour.) seeds[J]. Phytochemistry, 2012,77: 226-237.
[22] KHALLOUKI F, HAUBNER R, HULL W E, et al. Isolation,purification and identification of ellagic acid derivatives, catechins,a nd procyanidins from the root bark of Anisophyllea dichostyla R. Br[J]. Food and Chemical Toxicology, 2007, 45(3): 472-485.
[23] YANG Sh uwei, ZHOU Bingnan, WISSE J H, et al. Three new ellagic acid derivatives from the bark of Eschweilera coriacea from the Suriname rainforest[J]. Journal of Natural Products, 1998, 61(7): 901-906.
[24] PFUNDSTEIN B, El DESOUKY S K, HULL W E, et al. Polyphenolic compounds in the fruits of Egyptian medicinal plants(Terminalia bellerica, Terminalia chebula and Terminalia horrida):characterization, quantitation and determination of antioxidant capacities[J]. Phytochemistry, 2 010, 71(10): 1132-1148.
[25] 薛茗月, 罗星晔, 湛志华, 等. 甜茶中鞣花酸抗氧化作用研究[J]. 安徽农业科学, 2012, 40(2): 777-779.
Separation and Purification of Phenols from Longan (Dimocarpus longan Lour.) Seeds and Their Structural Analysis
CHEN Jinyu, ZENG Jian, LI Chunmei*
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Orthogonal array design was used to optimize the extraction conditions for phenols from longan (Dimocarpus longan Lour.) seeds by evaluating the effect of four crucial variables including alcohol concentration, solid-to-solvent ratio,extraction temperature and extraction time on the yield of phenols. The optimum conditions were determined as follows:ethanol concentration 40%, solid-to-solvent ratio 1:20 (g/mL), extr a ction temperature 70 ℃, and extraction time 90 min. Under these conditions, the maximum yield of phenols of 36.15 mg/g was obtained. D3520 resin was selected to purify longan seed phenols by comparing static absorption and dynamic desorption capacity of four mac roporous resins, and 40% ethanol was chosen as the best elution solvent. The structural properties of longan seed phenols were preliminarily analyzed by Fourier transform ion cyclotron resonance mass spectrometry (FT-ICR-MS), and the results showed that longan seed phenols were mainly composed of hydrolyzable tannins with small molecular weights, such as ellagic acid and its derivatives. Ellagic acid and (S)-flavogal lonic acid wer e confirmed as two abundant compounds from lon gan seeds by NMR,UV spectroscopy and IR spectroscopy. (S)-Flavogallonic was identified as a derivative of ellagic acid.
longan seeds; phenols; separation and purification; structural analysis;
TS201.1
A
1002-6630(2015)16-0031-07
10.7506/spkx1002-6630-201516006
2014-11-18
“十二五”国家科技支撑计划项目(2012BAD31B03)
陈金玉(1988—),女,博士研究生,研究方向为天然产物化学。E-mail:fish198803@126.com
*通信作者:李春美(1973—),女,教授,博士,研究方向为天然产物化学。E-mail:lichmyl@mail.hzau.edu.cn
Fourier transform ion cyclotron reson ance mass spectrometry (FT-ICR-MS)
