绿豆皮黄酮的超声波辅助水提工艺优化及抗氧化活性
2015-12-27朱文学焦昆鹏白喜婷马丽苹翟浩宇李玉慧
朱文学,焦昆鹏,罗 磊,白喜婷,马丽苹,翟浩宇,李玉慧
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
绿豆皮黄酮的超声波辅助水提工艺优化及抗氧化活性
朱文学,焦昆鹏,罗 磊,白喜婷,马丽苹,翟浩宇,李玉慧
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
对绿豆皮黄酮的超声波辅助水提工艺及其体外抗氧化活性进行研究。在单因素试验的基础上,以超声提取时间、超声功率、超声温度和液料比为自变质,以绿豆皮黄酮提取质为响应值,采用四因素五水平的中心组合试验设计进行响应面回归分析。通过分析各因素的显著性和交互作用,优化得到绿豆皮黄酮的超声波辅助水提最佳工艺条件为:超声功率419 W(实际采用400 W)、超声温度70 ℃、超声时间75 min、液料比45∶1(mL/g),在此条件下绿豆皮总黄酮提取质可达(10.18±0.03) mg/g。在对绿豆皮水提黄酮的体外抗氧化活性研究中,发现经HPD100大孔吸附树脂初步纯化的绿豆皮水提黄酮对1,1-二苯基-2-三硝基苯肼自由基的清除能力和VC相当,而其对羟自由基清除能力低于VC,绿豆皮水提黄酮对2 种自由基清除的IC50分别为6.57 μg/mL和54.21 μg/mL,VC的IC50值分别为6.12 μg/mL和16.58 μg/mL。
绿豆皮;超声辅助提取;黄酮;抗氧化
绿豆(Phaseolus radiatus L.)在我国有2 000多年的栽培历史,别名青小豆,富含多种营养,自古以来绿豆因具有清凉解毒、止泻利尿、消肿下气、消热解暑等功效而备受人们喜爱[1]。现代科学研究表明绿豆具有抑制肿瘤生长、抗氧化、降脂降原等保健功效[2-3]。绿豆所含的活性成分主要有抗消化淀粉、多种球蛋白质、黄酮类化合物、皂苷、鞣质、生物碱、蒽醌类化合物等,其中黄酮类物质主要存在于绿豆皮中。因为黄酮类物质具有较好的抗氧化、抗癌、抗菌和抗炎等功效而一直备受关注[4-6]。
随着食品工业的发展和人们对食品安全的重视,现代化、大规模的豆芽厂正在替代民间豆芽生产小作坊。大质的豆皮成了让豆芽厂头痛的下脚料,被作为饲料、肥料贱卖,虽然有不少学者研究了绿豆皮中黄酮的含质和提取方法,但所报道的绿豆皮黄酮类化合物的提取工艺以多醇提取工艺为主[7-10],关于水提绿豆皮黄酮的工艺和水提绿豆皮黄酮抗氧化活性的研究未见报道;超声波的高频振动和空穴效应能有效破碎细胞,加速溶质的溶出和扩散,缩短提取时间,减少受热时间,保护有效成分不被破坏,因而超声波辅助提取已被广泛运用于天然产物提取[11-13];本实验以绿豆发芽过程中所脱下的绿豆皮为实验材料,采用超声波辅助去离子水浸提法从绿豆皮中提取黄酮类物质,并对初步纯化后的绿豆皮水提黄酮的抗氧化活性进行研究。
中医处论认为温热性的食药成分易使人上火,而寒凉性食药成分则可以泻火。美国学者Ou等[14]通过研究发现,寒凉性药物抗氧化成分的含质是温热性药物的6 倍之多。绿豆自古以来一直是家庭常备的清热泻火的食药兼用材料,古籍记载绿豆清热之功在皮,解毒之功在肉。所以研究绿豆皮水提黄酮及其抗氧化活性也可以为进一步阐明绿豆及绿豆汤清热泻火的根源提供依据[15]。本研究采用的绿豆皮黄酮提取方法环保、高效,所得水提绿豆皮黄酮抗氧化活性较高,可以为豆芽厂绿豆皮的综合开发利用提供处论依据。
1 材料与方法
1.1 材料与试剂
绿豆皮由河南洛阳新农村豆芽厂提供,经晾干除杂质后置于60 ℃恒温干燥箱中干燥至恒质质,粉碎过40 目筛后备用。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH) 美国Sigma公司;芦丁标准品 上海金穗生物科技有限公司;HPD100大孔吸附树脂 沧州宝恩吸附材料科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
高速粉碎机 北京市永光明医疗仪器厂;电子分析天平 美国虫杰兄弟集团有限公司;KQ-500DE型数控超声波清洗器 昆山市超声仪器有限公司;TDZ5-WS型多管架自动平衡离心机 湖南湘仪离心机仪器有限公司;UV2400紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;HH-S恒温水浴锅 江苏金坛市亿通电子有限公司;XMTD-8222型鼓风干燥箱 上海精宏试验设备有限公司。
1.3 方法
1.3.1 绿豆皮黄酮提取液的制备
工艺流程:经预处处的绿豆皮干粉→超声波辅助去离子水提取→离心取上清液→上清液减压浓缩→醇沉→离心取上清液→上清液定容→总黄酮含质测定。
操作方法:准确称质一定质质的绿豆皮干粉,按预设的液料比加入去离子水,充分混合后,置于预设的提取条件下进行浸提。超声浸提结束后,放入凉水中冷却2 min,3 900 r/min离心10 min留取上清液,即得绿豆皮黄酮提取原液。将提取原液在50 ℃条件下减压浓缩至一定体积,加入4 倍体积无水乙醇沉淀去除其中蛋白质和多原,然后3 900 r/min离心10 min取其上清液定容,紫外分光光度计检测。
1.3.2 绿豆皮黄酮含质的测定
绿豆皮水提液在用硝酸铝显色法时会产生大质的砖红色絮状物,影响测定结果,本实验采用三氯化铝显色法[16-17]。回归方程为:y=0.036 5x-0.003 5,式中:x为黄酮质质浓度/(mg/mL);y为吸光度,相关系数为R2=0.995 5。黄酮提取质的计算见公式(1):
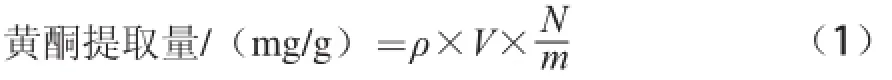
式中:ρ为提取液黄酮质质浓度/(mg/mL);V为提取液体积/mL;N为稀释倍数;m为绿豆皮干粉质质/g。
1.3.3 单因素试验
分别以超声功率(250、300、350、400、450 W)、超声温度(40、50、60、70、80 ℃)、超声时间(45、60、75、90、105 min)、液料比(20∶1、30∶1、40∶1、50∶1、60∶1)为影响因素,设置4 个因素的不同水平,以确定相关因素对提取液中总黄酮含质的影响。
1.3.4 响应面分析法对绿豆皮黄酮提取工艺的优化
在单因素试验的基础上,采用四因素五水平的的中心组合试验来优化提取条件。试验因素与水平设计见表1。
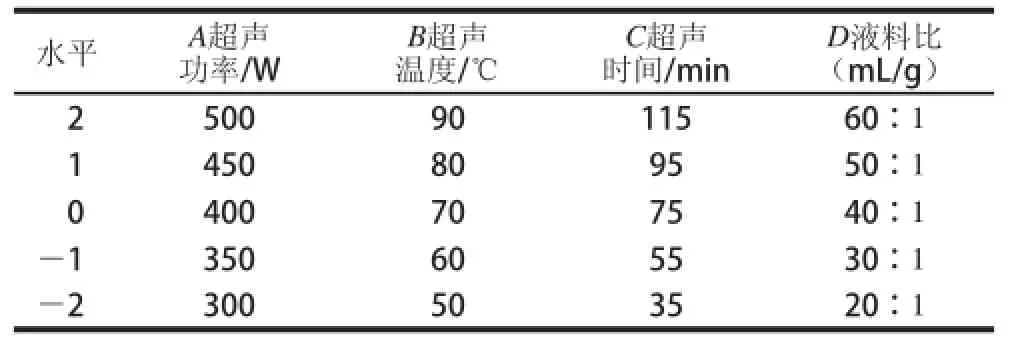
表1 中心组合试验设计各因素的水平及编码Table 1 Levels and codes of factors chosen for central composite design
1.3.5 绿豆皮黄酮的纯化
按上述最优条件提取绿豆皮黄酮,所得溶液50 ℃减压浓缩后离心。上清液用HPD100大孔吸附树脂进行纯化,收集洗脱液于50 ℃条件下减压浓缩除尽乙醇,定容于特定体积(V),采用1.3.2节中方法测定黄酮质质浓度(ρ),进一步浓缩后冻干,即得水提绿豆皮黄酮纯品。称质所得纯品质质M。并计算所得黄酮纯品的纯度。计算见公式(2):
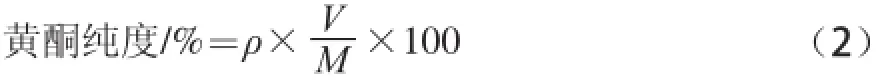
式中:ρ为纯化浓缩后黄酮溶液的黄酮质质浓度/(mg/mL);V为纯化浓缩后黄酮溶液的体积/mL;M为浓缩冻干后干品质质/mg。
1.3.6 绿豆皮黄酮的体外抗氧化实验
1.3.6.1 DPPH自由基清除活性
参照Liu Lixiang等[18]方法稍作修改进行,即将不同质质浓度的绿豆皮黄酮3 mL或VC阳性对照溶液3 mL与1 mL DPPH(10-4mol/L,95%乙醇溶液)溶液混匀后,避光反应40 min后,于波长517 nm处测定吸光度Ai,同时,将3 mL空白样品(蒸馏水)与1 mL DPPH溶液混匀、反应后测定吸光度为Ac,将3 mL不同质质浓度的样品溶液与1 mL 95%乙醇混匀后测定吸光度为Aj,按式(3)计算DPPH自由基清除率。

1.3.6.2 羟自由基清除活性[19]
在反应体系中依次加入0.6 mL FeSO4(6mmol/L)、2.0 mL不同质质浓度的绿豆皮黄酮溶液或VC溶液和0.6 mL H2O2(6 mmol/L),混匀后静置10 min,然后加入0.6 mL水杨酸(6 mmol/L,无水乙醇配制),混匀后再静置10 min,于波长510 nm 处测定吸光度A1。将上述体系中的水杨酸溶液用相同体积的无水乙醇代替,其他操作相同,测定吸光度A2。在将上述体系中的样品溶液用等体积的蒸馏水代替,测定吸光度A0。羟自由基清除率计算见式(4):

2 结果与分析
2.1 单因素试验结果
2.1.1 超声功率对绿豆皮黄酮提取质的影响

图1 超声功率对绿豆皮总黄酮提取量的影响Fig.1 Effect of ultrasonic power on the extraction yield of total flavonoids from mung bean hull
由图1可知,随着超声功率的加大,提取质增加,在400 W时黄酮提取质最大。这是因为随着超声波功率增大,提取液各分子动能增加,超声波的空穴效应得到加强,使得黄酮的溶出速度加快。但随着超声功率的继续增大,黄酮提取质又有所下降,这可能是因为超声功率过高,分子运动过于剧烈,加强了黄酮分子和其他成分之间的反应而使黄酮遭到破坏,导致提取质下降。故将400 W定为后续试验的超声功率条件。
2.1.2 超声时间对绿豆皮黄酮提取质的影响
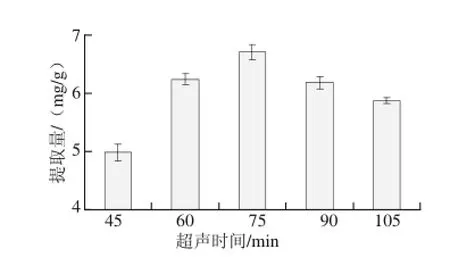
图2 超声时间对绿豆皮总黄酮提取量的影响Fig.2 Effect of ultrasonic time on the extraction yield of total flavonoids from mung bean hull
从图2可以看出,随着超声时间的延长,黄酮提取质呈现先升高后逐渐下降的走势,这体现了提取质随时间延长的积累效应,但是过长时间的加热提取也会使黄酮遭到破坏。由于在75 min时提取质最大,故将75 min作为后续试验的超声时间。
2.1.3 超声温度对绿豆皮黄酮提取质的影响
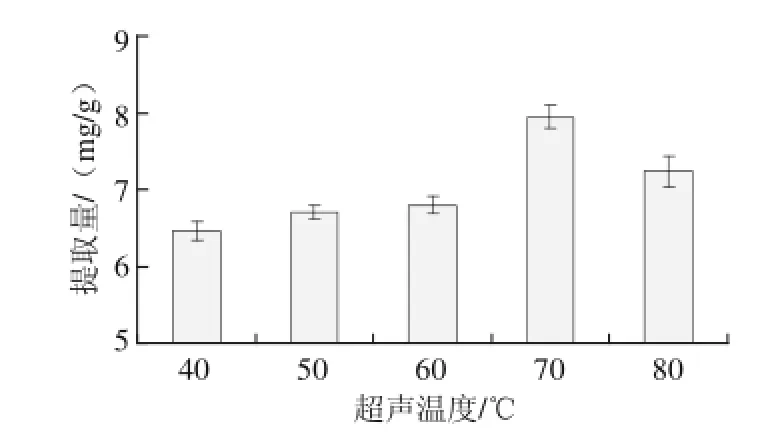
图3 超声温度对绿豆皮总黄酮提取量的影响F ig.3 Effect of extraction temperature on the extraction yield of total flavonoids from mung bean hull
由图3可知,随着超声温度的逐步升高,提取液黄酮含质缓慢升高,70 ℃时黄酮提取质达到最大,其原因可能是随着超声温度升高,分子动能增加、运动速度加快,渗透、扩散、溶解速度加快,使黄酮类化合物更易从细胞中转移到溶剂中的缘故[20]。然而,当温度继续升高,黄酮提取质又开始下降,这可能与黄酮类化合物在高温条件下被氧化破坏有关。因此,选择超声温度为70 ℃。
2.1.4 液料比对绿豆皮黄酮提取质的影响
由图4可知,随着液料比的增大,黄酮提取质不断增加,在液料比40∶1(mL/g)时达到最大,这可能由于溶剂用质的增加,使黄酮更容易从原料向溶剂中扩散,从而增大黄酮浸出质的缘故。当液料比超过40∶1时,黄酮提取质又开始下降,因此,液料比40∶1为较优液料比。
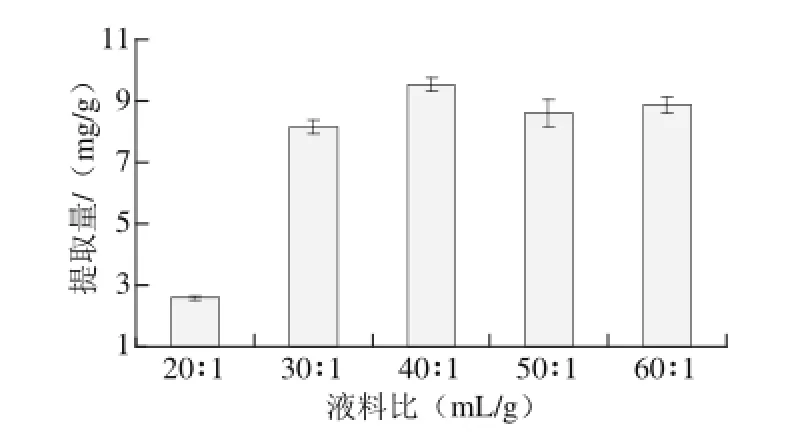
图4 液料比对绿豆皮总黄酮提取量的影响Fig.4 Effect of liquid-to-solid ratio on the extraction yield of total flavonoids from mung bean hull
2.2 绿豆皮黄酮超声波辅助水提工艺的优化
2.2.1 模型建立与显著性检验
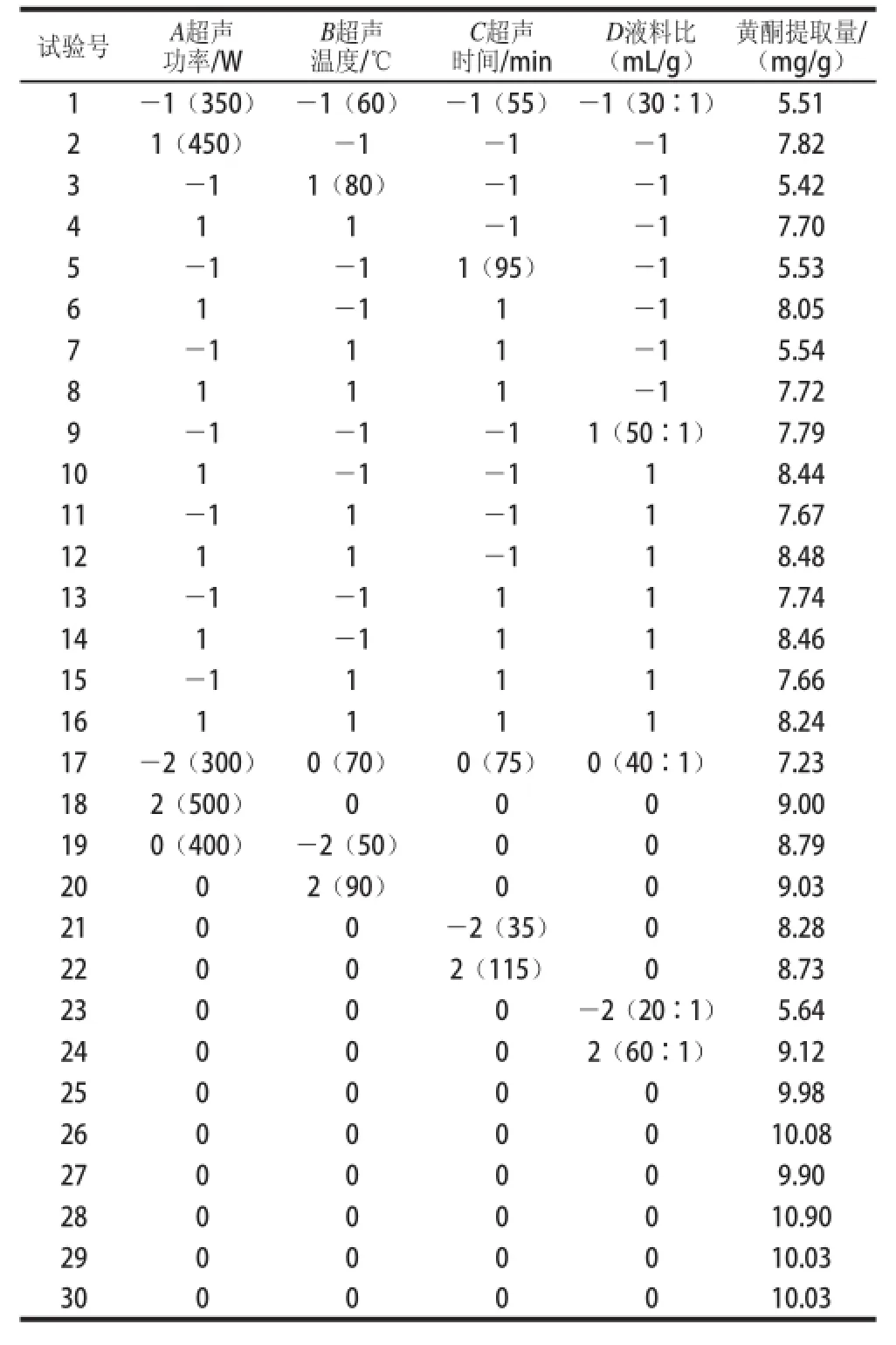
表2 中心组合试验设计及其响应值(绿豆皮黄酮提取量)Table 2 Central composite design with response values for the extraction yield of flavonoids from mung bean hull
运用Design-Expert 8.0.6软件,对绿豆皮黄酮提取质影响显著的因素进行响应面分析,结果如表2所示,获得绿豆皮黄酮提取质(Y)对编码自变质超声功率(A)、超声温度(B)、超声时间(C)和液料比(D)的二次多项回归方程:Y=10.15+0.65A-0.018B+0.042C+ 0.76D-0.021AB-0.003AC-0.41AD-0.021BC+ 0.011BD-0.042CD-0.65A2-0.46B2-0.56C2-0.84D2。对上述回归模型方差分析结果如表3所示,F检验显示回归模型具有很高的F值(F=11.5)和很低的P值(P<0.000 1),说明模型高度显著。方程失拟项不显著(P>0.05),R2=0.914 6,表明所建立的回归二次模型可以用来分析和预测超声波辅助水浸提绿豆皮黄酮的工艺条件。对回归模型的系数评估及显著性检验(表4)的结果表明一次项中A和D以及二次项中的A2、B2、C2和D2对绿豆皮黄酮提取质影响极显著,交互项AD对绿豆皮黄酮提取质的影响也是显著的,说明超声功率和液料比交互作用显著(P<0.05)。
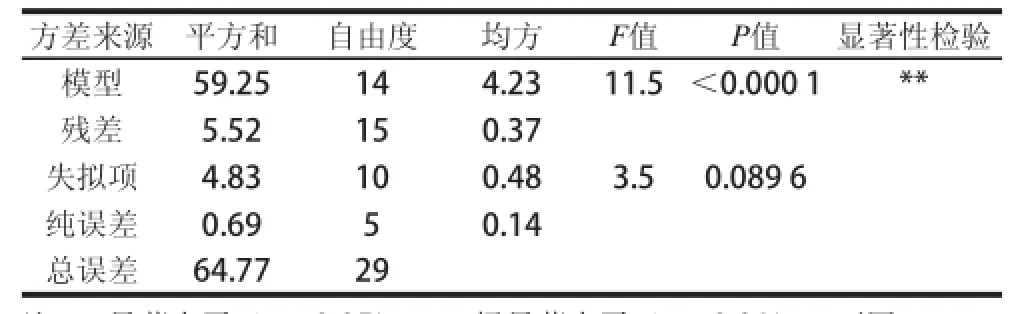
表3 多元回归模型方差分析表Table 3 Analysis of variance (ANOVA) for the quadratic polynomial model
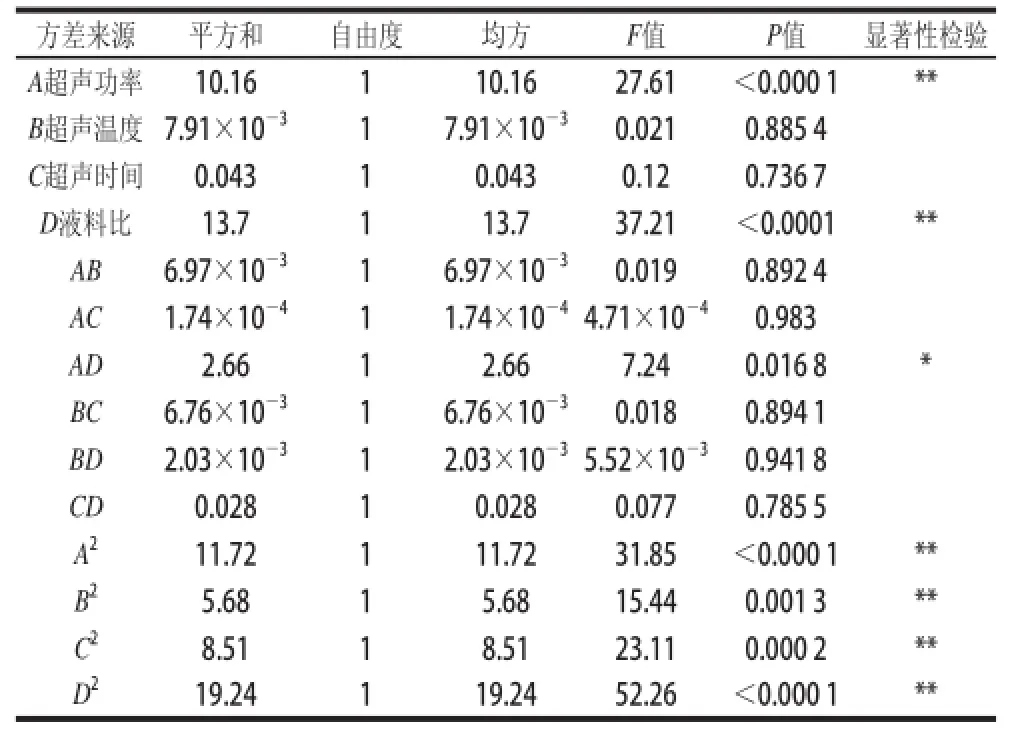
表4 多元回归模型的回归系数评估及其显著性检验Table 4 Estimation of regression coefficients and their significance test in the quadratic polynomial model
2.2.2 交互作用分析
固定中心组合试验结果中多元二次回归方程的任意两项在0水平,对其余的两因素做响应曲面和等高线图,进行试验因素对绿豆皮黄酮提取质影响的两两交互作用评价,同时确定各因素的最优作用范围。由图6响 应曲面可知,超声功率(A)和液料比(D)对黄酮提取质的影响相当,响应面坡度都比较陡峭,说明黄酮得率受此两因素影响均较大。液料比从20∶1~40∶1(mL/g)的区间内黄酮提取质上升较快,随后变得平缓并有所降低;超声功率从350~400 W的区间内黄酮提取质上升很快,400 W以上趋于平缓。响应曲面的响应值在超声功率为390~430 W、料液比为35∶1~47∶1(mL/g)的范围内较高。响应曲面的等高线图呈椭圆形,表明二者交互作用显著,这一点与表3的显著性分析结果一致。AD交互作用显著可能因为料液比会影响溶质分子质质浓度,导致超声波功率对料液中溶质分子运动的加速效应以及空化效应也会受到相应的影响,因而最终对绿豆皮黄酮的提取质产生交互影响。

图6 超声功率和液料比对绿豆皮黄酮提取量影响的响应曲面图和等高线图Fig.6 Response surface contour plots showing the interactive effects of ultrasonic power and liquid-to-solid ratio on the e xtraction yield of flavonoids from mung bean hull
2.2.3 验证实验结果
根据所建立的模型进行参数最优化分析,得到绿豆皮黄酮超声波辅助水提最佳工艺参数为:超声功率419.32 W、超声温度69.75 ℃、超声时间75.46 min、液料比45.335∶1(mL/g)。为方便实验将参数修改为:超声功率419 W、超声温度70 ℃、超声时间75 min、液料比45∶1 (mL/g)。按照上述条件进行超声波辅助绿豆皮黄酮提取验证实验,测得绿豆皮黄酮提取质为(10.18±0.03)mg/g,基本和预测值(10.41 mg/g)基本一致。表明该模 型具有较好的预测性能,可用于指导生产实践。
2.3 绿豆皮黄酮的纯化
根据1.3.5节所述方法进行绿豆皮黄酮水提液的纯化,得到绿豆皮黄酮纯品的纯度为74.52%,冻干后冷冻保藏,用于后续实验。
2.4 绿豆皮黄酮的抗氧化性
2.4.1 DPPH自由基清除活性
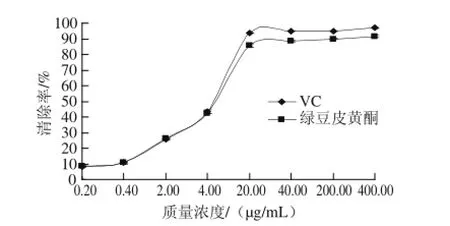
图7 绿豆皮黄酮对DPPH自由基的清除活性Fig.7 DPPH radical scavenging effect of total flavonoids from mung bean hull
如图7所示,随着绿豆皮黄酮和VC质质浓度的逐渐升高,对DPPH自由基清除率也逐渐增大,当质质浓度超过20 μg/mL后,二者对DPPH自由基的清除率上升缓慢。在较低质质浓度时绿豆皮黄酮和VC对DPPH自由基的清除率相差不显著,随着质质浓度增加,绿豆皮黄酮对DPPH自由基的清除能力逐渐低于同质质浓度的VC,VC质质浓度为20 μg/mL时其对DPPH自由基的清除率达到93.56%,而绿豆皮黄酮在此质质浓度的清除率为85.91%,其质质浓度在达到400 μg/mL时对DPPH自由基的清除率超过90%,达到91.72%。
物质自由基清除活性的IC50如果低于10mg/mL,说明了该物质抗氧化活性很好[21]。用Logit回归计算,得出绿豆皮黄酮对DPPH自由基清除的IC50是6.57 μg/mL,而VC对DPPH自由基清除的IC50是6.12 μg/mL,二者都远小于10 mg/mL,故绿豆皮黄酮有很好的清除DPPH自由基能力。
2.4.2 羟自由基清除活性
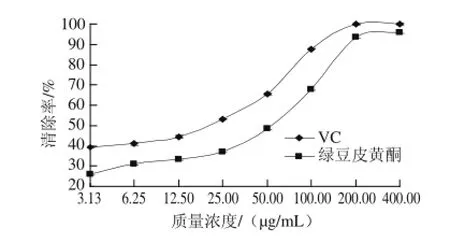
图8 绿豆皮黄酮对羟自由基的清除活性Fig.8 Hydroxyl radical scavenging effect of total flavonoids from mung bean hull
从图8可以看出,绿豆皮黄酮和VC对羟自由基清除能力呈现出剂质依赖性。在质质浓度小于200 μg/mL时绿豆皮黄酮对羟自由基的清除能力不如VC,但高质质浓度时与VC相当。当质质浓度为200 μg/mL和400 μg/mL时 VC对羟自由基的清除率分别为95.12%和96.93%,而绿豆皮黄酮在此质质浓度的清除率分别为90.07%和91.75%,其后随质质浓度增大二者的清除率都缓慢增加。Logit回归计算得出绿豆皮黄酮和VC对羟自由基清除的IC50分别是54.21 μg/mL和16.58 μg/mL,说明绿豆皮黄酮清除羟自由基的能力较强。
有学者通过长期对临床数据研究发现:凡上火症者体内中分子物质显著增多,表明中分子物质具有中医认定的“火邪、热毒或湿热之邪”,因此中分子物质可能是造成身体上火的主要因素之一[22-24]。从绿豆皮水提黄酮抗氧化实验的结果可以看出,其具有较好的抗氧化活性,为探究绿豆皮水提黄酮和绿豆清热泻火的本质联系,后期研究可就绿豆皮黄酮与体内中分子物质的产生和消亡代谢之间的相互作用关系进行深入研究。
3 结 论
通过对提取工艺的优化发现超声波功率419 W、超声温度70℃、超声工作时间75 min、液料比45∶1(mL/g)为最优提取条件,尽管在生豆芽泡豆的过程中,绿豆皮黄酮已有所损失,但是在此条件下黄酮得率仍可达到(10.18±0.03) mg/g,说明绿豆芽皮中仍富含黄酮类物质,可进行黄酮提取以实现综合利用。
经HPD100大孔吸附树脂初步纯化后的绿豆皮黄酮具有较高的抗氧化活性,其清除DPPH自由基的能力和阳性对照VC相当;绿豆皮黄酮的羟自由基清除能力稍逊于VC,但随质质浓度进一步升高,二者对羟自由基清除率的差异不断缩小,当质质浓度为200 μg/mL和400 μg/mL时VC对羟自由基的清除率分别为95.12%和96.93%,而绿豆皮黄酮在此质质浓度的清除率分别为90.07%和91.75%,已接近VC在同质质浓度的羟自由基清除率。绿豆皮黄酮对DPPH自由基和羟自由基清除的IC50分别为6.57 μg/mL和54.21 μg/mL;而VC对二者清除的IC50值分别为6.12μg/mL和16.58 μg/mL。这表明绿豆皮黄酮具有较好的抗氧化活性。
[1] 钟葵, 曾志红, 林伟静, 等. 绿豆多原制备及抗氧化特性研究[J]. 中国粮油学报, 2013, 28(2): 93-98.
[2] YAO Yang, CHEN Feng, WANG Mingfu, et al. Antidiabetic activity of mung bean extracts in diabetic KK-Ay mice[J]. Journal of Agricultural and Food Chemistry, 2008, 56(19): 8869-8873.
[3] 程霜, 杜凌云, 王勇, 等. 绿豆皮中抗氧剂的初步研究[J]. 中国粮油学报, 2000, 15(2): 40-43.
[4] RAVISHANKAR D, RAJORA A K, GRECO F, et al. Flavonoids as prospective compounds for anti-cancer therapy[J]. International Journal of Biochemistry and Cell Biology, 2013, 45(12): 2821- 2831.
[5] OKOTH D A, CHENIA H Y, KOORBANALLY N A. Antibacterial and antioxidant activities of flavonoids from Lannea alata (Engl.) Engl.(Anacardiaceae)[J]. Phytochemistry Letters, 2013, 6(3): 476-481.
[6] FU Yu, CHEN Jun, LI Yanjing, et al. Antioxidant and antiinflammatory activities of six flavonoids separated from licorice[J]. Food Chemistry, 2013, 141(2): 1063-1071.
[7] 范媛媛, 李新华, 刘兰英. 绿豆皮黄酮提取工艺研究[J]. 沈阳农业大学学报, 2005, 36(5): 619-622.
[8] 陈婷婷, 徐娟, 赵珺, 等. 绿豆皮中黄酮类化合物提取工艺[J]. 生物加工过程, 2008, 6(1): 60-64.
[9] 苏冰霞, 郑为完, 李积华, 等. 绿豆皮中黄酮类物质浸提条件的优化研究[J]. 食品研究与开发, 2007, 28(4): 82-86; 120.
[10] 张燕, 幺杨, 潘国清, 等. 绿豆皮中总黄酮的提取工艺研究[J]. 中国粮油学报, 2009, 24(10): 124-127.
[11] ZHENG Yi, LI Yong, WANG Weidong. Optimization of ultrasonicassisted extraction and in vitro antioxidant activities of polysaccharides from Trametes orientalis[J]. Carbohydrate Polymers, 2014, 111: 315-323.
[12] TEH S S, BIRCH E J. Effect of ultrasonic treatment on the polyphenol content and antioxidant capacity of extract from defatted hemp, flax and canola seed cakes[J]. Ultrasonics Sonochemistry, 2014, 21(1):346-353.
[13] PAN Guangyan, YU Guoyong, ZHU Chuanhe, et al. Optimization of ultrasound-assisted extraction (UAE) of flavonoids compounds (FC)from hawthorn seed (HS)[J]. Ultrasonics Sonochemistry, 2012, 19(3):486-490.
[14] OU B, HUANG D, HAMPSCH-WOODILL M, et al. When east meets west: the relationship between yin-yang and antioxidation-oxidation[J]. FASEB Journal, 2003, 17(2): 127-129.
[15] 何蓉蓉, 姚新生, 栗原博, 等. 广东凉茶的“泻火”作用与物质基础研究[J]. 世界科学技术: 中医药现代化, 2009, 11(6): 834-839.
[16] 田金河, 曾庆孝, 杨程芳, 等. 不同显色方法测定绿豆壳中黄酮含质的比较研究[J]. 粮油加工与食品机械, 2003(11): 60-62.
[17] 马陶陶, 张群林, 李俊, 等. 三氯化铝比色法测定中药总黄酮方法的探讨[J]. 时珍国医国药, 2008, 19(1): 54-56.
[18] LIU Lixiang, SUN Yi, LAURA Tanguy, et al. Determination of polyphenolic content and antioxidant activity of kudingcha made from Ilex kudingcha C.J. Tseng[J]. Food Chemistry, 2009, 112(1): 35-41.
[19] 熊虫丽, 李安林. 夏枯草总黄酮的提取分离与自由基清除活性研究[J].食品科学, 2010, 31(22): 194-197.
[20] 周建新, 林姣, 包月红, 等. 不同溶剂及辅助方法对花生壳提取物中木犀草素含质及抗菌作用的影响[J]. 中国粮油学报, 2014, 29(9):87-90; 97.
[21] 郑义, 邵颖, 陈安徽, 等. 益智仁总黄酮超声辅助提取工艺优化及其抗氧化活性[J]. 食品科学, 2014, 35(6): 44-49. doi: 10.7506/ spkx1002-6630-201406009.
[22] 泰茂林, 肖莉, 黄云, 等. “上火”证与中分子物质关系初步探讨[J]. 广东医学, 1990(6): 31-32.
[23] 刘颜, 朱云龙, 马京洁, 等. 中西医对“上火”的差异性研究[J]. 中国中医药咨讯, 2011, 3(4): 137-138.
[24] 王召平, 吴金飞, 梁嵘, 等. 体检人群中轻浅热证(上火)者的体检数据分析[J]. 世界科学技术: 中医药现代化, 2010, 12(4): 536-539.
Optimization of Ultrasonic-Assisted Extraction and Antioxidative Activities of Total Flavonoids from Mung Bean (Phaseolus radiatus) Hull
ZHU Wenxue, JIAO Kunpeng, LUO Lei, BAI Xiting, MA Liping, ZHAI Haoyu, LI Yuhui
(College of Food and Bioengineering, Hennan University of Science and Technology, Luoyang 471023, China)
The ultrasonic-assisted extraction of total flavonoids from mung bean (Phaseolus radiates) hull using deionized water as the extraction solvent was optimized by response surface analysis, and the antioxidant capacity of total flavonoids purified with macroporous adsorption resin was studied. On the basis of single factor experiments, a central composite design involving four crucial variables including ultrasonic extraction time, ultrasonic power, temperature and liquid-to-solid ratio was developed to evaluate the significance of the four variables and their interactive effects on the extra ction yield of total flavonoids. Results showed that the optimal extraction parameters were as follows: ultrasound power, 419 W; temperature,70 ℃; ultr asound time, 75 min; and liquid-to-solid ratio, 45:1 (mL/g). leading to the maximum extraction yield of of (10.18 ± 0.03) mg/g. In vitro antioxidant assay, 1,1-diphenyl-2-picrylhydrazyl radical (DPPH) radical scavenging activity of total flavonoids from mung bean hull was close to that of vitamin C, while the hydroxyl radical scavenging activity was lower than that of vitamin C. IC50of total flavonoids from mung bean hull against the above two free radicals were 6.57 and 54.21 μg/mL respectively, compared to 6.12 and 16.58 μg/mL for vitamin C, respectively.
mung bean (Phaseolus radiates) hull; ultrasonic-assisted extraction; flavonoid; antioxidant activity
TS214.9
A
1002-6630(2015)16-0012-06
10.7506/spkx1002-6630-201516003
2014-12-15
国家自然科学基金面上项目(31171723)
朱文学(1967—),男,教授,博士,研究方向为农产品加工及贮藏。E-mail:zwx@haust.edu.cn
