杏仁皮的苦杏仁苷含量测定及脱毒工艺探究
2015-12-27刘策曹清明屠焰刁其玉
刘策,曹清明,屠焰,刁其玉
(1.中南林业科技大学食品与科学工程学院,湖南长沙410004;2.中国农业科学院饲料研究所,北京100081)
杏仁皮的苦杏仁苷含量测定及脱毒工艺探究
刘策1,2,曹清明1,*,屠焰2,刁其玉2
(1.中南林业科技大学食品与科学工程学院,湖南长沙410004;2.中国农业科学院饲料研究所,北京100081)
建立了杏仁皮中活性物质苦杏仁苷含量的测定方法,并对杏仁皮脱毒工艺进行了优化。用紫外光谱法测得:在219 nm处有最大吸收光谱;苦杏仁苷的甲醇溶液在一定的浓度范围内,其吸光度值与浓度呈良好的线性关系(r2= 0.9992)。以苦杏仁苷标准品为对照,计算了样品中的苦杏仁苷含量。确定测定方法以后,对浸泡脱毒法进行单因素及正交优化,确定了0.1%柠檬酸浸泡8 h,浸泡温度70℃、料水比1∶15(g∶mL)为最佳脱毒条件。
杏仁皮;苦杏仁苷;紫外分光光度法;浸泡法脱毒
杏仁皮是杏仁的红棕色或者深黄色的种皮,大约占杏仁果实干重的2%~4%[1]。在杏仁加工过程中常常通过高温热烫漂方法脱去杏仁皮。脱去的杏仁皮作为废物丢弃,造成了极大的资源浪费,也污染了环境。
杏仁皮中含有11.4%~13.1%的粗蛋白质,也是膳食纤维的主要来源,可以作为食品加工原料或者动物饲料使用[2]。杏仁皮中存在一种重要的生物活性物质,即苦杏仁苷,苦杏仁苷是传统中药杏仁的有效成分,具有镇咳、平喘、增强免疫能力、抗肿瘤、降血糖等作用,但是,在苦杏仁苷酶存在时苦杏仁苷水解可生成苯甲醛、葡萄糖及氢氰酸。氢氰酸有剧毒,大量口服苦杏仁会中毒,甚至导致死亡,口服苦杏仁苷药物的LD50为60mg/kg[3]。据报道,杏仁皮中苦杏仁苷的含量为2.23%左右,与杏仁中的苦杏仁苷含量大体一致[4]。如果摄入量多,则会造成中毒甚至死亡。
目前国内外还没有关于杏仁皮的毒性物质和加工脱毒工艺的报道,可以参照杏仁的脱毒方法。杏仁类产品的加工脱毒工艺多采取沸水蒸煮法、高温浸泡法、烘干炒制法、生物发酵法等。沸水蒸煮法具有脱毒效果好,但是能耗大、成本高的特点。生物发酵法虽然绿色环保,但是处理周期长,操作复杂。高温浸泡处理是杏仁类产品加工过程中脱毒、钝酶、护色的一个重要工序,本文将参照此法对杏仁皮进行脱毒。
本文旨在研究杏仁皮的脱毒方法,以期将杏仁皮加以利用。首先通过测定苦杏仁苷含量来判断杏仁皮的毒性大小,在此基础上对高温浸泡法脱毒进行正交优化,以期寻找一套适宜的杏仁皮脱毒方法。
1 材料与方法
1.1 材料
杏仁皮:采购自张家口市万全县洗马林镇禾久果仁加工厂;苦杏仁苷标准品:纯度≥97%,上海源叶生物公司;甲醇(分析纯)、柠檬酸(分析纯)、盐酸(分析纯):北京化工厂。
1.2 仪器
UV-6300型紫外可见分光光计:上海美谱达仪器有限公司;DSHZ-300型多用途水浴恒温振荡器:江苏太仓市实验设备厂;JK-500B型超声波清洗器:合肥金尼克机械制造有限公司。
1.3 苦杏仁苷测定方法的建立
1.3.1 最大吸收波长的确定
精确称量20mg苦杏仁苷标准品溶于甲醇并定容至50mL,得到0.4mg/mL的苦杏仁苷甲醇溶液,稀释到0.1mg/m L。用紫外分光光度法,在200 nm~400 nm范围内进行全波长扫描,确定最大吸收波长。
1.3.2 苦杏仁苷标准曲线的测定
分别取0.4mg/mL苦杏仁苷甲醇溶液0.125、0.25、0.5、0.75、1、1.25mL,使用甲醇定容至5mL,得到0.01、0.02、0.04、0.06、0.08、0.1mg/mL的标准溶液。在1.3.1确定的最大吸收波长处测定吸光度值,绘制标准曲线。
1.3.3 杏仁皮样品的处理及含量测定
将杏仁皮样品粉碎后过40目筛,准确称取0.800g,用30m L甲醇浸泡10min。放入超声清洗机内进行超声处理30min,过滤。将滤液使用甲醇定容至50mL备用,静置1 h。用紫外分光光度计在最大吸收波长处测定吸光度值。并且参照标准曲线、稀释倍数及样品质量计算苦杏仁苷含量。
1.3.4 重复度试验及加标回收率试验
按照1.3.3的方法测定杏仁皮样品5次,测定其平均含量及相对标准偏差(RSD)。精确称取已知含量的同一样品约0.800 g,共5份,分别加入苦杏仁苷标准品4.0mg,测定加入标准品前后的苦杏仁苷含量,计算其平均回收率及相对标准偏差(RSD)。
1.4 浸泡法杏仁皮脱毒工艺的优化
1.4.1 浸泡法脱毒工艺流程
杏仁皮样品粉碎→量取一定体积的浸泡液浸泡→恒温水浴浸泡→每隔1小时换一次浸泡液→浸泡液低温烘干→测定苦杏仁苷含量。
1.4.2 浸泡法脱毒的单因素试验
1.4.2.1 浸泡液对杏仁皮脱毒效果的影响
选取蒸馏水、0.1%柠檬酸溶液和0.1%盐酸溶液加入杏仁皮中进行浸泡脱毒处理,并测定其苦杏仁苷含量。
1.4.2.2 浸泡时间对杏仁皮脱毒效果的影响
分别在浸泡1、2、4、6、8、12 h时取出杏仁皮样品,并测定其苦杏仁苷含量。
1.4.2.3 浸泡温度对杏仁皮脱毒效果的影响
分别将杏仁皮样品放置在40、50、60、70、80、90℃的恒温水浴中进行浸泡脱毒处理,并测定苦杏仁苷含量。
1.4.2.4 料水比对杏仁皮脱毒效果的影响
分别在料水比为1∶5、1∶10、1∶15、1∶20、1∶25、1∶30(g/m L)的条件下进行浸泡脱毒处理,测定苦杏仁苷含量。
1.4.3 浸泡法脱毒的正交优化试验
对不同的浸泡液、浸泡时间、浸泡温度及料水比4个因素进行正交优化。在单因素试验的基础上,采用L9(34)正交表进行正交试验,优化浸泡法脱毒的工艺条件。
1.5 数据处理
数据的处理和分析使用SAS9.2,正交试验优化采用ANOVA进行正交试验方差分析。
2 结果与分析
2.1 苦杏仁苷含量测定方法的建立
2.1.1 最大吸收波长与标准曲线的确定
0.1mg/m L苦杏仁苷的甲醇标准溶液在219 nm处出现最大吸收峰。因此确定该波长为苦杏仁苷甲醇溶液的最大吸收波长。分别测定0.01、0.02、0.04、0.06、0.08、0.1mg/mL标准溶液的吸光度值,得到标准曲线Y=8.790 4X+0.138 8,R2=0.999 2(X为苦杏仁苷甲醇溶液浓度mg/mL,Y为吸光度值Abs)。在波长219 nm处测其吸光度值与浓度呈良好的线性关系,可按此标准曲线进行定量分析。该结果与李强[5]和高凌宇[6]的试验结论基本一致。
2.1.2 重复度试验及加标回收率试验
苦杏仁苷含量测定的重复度和加标回收率试验的结果见表1及表2。
由表1和表2可知,重复度试验得到苦杏仁苷含量的平均值是3.61%,RSD为0.462 1%,平均回收率达到100.48%,相对标准偏差RSD为1.432%。尽管甲醇溶液挥发容易造成系统误差,但是试验在允许的误差范围内,因此能够准确的测定杏仁皮中的苦杏仁苷含量。
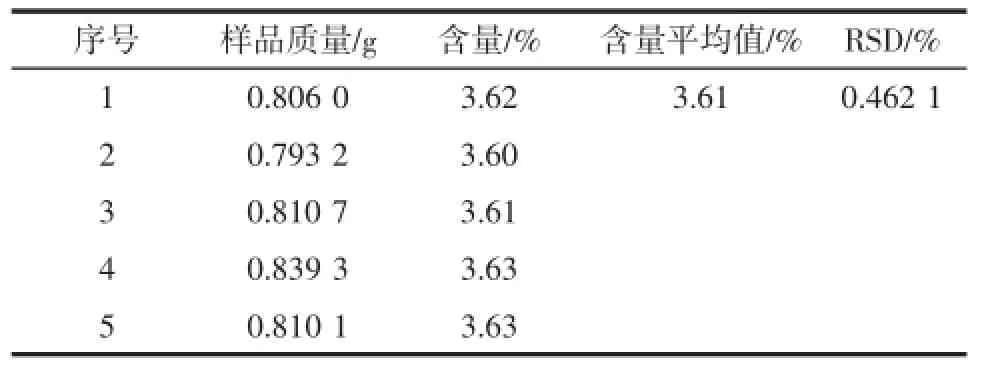
表1 重复度试验结果Table1 The experiment results of multiplicity
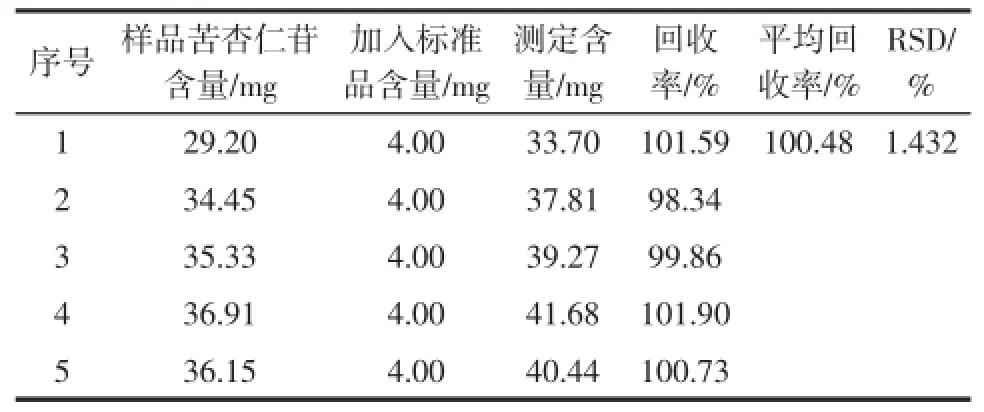
表2 苦杏仁苷含量测定的加标回收率试验Table2 The results of standards recovery
测定植物资源中苦杏仁苷含量的方法比较多,药典法(异烟酸-吡唑啉酮比色法)测定操作复杂,危险性高,误差大。高效液相色谱法测定的结果精密度高、误差小,但是对试验环境和仪器要求高,化验成本较高[7]。本文采用的紫外分光光度法来测定苦杏仁苷含量,以活性物质的含量代表毒素的残余量,操作简单、成本低、速度快,适合于杏仁皮或者其他杏仁产品中的苦杏仁苷含量的快速化验分析。
2.2 浸泡法对杏仁皮脱毒工艺的单因素试验
2.2.1 浸泡液对苦杏仁苷含量的影响
浸泡液对苦杏仁苷含量的影响见图1。

图1 浸泡液对苦杏仁苷含量的影响Fig.1 Influence of soaking liquid on amygdalin content
选取不同的浸泡液进行浸泡处理,从图1可以看出,使用0.1%柠檬酸的浸泡液处理后苦杏仁苷含量最低。据文献报道[8],微酸性环境能够促进苦杏仁苷的溶出和分解,而强酸的环境下(0.1%盐酸)的苦杏仁苷降解能力低于弱酸环境(0.1柠檬酸)。该结论与李军[9]进行的杏仁脱毒工艺研究的结论基本一致。
2.2.2 浸泡时间对苦杏仁苷含量的影响
本试验分别在浸泡1、2、4、6、8、12 h时观察苦杏仁苷含量的变化情况,结果见图2。

图2 浸泡时间对苦杏仁苷含量的影响Fig.2 Influence of soaking period on amygdalin content
从图2中发现,前4个小时,苦杏仁苷降解速率快,而后降解速率变慢,在12 h之后,苦杏仁苷含量大约在2.2%左右。过短的浸泡时间脱毒效果差,过长的时间会造成杏仁皮营养物质的损失,因此需要合理的控制浸泡时间。臧瑾康[10]研究浸泡法脱毒处理杏仁,需要在25℃~30℃的浸泡液中处理7 d~9 d,低温长时间的浸泡可以防止高温对杏仁营养的损失,而杏仁皮可以耐受高温浸泡,相比之下浸泡时间短,效率更高。2.2.3 浸泡温度对苦杏仁苷含量的影响
浸泡温度对苦杏仁苷含量的影响见图3。
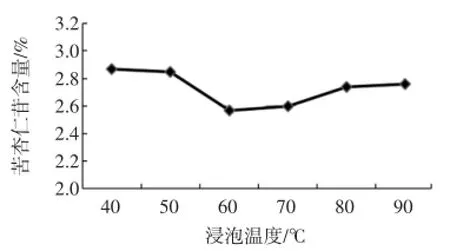
图3 浸泡温度对苦杏仁苷含量的影响Fig.3 Influence of soaking temperature on amygdalin content
本试验将杏仁皮样品放置在40、50、60、70、80、90℃的恒温水浴中进行浸泡脱毒处理,并测定苦杏仁苷含量。理论上温度越高,降解速率越快,苦杏仁苷含量会越来越低。但是从图3中发现,在60℃前,随着温度的升高,苦杏仁苷含量逐渐减少。而在此之后,随着温度升高,苦杏仁苷含量略微呈现升高的趋势。可能的原因为,苦杏仁苷降解分为二条途径,一条途径是高温热分解,另外一条途径是酶促降解。苦杏仁苷酶在高水温条件下失去酶活,因此降解的途径减少了一条,所以呈现了苦杏仁苷含量略微变大的趋势。杏仁的中药加工中的燀炒处理就是在高温条件下灭活苦杏仁苷酶,达到“杀酶保苷”的效果[11]。
2.2.4 料水比对苦杏仁苷含量的影响
料水比对苦杏仁苷含量的影响见图4。
本试验在料水比分别为1∶5、1∶10、1∶15、1∶20、

图4 料水比对苦杏仁苷含量的影响Fig.4 Influence of the ratio of material to liquid on amygdalin content
1∶25、1∶30 6种不同的比例观察苦杏仁苷含量的变化情况,从图4中发现,随着水分含量的逐渐增大,苦杏仁苷含量逐渐变小,在1∶15的料水比之后继续添加浸泡液,苦杏仁苷含量趋于稳定。浸泡脱毒的水分用量与杏仁皮脱毒处理时的颗粒大小有关,颗粒越大,与浸泡液有效接触面积越小,所需要的水分越多。2.3 浸泡法脱毒的正交优化试验
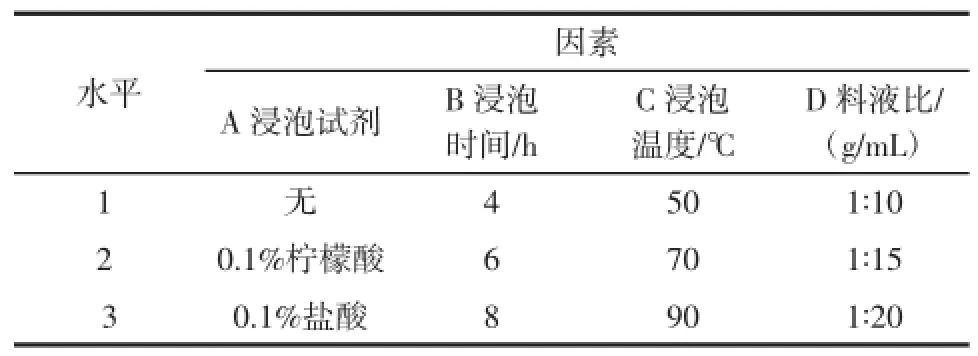
表3 因素水平表Table3 Factors and levels
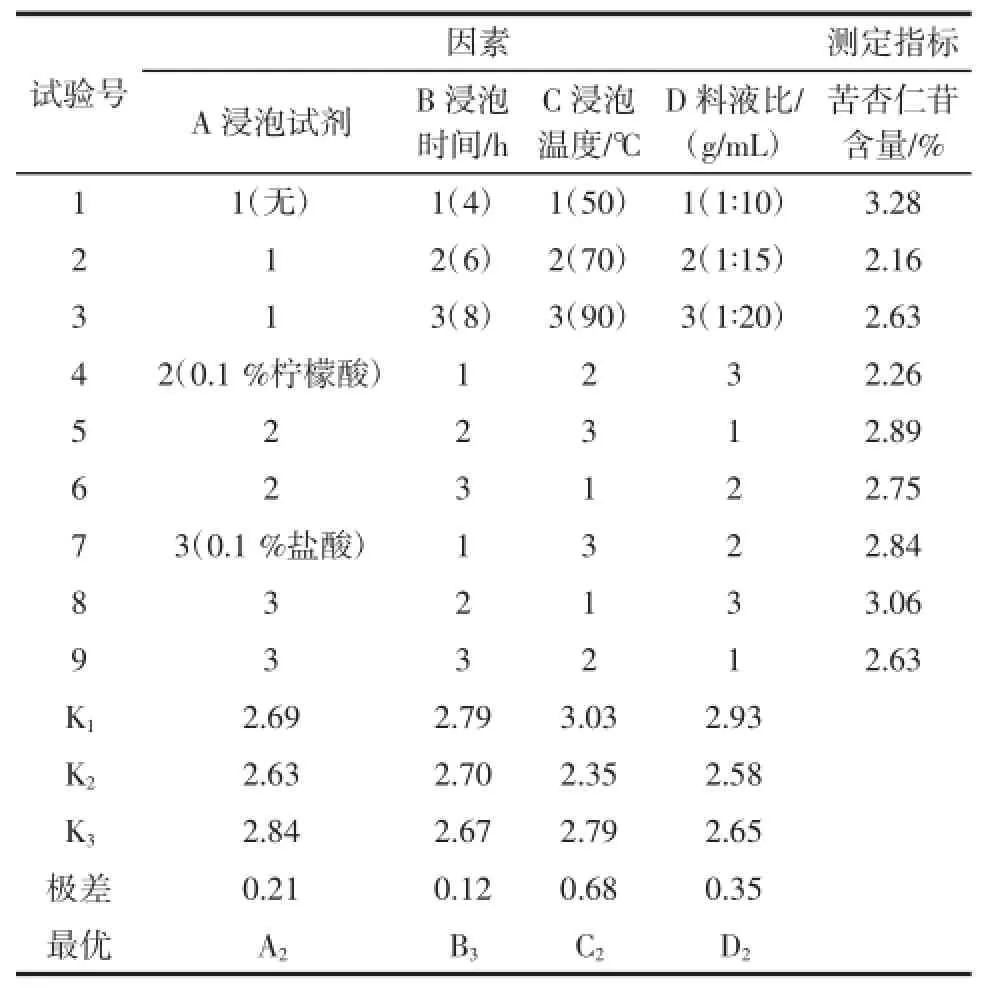
表4 正交试验结果Table 4 The results of orthogonal experiments
根据表4中的数据进行方差分析,结果见表5。
浸泡时间、浸泡试剂、浸泡温度、和料水比四个因素的具有极大的显著性差异(P<0.05)。各因素的对苦杏仁苷含量的影响大小次序为:浸泡温度>料液比>浸泡时间>浸泡试剂。综合各因素的K值和直观比较,得出浸泡法脱毒工艺理论上的最佳工艺条件为A2B3C2D2,即使用0.1%柠檬酸浸泡试剂,浸泡8 h,浸泡温度70℃、料水比1∶15时下脱毒效果最佳。
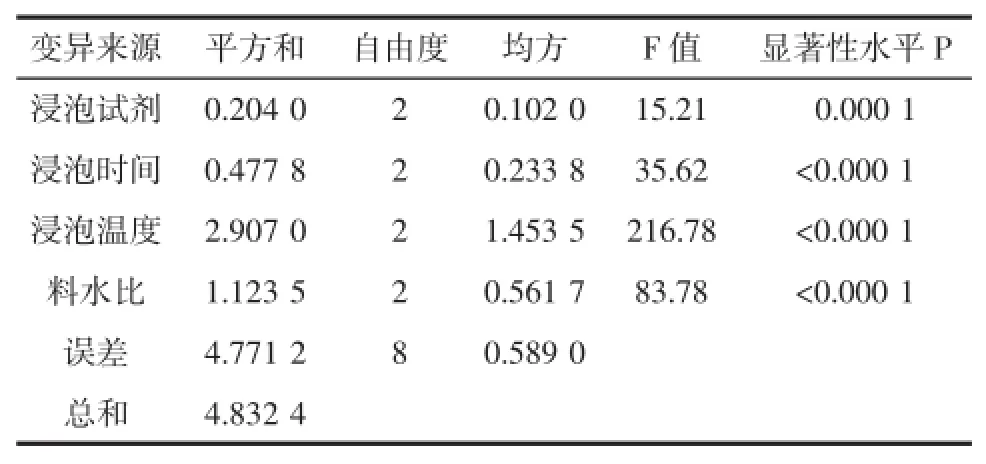
表5 正交试验的方差分析表Table5 ANOVA for orthogonal experiments
3 结论
以苦杏仁苷为标准品,采用紫外分光光度法,在波长为219 nm处测定了杏仁皮中苦杏仁苷的含量。本方法不仅稳定、灵敏度高、简便,而且节约时间和试剂,为中小型企业快速测定杏仁皮中苦杏仁苷的含量提供了良好的方法。
对浸泡高温法的脱毒工艺进行了单因素及正交优化,各因素影响的主次关系为浸泡温度>料液比>浸泡试剂>浸泡时间。确定了0.1%柠檬酸浸泡浸泡8 h,浸泡温度70℃、料水比1∶15(g∶m L)为最佳脱毒条件。
不同的加工脱毒工艺方法(比如高温烘干法、沸水蒸煮法、生物发酵法等脱毒方法)都存在弊端。而高温浸泡法能够有效地去除毒素,同时能够尽可能降低加工成本、节约能源、操作简单。本试验对高温浸泡法进行了研究,得到最佳的浸泡脱毒工艺条件,适用于广泛的中小型杏仁加工企业,具有较大的理论意义和实际的应用价值。
[1]崔海燕.高速逆流色谱分离纯化山楂和杏仁皮中主要活性成分的研究[D].西安:陕西师范大学,2010
[2]G MANDALARI,A TOMAINO,T ARCORACI,et al.Characterization of polyphenols,lipids and dietary fibre from almond skins (Amygdalus communis L.)[J].Journal of Food Composition and Analysis,2010,23(2):166-174
[3] B Y GE,H X CHEN,FM HAN,et al.Identification of amygdalin and its major metabolites in rat urine by LC-MS/MS[J].Journal of Chromatography B,2007,857(2):281-286
[4] 马雪松,陈缤.苦杏仁及其炮制品中苦杏仁苷含量测定[J].辽宁中医杂志,2006(3):355
[5] 李强.志丹杏杏仁中苦杏仁苷提取、纯化及水解研究[D].西安:陕西师范大学,2006
[6] 高凌宇,田文礼.杏花花粉中功能性成分的研究进展[J].农产品加工(学刊),2010(11):74-76
[7]钱平,贾云,刘志辉,等.高效液相色谱法测定郁李仁中苦杏仁苷的含量[J].中国中医药信息杂志,2009(12):50-51
[8]汤庆发,谢颖,陈飞龙,等.苦杏仁中苦杏仁苷的存在形式及其影响因素[J].中国实验方剂学杂志,2013(8):107-109
[9] 李军.苦杏仁脱苦工艺的研究[D].北京:北京林业大学,2012
[10]臧瑾康,吴纯红,沈中,等.苦杏仁脱苦去毒的最佳工艺条件探讨[J].四川食品与发酵,1997(4):20-24
[11]王力生,邹节明,袁伟恩,等.苦杏仁的炮制及有效成分提取和分析进展[J].分析测试技术与仪器,2005(1):34-38
The Determination of Amygdalin and the Process of Removing the Bitterness in the Almond Skin
LIU Ce1,2,CAO Qing-ming1,*,TU Yan2,DIAO Qi-yu2
(1.Food Science and Technology College,Central South University of Forestry and Technology,Changsha 410004,Hunan,China;2.Institute of Feed Research,TheChinese Academy of Agriculture Science,Beijing 100081,China)
This paper aimed to establish a method for measuring the concentration of amygdalin in almond skin. The optimization of detoxification also was finished.With Ultraviolet spectrometry,the maximum absorption wavelength determined at219 nm,and the calibration curve was linear in a certain range(r2=0.999 2),and with the standard of amygdalin as reference,amygdalin contents in samples were measured.Based on this method,the single factors and orthogonal optimization were used for the detoxification of soaking.The result is as follows:0.1%citric acid soaking reagent,8 hours for smoking,70℃soaking temperature,the rate of solid to liquid 1∶15(g/mL).
almond skin;amygdalin;UV spectrophotometry;the detoxification by soaking
10.3969/j.issn.1005-6521.2015.03.015
2013-09-03
奶牛产业技术体系北京市创新团队
刘策(1988—),男(汉),硕士研究生,主要从事新型饲料资源开发利用研究。
*通信作者:曹清明,副教授,硕士生导师。
