白簕叶不同极性部位的体外抗氧化活性分析
2015-12-27杨慧文张旭红陈健媚潘育方钱婧
杨慧文,张旭红,陈健媚,潘育方,*,钱婧
(1.广东药学院药科学院,广东广州510006;2.扬州工业职业技术学院文理系,江苏扬州225000)
白簕叶不同极性部位的体外抗氧化活性分析
杨慧文1,张旭红1,陈健媚1,潘育方1,*,钱婧2
(1.广东药学院药科学院,广东广州510006;2.扬州工业职业技术学院文理系,江苏扬州225000)
利用不同溶剂对白簕叶各极性部位进行提取、显色鉴定和薄层色谱分析,并考察其中乙酸乙酯、正丁醇和水3个不同极性部位提取液的体外抗氧化活性,通过测定其铁还原力、对DPPH·的清除率、总抗氧化力,筛选出主要的抗氧化活性部位。结果表明,白簕叶3个不同极性部位的成分的种类和含量差别均较大,体外抗氧化结果显示各部分体外抗氧化活性也存在较大差异,其中正丁醇部位抗氧化活性最高。
白簕叶;黄酮;抗氧化活性
白簕Acanthopanax trifoliatus(Linn.)Merr.,为五加科(Araliaceae)五加属(Acanthopanan)攀援状灌木,又称鹅掌簕、刺三加、白刺尖,分布于两广、福建、云南、贵州等地,东南亚如泰国、越南等也有分布[1]。白簕味苦、辛、凉,具有清热解毒、祛风利湿、止咳平喘、散瘀止痛之功效[2-3],其主要化学成分为槲皮甙、黄酮、多糖、咖啡酰奎宁酸等[4-6]。经研究,白簕具有消炎抑菌、防龋固齿、治疗新生儿湿疹等作用[7-9]。五加属植物多有抗氧化作用,刺五加可抑制鼠巨噬细胞中一氧化氮的产生[10],其茎提取物在四氯化碳中毒大鼠模型中具有抗氧化功效[11]。而白簕同为刺五加属,其抗氧化功效,尤其是关于其活性部位的筛选,少有研究。
因此,本实验通过测定铁还原力、对DPPH的清除率、总抗氧化力[12-14],将测定结果与维生素C进行对比,从三个方面研究白簕叶不同极性部位的抗氧化活性,筛选抗氧化活性部位,为进一步研究开发白簕提取物的抗氧化功效提供理论基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂
白簕茎购自恩平响山簕菜茶厂(经广东药学院中药学院中药资源系刘基柱副教授鉴定为五加属植物白簕,标本保存于广东药学院中药学院标本室)、镁粉(40目~90目):鹤壁市江浪金属有限公司;DPPH.(分析纯):美国Sigma公司;维生素C(VC)(分析纯):天津市石英钟厂霸州市化工分厂;三氯化铝、磷酸三钠、钼酸铵、香草醛、三氯化铁、硫酸、无水乙醇、正丁醇等均为分析纯。
1.1.2 主要仪器
KQ5200超声仪:东莞市科桥超声波设备有限公司;XW-80A微型漩涡混合仪:上海沪西分析仪器厂;HH-2恒温水浴锅:常州澳华仪器有限公司;RE-52AA旋转蒸发仪:上海亚荣生化仪器厂;SHZD-DⅢ循环式水泵:巩义市予华仪器有限责任公司;LD4-2A低速离心机:北京医用离心机厂;UV-1200紫外可见光分光光度计:上海美谱达仪器有限公司;万分之一天平:FA2104A上海精天电子仪器有限公司。
1.2 方法
1.2.1 样品的制备
40 g白簕叶粉碎,过60目筛。200m L石油醚在50℃下搅拌提取1 h,抽滤,反复提取,直至提取液近于无色,将叶渣自然风干;再用200mL氯仿在40℃下提取1 h,更换提取溶剂,共提8次,直至提取液近于无色,将叶渣自然风干。
用200mL乙酸乙酯在50℃下搅拌提取该叶渣1 h,收集提取液,重复数次直至乙酸乙酯提取液颜色很浅,合并提取液,在40℃下减压旋蒸,得白簕叶乙酸乙酯部位50mL。
自然风干叶渣后,200 mL 95%乙醇超声提取60 min,每次超声20min,过滤,重复操作,至乙醇提取液近于无色,合并提取液,40℃下减压旋蒸浓缩,用蒸馏水少量多次复溶,得白簕叶水提部位100mL。
用50mL水饱和正丁醇对上述水溶液进行萃取,萃取3次,合并萃取液,得正丁醇部位150mL。
将上述3个不同极性部位提取液在4℃下密封保存,备用。
1.2.2 显色反应
采用显色反应的方法,对1.2.1项下3个不同极性部位提取液进行定性鉴定。
1.2.2.1 盐酸-镁粉反应
分别取白簕叶各极性部位提取液2mL于不同试管中,各加入适量乙醇、少许镁粉振摇,滴加几滴浓盐酸,观察颜色反应。
1.2.2.2 碱性试剂显色反应
取两张滤纸,均点上白簕叶各极性部位提取液,其中一张用浓氨水熏,与另外一张对比观察颜色变化,于空气中放置一段时间后,再观察颜色变化。
1.2.2.3 铝盐反应
分别取白簕叶各极性部位提取液2mL于不同试管中,各加入2滴1%AlCl3醇溶液,与对照管对比观察颜色变化。用毛细管取样点于硅胶板上,于紫外灯下观察荧光。
1.2.2.4 Molish反应
分别取白簕叶各极性部位提取液2mL于不同试管中,各加入适量乙醇,2滴α萘酚溶液,斜置试管,沿管壁加入浓硫酸约1mL,静置,观察二层溶液界面的变化。
1.2.2.5 三氯化铁反应
分别取白簕叶各极性部位提取液4mL于不同试管中,各加入1滴5%三氯化铁溶液,与对照管对比观察颜色变化。
1.2.2.6 三氯甲烷-浓硫酸检验(Salkowski反应)
分别取白簕叶各极性部位提取液1mL于不同试管中,各加入1m L三氯甲烷混匀,沿管壁加入等体积浓硫酸,与对照管对比观察颜色的变化。
1.2.3 聚酰胺薄层色谱
取乙酸乙酯、正丁醇和水这3个部位的浓缩液于相同的聚酰胺薄膜上点样,每个样品点两个点。使用正丁醇-乙酸-水-石油醚(4∶1∶1∶2)系统进行展开,于紫外灯下观察展开效果。用浓氨水作为显色剂,同样在紫外灯下观察荧光效果。
1.2.4 体外抗氧化活性的测定
取一定体积白簕叶3个不同极性部位提取液各自减压旋干后,用5mL 70%乙醇复溶,分别得到乙酸乙酯部位待测液(32、80、160、240、320mg/m L)5个浓度梯度,水部位待测液(13、17、24、40、60mg/mL)5个浓度梯度,以及正丁醇部位待测液(3.0、3.9、5.4、9.0、13.5mg/mL)5个浓度梯度。其中浓度代表每毫升提取液相当于原药材的质量(mg)。
按照以下操作评价各部分样品的总抗氧化力和铁还原力、对DPPH·自由基清除率。制备浓度为20、30、40、50、60mg/mL的VC溶液作对比试验。
1.2.4.1 铁还原力的测定
取待测液1m L置于试管中,加入2.5m L磷酸缓冲液(0.2mol/L,pH=6.6)和2.5mL 1%铁氰化钾,放入50℃水浴锅中20min后取出急速冷却,加入10%三氯乙酸溶液2.5mL。将上述溶液离心10min(3000 r/min),取上清液5mL。再加入4mL蒸馏水及1mL 0.1%FeCl3混匀,静置10min后测定吸光值(λ=700 nm),吸光度值越大表明还原力越强[12]。
1.2.4.2 总抗氧化能力测定
取待测液1m L置于试管中,依次滴加1m L 0.6mol/L硫酸溶液、1.5mL 28mmol/L磷酸钠、1.5mL 4mmol/L钼酸铵,随后向试管中加入0.6mL蒸馏水,摇匀。95℃水浴90min,取出急速冷却。另取一支试管,加入除待测液外的上述溶液,作为空白对照。在λ=695 nm测定吸光度值。
1.2.4.3 对DPPH.自由基清除率的测定
取2.0mL待测液、2mL 0.15mmol/L的DPPH·乙醇溶液加入试管,充分混匀后静置30min。以70%乙醇作为空白对照,在517 nm下测定样品吸光度。根据公式计算出3个不同极性部位提取液对DPPH·的清除率[13]。
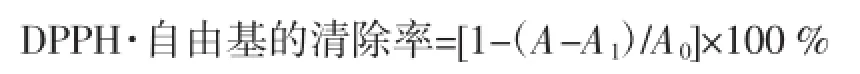
式中:A0为2.0mLDPPH·溶液+2.0mL 70%乙醇吸光度值;A为样品吸光度值;A1为2.0mL待测液+ 2.0mL 70%乙醇吸光度值。
1.2.5 数据处理
2 结果
2.1 显色反应
对白簕叶不同极性部位提取液进行七个显色反应,从而定性鉴定不同部位中所含的物质种类,其结果如表1所示。

表1 白簕叶不同极性部位提取液显色反应结果Table 1 Chromogenic reaction of different fractions from Acanthopanax trifoliatus(Linn.)Merr.leaves
盐酸-镁粉反应是检查样品中是否含有黄酮类化合物的最常用方法之一。由于黄酮具有邻酚羟基,可与镁离子形成红色或橙色络合物。表中结果显示除正丁醇部位提取液显现红色现象外,其余无明显反应,说明正丁醇部位很可能含有黄酮类物质。
碱液反应是在日光及紫外光下,通过纸斑反应,观察样品用碱性试剂处理后的颜色变化情况,对于鉴别黄酮类化合物有一定意义。其结果显示,正丁醇部位斑点颜色由淡黄色变为黄色,在空气中放置,黄色逐渐褪去,进一步验证了正丁醇部位黄酮类化合物的存在。
同样,铝盐反应也是较为经典的黄酮鉴别反应,结果显示正丁醇部位具有黄色荧光,说明该部位黄酮类化合物的存在。
Molish反应常用于糖类和苷的检测反应。实验结果发现,正丁醇部位和水提部位液在两层溶液交界面均出现棕色环,乙酸乙酯部位不存在此现象,说明正丁醇部位和水提部位可能含有苷类物质。
三氯化铁反应常用来判断酚羟基的有无,酚羟基可与三氯化铁中Fe3+形成配合物,显蓝紫色。香豆素类常含有酚羟基,可与三氯化铁形成绿色或墨绿色沉淀。实验现象显示,经三氯化铁试验,正丁醇部位显深蓝色,水提部位显浅墨绿色,乙酸乙酯部位显浅绿色,说明正丁醇部位、水提部位和乙酸乙酯部位可能均含有不同浓度的酚羟基。
Salkowski反应用于鉴别甾体、三萜类化合物阳性现象为硫酸层呈现红色或者蓝色,氯仿层有绿色荧光。经Salkowski反应后,正丁醇部位的氯仿层有绿色荧光出现,而两层溶液的交接出呈红色;水提部位的氯仿层和两溶液交界处分别出现浅绿色荧光和浅红色,可初步判断正丁醇部位和水提部位可能均含有不同浓度的三萜类或甾体类化合物。
2.2 聚酰胺薄层色谱
为进一步验证乙酸乙酯、正丁醇和水这3个不同极性部位的成分,对3个部位进行薄层鉴定,结果如下图1。
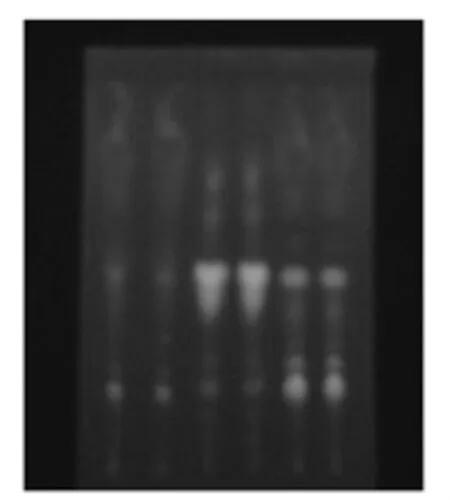
图1 聚酰胺薄层色谱结果Fig.1 Result of polyamide TLC chromatogram of different fractions from Acanthopanax trifoliatus(Linn.)Merr.leaves
由图可见,3个部位荧光的位置和颜色都有所不同,同一区段不同部位的荧光强弱也不同,说明3个部位所含的成分有明显区别,但也存在一定的交叉。
2.3 白簕叶各极性部位的铁还原力分析
还原力大小常作为评价抗氧化性强弱的指标之一,具有较强还原力的样品可使Fe3+还原为Fe2+。本实验测定不同极性部位提取液的还原力,与VC进行比较,结果见图2。
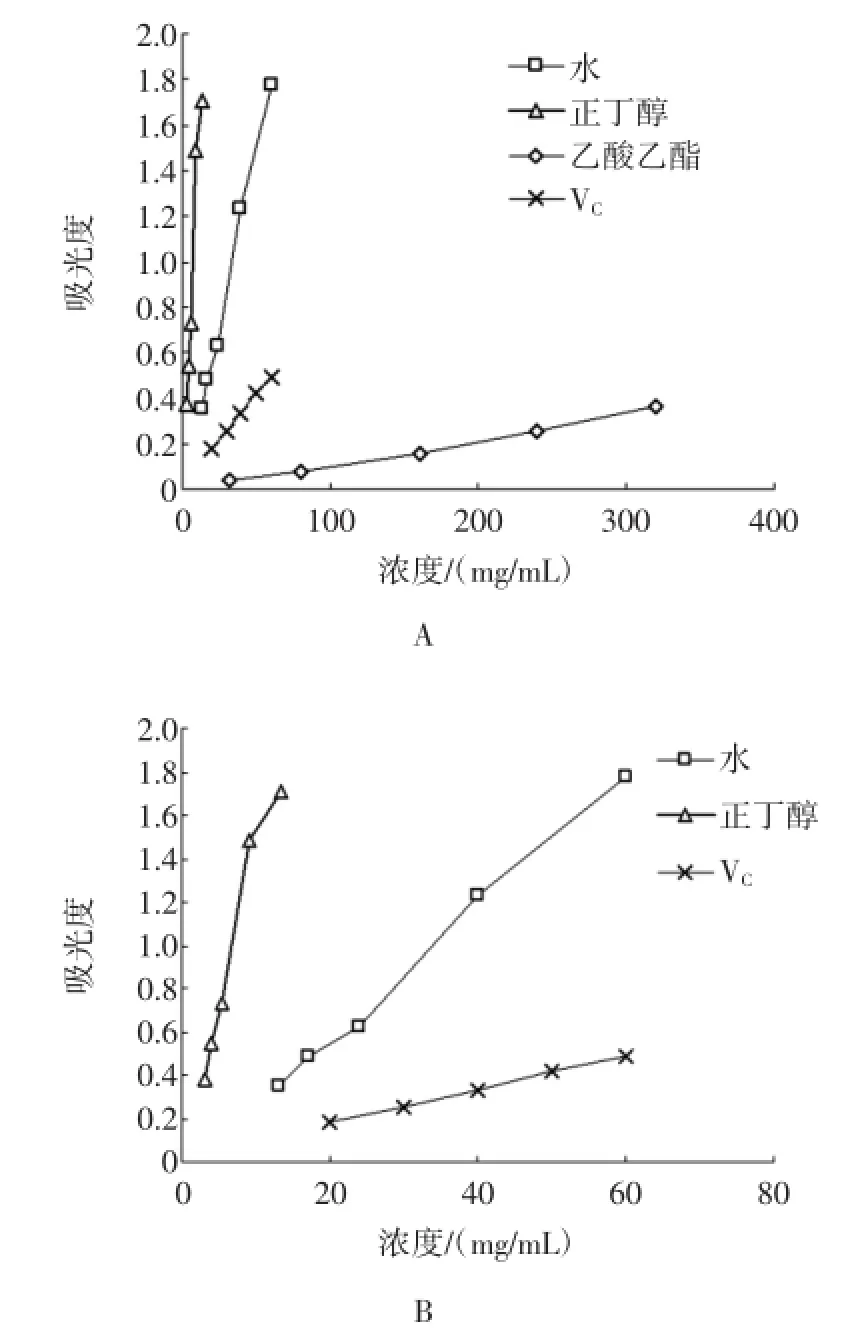
图2 白簕叶不同极性部位样品铁还原力的测定结果Fig.2 Reducing power of Fe3+of different polarity fractions from Acanthopanax trifoliatus(Linn.)M err.leaves
样品还原铁氰化钾后,与Fe3+反应生成普鲁士蓝,生成量越多,吸光度越大,说明样品还原力越强。由图2-A可知,白簕叶各极性部位和VC均表现出不同程度的铁还原力,比较图2-A各曲线可得,相同浓度下,正丁醇部位的铁还原力最强,水提部位次之,乙酸乙酯部位的铁还原力并不显著。在吸光度为0.33~0.37之间时,正丁醇、水提、乙酸乙酯部位和VC的样品浓度分别为3、13、320、40mg/mL。同样铁还原力强度对应的白簕叶不同极性部位提取液浓度差异较大,该现象可能是因为各部位所含具有铁还原力的物质种类不同或含量不同造成的。
将正丁醇、水提部位以及VC三种样品的铁还原力比较得图2-B,从图中可见,随着浓度的增加,正丁醇和水提部位样品的吸光度均随之增加,表明样品的铁还原力与浓度在试验范围内存在较好的相关性,铁还原力具有明显的量效关系。正丁醇和水提部位的铁还原力在试验范围内均高于VC。
2.4 白簕叶各部位的总抗氧化力
采用改良后的Prieto法测定白簕叶各部位抗氧化力,其原理是磷钼酸铵被具有抗氧化性的物质还原,得到最大吸收波长为695 nm的磷钼络合物。物质还原活性越强,即抗氧化性越强,生成物吸光度越大[15],测定结果如图3。
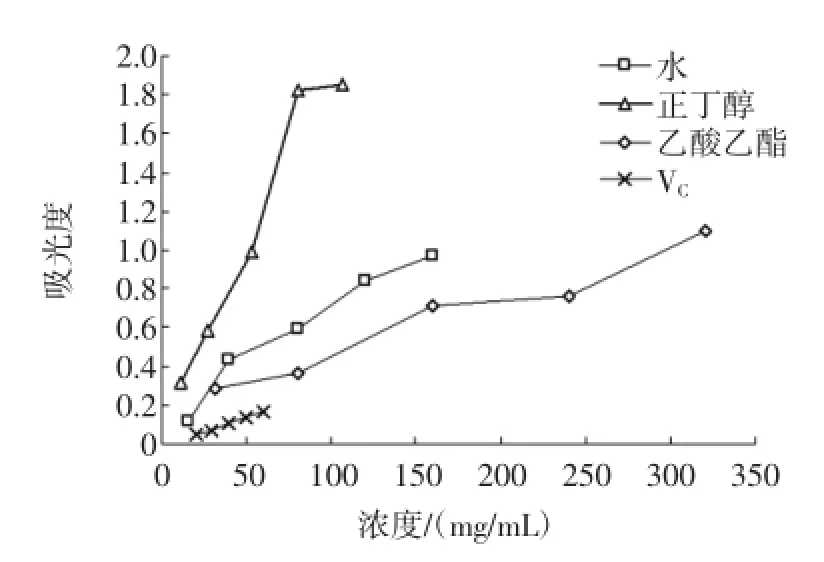
图3 白簕叶各极性部位的总抗氧化力Fig.3 Total antioxidant activity of different polarity fractions from Acanthopanax trifoliatus(Linn.)Merr.leaves
图3结果显示,白簕叶不同极性部位对磷钼酸铵均具有较好的还原能力。随着样品浓度的增加,各产物吸光度均逐渐增大,说明浓度增加该还原能力逐渐增强,各极性部位的抗氧化力呈现了良好的量效关系。与经典抗氧化剂VC相比,各极性部位对磷钼酸铵的还原能力均强于VC。在浓度为40mg/mL以上时,3个极性部位的抗氧化能力强弱依次为,正丁醇部位>水提部位>乙酸乙酯部位>VC。
2.5 白簕叶各部位对DPPH·自由基的清除率测定
DPPH·在是一种稳定的以氮为中心的自由基,具有孤对电子,易自行结合成为稳定的分子;其醇溶液呈紫色,最大吸收波为517 nm。当加入抗氧化剂时,其单电子被配对,溶液颜色变浅,导致其吸光值下降。根据吸光度值的降低计算清除率,清除率越大,抗氧化性越强,从而评价样品的抗氧化能力[16],结果如图4。
由图4-A可得,白簕叶各极性部位对DPPH·均具有较好的清除能力,对DPPH·的清除率随着浓度的增加而逐渐增大,但当浓度升高到一定值时,清除率上升明显缓慢或不再上升。由图4-B可得,在浓度低于9mg/mL时,正丁醇部位对DPPH·的清除具有较好的量效关系。当浓度到达试验范围最高值时,正丁醇、水和乙酸乙酯三个部位对DPPH·的清除率分别为97.40%、86.05%和90.10%,与VC的最高清除率92.43%均较为接近。其中正丁醇部位对DPPH·的清除能力,无论是最佳清除效果还是低浓度时的清除率,均高于经典抗氧化物VC。而乙酸乙酯和水提部位在低浓度时的清除能力和最佳清除效果均低于VC。总体来说,各样品的清除能力依次为,正丁醇部位>VC>水提部位>乙酸乙酯部位。该现象可能由于正丁醇部位中对DPPH·有清除能力的物质活性较强或含量较高。

图4 白簕叶不同极性部位样品对DPPH·清除率的测定结果Fig.4 Scavenging capacities for DPPH·of different polarity fractions from Acanthopanax trifoliatus(Linn.)Merr.Leaves
3 讨论
五加属(Acanthopanan)植物是一类药用价值较高的植物,大多分布在亚洲,其中的刺五加更是有“木本人参”的称号,临床上具有益气健脾、补肾安神等功效[17]。白簕是五加属中的一种,由于其兼具营养价值和药用价值,在产地已成为日常生活的特色蔬菜之一。本文利用溶剂萃取法对白簕叶不同极性部位做初步分离,并对不同部位的成分及抗氧化功效进行了研究。
本实验分离得到白簕叶的乙酸乙酯、正丁醇,及水提部位,对3个部位进行显色鉴定和聚酰胺薄层色谱鉴定结果表明,3个部位中所含成分种类和含量均有不同,在成分种类上有少许交叉。
对3个部位体外抗氧化实验结果表明,3个部位均具有不同程度的体外抗氧化活性,且三者的铁还原力和总抗氧化力均与浓度之间存在较好的相关性,有量效关系。正丁醇部位对DPPH·清除率在低浓度时具有量效关系,随着浓度的逐渐升高,到达9mg/mL以上时,清除率不再增加。3个部位的体外抗氧化活性强弱依次为:正丁醇部位>水提部位>乙酸乙酯部位,说明正丁醇部位具有体外抗氧化力的物质活性较强或含量较高。VC是一种公认的经典抗氧化物质,具有很强的抗氧化能力,实验中取VC进行相比,发现正丁醇部位的总抗氧化力、铁还原力以及对DPPH·清除率均明显高于VC;而水提部位除DPPH·清除率与VC接近,其铁还原力和总抗氧化力均高于VC。结果提示正丁醇部位和水提部位是白簕叶中抗氧化活性的主要部位,值得重点进一步研究,可通过进一步分离分析,确定白簕叶抗氧化活性的主要物质基础。
[1]梁明标,吴青,孙远明.保健野蔬——簕菜[J].蔬菜,2005(1):38
[2]江苏新药学院.中药大辞典[M].上海:上海人民卫生出版社,1977
[3]朱立新.中国野生蔬菜开发与利用[M].北京:金盾出版社,1996
[4]杜江,高林.白簕叶的化学成分研究[J].中国中药杂志,1992,17(6): 356-357,383
[5] Kiem P V,Minh C V,Cai X F,et al.A new 24-nor-lupane-glyco side of Acanthopanax trifoliatus[J].Arch Pharm Res,2003,26(9): 706-708
[6] P Sithisarn,S Muensaen,S Jarikasem.Determination of Caffeoyl Quinic Acidsand Flavonoids in Acanthopanax trifoliatus Leaves by HPLC[J].Natural Product Communications,2011,6(9):1289-1291
[7]黄晓慧,黄俊生,衷明华,等.白簕含氟牙膏的制作[J].韩山师范学院学报,2007(3):74-76
[8] 肖杭,黎云祥,蔡凌云,等.白簕叶总黄酮的提取和纯化及其抑菌试验初探[J].光谱实验室,2010(6):2130-2134
[9] 陈小菊.簕菜疗法在新生儿湿疹治疗中的应用和护理成效[J].实用医学杂志,2006(13):1587-1588
[10]Lin QY,Jin L J,Ma Y S,et al.Acanthopanax senticosus inhibits nitrc oxide production in murine macrophages in vitro and in vivo[J]. Phytother Res,2007,21:879-883
[11]Lee S,Son D,Ryu Jet al.Antioxidant activities of Acanthopanax senticosu stems and their lignan components[J].Arch Pharmacol Res,2004,27:106-110
[12]Ozsoy N,Can A,Yanardag R,et al.Antioxidant Activity of Smilax Excelsa L.Leaf Extracts[J].Food Chemistry,2008,110(3):574
[13]Leong L P,Shui G.An Investigation of Antioxidant Capacity of Fruits in Singapore Markets[J].Food Chemistry,2002,76:69-75
[14]彭惠惠,李吕木,钱坤,等.发酵芝麻粕中芝麻小肽的分离纯化及其体外抗氧化活性[J].食品科学,2013,34(9):66-69
[15]Pan YM,He CH,Wang HS,et al.Anti-oxidant activity of microwaveassisted extract of Buddleia officinalis and its major active component[J].Food Chemistry,2010,121:497-502
[16]彭长连,陈少薇.用清除有机自由基DPPH.法评价植物抗氧化能力[J].生物化学与生物物理进展,2000,27(6):658-661
[17]张琼,王长江.刺五加高产栽培技术[J].农村科学实验,2012(10): 15-16
Research on Antioxidant Activity of Different Fractions of Acanthopanax trifoliatus Leaves in Vitro
YANG Hui-wen1,ZHANG Xu-hong1,CHEN Jian-mei1,PAN Yu-fang1,*,QIAN Jing2
(1.College of Pharmacy,Guangdong Pharmaceutical University,Guangzhou 510006,Guangdong,China;2.Department of Arts and Science,Yangzhou Polytechnic Institute,Yangzhou 225000,Jiangsu,China)
To study the antioxidant activity of different fractions from Acanthopanax trifoliatus leaves in vitro,the leaves were extracted and separated into three parts with different polarity.Three methods including 2,2-diphenyl-1-picrylhyd-razyl radical scavenging assay,ferric reducing power and total antioxidant power were performed to detect the antioxidant activity.The results showed that among the three fractions,n-butanol layer exhitbited the strongest antioxidant activitie comparing with ethyl acetate,and water layer.
Acanthopanax trifoliatus leaves;flavonoid;antioxidant activity
10.3969/j.issn.1005-6521.2015.03.004
2013-12-28
杨慧文(1983—),女(汉),实验师,硕士,主要从事药学及新药开发的研究
*通信作者:潘育方(1966—),男,教授,主要从事药物新剂型及安全性评价的研究。
