鳕鱼皮中硫酸皮肤素的提取工艺
2015-12-27孙萍杜德红曹润智
孙萍,杜德红,曹润智
(青岛农业大学食品科学与工程学院,山东青岛266109)
鳕鱼皮中硫酸皮肤素的提取工艺
孙萍,杜德红,曹润智
(青岛农业大学食品科学与工程学院,山东青岛266109)
以鳕鱼皮为原料,采用木瓜蛋白酶和胰酶混合酶的方法,从鳕鱼皮中提取硫酸皮肤素,并通过乙醇沉淀的方法得到最终产品。研究料液比、酶添加量、pH、时间和温度等单因素对提取率的影响,并通过正交试验法对混合酶法提取硫酸皮肤素工艺条件进行优化。结果表明,混合酶提取硫酸皮肤素的最佳工艺为:料液比1∶25mg/mL、酶添加量0.5%、pH 8.5、提取时间22 h、提取温度50℃。采用此工艺条件提取率达到4.409%。
鳕鱼皮;木瓜蛋白酶;胰酶;硫酸皮肤素;提取
硫酸皮肤素(Dermatan sulfate,DS),又称硫酸肤质,硫酸软骨素B。最早于1941年由猪皮中分离得到,呈白色或微黄色粉末,无臭,无味,吸水性强,易溶于水,不溶于乙醇、丙酮和乙醚等有机溶剂中,其盐类对热较稳定,受热80℃亦不分解。硫酸皮肤素约含有50个~70个双糖基本单位,经HPLC测得相对分子质量为15 000~45 000,平均相对分子质量为35 700[1]。硫酸皮肤素主要用在医学上,其主要功能有:抗血栓作用[3-4],抗炎症反应,抗肿瘤作用[5-6],促进细胞再生作用[7]及药剂开发[8]。另外应用在化妆品中阻止脂蛋白在血管壁上的沉积,促进皮肤的更新,阻止皮肤的过度角质化和棘皮症,滋润皮肤、保持水分[9]。目前商品化硫酸皮肤素制剂的主要来源为猪皮,近年来也有从猪肠黏膜、牛肺、鳗鲡、鱼、海鞘、鸡冠、羊鼻软骨中提取DS的研究[10-13],鲜见从鳕鱼中提取DS的相关报道。
以鳕鱼加工中产生的大量下脚料鳕鱼皮为对象,采用木瓜蛋白酶和胰蛋白酶进行水解,对鳕鱼皮中的硫酸皮肤素的提取工艺进行了初步研究,为硫酸皮肤素的大量生产提供理论参考。
1 试剂与仪器
1.1 材料
鳕鱼皮:青岛佳元水产公司,鳕鱼种类为青岛地区产狭鳕鱼,同一批次新鲜鳕鱼加工,无病害、无杂质污染。
1.2 主要试剂
Q3357木瓜蛋白酶(200 u/mg~300 u/mg):上海佳和生物科技公司;0458胰酶(250 u/mg),美国Amresco公司;DS标准品:美国Sigma公司;阿利新蓝8GX:美国Waters公司;酪蛋白:上海基米生物科技公司。
1.3 主要仪器
UV-2000紫外可见分光光度计:尤尼柯(上海)仪器有限公司;高速小容量离心机:上海安亭仪器厂;移液枪:上海恒奇仪器仪表有限公司;电热恒温水浴锅:龙口市电炉制造厂。
2 实验方法
2.1 酶法提取工艺流程
鳕鱼皮→预处理→鱼皮干品→加酶提取→浸提液→灭酶过滤得滤液→活性炭吸附澄清→乙醇沉淀得澄清液→虹吸、常温干燥→成品
2.2 操作要点
2.2.1 鳕鱼皮前处理
除去鳕鱼皮上粘连的肌肉、杂质等非鱼皮成分,用清水洗净鱼皮,加适量丙酮洗涤除去脂肪,再用清水洗去残留的丙酮。控干鱼皮上的水分,将其展开拉平,烘箱中36℃烘2 h,取出后在室温条件下自然晾干。干燥状态的鱼皮质量很轻,韧性很强,不易粉碎成粉末,改用剪刀将干燥好的鱼皮剪成约2mm×2mm正方形小丁,装入容器中并放置在阴凉干燥处备用。
2.2.2 酶解
准确称取木瓜蛋白酶和胰酶进行酶解,以水解液中DS的含量为评价指标,采用分光光度计测定水解液的吸光值,选择最佳的酶解工艺条件。
2.2.3 乙醇沉淀
将酶解液在90℃下灭酶10min并过滤,在滤液中加入其质量3%的活性炭脱色15min,再次过滤,在澄清液中加入3倍体积的无水乙醇,隔夜沉淀,虹吸除去乙醇,将沉淀常温干燥,即得硫酸皮肤素粗品。
2.2.4 硫酸皮肤素提取率的测定
采用阿利新蓝法[14]。
2.2.4.1 标准曲线的绘制
在试管中分别加入0、40、60、80、100、120μL的DS标准液,用蒸馏水补足到200μL,准确加入3.00mL 1.4mg/mL阿利新蓝8GX染液,混匀,10min后,在480 nm比色测定,绘制标准曲线。
2.2.4.2 样品测定
酶解液在90℃下灭酶10 min并过滤,移取10.00mL滤液并稀释定容,预实验表明,将滤液定容至50mL时吸光度值在0.1~0.7间符合朗伯比尔定律。移取1.00m L蒸馏水,1.00m L样液于10m L试管中,加入3.00mL 1.4mg/mL阿利新蓝8GX染液,混匀,反应10min后,在480 nm处比色测定吸光值A。
2.2.4.3 硫酸皮肤素提取率计算
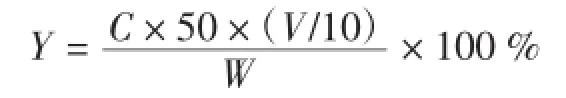
式中:Y为硫酸皮肤素提取率,%;C为硫酸皮肤素浓度,(mg/mL);50为每10 mL样液定容稀释到50 mL;10为10mL样液;V为每份样品酶解时加入的蒸馏水的体积,mL;W为每份样品的质量(本实验为5 g)。
2.2.5 硫酸皮肤素提取的单因素实验
本实验采用木瓜蛋白酶和胰酶混合提取两种酶添加量比例为1∶1,分别进行提取的单因素实验,考察料液比,酶添加量,pH,提取时间,提取温度等对硫酸皮肤素提取率的影响。
2.2.6 硫酸皮肤素提取的正交试验
在单因素实验结果基础上以料液比、混合酶添加量、pH、提取时间和提取温度5个因素,每因素四水平,以硫酸皮肤素提取率为考察指标,使用L16(45)正交表安排实验,如表1所示。
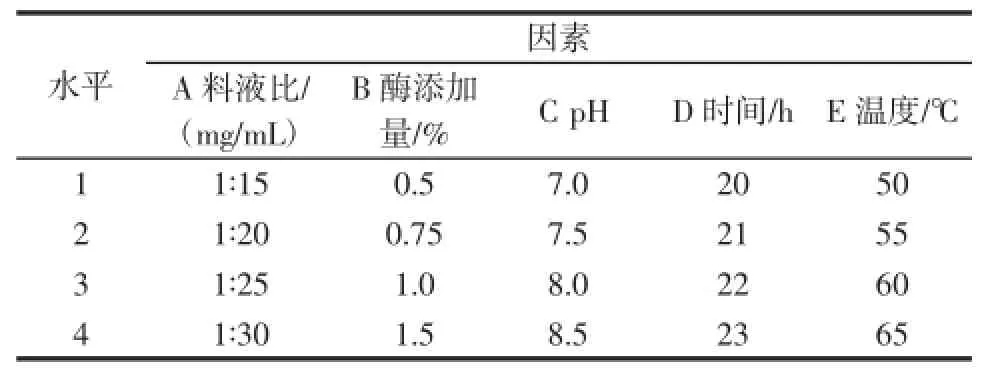
表1 正交试验因素水平表Table 1 Experimental range and levels of the independent variables
3 结果与分析
3.1 标准曲线的绘制
标准曲线如图1所示。
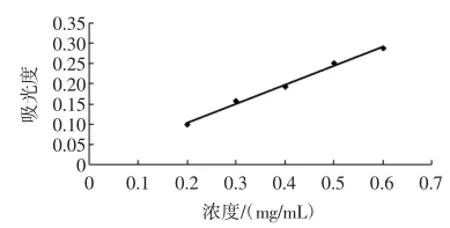
图1 硫酸皮肤素浓度与吸光值标准曲线Fig.1 Concentration of dermatan sulfate and absorption standard curve
图中标准曲线回归方程y=0.471 6x+0.008 7,y为吸光度值,x为硫酸皮肤素标准液浓度,R2=0.993 7。3.2 单因素实验结果
3.2.1 料液比对提取率的影响
料液比对硫酸皮肤素提取率的影响如图2所示。
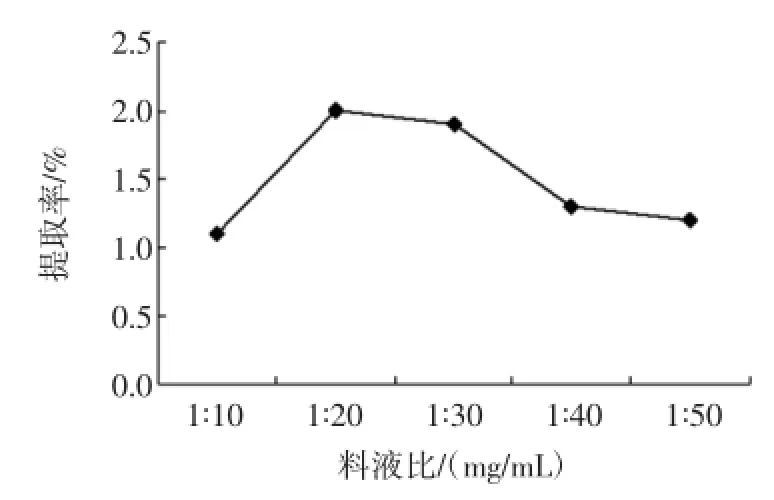
图2 料液比对硫酸皮肤素提取率的影响Fig.2 Effect of liquid-solid ratio on yield of dermatan sulfate
料液比对硫酸皮肤素提取率的影响呈先升后降的趋势,在料液比为1∶20(mg/mL)~1∶30(mg/mL)时提取率较高,继续增大料液比,稀释了酶的浓度,影响其作用的发挥,导致提取率的降低。所以本实验选择料液比为1∶20(mg/mL)。
3.2.2 混合酶添加量对提取率的影响
混合酶添加量对硫酸皮肤素提取率的影响如图3所示。
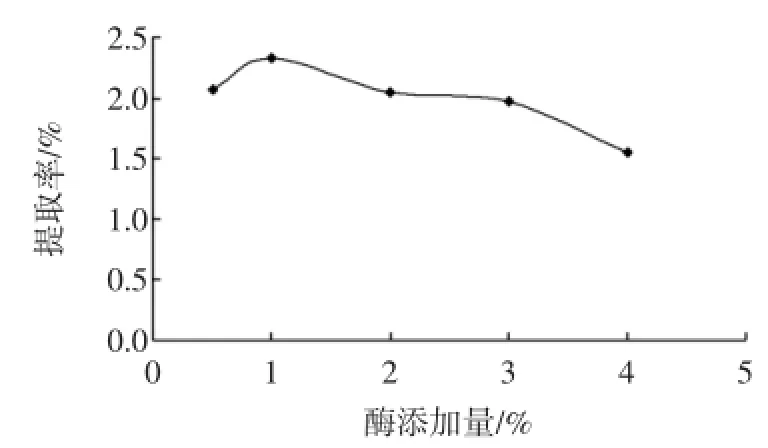
图3 混合酶添加量对硫酸皮肤素提取率的影响Fig.3 Effect of mixed enzymes addition on yield of dermatan sulfate
酶的添加量从0.5%增加到1%,硫酸皮肤素的提取率逐渐提高,但随着酶量的增加提取率不升反降,其原因可能是1%左右的加酶量就足以使样品全部水解,酶作为一种蛋白质,未起作用的多余的酶的性质发生了改变,可能水解成多肽或小的片段,在提取液中影响提取率的测定。同时考虑到成本因素,1%为最适合的酶添加量。
3.2.3 pH对提取率的影响
pH对硫酸皮肤素提取率的影响如图4所示。
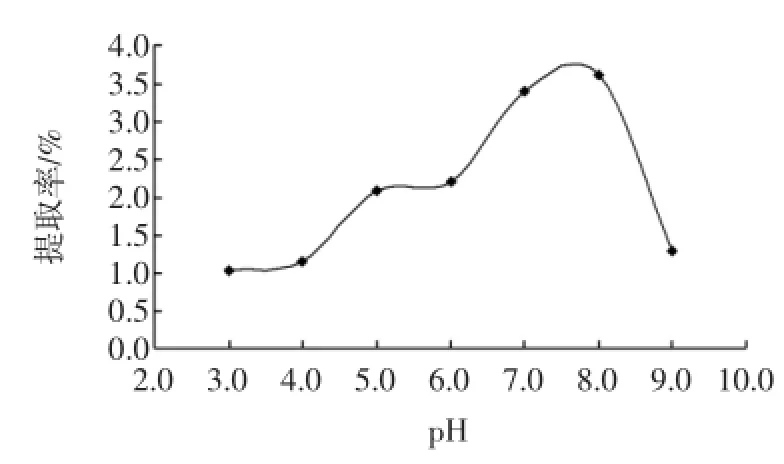
图4 pH对硫酸皮肤素提取率的影响Fig.4 Effect of pH on yield of dermatan sulfate
提取率在pH8.0之前呈上升趋势,在pH3.0~4.0,5.0~6.0范围内坡度较缓,而且提取率基本相等。pH6.0以后,提取率急速上升,约在pH8.0处达最大值,而pH8.0以后提取率又急速下降,说明在这个范围的pH对提取率的影响极大,所以选择pH8.0为最适合pH。
3.2.4 温度对提取率的影响
温度对硫酸皮肤素提取率的影响如图5所示。
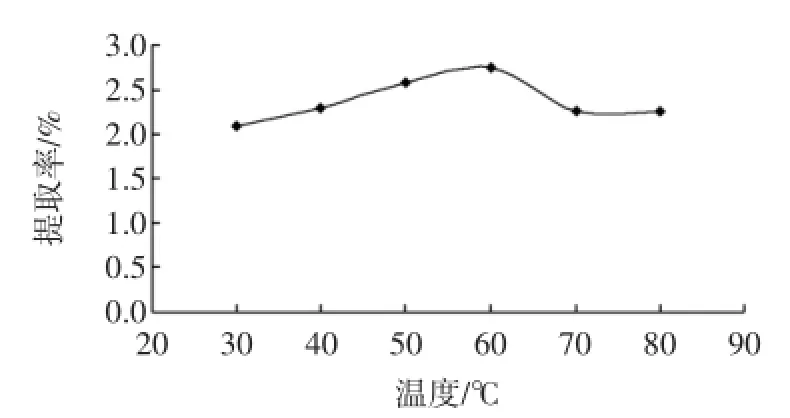
图5 温度对硫酸皮肤素提取率的影响Fig.5 Effect of temperature on yield of dermatan sulfate
温度的变化对提取率的影响较为缓和,60℃以前平缓增加,60℃时达最大值,随着温度升高,提取率又有所降低。即便较高的温度有助于提高提取率,但高温条件下会破坏硫酸皮肤素的结构,影响生物活性,本实验采用60℃为最佳提取温度。
3.2.5 时间对提取率的影响
时间对硫酸皮肤素提取率的影响如图6所示。
在所有因素中,时间的变化对提取率的影响最不明显,尤其在16 h~28 h之间,小于16 h有一个较为显著的上升趋势,考虑到实际生产周期以及短时间提取可能引起产品纯度不高等因素,综合比较,选择20 h为宜。
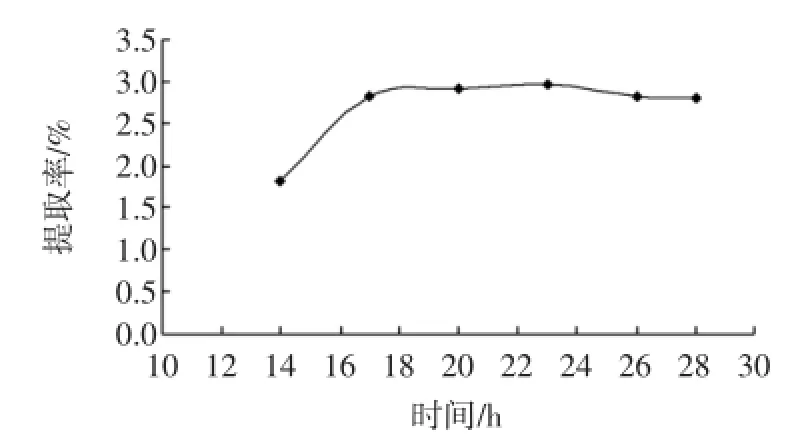
图6 时间对硫酸皮肤素提取率的影响Fig.6 Effect of time on yield of dermatan sulfate
3.3 正交试验结果
正交试验结果见表2。
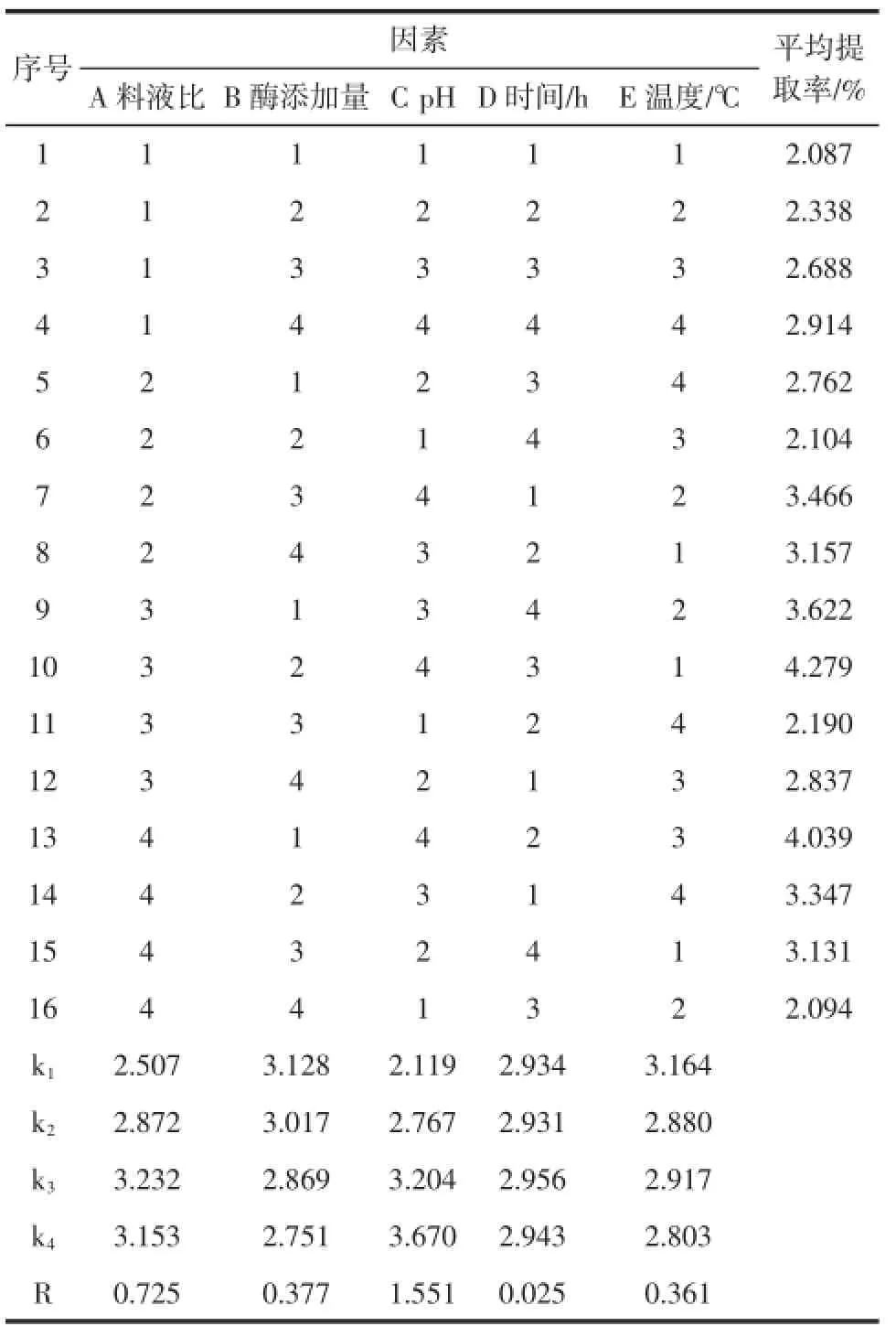
表2 正交试验设计及结果Table2 Orthogonal design and results
影响硫酸皮肤素提取率的因素主次顺序为:C>A>B>E>D,即pH>料液比>酶添加量>提取温度>提取时间。硫酸皮肤素最佳提取工艺条件为:A3B1C4D3E1,即料液比为1∶25,酶添加量0.5%,pH8.5,提取时间22 h,提取温度为50℃。按上述最佳条件,从鳕鱼皮中提取硫酸皮肤素,经3次提取,平均提取率为4.409%。
本文采用正交试验探讨硫酸皮肤素提取的最佳工艺条件,最后提取物为硫酸皮肤素粗品,可能含有其它种类的糖胺聚糖和小分子的蛋白质。以后的工作将对粗品进行分离提纯,对硫酸皮肤素含量进行测定。
[1] 陈国荣.糖化学基础[M].上海:华东理工大学出版社,2009:87-88
[2]Noti C,Seeberger P H.Chemical approaches to define the structureactivity relationship of heparinlike glycosaminoglycans[J].Chem Biol,2005,12(7):731-756
[3]谢继青,姬胜利,王凤山,等.硫酸皮肤素的药理作用研究进展[J].药物生物技术,2001,8(4):234
[4] Sie P,Dupouy D,Caranobe C,et al.Antithrombotic properties of a dermatan sulfate hexadecasaccharide fractionated by affinity for heparin cofactorⅡ[J].Blood,1993,81(7):1771-1777
[5] Mehta V B,C onnors L,Wang HC,et al.Fibroblast variants nonresponsive to fibroblast growth factor are defective in its nuclear translocation[J].J Biol Chem,1998,273(7):4197-4205
[6] Santra M,Mann D M,Mercer E W,et al.Ectopic expression of decorin protein core causes a generalized growth suppression in neoplastic cells of various histogenetic origin and requires endogenous p21,an inhibitor of cyclin-dependent kinases[J].J clin invest, 1997,100(1):149-157
[7] Penc S F,P omahas B,Winkler T,et al.Dermatan sulfate released after injury is a potent promoter of FGF22 activity[J].J Biol Chem, 1998,273(43):28116-28121
[8] 唐怡,李耀功.伟素—新型肝素类药物[J].中国新药杂志,1999,8 (6):414
[9]张树政.糖生物学与糖生物工程[M].北京:清华大学出版社, 2002:56-65
[10]石滨,郭学平,苏涛.L-硫酸皮肤素的研究概况[J].中国生化药物杂志,2001,22(2):105-106
[11]Sakai S,Kim W S,Leel S,et al.Purification and characterization of dermatan sulfate from the skin of the eel.Anguilla japonica[J].Carbohydrate Research,2003,338(3):263-269
[12]Souza MLS,Dellias JMM,Melo FR,et al.Structural composition and antico agulant activit y of dermatan sulfate from the skin of the electriceel,Electrophorus electricus(L)[J].Comparative Biochemistry and Physiology PartB,2007,147(2):387-394
[13]Chataiioannidis C C,Kar amano s N K,Tseg enidis T.Isolation and characterisation of a small dermatan sulphate proteogycan from ray skin(Rajaclavata)[J].Comparative Biochemistry and Physiology Part B,1999,124(1):15-24
[14]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社, 1999:94-408
Extraction of Dermatan Sulfate from Cod Skin
SUN Ping,DU De-hong,CAO Run-zhi
(College of Food Science and Engineering,Qingdao Agricultural University,Qingdao 266109,Shandong,China)
In this paper,the dermatan sulfate was extracted from cod skin with mixed enzymes including papain and trypsin to obtain the final product through ethanol precipitation.The optimum extracting conditions of dermatan sulfate were investigated by single factor and orthogonal tests.The results showed that the optimum technological conditions were as follows:liquid-solid ratio was 25∶1,enzymes addition was 0.5%,pH8.5,extraction time was 22 h,extraction temperature was 50℃.Extraction rate was 4.409%by this process conditions.
cod skin;papain;trypsin;dermatan sulfate;extraction
10.3969/j.issn.1005-6521.2015.03.007
2013-12-02
孙萍(1969—),女(汉),高级实验师,本科,研究方向:食品营养与安全。
