ST6Gal I调控胃癌细胞SGC7901增殖迁移能力的初步研究
2015-12-27诸梦露刘婷婷彭晓丹林绍强温州医科大学药学院浙江温州325035
诸梦露,刘婷婷,彭晓丹,林绍强(温州医科大学 药学院,浙江 温州 325035)
·论 著·
ST6Gal I调控胃癌细胞SGC7901增殖迁移能力的初步研究
诸梦露,刘婷婷,彭晓丹,林绍强
(温州医科大学 药学院,浙江 温州 325035)
目的:探讨唾液酸转移酶(ST6Gal I)对人胃癌细胞(SGC7901)增殖和迁移能力的影响。方法:采用脂质体2000(Lipofectamine 2000),构建ST6Gal I高表达和ST6Gal I低表达细胞株,以空载体(Vector)作为对照组。采用实时荧光定量PCR(real-time PCR,RT-PCR)检测转染后SGC7901细胞中ST6Gal I的mRNA水平;用细胞CCK-8试剂盒及Transwell小室实验检测转染前后细胞的增殖、迁移情况。结果:成功构建稳定转染单克隆细胞株分别为Vector、X61-4和PS7;与Vector组相比,PS7组的mRNA表达水平显著增加(P<0.05),X61-4组则显著降低(P<0.05);X61-4的细胞增殖明显高于PS7细胞(P<0.05);胃癌细胞ST6Gal I的表达水平与细胞迁移能力成正相关,PS7组的迁移率显著高于X61-4组(P<0.01)和Vector组(P<0.01),X61-4组的迁移率低于Vector组(P<0.05)。结论:细胞实验表明,降低ST6Gal I的表达可以有效促进胃癌SGC7901细胞的增殖能力,而上调ST6Gal I可以增强胃癌细胞的迁移能力。因此,ST6Gal I是与肿瘤增殖和转移相关的基因,是潜在的肿瘤分子治疗靶点。
唾液酸转移酶;胃肿瘤;唾液酸化;增殖;迁移
胃癌是世界上病死率极高的一种恶性肿瘤。据统计,每年因癌症死亡人达100万,其中胃癌致死率位列第二[1]。复发和转移是影响胃癌患者死亡的主要因素,但具体机制尚未清楚[2]。糖复合物由一些重要的生物分子构成,包括糖蛋白、糖脂和蛋白聚糖[3],肿瘤相关的糖复合物已经成为重要疾病发生发展的生物标记之一[3-5]。糖蛋白和糖脂寡糖链的末端往往装饰着唾液酸,唾液酸转移酶(ST6Gal I)是糖基转移酶家族成员之一,负责在糖蛋白或糖脂的非还原性末端特异性地加上单个唾液酸或多个唾液酸[6]。糖基化修饰的一种重要形式是唾液酸化修饰,ST6Gal I通过α2,3-,α2,6-或α2,8-连接方式将唾液酸链接到特定的底物上,属于糖基化转移酶家族。在此,我们重点研究α2,6-唾液酸转移酶,ST6Gal I在转移肿瘤组织中呈高表达[7]。
最新研究报道,肿瘤细胞的黏附和侵袭受到细胞表面过度α-2,6唾液酸化的极大影响。本课题拟以人胃癌细胞株(SGC7901)为研究对象,通过沉默和上调细胞表面的ST6Gal I的表达,经氨基糖苷类抗生素(G418)和杀稻瘟菌素S盐酸盐筛选后获得稳定细胞株,进而探讨细胞的增殖和迁移能力的研究,为胃癌的基因治疗提供有效靶点。
1 材料和方法
1.1 实验细胞 SGC7901细胞由温州医科大学实验室提供,置于-80 ℃冰箱冻存。
1.2 材料和仪器 FBS胎牛血清、1640培养基、Transwell(美国Gibco公司);实时荧光定量PCR real-time PCR,RT-PCR)试剂盒(日本TaKaRa公司);引物(温州长风生物有限公司);Takara反转录试剂盒(日本Takara公司);超净工作台(苏州净化设备有限公司);PCR仪(德国Biometra公司);荧光显微镜(日本Olympus公司);Spectra Max M2多功能酶标仪(美国Molecular Devices公司)。
1.3 方法
1.3.1 质粒的构建:干扰质粒Vector和ST6Gal I低表达质粒(X61-ST6Gal I)均由美国Invitrogen公司合成并构建。
1.3.2 细胞培养与稳定转染:SGC7901细胞培养于含有10% FBS、1%双链霉素的1640培养基中,置于37℃、5% CO2的培养箱中培养,细胞长到70%~80%时用含有0.25% EDTA的胰酶消化传代,取对数生长期的细胞用脂质体2000(Lipofectamine 2000)进行转染。转染后的细胞分为3组,分别为ST6Gal I高表达细胞株PS,ST6Gal I低表达细胞株X61,阴性对照组细胞株Vector。经过30 d的筛选,用RT-PCR进行验证,选择转染效果最好的单克隆株进行后续实验。
1.3.3 RT-PCR检测各组细胞株:ST6Gal I的表达量:①提取ST6Gal I RNA:设计2对RT-PCR的引物,用于扩增ST6Gal I和GAPDH序列。引物由美国Invitrogen公司合成。引物序列如下表1。细胞总RNA的具体提取步骤可参照文献[2]。各样品取500 ng的总RNA按照Takara的反转录试剂盒(primerscript®RTMaster Mix)的说明书进行操作,用随机引物进行反转录成cDNA,置于-20 ℃冰箱进行保存。②扩增ST6Gal I基因:将反转录所得的cDNA稀释10倍后,各取1μL 的cDNA稀释液根据RT-PCR试剂盒进行PCR扩增(此操作在冰上进行),实验重复3次。扩增体系如下表2,PCR循环参数如下表3。③在每组样品中挑选最佳效果的样品,取5μL于1.0%的琼脂糖胶上进行电泳,凝胶成像系统下观察结果并拍照。
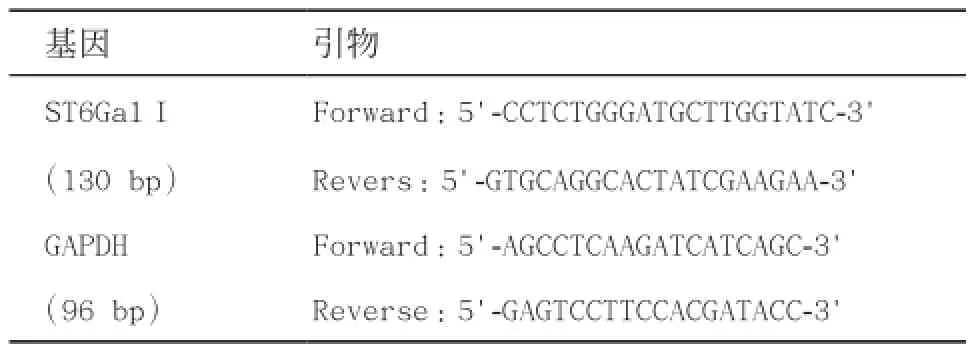
表1 RT-PCR各基因的引物

表2 RT-PCR扩增体系

表3 RT-PCR循环参数
1.3.4 细胞增殖活性实验:分别取对数生长期的3组细胞,在96孔板中接种细胞悬液,取其中一块板作为0 h时间点,其余的继续在37 ℃、5% CO2的细胞培养箱中培养。测定时间点设置为0、24、48、72、96、120、144 h。时间到点时,加入10 μL的CCK-8溶液,用酶标仪(酶联免疫检测仪)测定450 nm处的吸光度。
1.3.5 Transwell小室细胞迁移实验:选择单层生长状态良好的3组细胞,细胞无血清饥饿24 h。在Transwell小室的下室加入600μL含10% FBS的1640培养基,上室加入培养基100μL,在37 ℃、5% CO2的细胞培养箱中孵育24 h后,室温下固定,结晶紫染色。采用Leica DC 300F正置显微镜进行观察和拍照。最后,用33%醋酸脱色,在酶标仪上570 nm处检测其OD值,以OD相对值表示细胞迁移能力的大小。
1.4 统计学处理方法 采用GraphPad Prism 5统计软件对数据进行统计学分析。所有实验均重复3次,所有数据用±s表示,多组间均数比较采用ANOVA检验。P<0.05认为差异有统计学意义。
2 结果
2.1 ST6Gal I mRNA表达水平 稳定转染共筛选出9个PS、12个X61和7个Vector单克隆细胞株。PS组细胞mRNA表达均高于SGC7901细胞(见图1A),X61组细胞的表达均低于SGC7901细胞(见图1B),其中以PS7细胞株和X61-4号细胞株效果最佳,Vector组与SGC7901细胞相比,差异无统计学意义(见图1C)。因此,选用PS7、X61-4、Vector-2作为实验对象,分明命名为PS7、X61-4和Vector。
琼脂糖凝胶电泳图中ST6Gal I与GAPDH灰度值的比值结果显示(见图2),PS7组、X61-4组和Vector 组mRNA表达水平分别为:1.096±0.09、0.43±0.03、0.69±0.07。统计学分析表明,PS7组与Vector组比较,差异具有统计学意义(P<0.01),X61-4组与Vector组比较,差异具有统计学意义(P<0.05)。RT-PCR实验结果表明,成功构建ST6Gal I稳转高表达细胞株PS7和ST6Gal I稳转低表达细胞株X61-4。
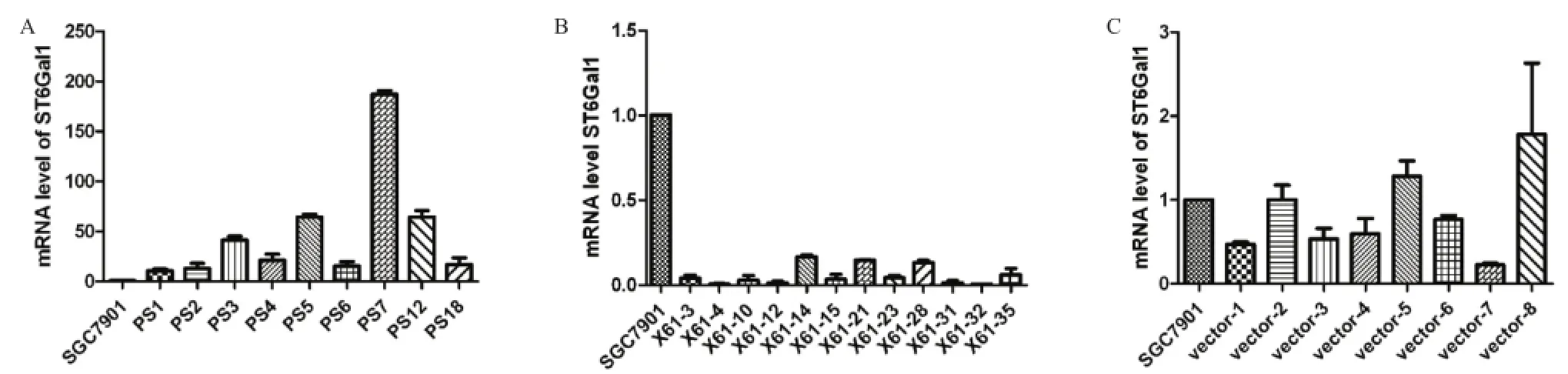
图1 稳转细胞株ST6Gal I的mRNA表达水平

图2 RT-PCR产物的琼脂糖凝胶电泳分析
2.2 ST6Gal I的改变对SGC7901细胞增殖和迁移能力的影响
2.2.1 ST6Gal I对SGC7901细胞体外增殖的影响:为了考察ST6Gal I在体外对SGC7901细胞增殖能力的影响,我们在建立稳定转染细胞株的基础上,用CCK-8试剂盒检测各组细胞体外增殖情况。各组细胞培过7 d,并定时测定OD值,OD值越大说明活细胞越多,细胞增殖能力则越强。从曲线趋势(见图3)我们可以看出Vector组细胞增殖速度最快,PS7组细胞增殖速度较慢,X61-4组细胞增殖速度居中,与Vector组细胞相比差异均具有统计学意义(P<0.05)。
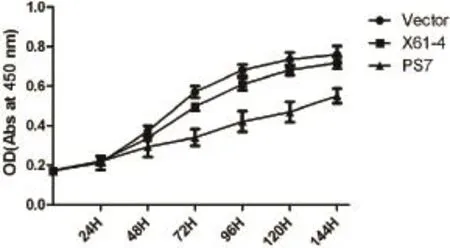
图3 各组细胞生长曲线
2.2.2 Transwell小室细胞迁移实验检测各组细胞的迁移能力:为了验证ST6Gal I的表达量对细胞迁移能力的影响,我们用Transwell小室细胞迁移实验检测各组细胞的迁移能力。用Leica DC 300F正置显微镜进行拍照(见图4),PS7组细胞的穿膜细胞数最多,X61-4组细胞最少,Vector组细胞居中。拍照后,用33%醋酸脱色,将结晶紫完全洗脱下来,洗脱液在酶标仪上570 nm处测其OD值。OD值分别为:X61-4组细胞:0.45±0.14,Vector组细胞:1.29±0.18,PS7组细胞:2.35±0.30。以穿膜细胞的相对OD值来反映细胞迁移力的大小。PS7组细胞的迁移能力明显升高(见图5),与Vector组相比差异具有统计学意义(P<0.01),X61-4组细胞明显降低,与Vector组相比差异具有统计学意义(P<0.05)。实验结果表明上调ST6Gal I表达可以促进细胞的迁移能力。
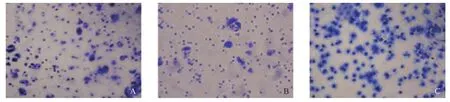
图4 Transwell小室细胞迁移实验检测各组细胞的迁移能力(×200)
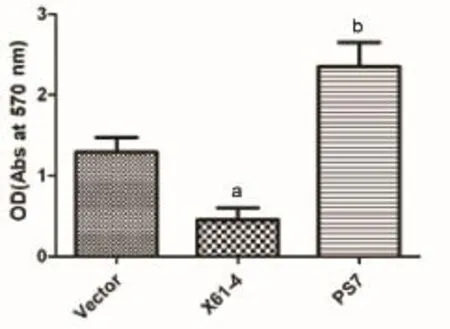
图5 各组细胞的迁移能力统计
3 讨论
唾液酸是连接在细胞表面糖蛋白或糖脂糖链末端的一种生理pH值条件呈负电荷的,含有9个碳原子的糖[8]。研究表明,唾液酸酶和唾液酸糖基转移酶在体内参与许多重要的生理和病理过程[9-11]。在肿瘤细胞中,肿瘤的恶性程度、不良预后常常与唾液酸转移酶的异常表达有关。一般而言,唾液酸转移酶的异常变化,伴随着肿瘤的恶化、高侵袭性和预后差。其中,ST6Gal I与癌症的发生发展密切相关,广泛参与肿瘤细胞的异常增殖信号的转导、细胞黏附、细胞迁移、对辐射的耐受性和对化疗药的耐药性等[12-13]。
为了探索ST6Gal I对胃癌细胞的影响,本研究通过脂质体2000将ST6Gal I高低表达质粒及相应空载质粒转入SGC7901细胞。转染后用抗生素进行稳定筛选,采用RT-PCR检测转染后各组细胞ST6Gal I mRNA的表达水平,结果显示PS7组细胞的ST6Gal I表达量最高,X61-4组细胞最低。以上结果提示我们成功得到了ST6Gal I高低表达阳性克隆细胞株。有实验显示,苑天红等[14]采用ASO(反义核酸)与siRNA两种技术,有效地降低人结肠癌细胞(SW480)的ST6Gal I的表达并降低细胞表面唾液酸化水平,还能显著降低SW480细胞黏附和侵袭细胞外基质(ECM)的能力。最近几年,有报道显示为了了解ST6Gal I与恶性结肠癌的相关性,Park等[15]在SW480细胞中构建了ST6Gal I敲除细胞株。结果发现,不管是体外实验还是体内实验,ST6Gal I表达量的降低将显著促进细胞增殖和肿瘤生长。本研究为了探索ST6Gal I对胃癌增殖迁移作用的影响,在之前构建的3组细胞的基础上,采用CCK-8试剂盒检测转染ST6Gal I后的细胞在24、48、72、96、120、144 h的细胞增殖能力,结果显示ST6Gal I表达水平的降低显著促进SGC7901细胞的增殖,但ST6Gal I表达水平的升高没有抑制SGC7901细胞的增殖。这种现象不只在细胞实验中出现,在SW480细胞[15]肿瘤移植实验的结果同样显示ST6Gal I敲除细胞株成瘤性显著增加,而ST6Gal I高表达细胞株的成瘤性与阴性对照组相比,虽然有所增加,差异无统计学意义。综上所述,ST6Gal I与SGC7901细胞的增殖有关,但是其内在分子机制仍需进一步的研究。为了探索ST6Gal I对胃癌迁移作用的影响,我们进行了Transwell体外迁移实验。结果显示,ST6Gal I高表达细胞株的迁移能力显著增强,而Vector组细胞株的迁移能力次之,ST6Gal I低表达细胞株的迁移能力最弱。从结果中我们推断ST6Gal I在胃癌迁移过程中发挥了重要作用,但ST6Gal I发挥了什么机制作用值得我们进行深入研究。
肿瘤恶性转移对肿瘤患者的预后具有重要意义,尤其是恶性肿瘤患者发生死亡的一个最主要的原因就是肿瘤的转移。肿瘤细胞的迁移和增殖与其细胞外基质的相互作用是不可分割的,而肿瘤与细胞外基质相互作用主要通过细胞表面糖复合物末端的的唾液酸化程度,肿瘤细胞表面唾液酸化的异常可以直接影响肿瘤细胞的迁移和增殖能力。
总之,ST6Gal I诱导的细胞膜表面受体的唾液酸化,从而影响肿瘤细胞功能变化,再结合唾液酸转移酶抑制剂的研究,为开发新型有效的抗肿瘤药物提供了可靠的依据。
[1] Brenner B,Hoshen MB,Purim O,et al.MicroRNAs as a potential prognostic factor in gastric cancer[J].World J Gastroenterol,2011,17(35):3976-3985.
[2] Kim HJ,Eun JY,Jeon YW,et al.Efficacy and safety of oxaliplatin,5-fluorouracil,and folinic acid combination chemotherapy as first-line treatment in metastatic or recurrent gastric cancer[J].Cancer Res Treat,2011,43(3):154-159.
[3] Reis CA,Osorio H,Silva L,et al.Alterations in glycosylation as biomarkers for cancer detection[J].J Clin Pathol,2010,63(4):322-329.
[4] Varki A,Kannagi R,Toole BP.Glycosylation changes in cancer[J].Essentials of Glycobiology,2009,Chapter 44:580-670.
[5] Drake PM,Cho WY,Li BS,et al.Sweetening the pot:adding glycosylation to the biomarker discovery equation[J].Clin Chem,2010,56(2):223-236.
[6] Harduin Lepers A,Vallejo Ruiz V,Krzewinski Recchi MA,et al.The human sialyltransferase family[J].Biochimie,2001,83(8):727-737.
[7] Lee M,Park JJ,Ko YG,et al.Cleavage of ST6Gal I by radiation-induced BACE1 inhibits golgi-anchored ST6Gal I-mediated sialylation of integrin beta1 and migration in colon cancer cells[J].Radiat Oncol,2012,7:47.
[8] Dall’Olio F,Chiricolo M.Sialyltransferases in cancer[J].Glycoconjugate J,2001,18(11-12):41-850.
[9] Korekane H,Matsumoto A,Ota F,et al.Involvement of ST-6Gal I in the biosynthesis of a unique human colon cancer biomarker candidate,alpha2,6-sialylated blood group type 2H(ST2H) antigen[J].J Biochem,2010,148(3):359-370.
[10] Lee M,Park JJ,Lee YS.Adhesion of ST6Gal I-mediated human colon cancer cells to fibronectin contributes to cell survival by integrin beta1-mediated paxillin and AKT activation[J].Oncol Rep,2010,23(3):757-761.
[11] Christie DR,Shaikh FM,Lucas JA,et al.ST6Gal I expression in ovarian cancer cells promotes an invasive phenotype by altering integrin glycosylation and function[J].J Ovarian Res,2008,1(1):3.
[12] Kitazume Kawaguchi S,Dohmae N,Takio K,et al.The relationship between ST6Gal I Golgi retention and its cleavage-secretion[J].Glycobiology,1999,9(12):1397-1406.
[13] Amano M,Galvan M,He J,et al.The ST6Gal I sialyltransferase selectively modifies N-glycans on CD45 to negatively regulate galectin-1-induced CD45 clustering,phosphatase modulation,and T cell death[J].J Biol Chem,2003,278(9):7469-7475.
[14] 苑天红,李明远,李婉宜,等.靶向ST6GALⅠ的siRNA与反义寡核苷酸联合应用对结肠癌细胞转移能力的影响[J].南方医科大学学报,2007,27(2):136-140.
[15] Park JJ,Yi JY,Jin YB,et al.Sialylation of epidermal growth factor receptor regulates receptor activity and chemosensitivity to gefitinib in colon cancer cells[J].Biochem Pharmacol,2012,83(7):849-857.
(本文编辑:吴昔昔)
Investigation of ST6Gal I on the ability of proliferation and migration in SGC7901 gastric cancer cell
ZHU Menglu,LIU Tingting,PENG Xiaodan,LIN Shaoqiang.
School of Pharmacy,Wenzhou Medical University,Wenzhou,325035
Objective:To explore the effect of α2,6 sialytransferase (ST6Gal I) on the abilities of proliferation and migration in SGC7901 cells.Methods:Gastric cancer cell lines SGC7901 were constructed to ST6Gal I high expression (PS7) and ST6Gal I lower expression (X61) with lipofectamine 2000 and empty vector (Vector) was used as a control group.The expression of ST6Gal I was examined with RTPCR.Cell proliferation was evaluated with the CCK-8 kit,and migration was evaluated with Transwell chamber assay.Results:The 3 stable transfected cell lines were constructed successfully.The most effective clone cells were chosed as our experimental cells,and named as Vector,X61-4 and PS7.In contrasted with Vector,the expression of ST6GAL I in X61-4 was statistically significant lower (P<0.05),and PS7 was statistically significant higher (P<0.05).Cell growth curve showed that cell proliferation of X61-4 was obviously higher than that of PS7 cells (P<0.05).The transwell chamber assay results showed that the migration of PS7 was significantly higher than that of the X61-4 (P<0.01) and Vector (P<0.01),X61-4 was lower than that of the Vector (P<0.05).Conclusion:Cell experiment results show that lower ST6Gal I can effectively promote the proliferation ability of SGC7901 gastric cancer cells,but high ST6Gal I can enhance gastric cancer cell migration ability.Therefore,ST6Gal I is related to the tumor proliferation and metastasis,and it is also a potential tumor molecular therapeutic targets.
ST6Gal I; stomach neoplasms; sialylation; proliferation; migration
R73-37
A
10.3969/j.issn.2095-9400.2015.04.001
2014-10-29
国家自然科学基金资助项目(81071751,80212074)。
诸梦露(1988-),女,浙江宁波人,硕士生。
林绍强,教授,博士生导师,Email:shaotsiang@163.com。
