垂盆草提取物对TGF-β 1诱导的肾小管上皮细胞-肌成纤维细胞转分化和基质累积的影响
2015-12-27杨嫆嫆陆红吴莲凤王斯璐林成成梁勇白永恒温州医科大学附属第一医院浙江温州3505医学检验中心外科实验室
杨嫆嫆,陆红,吴莲凤,王斯璐,林成成,梁勇,白永恒(温州医科大学附属第一医院,浙江 温州 3505,.医学检验中心;.外科实验室)
·论 著·
垂盆草提取物对TGF-β 1诱导的肾小管上皮细胞-肌成纤维细胞转分化和基质累积的影响
杨嫆嫆1,陆红1,吴莲凤1,王斯璐2,林成成2,梁勇2,白永恒2
(温州医科大学附属第一医院,浙江 温州 325015,1.医学检验中心;2.外科实验室)
目的:探讨垂盆草提取物(SSBE)对转化生长因子(TGF-β1)诱导的肾小管上皮细胞-肌成纤维细胞转分化(EMT)和基质累积的影响。方法:将体外培养的大鼠肾小管上皮细胞系(NRK-52E)细胞分为只加入溶剂的对照组,只加入TGF-β1(浓度为5μg/L)的诱导组,以及加入SSBE(浓度为10和100 mg/L)和TGF-β1(浓度为5μg/L)的干预组。细胞形态变化采用倒置相差显微镜观察;细胞免疫荧光染色检测I I I型胶原、α-平滑肌肌动蛋白(α-SMA)和钙黏蛋白(E-cadherin)的表达;反转录聚合酶链反应检测α-SMA、骨形成蛋白-7(BMP-7)、紧密连接蛋白(Tjp1)、I型胶原(Col1a1)、I I I型胶原(Col3a1)、基质金属蛋白酶-2 (MMP-2)和抑制因子-2(TIMP-2)mRNA的表达。结果:TGF-β1作用后,NRK-52E细胞形态发生变化,形成了长梭状的肌成纤维细胞(MFs);其上皮标志物E-cadherin和Tjp1的表达水平显著下降,而MFs标志物α-SMA表达显著增加;基质成分Col1a1和Col3a1的表达也明显增高。应用10和100 mg/L的SSBE干预后,抑制了TGF-β1诱导的细胞形态改变和α-SMA、Col1a1和Col3a1的高表达,并促进E-cadherin和Tjp1的表达。另外,SSBE也提高了BMP-7表达水平和MMP-2/TIMP-2比值。结论:SSBE可抑制TGF-β1诱导的肾小管上皮细胞纤维化样改变,而这一作用与其能有效阻止EMT进程和基质累积有关。
垂盆草提取物;转化生长因子-β1;上皮-间叶转分化;基质累积
肾小管上皮细胞向肌成纤维细胞表型转化(epithelial-mesenchymal transition,EMT)是肾间质纤维化发生发展的关键环节[1]。在EMT过程中,小管细胞丧失了上皮细胞的标志,如钙黏蛋白(E-cadherin)等,形成了阳性表达α-平滑肌肌动蛋白α-SMA)的肌成纤维细胞(myofibroblasts,MFs)[2]。MFs是一种基质产生细胞,可分泌大量基质成分I型胶原(Col1a1)和I I I型胶原(Col3a1)在肾组织间隙累积从而导致纤维化的发生。抑制EMT进程,对防治肾间质纤维化具有十分重要的意义。垂盆草是一种景天科多年生草本植物,我们的前期研究显示,其提取物(Sedum sarmentosum Bunge extract,SSBE)可拮抗马兜铃酸所致的肾小管上皮细胞纤维化样改变[3]。这种抗纤维化作用,我们推测可能与SSBE抑制TGF-β 1的高表达密切相关。因此,本研究中我们拟采用TGF-β 1诱导肾小管上皮细胞(NRK-52E)出现EMT转变,来探讨SSBE对EMT和基质累积的影响。
1 材料和方法
1.1 材料 SSBE,安徽宣城百草植物工贸公司;DMEM细胞培养液,美国Hyclone公司;胎牛血清,杭州四季青生物公司;胰蛋白酶和TRIzol提取液,美国Gibco公司;人重组TGF-β 1蛋白,美国PeproTech公司;Col3a1一抗,北京Bioss公司;α-SMA一抗,美国Santa Cruz公司;E-cadherin一抗,美国Abcam公司;荧光素(FITC)标记山羊抗兔IgG,北京康位生物公司;RT-PCR试剂,美国Promega公司。MyCycler梯度PCR仪,美国Bio-Rod公司;7500定量PCR仪,美国Applied Biosystems公司;Varioskan Flash全波长多功能扫描仪,美国Thermo Scien-tific公司;DM4000 B LED荧光正置显微镜,德国Leica公司。
1.2 方法
1.2.1 细胞:大鼠肾小管上皮细胞株(NRK-52E)购于中科院上海生命科学研究院细胞资源中心。
1.2.2 实验分组和细胞形态学观察:细胞培养前,按适当浓度接种于六孔板中,待融合到70%~80%时,换成无血清DMEM培养液并开始正式实验。①对照组:未加入SSBE或TGF-β 1;②诱导组:培养液中加入TGF-β 1(浓度为5μg/L);③治疗组:培养液中同时加入SSBE和TGF-β 1(浓度为5μg/L),SSBE的浓度分别为10和100 mg/L。上述处理后的细胞置37 ℃和5% CO2的培养箱中培养,用倒置相差显微镜观察细胞形态变化。
1.2.3 real-time RT-PCR检测mRNA表达:采用Trizol试剂提取已处理细胞中的RNA,于260/280 nm测定吸光度值以确定样本纯度和浓度。根据试剂说明书将RNA反转录成cDNA。设计骨形成蛋白-7(BMP-7)、α-SMA、紧密连接蛋白(Tjp1)、基质金属蛋白酶2 (MMP-2)、基质金属蛋白酶组织抑制剂2(TIMP-2)、Col1a1和Col3a1 mRNA特异性引物,以β-actin作为内参对照(见表1),由上海捷瑞公司合成。取反转录产物1 μL进行PCR扩增,PCR扩增体系:5 μL 2×SYBR Green荧光定量试剂、2 μL引物(上、下游各1μL,终浓度200 nmol/L)、2μL反应缓冲液、1μL cDNA。扩增程序为:95 ℃ 5 min、95 ℃ 10 s、60 ℃ 35 s,40个循环。采用溶解曲线评价PCR结果可靠性,采用2-△△Ct计算相对mRNA表达量。△△Ct= [Ct目的基因(待测样品)-Ct内参(待测样品)]-[Ct目的基因(校正样品)-Ct内参(校正样品)]。
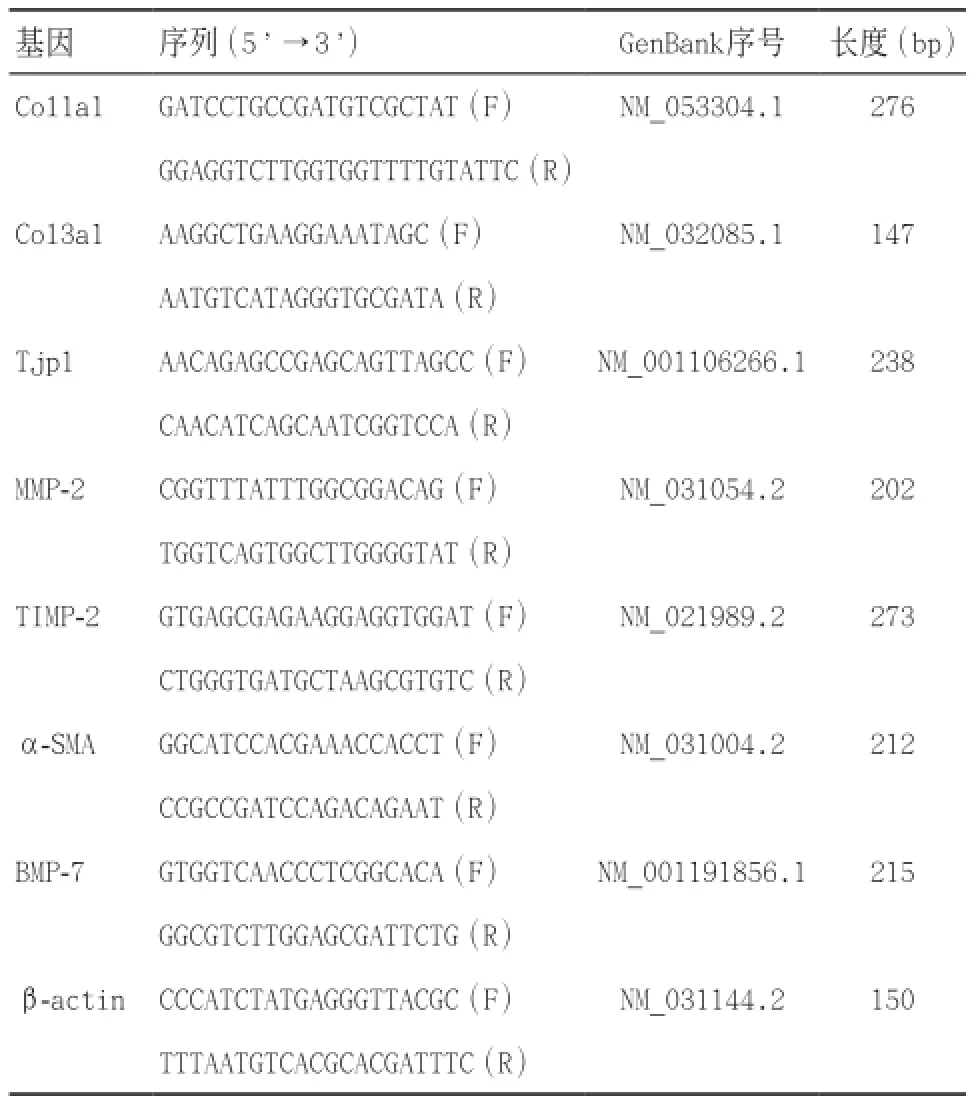
表1 扩增EMT和基质成分mRNA特异性引物
1.2.4 细胞免疫荧光染色检测EMT和基质成分相关分子的表达:将细胞经胰酶消化收集后分别以1× 105个细胞接种于含载玻片的六孔板中,细胞培养至70%融合后,分别用TGF-β 1和TGF-β 1联用SSBE进行处理24 h,用4%多聚甲醛固定30 min,0.3% Triton-X(1 mL/孔)破膜,室温20 min。0.5%正常山羊血清封闭。在各细胞爬片上滴加E-cadherin、α-SMA和Col3a1一抗工作液,4 ℃孵育过夜。滴加Dylight488(绿色)或594(红色)标记的二抗工作液,37 ℃孵育60 min。滴加DAPI于盖玻片上,室温染色5 min。细胞胞质绿色或红色和胞核蓝色为阳性着色。每组取3张片,每张片子取10个高倍视野,运用Image Pro Plus软件分析平均光密度值。
1.3 统计学处理方法 采用SPSS15.0统计学软件。计量数据以±s表示,两组样本比较采用t检验和精确概率法,多组间样本比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 SSBE抑制TGF-β1诱导NRK-52E细胞的形态改变
相差显微镜下,对照组NRK-52E细胞培养24 h后呈现铺路石状,细胞结合紧密,细胞间隙不明显(见图1);5μg/L的TGF-β 1的诱导下,NRK-52E细胞呈梭形或不规则形状,细胞间隙拉大;在TGF-β 1基础上用10 mg/L的SSBE干预后,梭形细胞有所改善,细胞间隙缩小;当SSBE浓度增加到100 mg/L后,细胞形态恢复到铺路石状,细胞间隙减小,相互间结合紧密。这些结果提示SSBE抑制了TGF-β 1诱导的小管上皮细胞纤维样改变,并呈现浓度依赖性。
2.2 SSBE抑制TGF-β1诱导的EMT和基质累积 免疫荧光染色结果显示,5 μg/L TGF-β 1的作用下,NRK-52E细胞中上皮细胞标志物E-cadherin蛋白的表达水平明显下调,而MFs标志物α-SMA的表达水平明显升高,见图2。此外,TGF-β 1也促进了基质成分Col3a1蛋白的表达。Real-time RT-PCR结果显示,TGF-β 1抑制了紧密连接蛋白Tjp1 mRNA的表达,促进了α-SMA、Col1a1和Col3a1 mRNA的表达(见图3)。应用10和100 mg/L SSBE干预后,TGF-β 1诱导的这些EMT改变以及基质累积均被抑制,并且其抑制作用呈现浓度相关性。

图1 SSBE对TGF-β 1作用下NRK-52E细胞形态的影响(×200)
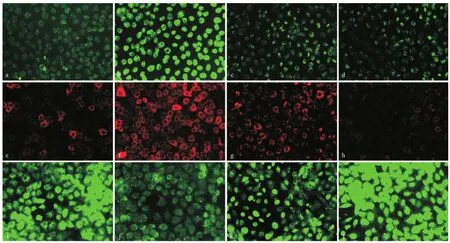
图2 SSBE对TGF-β 1作用下NRK-52E细胞EMT和胶原累积的影响(×200)

图3 SSBE对TGF-β 1诱导的EMT和基质累积相关基因表达的影响
2.3 SSBE逆转TGF-β1诱导的BMP-7高表达 以前研究显示,TGF-β 1诱导的EMT反应可被BMP-7所逆转,BMP-7表达下降可能是EMT形成重要的原因之一[4]。因此,我们评价了SSBE对BMP-7的影响。Real-time RT-PCR结果显示,在TGF-β 1作用后,NRK-52E细胞中BMP-7 mRNA的表达水平显著下调;而SSBE干预后,BMP-7 mRNA的表达水平恢复(见图4A)。
2.4 SSBE恢复TGF-β1诱导的MMP-2/TIMP-2失衡
MMP-2及TIMP-2是体内基质成分合成和降解重要的调节因素[5]。MMP-2/TIMP-2比例一旦降低,说明基质合成速度超过降解速度,导致基质累积和纤维化。本研究中,TGF-β 1虽同时上调了MMP-2和TIMP-2 mRNA表达水平,但上调TIMP-2 mRNA的程度高于MMP-2,从而导致其比例降低(见图4B-C)。而应用SSBE干预后,尽管MMP-2和TIMP-2 mRNA表达水平均下调,但TIMP-2 mRNA的表达水平下降更为严重。这些结果提示SSBE恢复了TGF-β 1诱导的MMP-2/TIMP-2失衡,从而改善基质成分累积程度。
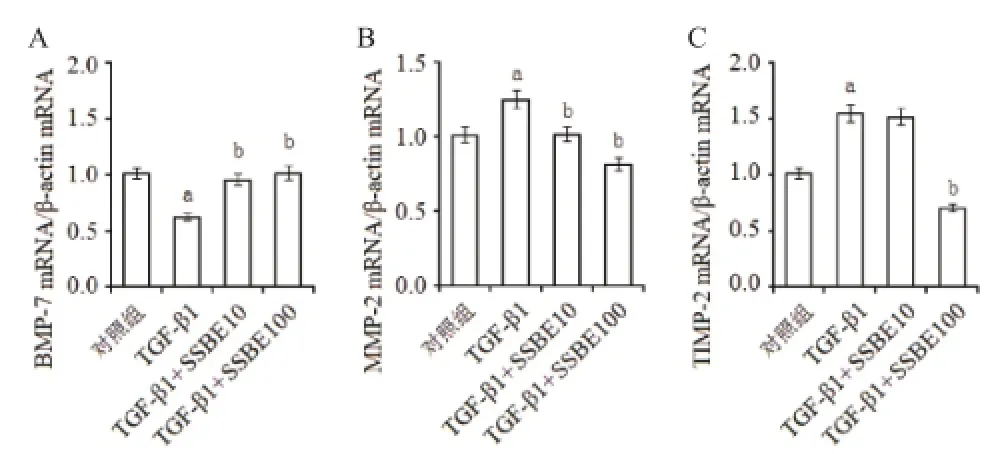
图4 SSBE干预TGF-β1对BMP-7、MMP2和TIMP-2 mRNA表达的影响
3 讨论
根据功能学和形态学分类,可将肾组织分为上皮和间叶两种细胞类型,每一种都有其特有的功能。上皮细胞是多细胞结构,由紧密连接的细胞组成,并紧密黏附于基底膜表面。间叶细胞(主要为MFs)则为连接疏松的细胞,主要存在于细胞外基质,它们自己产生并有非常强的迁移能力。现今越来越多的证据证明上皮细胞能通过EMT改变其表型获得MFs的特征,使其增加移动和合成基质成分,如Col1a1 和Col3a1等[2]。EMT通常见于胚胎生长期组织形态形成和肿瘤的生长过程。然而,在恶劣或损伤微环境中,上皮细胞可以通过EMT,使其获得适应环境的表型,参与损伤后组织修复和纤维化[5]。在机体内,多种因素均可导致EMT的发生,如促纤维因子TGF-β 1表达的升高,BMP-7表达的下调等[6-7]。本实验中,我们应用TGF-β 1作用肾小管上皮细胞后,小管上皮细胞出现纤维样改变,NRK-52E细胞表达上皮细胞标志物E-cadherin和Tjp1减少,而表达MFs标志物α-SMA增多,基质成分Col1a1和Col3a1表达增加,这些结果提示TGF-β 1诱导了EMT的发生。应用SSBE干预后,小管上皮细胞EMT转变得到缓解,并且拮抗EMT作用的BMP-7表达也随之升高。因此,这些结果提示SSBE能拮抗TGF-β 1诱导的EMT和肾纤维化作用。
SSBE为垂盆草的回流提取物[8],而后者属于景天科多年生草本植物,是中国药典记载的常用中药之一,具有清利湿热、解毒功效。考虑到SSBE是一种多组分的混合物,是否是由于其内组分的作用而影响其效应呢?我们前期通过高效液相色谱法测定其成分,发现SSBE中含有槲皮素、山萘酚、异鼠李素、木犀草素和异甘草素等,其中槲皮素含量最高。槲皮素又名栎精,具有降低血压、增强毛细血管抵抗力、减少毛细血管脆性、降血脂等作用。此外,槲皮素也具有抗肿瘤和抗纤维化的作用,并且这种抗纤维化作用主要是通过调控MMP-2的表达来实现[9]。本研究中,我们也分析了SSBE对MMP-2及其抑制因子TIMP-2表达的影响。结果发现SSBE恢复了由于TGF-β 1所致的MMP-2/TIMP-2比值下调,说明SSBE抑制了MFs合成基质,促进其降解。基于上述证据,推测SSBE的抗纤维化作用可能与其主要组分槲皮素存在一定的相关性。
综上所述,我们从体外实验角度证实了SSBE能拮抗TGF-β 1诱导的EMT效应,抑制基质合成,促进降解,进而发挥抗肾纤维化作用。在未来的工作,我们将评价SSBE各组分对于小管上皮细胞EMT以及肾纤维化的作用,并且深入探索其可能的分子机制,为今后纤维化类疾病的中草药治疗提供理论依据。
[1] Liu Y.Cellular and molecular mechanisms of renal fibrosis [J].Nat Rev Nephrol,2011,7(12):684-696.
[2] Liu Y.New insights into epithelial-mesenchymal transition in kidney fibrosis[J].J Am Soc Nephrol,2010,21(2):212-222.
[3] Bai Y,Lu H,Hu L,et al.Effect of Sedum sarmentosum BUNGE extract on aristolochic acid-induced renal tubular epithelial cell injury[J].J Pharmacol Sci,2014,124(4):445-456.
[4] Xu Y,Wan J,Jiang D,et al.BMP-7 counteracts TGF-beta1-induced epithelial-to-mesenchymal transition in human renal proximal tubular epithelial cells[J].J Nephrol,2009,22(3):403-410.
[5] Anglani F,Ceol M,Mezzabotta F,et al.The renal stem cell system in kidney repair and regeneration[J].Front Biosci,2008,13:6395-6405.
[6] 胡丽萍,陆红,白永恒,等.小G蛋白Rac1在马兜铃酸诱导肾小管上皮细胞损伤中的作用及意义[J].温州医学院学报,2013,43(12):775-778.
[7] Lian YG,Zhou QG,Zhang YJ,et al.VEGF ameliorates tubulointerstitial fibrosis in unilateral ureteral obstruction mice via inhibition of epithelial-mesenchymal transition[J].Acta Pharmacol Sin,2011,32(12):1513-1521.
[8] Bai Y,Lu H,Zhang G,et al.Sedum sarmentosum Bunge extract exerts renal anti-fibrotic effects in vivo and in vitro[J].Life Sci,2014,105(1-2):22-30.
[9] Yoon JS,Chae MK,Jang SY,et al.Antifibrotic effects of quercetin in primary orbital fibroblasts and orbital fat tissue cultures of Graves’ orbitopathy[J].Invest Ophthalmol Vis Sci,2012,53(9):5921-5929.
(本文编辑:吴健敏)
Effect of Sedum sarmentosum Bunge Extract on TGF-β1-induced renal epithelial-to-mesenchymal transi- tion and matrix accumulation
YANG Rongrong1,LU Hong1,WU Lianfeng1,WANG Silu2,LIN Chengcheng2,LIANG Yong2,BAI Yongheng2.
1.Department of Laboratory Medicine,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou,325015; 2.Wenzhou Key Laboratory of Surgery,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou,325015
Objective:To investigate the protective effects of Sedum sarmentosum Bunge Extract (SSBE) on TGF-β1-induced epithelial-to-mesenchymal transition (EMT) and matrix accumulation in renal tubular epithelial cells (NRK-52E).Methods:NRK-52E cells were divided randomly into:control group treated with only solvent,TGF-β1 group treated with TGF-β1 at the concentrations with 5 µg/L and SSBE group treated with TGF-β1 plus SSBE at the concentrations with 10 and 100 mg/L.The morphology of the NRK-52E cells was observed under inverted/phase contrast microscope.Immunofluorescent analysis was performed to detect the expression of epithelial marker α-smooth muscle actin (α-SMA),mesenchymal marker E-cadherin,and matrix component type III collagen.Gene expression of α-SMA,bone morphogenic protein-7 (BMP-7),tight junction protein-1 (Tjp1),Col1a1,Col3a1,MMP-2,and TIMP-2 were also quantified by real-time RT-PCR.Results:In TGF-β-treated NRK-52E cells,fibrosis-like phonotype was obviously increased.TGF-β1 increased the expression of α-SMA,and decreased the expression of E-cadherin and Tjp1.Also,TGF-β1 enhanced the expression of type I and III collagens.Treatment with SSBE at the concentrations with 10 and 100 mg/L inhibited TGF-β1-induced fibrosislike phenotype of NRK-52E cells,accompanied with down-regulated expression of α-SMA,Col1a1 and Col1a1 and up-regulated expression of E-cadherin and Tip1.In addition,SSBE increased the expression of BMP-7 and the ratio between MMP-2 and TIMP-2.Conclusion:SSBE treatment reduce TGF-β1-induced fibrosis-like reaction in renal tubular epithelial cells through inhibiting EMT and matrix accumulation.
Sedum sarmentosum Bunge Extract; TGF-β1; epithelial-to-mesenchymal transition; matrix accumulation
R730.52
A
10.3969/j.issn.2095-9400.2015.04.003
2014-09-11
浙江省自然科学基金资助项目(LQ12H05001);温州市科技计划项目(Y20110028,Y20140023)。
杨嫆嫆(1961-),女,浙江乐清人,主管技师。
白永恒,主管技师,Email:greatsailor@163.com。
