microRNA-101a与COX-2在尿酸性肾病模型中的变化
2015-12-27叶菡洋金建李占园陈琰郑育金领微周志宏
叶菡洋,金建,李占园,陈琰,郑育,金领微,周志宏
(温州医科大学附属第二医院,浙江 温州 325027,1.肾内科;2.内分泌科)
·论 著·
microRNA-101a与COX-2在尿酸性肾病模型中的变化
叶菡洋1,金建2,李占园1,陈琰1,郑育1,金领微1,周志宏1
(温州医科大学附属第二医院,浙江 温州 325027,1.肾内科;2.内分泌科)
目的:观察microRNA-101a(miR-101a)和环氧化酶-2(COX-2)在尿酸性肾病大鼠模型中的变化情况。方法:将24只雄性SD大鼠随机分成3组,即正常对照组(BC组)、模型组(M组)和塞来昔布组(S组),每组各8只,以含酵母和腺嘌呤的饲料喂养造模,21 d后检测各组大鼠血清中肌酐(Cr)、尿素氮(BUN)、尿酸(UA)的含量,并用实时定量PCR技术检测大鼠肾脏皮质中miR-101a的表达及Wersten Blot法检测COX-2及caspase-3的表达。结果:M组Cr、BUN、UA较BC组升高(P<0.05),S组Cr、BUN、UA较M组降低(P<0.05);M组miR-101a的表达较BC组明显降低(P<0.05),S组miR-101a的表达较M组大鼠升高(P<0.05);M组COX-2及caspase-3的表达较BC组明显升高(P<0.05),S组COX-2及caspase-3的表达较M组明显降低(P<0.05)。结论:miR-101a表达降低及COX-2表达升高可能参与高尿酸引起的肾脏损害的过程,COX-2特异性抑制剂塞来昔布可减轻其损害。
尿酸性肾病;microRNA-101a;环氧化酶-2;塞来昔布;凋亡;大鼠
高尿酸血症在我国当代人口中越来越常见,并有年轻化趋势,其导致的尿酸性肾病也是引起肾脏功能不全常见的原因之一。尿酸性肾病的主要机制是尿酸盐结晶在肾小管和肾间质的沉积而引起的局部炎症反应,炎症细胞浸润,导致肾小管上皮细胞凋亡坏死,上皮萎缩,间质纤维化。环氧化酶-2(cycloxygenase-2,COX-2)是公认的介导炎症的重要蛋白之一,在多种炎症的发生发展过程中起重要的促进作用[1]。近年来,研究报道microRNA-101a (miR-101a)具有调节COX-2表达的作用,参与许多炎症反应的过程[2-3]。本实验建立高尿酸血症大鼠模型,观察miR-101a和COX-2的表达水平,并研究COX-2特异性抑制剂塞来昔布是否具有减轻高尿酸引起的肾脏损害的作用。
1 材料和方法
1.1 材料和试剂 24只雄性SD大鼠(体质量200~250 g,实验动物合格证号20120002)购自上海莱克实验动物有限责任公司;酵母干粉,UNIPATH公司产品;腺嘌呤,MERCK公司产品;塞来昔布由辉瑞制药有限公司提供;血生化分析仪Roche cobasc 501购自德国罗氏诊断有限公司;RT试剂盒购自加拿大MBI Fermentas公司;miScript Reverse Transcription Kit购自Qiagen公司;DEPC水(RNase-free and DNasefree)均购自Invitrogen公司;PCR试剂盒(SYBR Green Real time PCR Master Mix),96孔板及封板膜均购自ABI公司;电泳转印系统购自BIO-RAD公司;COX-2和caspase-3引物均购自Invitrogen公司;BCA蛋白浓度测定试剂盒购自美国Pierce公司;COX-2抗体、caspase-3抗体及山羊抗兔抗体购自Abcam公司;Backman DU800计算机分光光度分析仪Backman;酶标仪ECX800购自Bio-TEX;其他试剂均为进口或国产分析纯。
1.2 大鼠饲养、分组及模型制作 24只雄性SD大鼠,均清洁级饲养环境稳定饲养,分3组,各8只:①正常对照组(BC组):给予常规的饲料(市售饲料)饲养;②模型组(M组):给予含酵母粉和腺嘌呤饲料(85 g市售饲料+15 g酵母+100 mg腺嘌呤)饲养[4];③塞来昔布组(S组):给予含酵母粉和腺嘌呤饲料(85 g市售饲料+15 g酵母+100 mg腺嘌呤)饲养,并予塞来昔布悬液25 mg/kg每日灌胃。21 d后静脉取血并取左侧肾脏皮质组织检测相关指标。
1.3 血清肌酐(Cr)、尿素氮(BUN)、尿酸(UA)的检测 造模21 d后,抽取大鼠静脉血,用常规生化测定方法检测肾功能指标Cr、BUN、UA的水平。
1.4 Real time PCR技术检测各组中miR-101a的表达量 取肾脏皮质组织50~100 mg,加Trizol裂解,氯仿萃取,异丙醇浓缩过夜,提取总RNA,再取100 ng总RNA,应用miRNA Isolation Kit分离小于100 nt的小分子RNA,应用miScript Reverse Transcription Kit反转录合成cDNA,反转录引物:5’-GTC GTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCTT CGTT-3’。在ABI 7500 FAST进行定量PCR检测。PCR条件:95 ℃ 5 s,60 ℃ 34 s,共40个循环。上游引物:5’-TTCGTCGTCGTCGGTACAGTACTGTGAT-3’,下游引物:5’-GCAGGGTCCGAGGTATTC-3’。以U6 RNA为内参,目的基因的相对表达率(relativeexpression,RQ)采用△△CT方法计算,miR-101a的△CT sample= CT sample-CT/U6 sample,△CT control=CT control-CT U6 control,△△CT=△CT sample-△CT control。
1.5 Western Blot检测各组中COX-2及caspase-3蛋白表达水平 取肾脏皮质组织约30 mg,加蛋白裂解液研磨,提取总蛋白,用BCA法测定蛋白浓度,取蛋白50 μ g,行10% SDS-PAGE电泳并转膜,用5%脱脂牛奶室温下封闭1.5 h。一抗(COX-2 antibody 1∶800,caspase-3 antibody 1∶1 000)4 ℃孵育过夜,TBS-T溶液洗膜3次。室温下加入IgG抗体(1∶4 000)孵育1.5 h,洗膜3次,用Odyssey近红外双色激光成像系统选择800通道进行扫描条带,以βactin作为内参照标化COX-2及caspase-3的表达,各组生物学重复3次,技术重复3次,用AlphaEaseFC凝胶成像分析软件进行半定量分析。
1.6 统计学处理方法 采用SPSS 17.0统计软件进行统计学处理。计量资料以±s表示,多组间均数比较采用单因素方差分析,独立的两组间比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清Cr、BUN、UA的比较 SD大鼠饲养21 d后M组大鼠血Cr、BUN、UA均高于BC组,差异有统计学意义(P<0.05),说明尿酸性肾病大鼠模型造模成功。S组大鼠血Cr、BUN、UA低于M组,差异有统计学意义(P<0.05)。见表1。
表1 各组肾功能指标的比较(n=8,±s)
与BC组比:aP<0.05;与M组比:bP<0.05
2.2 Real time PCR技术检测各组中miR-101a的表达量 miR-101a的表达水平在M组(为0.48±0.17)较BC组(为1.00±0.00)明显降低,差异有统计学意义(P<0.05),而S组(0.71±0.21)较M组(0.48±0.17)明显升高,差异有统计学意义(P<0.05)。见图1。
2.3 Western Blot法检测各组中COX-2及caspase-3蛋白表达水平 COX-2和caspase-3的表达水平在M组较BC组明显升高,差异有统计学意义(P<0.05),而S组较M组明显降低,差异有统计学意义(P<0.05)。见图2。
3 讨论
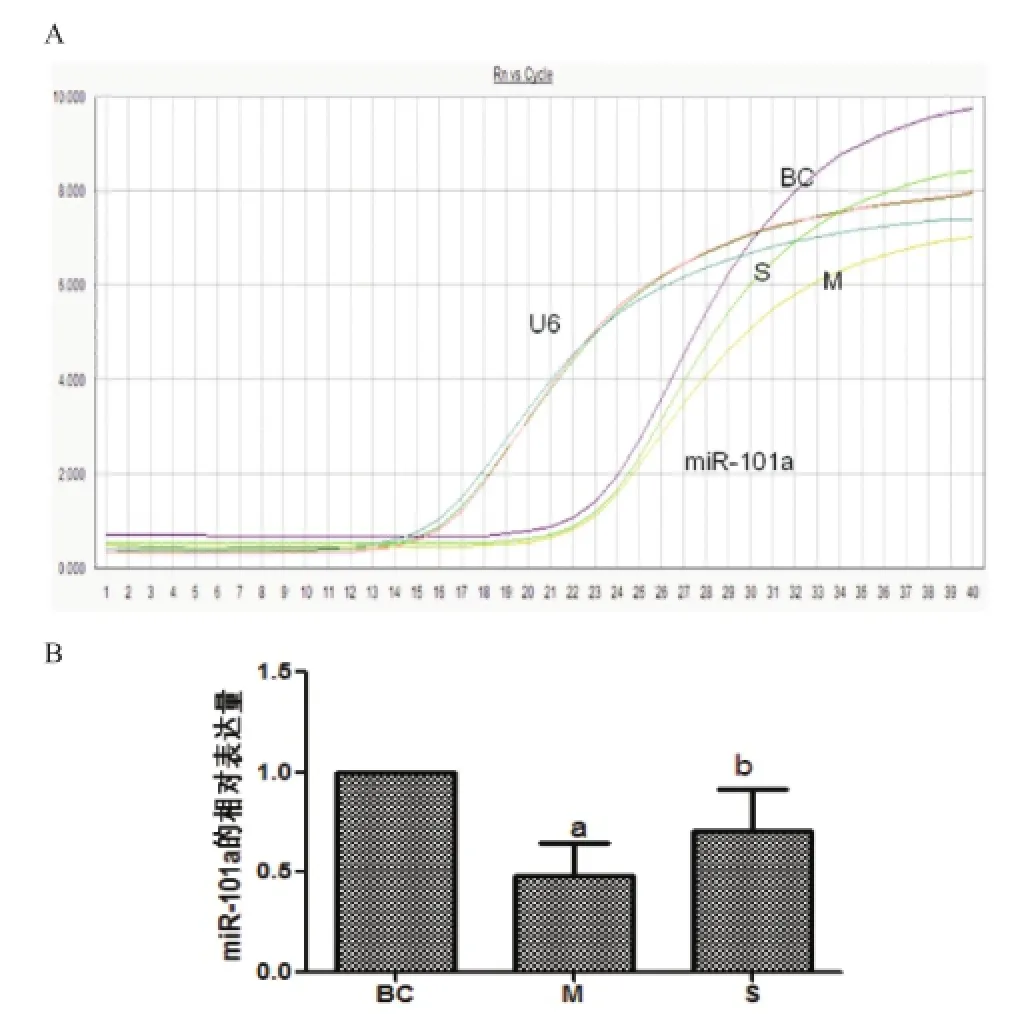
图1 Real time PCR技术检测miR-101a的表达
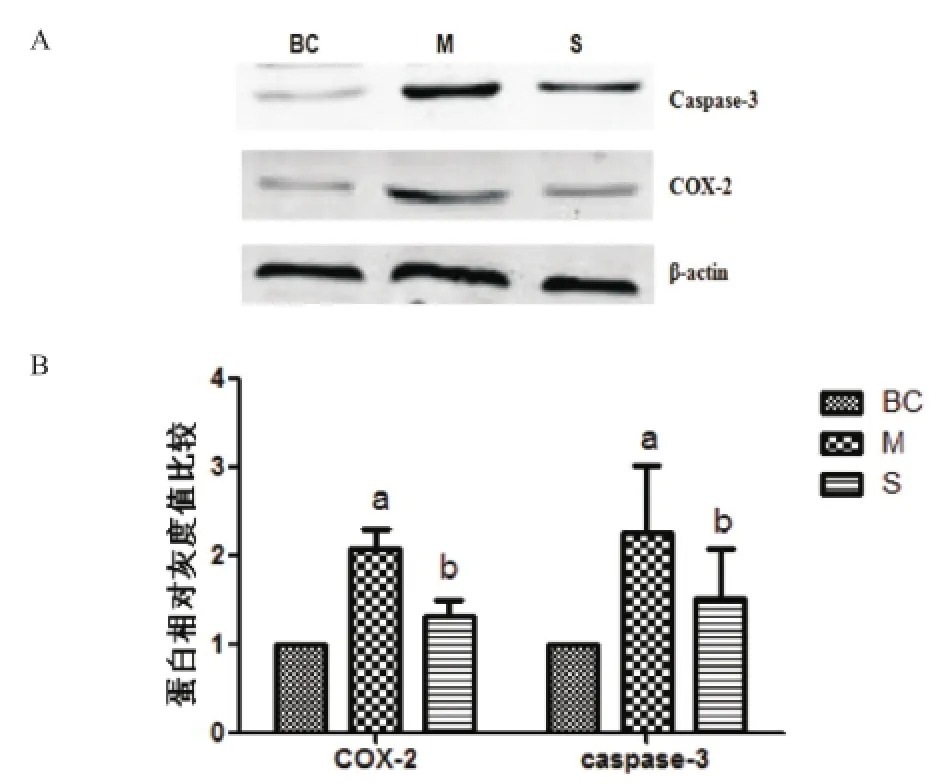
图2 Western Blot法检测各组中COX-2及caspase-3蛋白表达水平
尿酸性肾病对肾脏的损害以肾小管-间质病理改变为主要表现,光镜下可见肾小管呈囊性扩张,上皮萎缩,间质细胞萎缩,间质纤维化,伴大量淋巴和单核细胞的浸润[4]。研究报道,用含0.25%的腺嘌呤饲料饲养的雄性Wistar大鼠出现血尿酸升高,肾功能下降,肾脏组织炎症递质肿瘤坏死因子α(TNF-α)、核转录因子kappa B(NF-κB)等表达增多,伴有肾小管凋亡增多,肾间质胶原纤维含量增多[5]。Lobo等[6]研究50例血透患者发现伴有高尿酸血症的患者血清中TNF-α、白细胞介素-6(IL-6)、C反应蛋白(CRP)、血管细胞黏附分子-1(VCAM-1)、细胞间黏附分子-1(ICAM-1)等炎症因子处于高水平,推测尿酸在炎症的发生过程中起重要作用。可见尿酸性肾病肾脏组织存在炎症反应,这也是导致慢性肾脏损害的机制之一。本实验用酵母粉联合腺嘌呤诱导大鼠尿酸性肾病模型,21 d后测肾功能指标明显升高,可见模型诱导成功。
COX-2是环氧化酶家族成员之一,介导前列腺素类炎症递质的产生,在炎症过程中起重要的作用。在正常生理条件下,细胞COX-2处于低表达水平[7],当受到炎症刺激时,COX-2被诱导处于高表达水平。在缺血再灌注肾脏损伤中,COX-2大量被诱导生产,促进局部炎症反应,而神经生长因子-1能通过抑制COX-2的表达,减少炎症因子的产生,减少细胞凋亡[8]。有学者通过体外培养肾脏系膜细胞发现一定高浓度的尿酸能直接诱导COX-2和PGE2(前列腺素E2)的合成,促进炎症反应[9]。caspase-3是细胞凋亡执行蛋白,反映细胞的整体凋亡水平。本实验在高尿酸肾病大鼠模型中发现COX-2和caspase-3表达水平明显升高,推测COX-2在高尿酸引起的肾脏炎症反应中起重要作用,并促进细胞凋亡。用COX-2特异性抑制剂治疗后,COX-2和caspase-3表达减少,细胞凋亡水平降低,进一步说明COX-2在高尿酸引起的炎症介导的细胞凋亡中起重要作用。此外,本实验中S组caspase-3表达水平较BC组明显升高,差异有统计学意义(P<0.05),表明S组细胞凋亡水平较BC组高。现研究已证实COX-2存在结构型和诱导型两种形式,COX-2抑制剂能阻断诱导型COX-2,减轻炎症反应保护肾脏组织,也能阻断结构型COX-2对肾脏产生毒害作用[10]。
本研究还发现在高尿酸肾病大鼠模型中miR-101a表达降低,并且与COX-2的表达水平呈相反趋势。有研究[11]报道,miR-101a与COX-2基因的3’UTR区序列互补配对并与之结合从而抑制该基因的表达。此外,在一些肿瘤组织中发现miR-101a表达降低而COX-2升高,推测miR-101a对COX-2具有调节作用,这可能参与了肿瘤发生的机制[3,12]。Tanaka等[13]通过实验证实带有荧光标记的COX-2 3’URT区域的报告结构基团,起荧光活性能被miR-101a显著抑制,说明miR-101a能直接与COX-2的3’URT直接结合,强烈推测COX-2是miR-101a的靶基因之一。成熟的miR-101a能直接调控COX-2的表达,在本实验中,我们推测miR-101a在高尿酸性肾病中表达异常降低可能与COX-2表达增多有关。
综上所述,我们推测miR-101a/COX-2在高尿酸引起的肾脏损害中起重要作用,具体机制尚有待进一步研究。
参考文献:
[1] Weinberg JB.Nitric oxide synthase 2 and cyclooxygenase 2 interactions in inflammation[J].Immunol Res,2000,22(2-3):319-341.
[2] Harper KA,Tyson-Capper AJ.Complexity of COX-2 gene regulation[J].Biochem Soc Trans,2008,36(Pt 3):543-545.
[3] Strillacci A,Griffoni C,Sansone P,et al.MiR-101 downregulation is involved in cyclooxygenase-2 overexpression in human colon cancer cells[J].Exp Cell Res,2009,315(8):1439-1447.
[4] 何立群,聂永红,邹士林,新型尿酸性肾病动物模型的建立[J].上海实验动物科学,2001,21(1):22-24.
[5] Diwan V,Mistry A,Gobe G,et al.Adenine-induced chronic kidney and cardiovascular damage in rats[J].J Pharmacol Toxicol Methods,2013,68(2):197-207.
[6] Lobo JC,Stockler-Pinto MB,da Nóbrega AC,et al.Is there association between uric acid and inflammation in hemodialysis patients?[J].Ren Fail,2013,35(3):361-366.
[7] Mitchell JA,Warner TD.Cyclo-oxygenase-2:pharmacology,physiology,biochemistry and relevance to NSAID therapy [J].Br J Pharmacol,1999,128(6):1121-1132.
[8] Ranganathan PV,Jayakumar C,Mohamed R,et al.Netrin-1 regulates the inflammatory response of neutrophils and macrophages,and suppresses ischemic acute kidney injury by inhibiting COX-2-mediated PGE2 production[J].Kidney Int,2013,83(6):1087-1098.
[9] Nicholas K,Melissa C,Eliana GV,et al.Identification of the molecular pathways that drive constitutive renal COX-2 expression:implications for novel COX-2-targetted therapies that spare the cardiovascular system[J].The FASEB Journal,2014,28(1):837-839.
[10] Convento MS,Pessoa E,Dalboni MA,et al.Pro-inflammatory and oxidative effects of noncrystalline uric acid in human mesangial cells:contribution to hyperuricemic glomerular damage[J].Urol Res,2011,39(1):21-27.
[11] Chakrabarty A,Tranguch S,Daikoku T,et al.MicroRNA regulation of cyclooxygenase-2 during embryo implantation [J].Proc Natl Acad Sci USA,2007,104(38):15144-15149.
[12] Wang HJ,Ruan HJ,He XJ,et al.MicroRNA-101 is downregulated in gastric cancer and involved in cell migration and invasion [J].Eur J Cancer,2010,46(12):2295-2303.
[13] Tanaka T,Haneda S,Imakawa K,et al.A microRNA,miR-101a,controls mammary gland development by regulating cyclooxygenase-2 expression[J].Differentiation,2009,77 (2):181-187.
(本文编辑:胡苗苗)
The role of microRNA-101a and cycloxygenase-2 in kidney damage induced by hyperuricemia
YEHanyang1,JIN Jian2,LI Zhanyuan1,CHEN Yan1,ZHENG Yu1,JIN Lingwei1,ZHOU Zhihong1.
1.Department of Nephrology,the Second Affiliated Hospital of Wenzhou Medical University,Wenzhou,325027;2.Department of Endocrinology,the Second Affiliated Hospital of Wenzhou Medical University,Wenzhou,325027
Objective:To investigate the effects of miR-101a and cycloxygenase-2 (COX-2) on rats model of urate nephropathy.Methods:Twenty four rats models of urate nephropathy through fed with yeast and adenine for 21 days were divided into three groups,normal control groups,model groups and celecoxib groups.Seum creatinine (Cr),blood urea nitrogen (BUN) and blood uric acid (UA) was tested after feeding with yeast and adenine for 21 days.The real time PCR was preformed to analyze the expression of miR-101a and Western Blot was preformed to analyze the expression of COX-2 and caspase-3 in renal cortex.Results:Cr,BUN and UA of model group were significantly higher than that of normal control groups (P<0.05).The expression of miR-101a n renal cortex from model groups was lower than that of normal control groups (P<0.05),while higher than that of celecoxib groups (P<0.05).The expression of COX2 and caspase-3 in renal cortex from model groups were higher than that of normal control group (P<0.05),while lower than that of celecoxib groups (P<0.05).Concluion:Decreasing miR-101a and increasing COX2 may involve in kidney damage induced by hyperuricemia,celecoxib as a specific inhibitor protects kidney from this damage.
urate nephropathy; microRNA-101a; cycloxygenase-2; celecoxib; apoptosis; rats
R541
A
10.3969/j.issn.2095-9400.2015.04.006
2014-06-06
叶菡洋(1979-),女,浙江温州人,主治医师,硕士。
周志宏,主任医师,Email:markzhou@wzhealth.com。
