三个新的小鼠Pax-8剪接体的克隆及时空表达
2015-12-27宋丽娟倪云杰林振浩侯良磊吴漪皓胡欢欢黄晓燕杨德业温州医科大学附属第一医院心内科浙江温州3505杭州师范大学附属医院心内科浙江杭州3005
宋丽娟,倪云杰,林振浩,侯良磊,吴漪皓,胡欢欢,黄晓燕,杨德业,(.温州医科大学附属第一医院 心内科,浙江 温州 3505;.杭州师范大学附属医院 心内科,浙江杭州 3005)
·论 著·
三个新的小鼠Pax-8剪接体的克隆及时空表达
宋丽娟1,倪云杰1,林振浩1,侯良磊1,吴漪皓1,胡欢欢1,黄晓燕2,杨德业1,2
(1.温州医科大学附属第一医院 心内科,浙江 温州 325015;2.杭州师范大学附属医院 心内科,浙江杭州 310015)
目的:转录因子Pax-8在胚胎发育及肿瘤发生中具有重要作用,本研究旨在克隆及鉴定小鼠Pax-8基因亚型,并检测其时空表达。方法:从野生型C57BL/6胎鼠的心脏中提取总RNA(Trizol法),反转录成cDNA,应用Q5超保真酶进行目的基因扩增,并克隆至真核表达质粒,进行酶切鉴定及测序鉴定。结果:在小鼠发育不同时期,除已知全长Pax-8a外,发现3个新的小鼠Pax-8选择性剪接体,分别命名为Pax-8b(第4外显子缺失)、Pax-8c(第4和第11外显子缺失)、Pax-8d(第4和第9外显子缺失)。结论:小鼠心脏中Pax-8存在四种选择性剪接体,且在不同发育时期差异表达。
Pax-8基因;剪接体;时空表达;克隆;小鼠
转录因子Pax-8属于成对盒基因家族,该家族共有9个成员,分别命名为Pax-1至Pax-9,其编码产物对胚胎时期组织器官的发育和分化有重要作用。Pax-8基因在肾脏和甲状腺表达较高,在其他器官如心脏、肺、小肠等也有少量表达[1]。Pax-8基因是成熟的甲状腺细胞生存和功能维持的必备条件,和甲状腺功能减退、甲状腺肿瘤、泌尿系统肿瘤、卵巢肿瘤等密切相关[2-6]。研究发现Pax-8基因敲除小鼠心脏呈球形,出现室间隔缺损,体外水平Pax-8可抑制心肌细胞凋亡,提示Pax-8基因可能通过心肌细胞凋亡通路而参与心脏发育过程[7-10]。
Kozmik等[11]发现人类Pax-8基因有多个剪接体,在人肾脏肿瘤细胞系中,Pax-8因第7和第8外显子丢失或存在而形成四种亚型,在人的胎盘中发现另2种亚型。Poleev等[12]发现不同的Pax-8剪接体形式可能参与了转录激活调控。然而,小鼠心脏发育过程中是否存在Pax-8不同亚型,及其功能的研究鲜见报道。因此,我们从不同发育阶段的C57BL/6小鼠心脏中克隆Pax-8基因,旨在研究Pax-8各亚型在心脏中的时空表达及其功能。
1 材料和方法
1.1 材料和试剂 3个月龄C57BL/6雌雄小鼠购于杭州师范大学实验动物中心;pcDNA3.1(-)、引物、Trizol试剂、Lipofectamine 2000、琼脂糖购于Invitrogen;氯仿、异丙醇、无水乙醇、DEPC水购于上海生工公司、4S Red Plus增强型安全核酸染色剂购于生工生物工程(上海)股份有限公司;Ta-KaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0、rTaq酶、DNA ladder购自大连宝生物工程有限公司;NEB Q5超保真DNA聚合酶、限制性内切酶购自NEB公司;pGEM®-T Easy Vector Systems I购自普洛麦格(北京)生物技术有限公司;感受态细胞DH5a购自北京全式金生物技术有限公司。
1.2 心脏RNA提取及反转录 取雌雄小鼠各10只配笼,在母鼠怀孕13.5、15.5和17.5 d时,颈脱臼法处死,取出胚胎,分离胚胎心脏;分离出生12 h乳鼠的心脏。Trizol法提取心脏总RNA,反转录获得心脏cDNA。
1.3 Pax-8基因扩增及连接 扩增使用引物序列如下:F:5’-GATGCCTCACAACTCGATCAG-3’,R:5’-GTCCCCA TGACAACTACAGATGG-3’。反应条件:98 ℃ 30 s;98 ℃ 10 s,64 ℃ 30 s,72 ℃ 50 s,循环34次;72 ℃ 5 min;4 ℃保持。PCR产物纯化加尾后与T-Easy载体连接、转化、小提。
1.4 重组Pax-8-pcDNA3.1(-)真核表达载体的构建 Not I酶切pcDNA3.1(-)载体与Pax-8-T Easy重组载体,酶切后的pcDNA3.1(-)载体经去磷酸化后再与Pax-8片段连接、转化,获得重组Pax-8-pcDNA3.1(-)真核表达载体。重组载体使用限制性内切酶BspE I与BamH I酶切鉴定插入方向。正向插入质粒送测序。
2 结果
2.1 不同胚胎发育时期心脏中Pax-8的克隆 各发育时期心脏RNA经反转录扩增后,得到多条不同长度剪接体片段(见图1)。在E13.5心脏中克隆出2条条带,长度分别约为1 400 bp和1 000 bp;在E15.5心脏中克隆出3条条带,长度约为1 400 bp、1 100 bp和1 000 bp;在E17.5心脏中克隆出2条条带,长度分别约1 400 bp和1 100 bp;出生12 h的乳鼠心脏中出现5条条带,长度分别约1 500 bp、1 400 bp、1 200 bp、1 100 bp及1 000 bp。
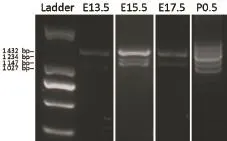
图1 不同胚胎发育时期心脏中Pax-8的表达
测序结果经BLAST比对(NM_011040.4),如图2所示,发现克隆所得约1 500 bp片段和1 400 bp片段相同,为小鼠全长Pax-8,命名为Pax-8a(1 374 bp);长度约为1 200 bp的片段缺失Pax-8基因第4外显子,命名为Pax-8b(1 176 bp);长度约为1 100 bp的片段缺失第4外显子和第11外显子,命名为Pax-8c (1 079 bp);长度约为1 000 bp的片段缺失第4外显子和第9外显子,命名为Pax-8d(969 bp)。
2.2 各Pax-8亚型克隆和重组质粒载体构建 DNA片段与T-easy连接后,使用Not I酶切,然后与经Not I酶切去磷酸化的pcDNA3.1(-)进行连接。连接产物转化、小提,获得重组载体,经BspEI和BamHI双酶切结果显示插入的目的基因片段方向及大小正确(见图3),即Pax-8a-pcDNA3.1(-)全长6 851 bp,酶切获得1 060 bp和5 791 bp的两条片段;Pax-8b-pcDNA3.1(-)全长6 653 bp,酶切获得1 060 bp和5 593 bp两条片段;Pax-8c-pcDNA3.1(-)全长6 566 bp,酶切获得973 bp和5 593 bp两条片段;Pax-8d-pcDNA3.1(-)全长6 446 bp,酶切获得853 bp和5 593 bp两条条带。
3 讨论
Pax基因家族是一个古老的高度保守的家族,其编码产物为一组转录因子,在器官形成、分化过程中起重要作用。Pax-8是Pax基因家族一员,和组织器官的发育分化、功能维持、肿瘤发生发展等密切相关,在多个物种、多个器官中存在不同剪接体[13-14]。人的Pax-8基因含11个外显子,已有文献[11]报道的人肾脏肿瘤细胞来源的Pax-8有4个亚型,它们存在第7和/或第8外显子缺失,但都保留了Pax-8的成对结构域。小鼠Pax-8基因含12个外显子,本研究发现小鼠心脏中存在3个缺少第4外显子的Pax-8亚型,即Pax-8b、Pax-8c、Pax-8d,其中第3和第4外显子编码小鼠Pax-8成对结构域,提示这3种亚型可能影响Pax-8与其他基因、蛋白等的结合。
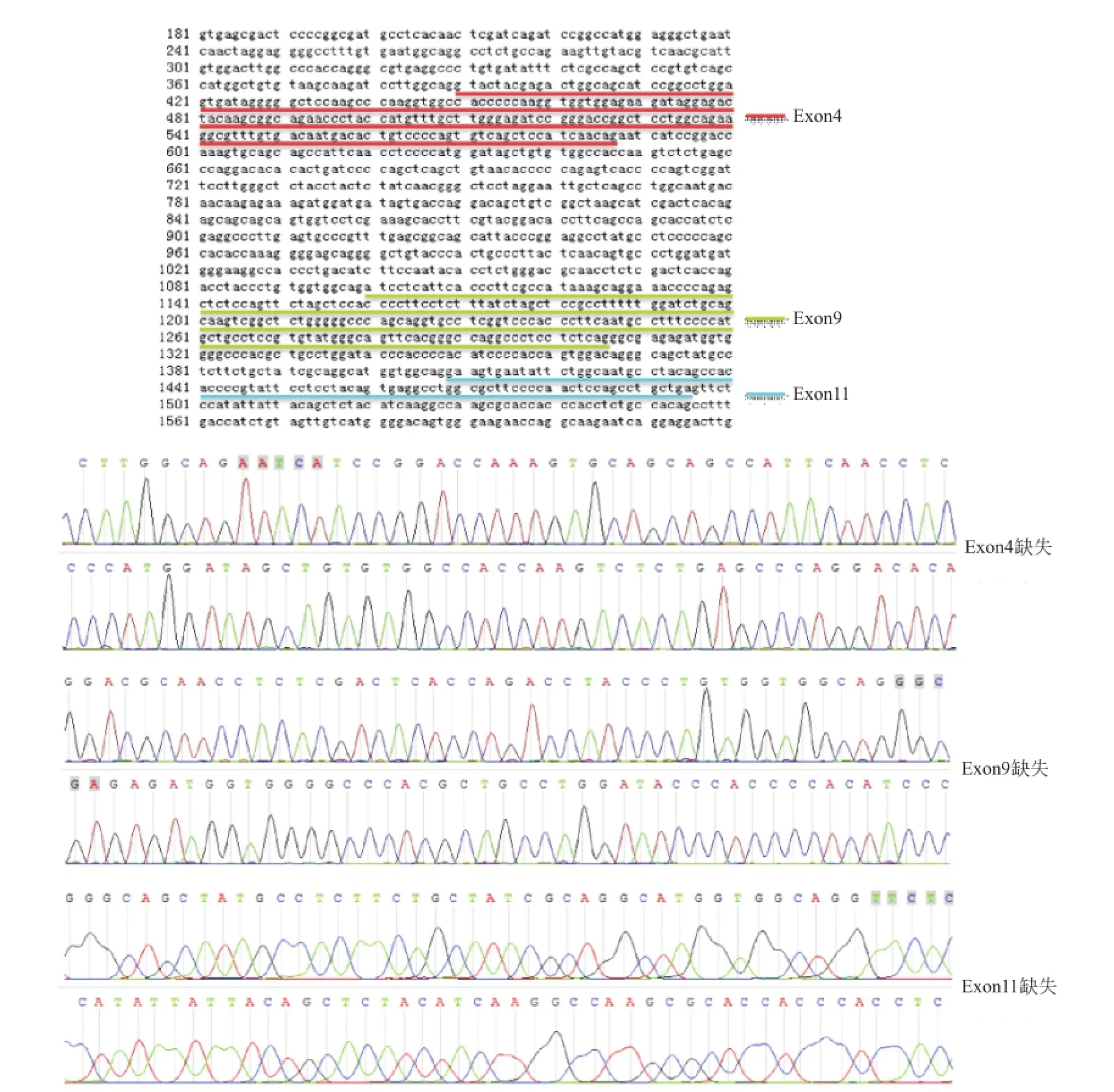
图2 Pax-8基因(NM_011040.4)外显子示意图及不同外显子缺失亚型测序结果(部分)。外显子4、9、11部分分别用红、绿、蓝下划线标示
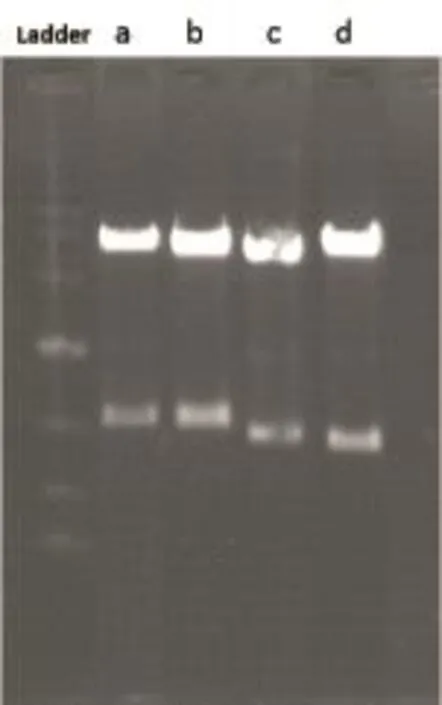
图3 各重组Pax-8-pcDNA3.1(-)质粒经BspEI和BamHI双酶切电泳结果
在本实验所观察的时间点中,Pax-8a持续表达,而各亚型表达水平随发育进程而变化,提示Pax-8的不同剪接形式不仅参与了Pax-8 mRNA亚型的生成,还可能通过时空表达的变化参与小鼠心脏发育。这些剪接体对心脏发育的未知功能或作用,值得后期深入研究。
[1] Plachov D,Chowdhury K,Walther C,et al.Pax8,a murine paired box gene expressed in the developing excretory system and thyroid gland[J].Development,1990,110(2):643-651.
[2] Marotta P,Amendola E,Sca rfò M,et al.The paired box transcription factor Pax8 is essential for function and survival of adult thyroid cells[J].Mol Cell Endocrinol,2014,396(1-2):26-36.
[3] Di Palma T,Filippone MG,Pierantoni GM,et al.Pax8 has a critical role in epithelial cell survival and proliferation[J].Cell Death Dis,2013,4:e729.
[4] Fabbro D,Pellizzari L,Mercuri F,et al.Pax-8 protein levelsregulate thyroglobulin gene expression[J].J Mol Endocrinol,1998,21(3):347-354.
[5] Di Palma T,Lucci V,de Cristofaro T,et al.A role for PAX8 in the tumorigenic phenotype of ovarian cancer cells[J].BMC Cancer,2014,14:292.
[6] Yemelyanova A,Gown AM,Wu LS,et al.PAX8 expression in uterine adenocarcinomas and mesonephric proliferations [J].Int J Gynecol Pathol,2014,33(5):492-499.
[7] 杨德业,张怀勤,黄晓燕,等.室间隔缺损相关基因-BMPR下游基因的探讨[J].温州医学院学报,2003,33(2):76-78.
[8] 章佳颖,来丹丹,褚茂平,等.Pax-8基因在胚胎心脏发育中的作用[J].中国病理生理杂志,2009,25(7):1292-1297.
[9] 高瞻,来丹丹,杨德业.Pax-8基因在大鼠心肌细胞凋亡中的作用[J].解放军医学杂志,2009,34(9):1082-1084.
[10] Yang D,Lai D,Huang X,et al.The defects in development and apoptosis of cardiomyocytes in mice lacking the transcriptional factor Pax-8[J].Int J Cardiol,2012,154(1):43-51.
[11] Kozmik Z,Kurzbauer R,Dörfler P.Alternative splicing of Pax-8 gene transcripts is developmentally regulated and generates isoforms with differenttransactivation properties [J].Mol Cell Biol,1993,13(10):6024-6035.
[12] Poleev A,Wendler F,Fickenscher H,et al.Distinct functional properties of three human paired-box-protein,PAX8,isoforms generated by alternative splicing in thyroid,kidney and Wilms’ tumors[J].Eur J Biochem,1995,228(3):899-911.
[13] 王秀,王蔚,王义权.Pax基因功能及其选择性剪接的研究进展[J].生命科学,2008,20(1):125-130.
[14] 李莉,杨杨,薛雷.Pax基因家族在果蝇发育过程中的调控作用[J].遗传,2010,32(2):115-121.
(本文编辑:吴健敏)
Cloning of three newly-identified alternatively splicing isoforms of mouse Pax-8 and their spatial and tempo-ral expression patterns
S ONG Lijuan1,NI Yunjie1,LIN Zhenhao1,HOU Lianglei1,WU Yihao1,HU Huanhuan1,HUANG Xiaoyan2,YANG Deye1,2.
1.Department of Cardiology,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou,325035; 2.Department of Cardiology,the Affiliated Hospital of Hangzhou Normal University,Hangzhou,310015
Objective:Pax-8 gene plays a pivotal role in embryonic development and tumorgenesis.This tudy aims to identify and clone different alternatively splicing isoforms of mouse Pax-8,and to detect their spaial and temporal expression patterns.Methods:Hearts from wild-type prenatal and postnatal mice of C57BL/6 background were carefully excised and total RNA was extracted using Trizol reagent.The cDNA fragment of Pax-8 was reverse transcribed and amplified by Q5 Taq polymerase and cloned into pcDNA3.1(-) vector.The recombinant vectors were validated by enzyme digestion and sequencing.Results:In comparison to their cognate ull-length Pax-8a,three alternatively splicing isoforms of mouse Pax-8,designated Pax-8b (exon4 deleted),Pax-8c (exon 4 and 11 deleted) and Pad-8d (exon 4 and 9 deleted),were identified in different periods of embryogenesis and successfully cloned.Conclusion:Mouse heart has four alternatively splicing isoforms of mouse Pax-8 that express in different spatial and temporal expression patterns.Such findings open a bright avenue for the urther functional study.
Pax-8 gene; alternatively splicing isoforms; spatial and temporal expression; cloning; mice
Q785
A
10.3969/j.issn.2095-9400.2015.04.002
2014-12-23
国家自然科学基金资助项目(81270230)
宋丽娟(1989-),女,江西赣州人,硕士生。
杨德业,教授,博士生导师,Email:deyeyang@126.com。
