IB~I IB期宫颈癌盆腔淋巴结转移相关因素分析
2015-12-27陈慧君黄亦波林蓉蓉郑飞云
陈慧君,黄亦波,林蓉蓉,郑飞云
1.温州医科大学 第一临床医学院,浙江 温州 325035;2.温州医科大学附属第一医院 妇科,浙江温州 325015)
·论 著·
IB~I IB期宫颈癌盆腔淋巴结转移相关因素分析
陈慧君1,黄亦波1,林蓉蓉1,郑飞云2
1.温州医科大学 第一临床医学院,浙江 温州 325035;2.温州医科大学附属第一医院 妇科,浙江温州 325015)
目的:分析IB~I IB期宫颈癌盆腔淋巴结转移情况及相关高危因素,为早期宫颈癌的手术方式提供参考。方法:对158例进行广泛性全子宫切除术联合盆腔淋巴结清扫的IB~I IB期宫颈癌患者的临床病理资料进行回顾性分析,对影响淋巴结转移的因素采用logistic回归分析。结果:158例IB~I IB期宫颈癌有36例淋巴结转移阳性,转移率为22.8%,其中闭孔淋巴结转移22例(占13.9%),髂内淋巴结转移15例(占9.5%),髂外淋巴结转移10例(占6.3%),髂总淋巴结转移7例(占4.4%),腹股沟深淋巴结转移4例(占2.5%),宫旁淋巴结转移1例(占0.6%),腹主动脉旁淋巴结转移1例(占0.6%)。21例孤立淋巴结阳性,15例多组淋巴结阳性。单因素分析结果显示肿瘤直径大小超过4 cm,术前鳞状细胞癌抗原(SCC-Ag)及宫旁浸润与盆腔淋巴结转移相关(P<0.05)。logistic回归分析结果显示肿瘤直径超过4 cm及宫旁浸润是盆腔淋巴结转移的独立危险因素(P<0.05)。结论:IB~I IB期宫颈癌盆腔淋巴结转以闭孔淋巴结最易受累,肿瘤直径超过4 cm及宫旁浸润是盆腔淋巴结转移的高危因素。
宫颈肿瘤;盆腔淋巴结转移;肿瘤大小;宫旁浸润;回归分析
盆腔淋巴结转移是影响宫颈癌患者生存及预后的重要因素。但是早期宫颈癌淋巴结转移率低[1-2],且广泛全子宫切除术联合盆腔淋巴清扫术后并发症较多[3-4],严重影响患者术后生活质量。国外研究报道[5-8]对早期宫颈癌实施根治性全子宫切除术联合盆腔淋巴清扫术存在一定争议。本研究通过回顾性分析IB~IIB期宫颈癌盆腔淋巴结转移情况,探讨宫颈癌淋巴结转移的特征及其相关临床病理因素,为早期宫颈癌患者的个体化治疗提供参考。
1 资料和方法
1.1 一般资料 选取2012年5月至2014年5月我院
1.2 方法 ①所有患者均实施广泛性子宫全切除术联合盆腔淋巴清扫术,术前均未实施放化疗等辅助治疗,根据术后病理结果,对有淋巴结转移阳性、脉管浸润阳性、手术切缘阳性者予辅以体外放疗或化疗,术后予门诊、电话等方式积极随访。②通过回顾性分析方法,采用单因素分析比较盆腔淋巴结阴性与阳性患者相关临床病理因素,包括年龄、分期、是否绝经、孕次、产次、阴道穹窿受累与否、肿瘤大小、肿瘤生长方式、术前鳞状细胞癌抗原(SCC-Ag)水平和分化程度、病理类型,并对差异有统计学意义(P<0.05)的变量采用logistic回归分析,探讨早期宫颈癌淋巴结转移的独立危险因素。1.3 统计学处理方法 采用SPSS 19.0统计学软件。计数资料以百分率表示。单因素分析采用卡方检验。多因素分析采用logistic回归分析,用前进法(α=0.05)进行变量筛选。P<0.05为差异有统计学意义。
2 结果
2.1 盆腔淋巴结转移情况 158例IB~IIB期宫颈癌有36例盆腔淋巴结阳性,淋巴结转移率为22.8% (36/158),其中闭孔淋巴结转移22例(占13.9%),髂内淋巴结转移15例(占9.5%),髂外淋巴结转移10例(占6.3%),髂总淋巴结转移7例(占4.4%),腹股沟深淋巴结转移4例(占2.5%),宫旁淋巴结转移1例(占0.6%),腹主动脉旁淋巴结转移1例(占0.6%)。孤立淋巴结转移22例,多组淋巴结转移14例。
2.2 盆腔淋巴结转移单因素分析 结果显示肿瘤直径超过4 cm、术前SCC-Ag水平及宫旁浸润与盆腔淋巴结转移相关(P<0.05),而与患者年龄、分期、是否绝经、孕次、产次、阴道穹窿是否受累、肿瘤生长方式、分化程度及病理分型无关(P>0.05)。见表1。
2.3 盆腔淋巴结转移logistic回归分析 结果显示术前SCC-Ag水平>4 μg/L与盆腔淋巴结转移的关系差异无统计学意义(P>0.05);而肿瘤直径≥4 cm及宫旁浸润阳性是盆腔淋巴结转移的独立危险因素(P<0.05)。见表2。
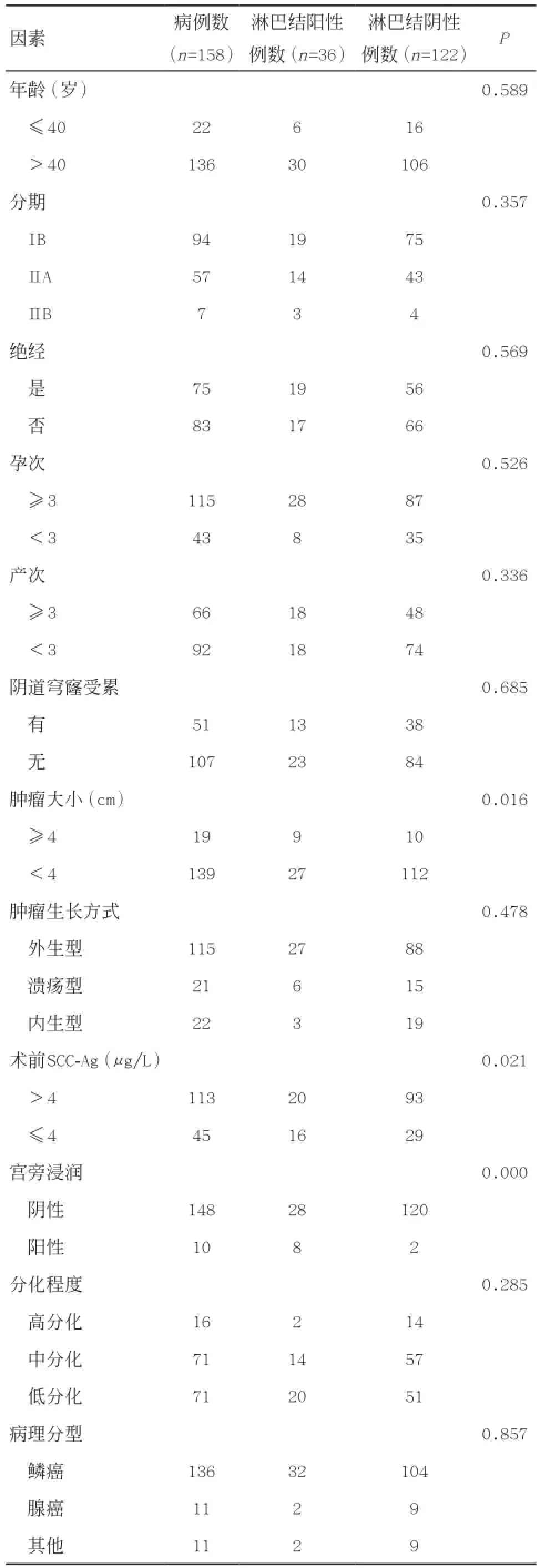
表1 盆腔淋巴结转移单因素分析结果

表2 盆腔淋巴结转移多因素logistic回归分析
3 讨论
宫颈癌扩散的主要方式是直接蔓延和盆腔淋巴结转移,而盆腔淋巴结转移是宫颈癌扩散的主要转移途径,是影响宫颈癌患者生存及预后的重要因素[9-11]。报道认为早期宫颈浸润癌的标准治疗方式是广泛子宫切除联合盆腔淋巴清扫术[12],但术后并发症较多,如失血、输血、肠梗阻、神经血管损伤、淋巴水肿、淋巴囊肿等[3-4,13-14]。并且早期宫颈癌淋巴结转移率低[1-2],为减少盆腔淋巴清扫术后并发症,现在有不少国外研究[5-7]主张早期宫颈浸润癌实施保守手术,如单纯子宫切除术等。因此如何准确地判定早期宫颈癌盆腔淋巴结转移情况,选定合理的手术范围,是否可避免盆腔淋巴清扫,以提高患者生存和生活质量值得探讨。
本研究回顾性分析158例宫颈癌淋巴结转移情况,以闭孔淋巴结最易受累,单因素分析结果提示肿瘤直径超过4 cm、术前SCC-Ag及宫旁浸润与淋巴结转移相关,而logistic回归分析结果显示肿瘤直径大小超过4 cm及宫旁浸润是淋巴结转移的高危因素。IB、IIA、IIB期宫颈癌盆腔淋巴结转移率分别为20.2%(19/94)、24.6%(14/57)、42.9%(3/7),结果显示淋巴结转移率有随着宫颈癌期别增高而增高趋势,但差异无统计学意义,说明临床分期与盆腔淋巴结转移是否相关仍需大样本的临床资料去证实。
Togami等[15]研究了163例IA2~I IB期宫颈癌盆腔淋巴结转移情况,结果显示IA2、IB1、IB2、I IA、IIB期宫颈癌盆腔淋巴结转移率分别为0%(0/12)、17%(13/76)、22%(6/27)、33%(8/24)、63%(15/24),随访研究发现盆腔淋巴结阴性和阳性患者中,5年无复发率分别为92%和46%,5年生存率分别为94% 和61%,证实了盆腔淋巴结转移是宫颈癌患者生存、复发的独立因素。有研究[16]表明宫颈癌治疗前SCC-Ag水平为4μ g/L是判断淋巴结转移高风险的理想界值,而本研究单因素分析也显示术前SCC-Ag>4μ g/L与盆腔淋巴结转移密切相关。
Turan等[17]研究认为早期宫颈癌肿瘤直径大小与盆腔淋巴结转移相关,且肿瘤大小超过4 cm与淋巴结转移显著相关,是宫颈癌淋巴结转移的独立危险因素之一。而Togami等[15]也认同宫颈癌盆腔淋巴结转移与肿瘤大小密切相关,但肿瘤直径超过2 cm已是盆腔淋巴结转移的危险因素。因临床上确切的测量肿瘤体积存在难度,故常以肿瘤直径大小来表示。本研究单因素分析和logistic回归分析结果均显示肿瘤直径超过4 cm是盆腔淋巴结转移的独立危险因素。
李洋[18]对142例IA~IIB期宫颈癌进行研究,认为肿瘤大小超过4 cm、深度浸润、脉管浸润及宫旁浸润是淋巴结转移的高危因素。万磊等[19]采用多因素分析发现间质浸润、淋巴血管浸润、肿瘤直径与淋巴结转移密切相关。Takeda等[16]认为SCC与CA125联合预测淋巴结转移有重要意义,且淋巴血管浸润是宫颈癌患者预后不良的独立影响因素。许多研究[7,20-22]采用单因素、多因素分析均提示淋巴血管浸润与淋巴结转移呈正相关。考虑到早期宫颈癌术前不能很准确地预估是否有脉管浸润,本研究并没有将脉管浸润纳入单因素分析。
早期宫颈癌盆腔前哨淋巴结及转移的前哨淋巴结位置集中于宫旁、闭孔淋巴结[23],本研究也显示早期宫颈癌淋巴结转移患者中,闭孔淋巴结转移构成比占61.1%,与研究报道一致。前哨淋巴结检测已被广泛应用于描述宫颈癌淋巴结转移的情况[23-24]。Altgassen等[25]研究发现宫颈癌肿瘤直径小于2 cm时,前哨淋巴结检测的敏感性高达94.3%,而肿瘤直径大于2 cm时,敏感性则只有88.5%,认为宫颈癌肿瘤直径小于2 cm时前哨淋巴结检测敏感性较高。而Cormier等[1]报道显示在早期宫颈癌中前哨淋巴结的敏感性高达93%。Eiriksson等[26]认为前哨淋巴结阴性者可避免盆腔淋巴结清扫。因此前哨淋巴结检测是否能取代盆腔淋巴结清扫仍需多中心的、大量的样本去证实。
综上所述,本研究认为IB~IIB期宫颈癌盆腔淋巴结转移与肿瘤大小及宫旁浸润密切相关,当宫颈癌患者存在上述盆腔淋巴结转移高危因素时,应积极治疗,改善预后,当肿瘤小于4 cm且宫旁浸润阴性时,应术前准确评估,为制定早期宫颈癌个体化治疗方案。本研究为回顾性分析研究,纳入病例数较少,可能存在数据分析的偏倚,有待于扩大样本进一步进行前瞻性研究。
参考文献
[1] Cormier B,Diaz JP,Shih K,et al.Establishing a sentinel lymph node mapping algorithm for the treatment of early cervical cancer[J].Gynecol Oncol,2011,122(2):275-280.
[2] Roy M,Bouchard-Fortier G,Popa I,et al.Value of sentinel node mapping in cancer of the cervix[J].Gynecol Oncol,2011,122(2):269-274.
[3] Bergmark K,Avall-Lundqvist E,Dickman PW,et al.Lymphedema and bladder-emptying difficulties after radical hysterectomy for early cervical cancer and among population controls[J].Int J Gynecol Cancer,2006,16(3):1130-1139.
[4] Tada H,Teramukai S,Fukushima M,et al.Risk factors for lower limb lymphedema after lymph node dissection in patients with ovarian and uterine carcinoma[J].BMC Cancer,2009,9(47):1-6.
[5] Frumovitz M,Sun CC,Schmeler KM,et al.Parametrial involvement in radical hysterectomy specimens for women with early-stage cervical cancer[J].Obstet Gynecol,2009,114(1):93-102.
[6] Kodama J,Kusumoto T,Nakamura K,et al.Factors associated with parametrial involvement in stage IB1 cervical cancer and identification of patients suitable for less radical surgery[J].Gynecol Oncol,2011,122(3):491-494.
[7] Murakami I,Fujii T,Kameyama K,et al.Tumor volume and lymphovascular space invasion as a prognostic factor in early invasive adenocarcinoma of the cervix[J].J Gynecol Oncol,2012,23(3):153-158.
[8] Meirovitz M,Sade S,Dreiher J,et al.Is radical hysterectomy necessary in early cervical cancer?[J].Gynecol Obstet Invest,2013,76(3):158-162.
[9] Hosaka M,Watari H,Mitamura T,et al.Survival and prognosticators of node-positive cervical cancer patients treated with radical hysterectomy and systematic lymphadenectomy [J].Int J Clin Oncol,2011,16(1):33-38.
[10] Kasamatsu T,Onda T,Sawada M,et al.Radical hysterectomy for FIGO stage I-IIB adenocarcinoma of the uterine cervix [J].Br J Cancer,2009,100(9):1400-1405.
[11] Lee J,Song Y,Soh EY.Prognostic significance of th number of metastatic lymph nodes to stratify the risk of recurrence[J].World J Surg,2014,38(4):858-862.
[12] Sakuragi N.Up-to-date management of lymph node metastasis and the role of tailored lymphadenectomy in cervical cancer[J].Int J Clin Oncol,2007,12(3):165-175.
[13] Pieterse QD,Maas CP,Ter Kuile MM,et al.An observational longitudinal study to evaluate miction,defecation,and sexual function after radical hysterectomy with pelvic lymphadenectomy for early-stage cervical cancer[J].Int J Gynecol Cancer,2006,16(3):1119-1129.
[14] 陈映鹤,木海琦,何有华,等.妇产科手术致泌尿系统器官损伤的原因及防治[J].温州医学院学报,2010,40(5):487-489.
[15] Togami S,Kamio M,Yanazume S,et al.Can pelvic lymphadenectomy be omitted in stage IA2 to Iib uterine cervical cancer?[J].Int J Gynecol Cancer,2014,24(6):1072-1076.
[16] Takeda M,Sakuragi N,Okamoto K,et al.Preoperative serum SCC,CA125,and CA19-9 levels and lymph node status in squamous cell carcinoma of the uterine cervix[J].Acta Obstet Gynecol Scand,2002,81(5):451-457.
[17] Turan T,Yildirim BA,Tulunay G,et al.Prognostic effect of different cut-off values (20mm,30mm and 40mm) for clinical tumor size in Figo Stage IB cervical cancer[J].Surg Oncol,2010,19(2):106-113.
[18] 李洋.Ia~IIb期宫颈癌盆腔淋巴结转移高危因素的临床分析[J].中国妇幼保健,2013,28(22):3584-3586.
[19] 万磊,李隆玉,曾四元,等.宫颈鳞癌淋巴结转移的高危因素分析[J].中国妇幼保健,2014,29(4):528-529.
[20] Singh P,Tripcony L,Nicklin J,et al.Analysis of prognostic variables,development of predictive models,and stratification of risk groups in surgically treated FIGO early-stage (IA-IIA) carcinoma cervix[J].Int J Gynecol Cancer,2012,22(1):115-122.
[21] Khunamornpong S,Lekawanvijit S,Settakorn J,et al.Prognostic model in patients with early-stage squamous cell carcinoma of the uterine cervix:a combination of invasive margin pathological characteristics and lymphovascular space invasion[J].Asian Pac J Cancer Prev,2013,14(11):6935-6940.
[22] Milam MR,Frumovitz M,dos Reis R,et al.Preoperative lymph-vascular space invasion is associated with nodal metastases in women with early-stage cervical ancer[J].Gynecol Oncol,2007,106(1):12-15.
[23] Diaz JP,Gemignani ML,Pandit-Taskar N,et al.Sentinel lymph node biopsy in the management of early-stage cervical carcinoma[J].Gynecol Oncol,2011,120(3):347-352.
[24] Martinez A,Mery E,Filleron T,et al.Accuracy of intraoperative pathological examination of SLN in cervical cancer[J].Gynecol Oncol,2013,130(3):525-529.
[25] Altgassen C,Hertel H,Brandstadt A,et al.Multicenter validation study of the sentinel lymph node concept in cervical cancer:ago study group[J].J Clin Oncol,2008,26(18):2943-2951.
[26] Eiriksson LR,Covens A.Sentinel lymph node mapping in cervical cancer:the future?[J].BJOG,2012,119(2):129-133.
(本文编辑:吴健敏)
Analysis of factors affecting lymph node metastasis in FIGO IB to IIB uterine cervical cancer
CHEN Hui-un1,HUANG Yibo1,LIN Rongrong1,ZHENG Feiyun1.
1.The First Clinical Medical College of Wenzhou Medical University,Wenzhou,325035; 2.Department of Gynecology,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou,325015
Objective:To analysis the factors affecting lymph node metastasis in stage IB1 to IIB uterine cervical cancer.Methods:A total of 158 patients with stage IB to IIB cervical carcinomas treated with radical hysterectomy and systematic pelvic lymphadenectomy were retrospectively analyzed.The logistic multivariate analysis was used to select independent high-risk factors.Results:Thirty-six (22.8%) patients had pelvic lymph node metastasis.Of 36 lymph node metastases,22 were in the obturator,15 in the internal iliac,10 in the external liac,7 in the common iliac,4 in the deep inguinal,1 in the parametrial iliac and 1 in the para aortic.Univariate analysis revealed that tumor size,preoperative SCC-Ag level and parametrial invasion were related to pelvic ymph node metastasis.Multivariate analysis revealed that tumor size greater than 4 cm and parametrial invasion were independently associated with nodal metastasis.Conclusion:The obturator lymph nodes are most frequenty involved in stage IB~IIB uterine cervical cancer.Tumor size greater than 4 cm and parametrial invasion are high-risk factors of pelvic lymph node metastasis.
uterine cervical neoplasms; pelvic lymph node metastasis; tumor size; parametrial invasion:egression analysis
R713.4;R73
A
10.3969/j.issn.2095-9400.2015.04.004
2014-08-31
浙江省自然科学基金资助项目(Y2090699)。
陈慧君(1990-),女,浙江苍南人,硕士生。
郑飞云,教授,Email:zfy5710@163.com。158例IB~I IB期宫颈癌患者为研究对象,临床资料和病理资料均完整,手术方式均为广泛性全子宫切除术联合盆腔淋巴清扫术。年龄26~74岁,平均年龄(51.5±10.5)岁,按FIGO分期标准,均为IB~I IB期,其中IB期94例,I IA期57例,I IB期7例。术后病理证实鳞癌136例,腺癌11例,其他11例。
