氨基丁酸修饰的痂囊腔菌素A类衍生物的合成与表征
2015-12-26陈水生
毛 惠,温 馨,乔 瑞,杨 松,陈水生
(阜阳师范学院 化学与材料工程学院,安徽 阜阳 236037)
氨基丁酸修饰的痂囊腔菌素A类衍生物的合成与表征
毛 惠,温 馨,乔 瑞*,杨 松,陈水生
(阜阳师范学院 化学与材料工程学院,安徽 阜阳 236037)
痂囊腔菌素A在光疗窗口(600~900nm)的弱吸收,限制了它在临床上的使用。为解决这一问题,并对该化合物的进一步修饰提供基础,合成得到了γ-氨基丁酸修饰的痂囊腔菌素A衍生物,利用核磁共振、质谱等方法确定了衍生物结构。吸收光谱和电子顺磁自旋光谱表明,该衍生物不仅在光疗窗口具有良好的吸光能力,而且具有良好的活性氧物种产生能力。
光动力治疗;痂囊腔菌素A;活性氧
光动力疗法(PhotodynamicTherapy,PDT)是近年来逐步发展起来的一种新型肿瘤临床疗法。因其具有特异性杀伤肿瘤细胞、对健康组织损伤小、毒副作用低以及经济方便等独特优点,很多国家陆续批准该方法用于临床治疗。光动力疗法的基础在于光疗靶点分子如DNA等的光敏氧化。在光动力治疗中,光敏氧化作用主要通过化学机制来实现的[1]。光敏剂(Photosensiters,PS)导入体内后,先让其在组织间分布,待光敏剂在靶点与非靶点中的浓度比达到最大值时,利用与光敏剂吸收相匹配的光源照射靶点,通过光与光敏剂之间协同作用所产生的活性氧物种,实现对靶体组织的损伤与破坏,达到治疗目的。
近年来,随着光动力疗法的不断发展,光动力疗法要素之一光敏剂的研究范围也从最初的合成新型结构光敏剂,逐步拓展到设计合成特定的功能卟啉类与非卟啉类有机化合物[1-5],和将纳米材料、纳米技术等新材料新方法与光敏剂相结合[6-8]等多个研究方向。其中,苝醌类光敏剂一直是研究热点之一。痂囊腔菌素A(ElsinochromeA,EA,结构如图1)是以3, 10-二羟基-4,9-苝醌为母体的一类天然光敏剂。苝醌类光敏剂主要有竹红菌素(Hypocrellins,包括甲素HA和乙素HB,结构如图1)、金丝桃素(Hypercin,结构如图1),具有三重态量子产率高、单重态氧量子产率高、光毒性高、从正常组织排出速度快(24 小时之内)等优点,而且近来的研究发现该类光敏剂还能杀灭HIV病毒、抗单纯性疱疹类型I病毒和Sindbis病毒的活性,因而使得该类光敏剂在光动力疗法研究领域受到了广泛的关注。

图1 几种苝醌类光敏剂的结构
与目前已被广泛研究的竹红菌素[9-16]相比,有关痂囊腔菌素衍生物的合成文献并不多见。研究结果表明,由于痂囊腔菌素A分子的HOMO和LUMO两能级间能级差小(0.313 52eV),使其单重态氧的量子产率高于竹红菌素和金丝桃素,在氘代甲醇中可以达到0.89[17]。同时抗肿瘤的实验结果也表明痂囊腔菌素拥有比竹红菌素更高的抗肿瘤活性[18],这些研究成果逐渐引起从事光动力疗法研究的工作者的广泛关注。此前,乔瑞等以改善痂囊腔菌素A衍生物的长波吸收和增强I型光动力机制为目的,结合计算机辅助设计并合成了乙二胺修饰的痂囊腔菌素A衍生物(EDEA)[19]。EDEA的最大吸收波长由470nm位移到708nm,使得衍生物在光疗窗口的吸收大大加强。与母体相比,EDEA的活性氧量子产率和对DNA的光损伤能力明显提高。但是,由于化合物EDEA没有其它可供进一步修饰的官能团,限制了对其进行更深入的修饰与研究。
本文合成得到了γ-氨基丁酸修饰的痂囊腔菌素A衍生物(GAEA),不仅改善了痂囊腔菌素A在光疗窗口的吸光能力,而且引入了可供进一步进行修饰的羧基基团。同时利用电子顺磁共振(ESR)技术研究了化合物GAEA的活性氧产生能力。
1 材料与方法
1.1 主要仪器与试剂
AVANCE-400核磁共振光谱仪(瑞士布鲁克),TU-1901紫外可见分光光度计(北京普析),WQF-510红外光谱仪(北京瑞利),ESP-300E电子顺磁共振光谱仪(瑞士布鲁克),质谱采用MALDI-TOF方法在Varian3800/2200(美国瓦里安)上测定。
EA由南京师范大学分析测试中心周家宏教授赠送。5,5-二甲基-1-吡咯啉-N-氧化物(DMPO),2,2,6,6-四甲基-4-哌啶酮(TEMP),1,4-二氮杂二环[2.2.2]辛烷(DABCO),γ-氨基丁酸购于Sigma-Aldrich公司。所有有机溶剂全部购于国药集团。
1.2GAEA的合成
称取γ-氨基丁酸(1.0g)、氢氧化钠(1.6g)加入三口瓶,再加入160mLDMF和水的混合溶液(1/1,v/v)。待完全溶解后,加入痂囊腔菌素A(100mg)。氩气保护下加热至150 ℃,避光回流10小时。停止反应后,加入稀盐酸调节pH到中性,过滤收集沉淀。烘干后,用三氯甲烷溶解,利用薄层色谱分离,展开剂为乙酸乙酯-石油醚(2/1,v/v),得GAEA44mg, 产率40%。FT-IR(KBr,νmax,cm-1): 3 423, 2 980, 1 739, 1 612.1H-NMR(400MHz,CDCl3,δ,ppm): 16.12(2H,s), 13.78(1H,s), 6.38(2H,s), 5.09(1H,m), 4.29(2H,s), 3.94(3H,s), 3.62(6H,s), 3.35(2H,m), 2.29(2H,m), 2.14(6H,s), 1.88(2H,m).MALDI-TOFMS: 616.19 (M+1).
1.3ESR测试
ESR用BrukerESP-300E电子自旋共振仪在室温下测得(X波段,微波频率为100Hz),照射光源为Quanta-RayNd:YAG型激光(532nm,脉宽为5-6ns,重复频率为10Hz,能量为10mJperpulse)。测量时仪器参数为:
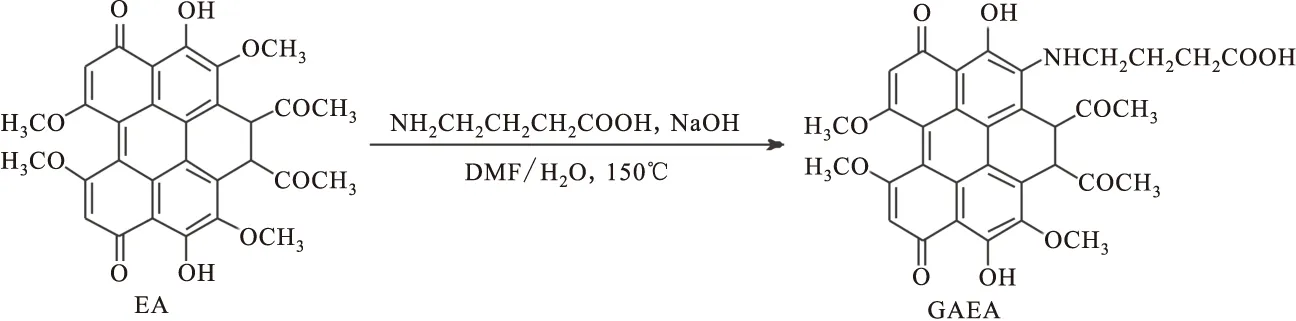
图2 GAEA的合成
2 结果与讨论
2.1GAEA的吸收光谱
由图3可以明显看出,GAEA的吸收光谱发生了显著的红移。GAEA的最大吸收波长由470nm位移到640nm。与EA相比,GAEA的最大吸收波长红移了170nm,主要是因为γ-氨基丁酸中的氨基取代了EA中的甲氧基后降低了π-π*跃迁能级,同时有效提高了GAEA在光动力治疗窗口(600-900nm)的吸光能力。此外,利用1HNMR和质谱等手段进一步确定了化合物GAEA的结构。
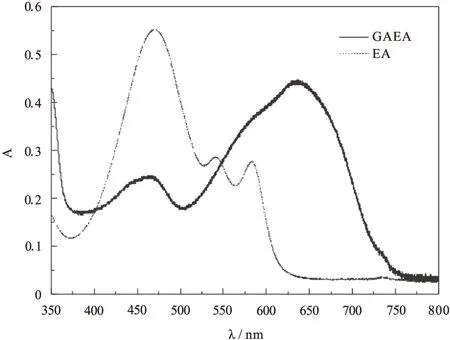
图3 GAEA与EA在DMSO中的吸收光谱
2.2 活性氧产生能力
利用ESR技术研究了GAEA的活性氧物种的产生能力。加入TEMP(3×10-3mol·L-1),光照GAEA的氧气饱和的DMSO溶液(3×10-4mol·L-1)60s后,得到一个等强度的三重峰信号(图4,曲线a)。这是典型的TEMPO的ESR信号(αN=13.0G,g= 2.005 6)。从ESR信号可以计算出裂分常数为16.0G,这一数值与文献中TEMPO的裂分常数一致[19]。对比实验证明,没有光、氧气、光敏剂或者TEMP,都无法得到这一信号。为了进一步验证单重态氧的产生,向GAEA氧气饱和的DMSO溶液(3×10-4mol·L-1)中加入了典型的单重态氧猝灭剂DABCO,光照后,虽然仍能够观察到TEMPO的ESR信号,但是其信号强度明显降低。
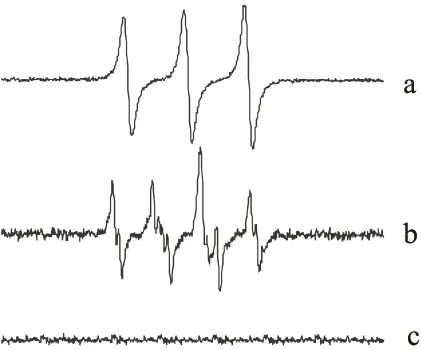
图4 (a) 加入TEMP(3×10-3 mol·L-1),光照GAEA的氧气饱和DMSO溶液(3×10-4 mol·L-1) 60 s后,得到的ESR光谱;(b) 加入DMPO(3×10-3 mol·L-1),光照GAEA的空气饱和DMSO溶液(3×10-4 mol·L-1)60 s后,得到的ESR光谱; (c) 测试条件与a和b相同,但是没有GAEA、氧气或者光照
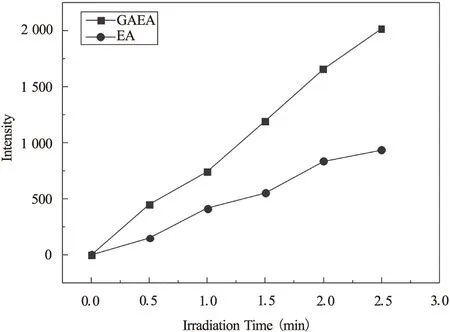
图5 GAEA与EA 的的ESR信号强度随光照时间变化

综上所述,γ-氨基丁酸修饰的痂囊腔菌素A衍生物GAEA不仅在光疗窗口具有良好的吸光能力,而且具有较好的活性氧产生能力,GAEA的超氧负离子自由基是母体化合物EA的2.2倍,是一种潜在的光动力治疗药物。
致谢:感谢安徽环境污染物降解与监测省级实验室在样品测试中给予的帮助。
[1]LuK,HeC,LinW.AChlorin-BasednanoscaleMetal-Organicframeworkforphotodynamictherapyofcoloncancers[J].JournaloftheAmericanChemicalSociety, 2015, 137(24): 7600-7603.
[2]PareekY,RavikanthM,ChandrashekarT,etal.Smaragdyrins:emeraldsofexpandedporphyrinfamily[J].AccountofChemicalResearch, 2012, 45(10): 1801-1816.
[3]ZhangC,ZhaoJ,WuS,etal.IntramolecularRETenhancedvisibleLight-AbsorbingbodipyorganictripletphotosensitizersandapplicationinphotooxidationandTriplet-Tripletannihilationupconversion[J].JournaloftheAmericanChemicalSociety, 2013, 135(28): 10566-10578.
[4]KimS,TachikawaT,FujitsukaM,etal.Far-RedfluorescenceprobeformonitoringsingletOxygenduringphotodynamictherapy[J].JournaloftheAmericanChemicalSociety, 2014, 136(33): 11707-11715.
[5]WestbergM,HolmegaardL,PimentaFM,etal.Rationaldesignofanefficient,geneticallyencodable,Protein-EncasedsingletOxygenphotosensitizer[J].JournaloftheAmericanChemicalSociety, 2015, 137(4): 1632-1642.
[6]LuckyS,SooK,ZhangY,etal.Nanoparticlesinphotodynamictherapy[J].ChemicalReviews, 2015, 115(4): 1990-2042.
[7]ChenG,YangC,PrasadPN.Nanophotonicsandnanochemistry:controllingtheexcitationdynamicsforfrequencyUp-andDown-ConversioninLanthanide-Dopednanoparticles[J].AccountsofChemicalResearch, 2013, 46(7): 1474-1486.
[8]WangS,RiedingerA,LiH,etal.PlasmonicCoppersulfidenanocrystalsexhibitingNear-Infraredphotothermalandphotodynamictherapeuticeffects[J].ACSNano, 2015, 9(2): 1788-1800.
[9] 徐尚杰,张晓星,陈 申,等.新型光动力药物——竹红菌素衍生物的研究与进展[J].科学通报,2003,48(10):1005-1015.
[10]乔 瑞.竹红菌素类光动力药物[J].阜阳师范学院学报(自然科学版),2009,26(3):28-33.
[11]DengH,LiuX,XieJ,etal.QuantitativeandSite-Directedchemicalmodificationofhypocrellinstowarddirectdrugdeliveryandeffectivephotodynamicactivity[J].JournalofMedicinalChemistry, 2012, 55(5): 1910-1919.
[12]ZhaoJ,DengH,XieJ,etal.Towardscharacteristicsofphotodynamicdrugsspecificallyaimedatmicrovasculardiseases[J].MiniReviewsinMedicinalChemistry, 2010, 10(4): 332-341.
[13]LiuX,XieJ,ZhangL,etal.AnovelhypocrellinBderivativedesignedandsynthesizedbytakingconsiderationtobothdrugdeliveryandbiologicalphotodynamicactivity[J].JournalofPhotochemistryandPhotobiologyB-Biology, 2009, 94(3): 171-178.
[14]XiaS,ZhouJ,ChenJ,etal.Atyrosine-modifiedhypocrellinBwithaffinityforandphotodamagingabilitytowardscalfthymusDNA[J].ChemicalCommunications, 2003, 39(23): 2900-2901.
[15]QiaoR,ZengZ,XiaS,etal.UsingelectrostaticinteractionstoincreasethephotodamagingabilityofhypocrellinB:synthesisandstudyof2-(dimethylamino)ethanethiol-modifiedHB[J].NewJournalofChemistry, 2007, 31(2): 196-198.
[16]LiuY,XiaS,ZengZ,etal.SynthesisofahypocrellinB-polyamideconjugateasDNA-targetingphotosensitizer[J].ChineseChemicalLetters, 2008, 19(2): 157-160.
[17]曹 槐,李 聪,刘世熙,等.痂囊腔菌素A的结构[J].化学学报,2000,58(7):821-824.
[18]MaL,TaiH,LiC,etal.PhotodynamicinhibitoryeffectsofthreeperylenequinonesonhumancolorectalcarcinomacelllineandPrimateembryonicstemcellline[J].WorldJournalofGastroenterology, 2003, 9(3): 485-490.
[19]ZengZ,ZhouJ,ZhangY,etal.PhotodynamicpropertiesofhypocrellinA,complexeswithrareearthtrivalentions:roleoftheexcitedstateenergiesofthemetalions[J].JournalofPhysicalChemistryB, 2007, 111(10): 2688-2696.
Thesynthesisandcharacterizationofγ-aminobutyricacid-modifiedElsinochromeA
MAOHui,WENXing,QIAORui*,YANGSong,CHENShui-sheng
(SchoolofChemistryandMaterialsEngineering,FuyangNormalUniversity,FuyangAnhui236037,China)
Toovercomethelackofappreciableabsorptioninthephototherapeuticwindow(600~900nm)ofthenaturallyoccurringperylenequinonoidpigment,ElsinochromeA,whichlimiteditsclinicalapplication,anγ-aminobutyricacid-modifiedelsinochromeA,possessinglongwavelengthabsorption(640nm)wassynthesized.Electronparamagneticresonanceindicatedthatγ-aminobutyricacid-modifiedelsinochromeApossessedphotosensitizingactivityanditsyieldofreactiveoxygenspecies(ROS)wasgreaterthanthatofunmodifiedElsinochromeA.
photodynamictherapy;ElsinochromeA;reactiveoxygenspecies
2015-07-12
国家自然科学基金(21302019);国家级大学生创新创业训练计划(AH201410371019);阜阳师范学院教学工程项目(2013JCJS01)资助。
乔 瑞(1979-),男,博士,副教授,研究方向:生物化学。Email:qiaorui@mail.ipc.ac.cn
O625.46
A
1004-4329(2015)04-062-04
10.14096/j.cnki.cn34-1069/n/1004-4329(2015)04-062-04
