LHβ亚基在罗非鱼腺中的表达及精巢中细胞定位
2015-12-26吴风瑞苏咪咪李文雍
吴风瑞 ,苏咪咪,刘 勇,丁 彪,李文雍,2
(1. 阜阳师范学院 生物与食品工程学院, 安徽 阜阳 236037;2. 胎发育与生殖调节安徽省重点实验室,安徽 阜阳 236037)
LHβ亚基在罗非鱼腺中的表达及精巢中细胞定位
吴风瑞1,2,苏咪咪1,刘 勇1,2,丁 彪1,2,李文雍1,2
(1. 阜阳师范学院 生物与食品工程学院, 安徽 阜阳 236037;2. 胎发育与生殖调节安徽省重点实验室,安徽 阜阳 236037)
近年来大量研究表明鱼类促性腺激素不仅在垂体中表达和分泌,性腺局部也是产生促性腺激素的场所。为验证尼罗罗非鱼LHβ是否也在性腺中表达,本研究采用RT-PCR方法检测了LHβ亚基在罗非鱼垂体、卵巢和精巢中转录水平,同时通过免疫组化的方法观察了LHβ亚基在罗非鱼精巢中表达的细胞类型。结果发现,除垂体外,LHβ亚基在罗非鱼卵巢和精巢中均有表达,且表达于精原细胞、精母细胞和精子细胞中。本研究结果将为进一步揭示罗非鱼促性腺激素功能提供基础的理论依据,也对鱼类的人工繁育具有重要意义。
LHβ亚基;RT-PCR;免疫组织化学;精巢;罗非鱼
脊椎动物垂体分泌的促性腺激素包括促滤泡激素(Follicle-stimulatinghormone,FSH)和促黄体激素(Luteinizinghormone,LH)两类,由结构亚基α和激素特异型亚基β构成的异质二聚体[1]。长期以来,人们都认为鱼类促性腺激素仅在垂体中表达和分泌,受“下丘脑-垂体-性腺”管理功能轴调控。然而越来越多的研究表明,促性腺激素三个亚基不仅在垂体中表达,在鱼类不同生长发育时期的性腺局部和其他组织也可检测到其mRNA表达信号,如南方鲇[2]、 黑鲷[3]、 金头海鲷[4]、 花鳗鲡[5]和半滑舌鳎[6]等,达到调节配子的发生、成熟和精子和卵子排放的目的。
尼罗罗非鱼((Oreochromisniloticus))为热带鱼类,隶属鲈形目(Perciformes)、丽鱼科(Cichlidae),其成熟时间短(雄鱼大约为半年,雌鱼大约为8个月),产卵周期短,是研究性别决定和性腺发育的好材料[7]。为研究罗非鱼LHβ亚基在精巢中的表达及细胞定位,本研究采用RT-PCR结合半定量分析的方法检测了LHβ亚基在罗非鱼垂体和性腺中转录水平,利用免疫组织化学的方法对LHβ亚基mRNA在精巢中表达的细胞类型进行分析。本研究结果不仅表明促性腺激素的垂体外分泌是硬骨鱼类中广泛存在的现象,也为进一步研究促性腺激素在罗非鱼性腺发育、配子成熟和释放过程中的功能提供基础的依据。
1 材料和方法
1.1 实验动物和试剂
本实验中所用罗非鱼购自本地水产市场,雌雄均性成熟,于室内35×35×50cm3玻璃水族箱内暂养,自然光照。本实验所用PCR引物由上海立菲生物技术公司合成,RNA提取试剂、Taq酶、DNaseI(RNasefree)购自Takara公司,其余均为国产分析纯试剂。
1.2RT-PCR
提取罗非鱼成鱼垂体、性腺总RNA,经DNaseI(RNasefree)处理后逆转录合成第一链cDNA,采用RT-PCR的方法研究罗非鱼LHβ亚基在垂体、卵巢和精巢中的表达。用LHβ正向引物(5′-GAATGCTCCTTGCTCTGATG-3′)和LHβ反向引物(5′-CCAGGTGGGCAATCGGGAAG-3′)、β-actin正向引物(5′-GGCATCACACCTTCTACAACGA-3′)和β-actin反向引物(5′-ACGCTCTGTCAGGATCTTCA′)扩增LHβ和β-actin开放阅读框部分片段。反应体系为25μl,反应条件依次为:94 ℃预变性 3min,变性94 ℃ 30s,退火57 ℃ 30s,延伸72 ℃ 30s,PCR产物在1.2%琼脂糖凝胶上电泳,用Bio-Rad公司凝胶成像系统成像,进行半定量分析,数据用3个平行实验的平均值±标准误表示,用GraphPadPrism5 (GraphPadSoftware,SanDiego,CA)进行相关分析,当P<0.05时,认为差异显著,当P<0.01时,认为差异极显著。
1.3 免疫组织化学
取罗非鱼垂体和精巢组织,用固定液为Bouin氏液(饱和苦味酸75mL+ 甲醛25mL+ 冰醋酸 5mL)。材料常规包埋、连续切片,厚度为5μm。二甲苯脱蜡、梯度酒精脱水,1×PBS洗5次,再用3%H2O2室温避光处理10分钟以封闭内源性过氧化物酶,PBS清洗5次,血清封闭15min,滴加石斑鱼LHβ抗体(其他实验室惠赠)37 ℃孵育30min后,同时含有一张以与一抗同一来源的动物血清替代一抗的切片作为阴性对照,以罗非鱼芳香化酶cyp19a1a抗体作为阳性对照。清洗后滴加羊抗兔辣根过氧化酶标记的二抗(博士德,中国武汉)室温孵育30min,DAB(3,3N-DiaminobenzidineTertrahydrochloride,Sigma)显色,苏木素复染,返蓝,脱水透明封片后,奥林巴斯BX51显微成像。
2 结果
2.1 罗非鱼LHβmRNA在垂体、卵巢和精巢中的表达
PCR结果表明,罗非鱼LHβmRNA在垂体、卵巢和精巢中均具有表达水平,其在垂体中表达水平最高,卵巢次之,而在精巢中表达水平最低,结果如图1所示。
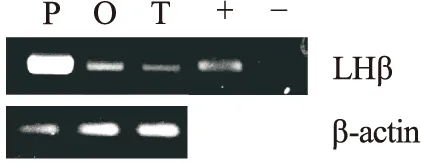
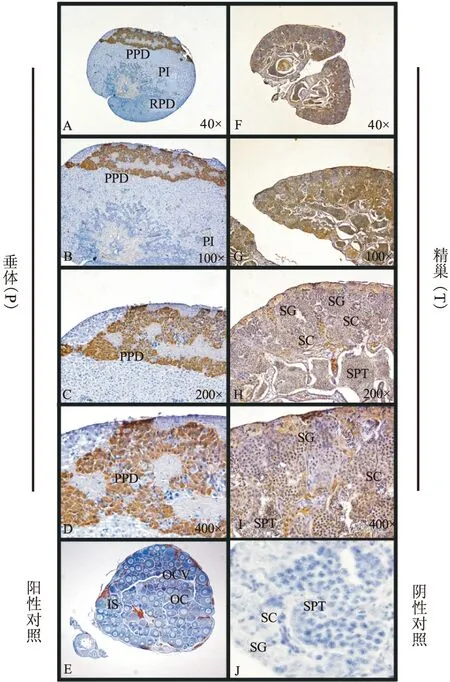
图1 罗非鱼LHβ mRNA在垂体、卵巢和精巢中的表达模式。P,垂体;O,卵巢;T,精巢;+,阳性对照;-,阴性对照;底端为内参β-actin
随后我们又采用了半定量分析对凝胶电泳图进行光密度分析,罗非鱼LHβmRNA在垂体中的表达水平大约是其在卵巢和精巢中的3-4倍(图2),且差异显著(0.01 图2 罗非鱼LHβ mRNA在垂体、卵巢和精巢中的表达模式。图中横坐标示罗非鱼垂体、卵巢、精巢组织,纵坐标为LHβ相对内参β-actin表达水平,*P<0.05 2.2 罗非鱼LHβ在垂体和精巢中表达的细胞类型 免疫组织化学结果表明,LHβ在罗非鱼垂体主要表达于近端部。而在精巢中,表达于精原细胞、精母细胞和精子细胞中。阳性对照cyp19a1a表达与该时期卵巢间质细胞,而阴性对照无显色,结果如图3所示。 硬骨鱼类促黄体激素LH主要是由垂体产生和释放,并通过血液运送到其靶器官。本研究通过RT-PCR方法发现罗非鱼LHβ不仅在垂体中表达,在卵巢和精巢中也检测到mRNA表达信号。结合我们前期[2]在南方鲇的研究和其他已有相关报道,我们认为这种垂体以外的促性腺激素的表达模式是硬骨鱼类中普遍存在的现象。 图3 罗非鱼LHβ在垂体和精巢中表达的细胞类型。PI,中间部;PPD,近端部;RPD,喙部;SG,精原细胞;SC,精母细胞;SPT,精子;OC,卵母细胞;IS,间质细胞;OCV,卵巢腔,图中40、100、200、400×示放大倍数 序列同源性分析表明,罗非鱼LHβ氨基酸序列和石斑鱼具有94%相似性[8],特别是12个半胱氨酸残基和N末端糖基化位点。Li等采用石斑鱼LHβ多克隆抗体发现LHβ主要在石斑鱼垂体近端部表达[8],我们以该抗体为一抗通过免疫组织化学的方法发现罗非鱼LHβ也表达于垂体近端部,表明此抗体在罗非鱼也具有良好的特异性。进而我们又采用该抗体研究了LHβ在罗非鱼精巢中表达的细胞类型,结果发现LHβ在罗非鱼精巢生殖细胞如精原细胞、精母细胞和精子细胞中表达,以促进精子发生、成熟,提高精子质量[9]。在金头海鲷中,通过原位杂交的方法发现LH在I、II和III期卵母细胞中表达,进一步暗示促黄体激素可以直接在性腺局部中产生并直接作用于性腺,促进配子的成熟和释放。大量研究表明,许多性腺局部的旁分泌因子同促性腺激素一起组成性腺局部的信号网络协调细胞通讯过程,共同促进性腺生殖细胞的最终成熟[10-12]。基于本研究和其他结果,我们推测精巢中促黄体激素LH可作为自分泌或旁分泌分子,增进了精巢体细胞和生殖细胞之间的相互作用,直接或间接地影响性腺发育、配子发生和成熟过程。 [1]GharibSD,WiermanME,ShupnikM,etal.Molecularbiologyofthepituitarygonadotropins[J].EndocrineReviews, 1990, 11(1): 177-199. [2]WuFR,ZhangXY,ZhangWL,etal.ExpressionofthreegonadotropinsubunitsinSoutherncatfishgonadandtheirpossiblerolesduringearlygonadaldevelopment[J].ComparativeBiochemistryandPhysiologyA-molecular&IntegrativePhysiology, 2009, 153(1): 44-48. [3]AnKw,LeeKY,YunSg,etal.Molecularcharacterizationofgonadotropinsubunitsandgonadotropinreceptorsinblackporgy,Acanthopagrusschlegeli:effectsofestradiol-17betaonmRNAexpressionprofiles[J].ComparativeBiochemistryandPhysiology.PartB,Biochemistry&MolecularBiology, 2009, 152(2): 177-188. [4]WongTT,ZoharY.Novelexpressionofgonadotropinsubunitgenesinoocytesofthegiltheadseabream(Sparusaurata)[J].Endocrinology, 2004, 145(11): 5210-5220. [5]HuangH,ZhangY,HuangWR,etal.Molecularcharacterizationofmarbledeel(Anguillamarmorata)gonadotropinsubunitsandtheirmRNAexpressionprofilesduringartificiallyinducedgonadaldevelopment[J].GeneralandComparativeEndocrinology, 2009, 162(2): 192-202. [6] 李晓晓,柳学周,史 宝,等.半滑舌鳎促性腺激素α亚基cDNA的克隆及组织表达特征[J].渔业科学进展,2013,34(5):23-30.[7]WuFR,ZhouLY,NagahamaY,etal.Duplicationanddistinctexpressionpatternsoftwothrombospondin-1isoformsinteleostfishes[J].GeneExpressionPatterns, 2009, 9(6): 436-443. [8]LiCJ,ZhouL,WangY,etalMolecularandexpressioncharacterizationofthreegonadotropinsubunitscommonalpha,FSHbetaandLHbetaingroupers[J].MolCellEndocrinol, 2005, 233(1-2):33-46. [9] 徐永江,柳学周,王妍妍,等.外源激素诱导对条斑星鲽(Veraspermoseri)精子质量的影响[J].海洋与湖沼,2012,43(6):1170-1176. [10]GeW.Gonadotropinsandtheirparacrinesignalingnetworkinthezebrafishovary[J].FishPhysiologyandBiochemistry, 2005, 31(2/3): 209-214. [11]MazónMJ,MolésG,RochaA,etal.A,CarrilloM,ZanuyS,GómezA.GonadotropinsinEuropeanseabass:Endocrinerolesandbiotechnologicalapplications[J].GenCompEndocrinol, 2015. [12]HorieY,KobayashiT.Gonadotrophiccellsandgonadalsexdifferentiationinmedaka:Characterizationofseveralnorthernandsouthernstrains[J].JExpZoolAEcolGenetPhysiol. 2015. ExpressionofLHβsubunitintilapiagonadandcelllocalizationintestis WUFeng-rui1,2,SUMi-mi1,LIUYong1,2,DINGBiao1,2,LIWen-yong1,2 (1.SchoolofBiologicalScienceandFoodEngineering,FuyangNormalUniversity,FuyangAnhui236037,China;2.KeyLaboratoryofEmbryoDevelopmentandReproductiveRegulation,FuyangAnhui236037,China) Ithasbeenreportedthatfishgonadotropinwasexpressedinpituitary,butalsoinlocalgonad.ToconfirmwhethertilapiaLHβsubunitisexpressedingonadornot,RT-PCRwasperformedtodetectthetranscriptionlevelintilapiapituitary,ovaryandtestis.Moreover,thegonadalcelltypewhereLHβexpresswasfurtheranalyzedbyImunohistochemistry.TheresultsshowedthattilapiaLHβwasexpressedbothinovaryandtestisbesidespituitary,andtheexpressionlevelofLHβinpituitarywasas3-4timesthaninovaryandtestis.Meanwhile,LHβwasfoundinspermatocytes,spermatogoniumandspermatidsintestis.Together,theseresultswillprovidebasicdataforfurtherindicatingthefunctionofgonadotropinintilapia,andcouldbebeneficialforartificialinseminationinfish. LHβsubunit;RT-PCR;Imunohistochemistry;testis;Tilapia. 安徽省自然科学基金青年项目(1408085QC65),安徽省高等学校省级自然科学研究重点项目(KJ2013A202);大学生创新创业训练计划项目(AH201410371083)资助。 吴风瑞(1981-),男,博士,副教授,研究方向:胚胎发育的分子机制。 Q952 A 1004-4329(2015)04-066-03 10.14096/j.cnki.cn34-1069/n/1004-4329(2015)04-066-03 投稿日期:2015-6-17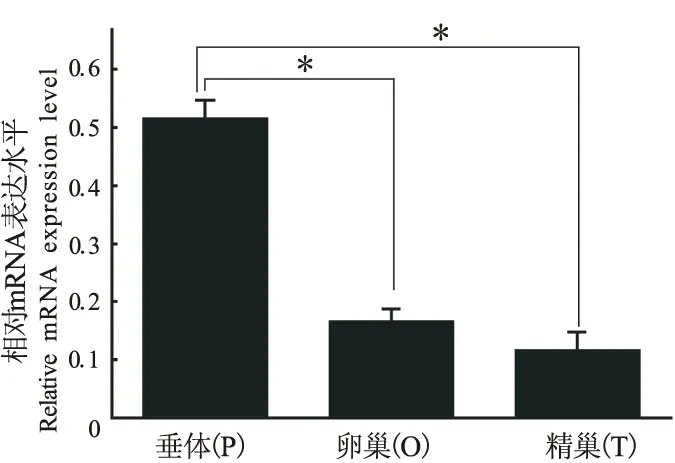
3 分析与讨论