Chiralpak AD 和Chiralcel OD-H 手性固定相拆分3α-酰氧基-6β-乙酰氧基莨菪烷类化合物
2015-12-26谢一凡胡优敏刘慧中钮因尧
成 斌, 谢一凡, 胡优敏, 刘慧中, 钮因尧* , 陆 阳
(1. 上海交通大学医学院药学系化学教研室,上海200025;2. 上海交通大学医学院实验教学中心功能学实验室,上海200025;3. 上海交通大学医学院实验教学中心化学生物学实验室,上海200025)
毒蕈碱型胆碱能受体(muscarinic receptor,简称M 受体)广泛分布于中枢及外周神经组织、心脏、平滑肌及腺体等,调节神经信号传递、心血管活动、平滑肌收缩及分泌腺功能等。M 受体有M1~M55种亚型。其中,M3亚型主要位于平滑肌和腺体,是多种疾病的重要靶标。M3受体拮抗剂可用于临床治疗膀胱过度活动症等与平滑肌有关的疾病[1,2],并已成为缓解慢性阻塞性肺病的首选药物[1,3]。但是,亚型选择性(M3/M2)偏低的M3受体拮抗剂在临床应用中,因拮抗M2亚型受体会引起心动过速、矛盾性支气管收缩、黏液高分泌而产生较强的副作用[4-7]。
由本课题组合成的系列外消旋3α-酰氧基-6β-乙酰氧基莨菪烷类化合物具有较好的M3受体拮抗活性及一定的亚型选择性(M3/M2)[8,9]。这些化合物都具有(3S,6S)和(3R,6R)对映异构体。前期初步研究结果表明(3S,6S)-异构体的拮抗活性大多为(3R,6R)-异构体的100 倍以上,且分子的绝对构型对亚型选择性(M3/M2)也有一定的影响[10]。与外消旋体相比,(3S,6S)-异构体更具有高效低毒的潜质和药物研发价值。因此,本课题组进一步设计合成了系列手性3α-酰氧基-6β-乙酰氧基莨菪烷用于生物学研究。为了准确评价该类化合物不同对映异构体的拮抗活性及亚型选择性(M3/M2),需要建立分析异构体光学纯度的方法,而该方法鲜见报道。
本文应用高效液相色谱(HPLC)法,分别利用淀粉型Chiralpak AD、纤维素型Chiralcel OD-H 手性柱,尝试拆分3α-酰氧基-6β-乙酰氧基莨菪烷类化合物的6 对对映异构体(结构见图1),探讨手性拆分机理,分析C-3α 位取代基团的立体、静电性质对拆分结果的影响,为其他莨菪烷类化合物的拆分分离提供方法参考。
1 实验部分
1.1 仪器和试剂
美国Agilent 1260 高效液相色谱仪包括G1311C 四元泵、G1329B 自动进样器、G1316A 柱温箱、G4212B 二极管阵列检测器和OpenLAB CDS Chemstation 色谱工作站;Chiralpak AD (250 mm×4.6 mm,10 μm)色谱柱和Chiralcel OD-H(250 mm×4.6 mm,5 μm)色谱柱购自大赛璐药物手性技术上海有限公司;正己烷、异丙醇为HPLC 级(美国TEDIA 公司);3α-酰氧基-6β-乙酰氧基莨菪烷类化合物由上海交通大学医学院化学教研室合成。
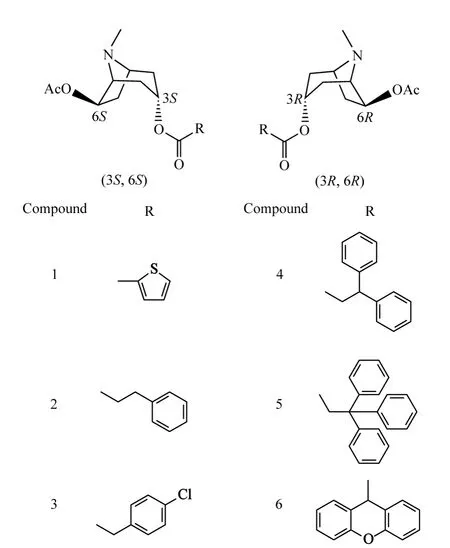
图1 3α-酰氧基-6β-乙酰氧基莨菪烷的对映异构体的结构Fig.1 Structures of enantiomers of 3α-acyloxy-6βacetoxyltropane compounds
1.2 样品制备
于1 mL 异丙醇中加入1 mg 样品,超声溶解。取该溶液100 μL,加入400 μL 正己烷,振荡摇匀。
1.3 色谱条件
色谱柱为Chiralpak AD、Chiralcel OD-H 手性柱,流动相为不同配比的正己烷-异丙醇,流速0.8 mL/min,检测波长为210 ~250 nm 范围内化合物的最大吸收波长,柱温30 ℃,进样体积5.0 μL。
2 结果与讨论
2.1 Chiralpak AD 手性柱对系列化合物的拆分
在正相色谱条件下,选择不同的流动相以及各种配比拆分6 个目标物,通过比较分离结果,获得最优的色谱分离条件。以正己烷-异丙醇为流动相,6对对映异构体在Chiralpak AD 手性柱上的拆分结果见表1,色谱图见图2。可以看出,Chiralpak AD手性柱对对映体6 的选择性识别能力最强(选择性因子α =1.21),对映体6 实现完全分离(Rs=3.31);手性柱对对映体2、3、4 的选择性识别能力较低(α=1.03,1.05,1.05),3 对对映体仅实现部分分离(Rs=0.55,0.72,0.90);对对映体1、5 没有选择性(α 均为1.00),两对对映体完全没有被分离(Rs均为0)。
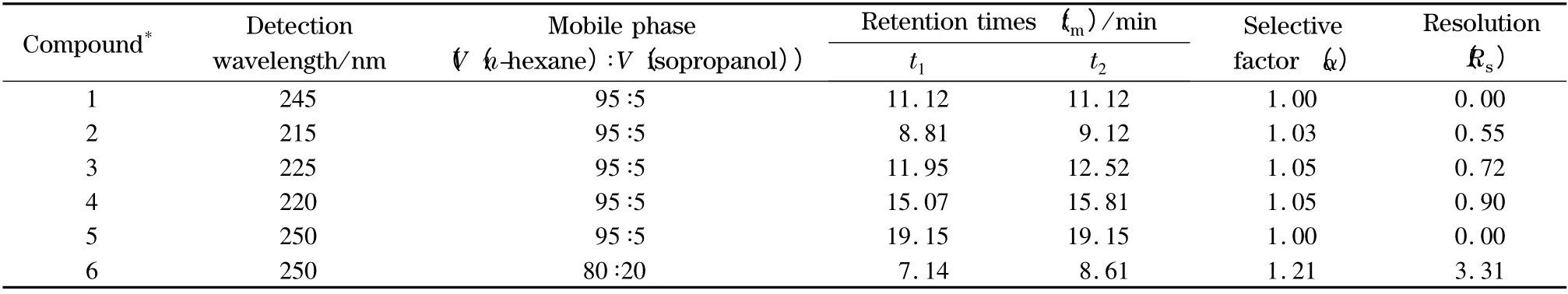
表1 3α-酰氧基-6β-乙酰氧基莨菪烷系列化合物在Chiralpak AD 手性柱上的拆分Table 1 Enantioseparation of 3α-acyloxy-6β-acetoxyltropane compounds on a Chiralpak AD column
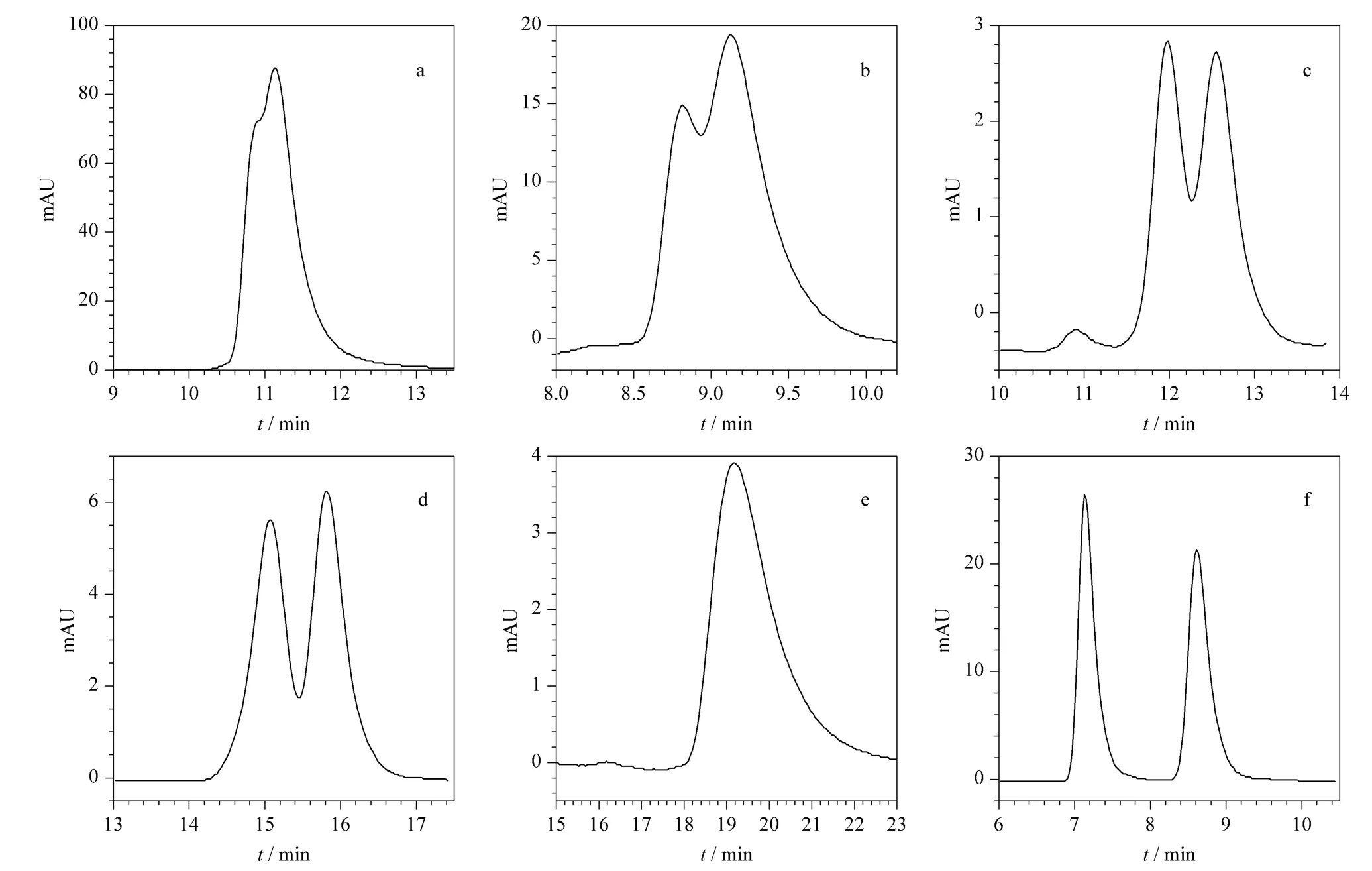
图2 正相色谱条件下6 个3α-酰氧基-6β-乙酰氧基莨菪烷化合物在Chiralpak AD 柱上拆分的色谱图Fig.2 Chromatograms of enantioseparation of six 3α-acyloxy-6β-acetoxyltropane compounds on a Chiralpak AD column under normal phase conditions
2.2 Chiralcel OD-H 手性柱对系列化合物的拆分
在正相色谱条件下,通过条件优化实验,获得Chiralcel OD-H 手性柱拆分6 对对映体的最优分离条件。以正己烷-异丙醇为流动相,6 对对映异构体在Chiralcel OD-H 手性柱上的拆分结果见表2,色谱图见图3。可以看出,Chiralcel OD-H 手性柱对对映体1 的选择性最大(α =1.10),对映体实现完全分离(Rs=2.32);与淀粉型Chiralpak AD 手性柱相比,纤维素型Chiralcel OD-H 手性柱对对映体2、3、4 的选择性增强(α=1.04,1.07,1.09);对映体2的分离度明显增大(Rs=0.80),而对映体3、4 分别实现基本分离(1 <Rs=1.46 <1.5)和基线分离(Rs=1.54);但是对对映体6 的选择性却降低(α =1.05),对映体仅实现部分分离(Rs=1.00);手性柱对对映体5 没有选择性(α =1.00),对映体完全没有被分离(Rs=0)。

表2 3α-酰氧基-6β-乙酰氧基莨菪烷系列化合物在Chiralcel OD-H 手性柱上的拆分Table 2 Enantioseparation of 3α-acyloxy-6β-acetoxyltropane compounds on a Chiralcel OD-H column
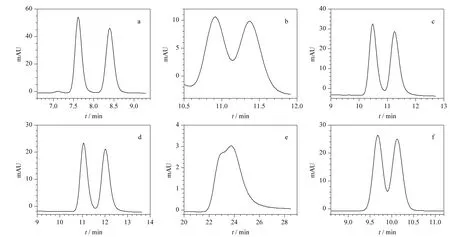
图3 6 对3α-酰氧基-6β-乙酰氧基莨菪烷对映体在正相条件下Chiralcel OD-H 柱上拆分的色谱图Fig.3 Chromatograms of enantioseparation of six 3α-acyloxy-6β-acetoxyltropane compounds on a Chiralcel OD-H column under normal phase conditions
2.3 两种手性柱对3α-酰氧基-6β-乙酰氧基莨菪烷的拆分机理和结果分析
Chiralpak AD、Chiralcel OD-H 柱的手性固定相分别是涂敷在10 μm、5 μm 厚硅胶表面的直链淀粉-三(3,5-二甲苯基氨基苯甲酸酯)和纤维素-三(3,5-二甲苯基氨基苯甲酸酯)[11](结构见图4)。多糖类手性固定相的拆分机制尚未被完全阐明。一般认为手性固定相内部存在手性空腔,化合物全部或部分进入空腔,与固定相之间产生氢键作用,同时发生偶极-偶极、π-π 等相互作用。具有一定空间位阻的取代基能使一对对映体与固定相的手性空腔产生一定的空间适应性差异,有助于形成具有不同稳定性的非对映体复合物,从而被先后洗脱分离[12,13]。
本文中莨菪烷类化合物的C-3α 位酰氧基的羰基O 作为给电子体可能与固定相R 基团中的NH形成氢键,同时,C-3α 位上的五、六元环和固定相的芳香环也可能存在π-π 作用。但是,由于C-3α 位取代基团的静电、立体性质不同,同一手性柱对于3α-酰氧基-6β-乙酰氧基莨菪烷系列各化合物的拆分效果存在明显差异。
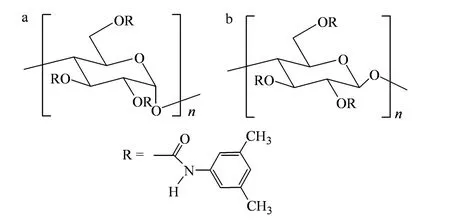
图4 (a)Chiralpak AD 和(b)Chiralcel OD-H 手性固定相的结构Fig.4 Structures of chiral stationary phases of (a)Chiralpak AD and (b)Chiralcel OD-H
对映体4 的C-3α 位取代基团3,3-二苯基-丙酰氧基,其体积比对映体2、3 的苯丙酰氧基、对氯苯乙酰氧基的体积大。适当增加化合物的空间位阻,有利于扩大一对对映体与固定相之间的空间适应性差异,提高手性柱对旋光异构体的识别能力,所以对映体4 在两种手性柱上的拆分效果都优于对映体2、3。对映体3 与2 相比,C-3α 位取代基的苯环上多了一个氯原子,通过p-π 共轭,适当增强化合物与手性固定相之间的π-π 作用,有利于增加一对对映体保留时间之间的差异,使其更容易被分离。在两种手性柱上,对映体3 的分离度比对映体2 略高。对映体6 与4 相比,在C-3α 位通过环化固定两个苯环的相对位置,进一步增加了空间位阻,提高了Chiralpak AD 手性柱对对映体6 的选择性识别能力,从而实现了对映体的完全分离。对映体5 与4相比,C-3α 位的取代基团(3,3,3-三苯基-丙酰氧基)多了一个苯环,在增加空间体积的同时,可能大大增强了化合物与固定相之间的π-π 相互作用,延长化合物在两种手性柱中的保留时间(对映体5 在两种手性柱中的保留时间最长),同时显著降低了对映体与固定相之间的空间适应性差异,使得两种手性柱对对映体5 无选择性识别能力,对映体完全不能被拆分。可见π-π 相互作用在对映体的拆分中也发挥着重要作用。
淀粉型Chiralpak AD 和纤维素型Chiralcel OD-H 两种手性柱的固定相虽然都属于多糖,且分子式相同,但淀粉型固定相以α-1,4 糖苷键连接形成螺旋结构,而纤维素型固定相却通过β-1,4 糖苷键形成线型结构,它们各自形成的手性空腔的空间结构不同,与同一化合物的一对对映异构体之间的空间适应性差异不同,使得化合物在两种手性柱上的拆分效果完全不同。例如,在Chiralpak AD 柱上,对映体6 实现完全分离,对映体1 完全不能分离。但在Chiralcel OD-H 柱上,对映体6 只能实现部分分离,而对映体1 却实现完全分离。除对映体5、6 以外,Chiralcel OD-H 柱对化合物的拆分能力都强于Chiralpak AD 柱,表明总体上Chiralcel ODH 柱对3α-酰氧基-6β-乙酰氧基莨菪烷系列化合物的拆分效果更好。此外,由于两手性柱填料的粒径不同(Chiralpak AD,10 μm;Chiralcel OD-H,5 μm),柱效相差较大,对拆分效果也会产生一定的影响。
流动相中的极性成分异丙醇也能与固定相形成氢键,抑制化合物-固定相复合物的形成,降低Chiralpak AD、Chiralcel OD-H 柱的手性识别能力。因此,减小流动相中异丙醇的比例,能增强两种手性柱对对映异构体的手性识别能力,延长化合物在柱中的保留时间,提高对映体的分离度[14]。
3 结论
本文考察了6 个外消旋体3α-酰氧基-6β-乙酰氧基莨菪烷在Chiralpak AD、Chiralcel OD-H 手性柱上的拆分情况。在Chiralpak AD 手性柱上,对映体6 实现完全分离,而对映体1 完全不能分离;在Chiralcel OD-H 柱上,对映体1、4、3 分别实现完全分离、基线分离和基本分离,对映体6 只能实现部分分离;对映体5 在两种手性柱上都完全不能被分离。说明固定相手性空腔的结构对化合物的拆分结果影响很大。对映体5 在两种手性柱上都完全不能被分离。拆分结果表明,C-3α 位取代基团的空间位阻效应是决定对映体与手性空腔空间适应性差异的关键因素,它主导手性固定相选择性识别对映体的能力强弱,但是化合物与固定相之间的分子间作用力在对映体的拆分中也发挥重要作用。本研究方法为其他莨菪烷类化合物的手性拆分提供了参考。
[1] Glavind K,Chancellor M. Int Urogynecol J,2011,22(8):907
[2] Ehlert F J. Life Sci,2003,74(2/3):355
[3] Cazzola M,Page C P,Calzetta L,et al. Pharmacol Rev,2012,64(3):450
[4] Diouf O,Gadeau S,Chelle F,et al. Bioorg Med Chem Lett,2002,12(18):2535
[5] Alabaster V A. Life Sci,1997,60(13/14):1053
[6] Mitsuya M,Mase T,Tsuchiya Y,et al. Bioorg Med Chem,1999,7(11):2555
[7] Mitsuya M,Kobayashi K,Kawakami K,et al. J Med Chem,2000,43(26):5017
[8] Liu H Z,Ou M X,Yan Z H,et al. Journal of Shanghai Jiaotong University:Medical Science (刘慧中,欧美贤,严忠红,等. 上海交通大学学报:医学版),2012,32(1):27
[9] Ou M X,Shi Y M,Liu H Z,et al. Journal of Shanghai Jiaotong University:Medical Science (欧美贤,史一鸣,刘慧中,等. 上海交通大学学报:医学版),2011,31(7):909
[10] Wang Z P,Liu H Z,Zhu L,et al. Bioorg Med Chem,2013,21(5):1234
[11] Xun Y B,Ao H G,Qiu J,et al. West China Journal of Pharmaceutical Sciences (寻延滨,敖红光,邱婧,等. 华西药学杂志),2013,28(5):495
[12] Wang M. Chinese Journal of Chromatography (王敏. 色谱),2014,32(2):198
[13] Yang L M,Xie Y F,Gu Z H,et al. Chirality,2011,23(8):581
[14] Zou Q G,Sun L L,Wei P. Journal of China Pharmaceutical University (邹巧根,孙莉莉,韦萍. 中国药科大学学报),2012,43(1):51
