高效阴离子交换色谱-积分脉冲安培检测法同时测定黄酒中的单糖和低聚糖及其指纹图谱的构建
2015-12-26胡贝贞董文洪夏碧琪宋伟华
胡贝贞, 董文洪, 夏碧琪, 宋伟华, 韩 超*
(1. 绍兴出入境检验检疫局,浙江 绍兴312000;2. 温州出入境检验检疫局,浙江 温州325027)
黄酒是我国的传统酿造酒,其中含有功能性氨基酸和肽类、糖类(低聚糖为主)、无机元素、多酚等多种对人体有益的生物活性成分,这些组分赋予了黄酒独特的保健功能,其功用和价值得到了广泛认可。近年来,已有较多研究机构开展了黄酒功效和有益成分的研究[1,2]。糖类是黄酒中的主要成分之一,主要来源于生产过程中未完全发酵的残糖和糊精[3],其中含量最高的是葡萄糖,其次是潘糖、麦芽糖、异麦芽糖等低聚糖,它们赋予了酒液甜味和黏稠的口感。由于发酵工艺上的差别,不同品种的黄酒按含糖量高低可分为干型、半干型、半甜型、甜型4类[4],摄取低聚糖对人体健康有益。目前测定黄酒中糖类的标准方法均是测定总糖含量的化学滴定方法,结果以葡萄糖含量计,仅有少量仪器分析的研究[5-7]对低聚糖进行了测定,研究结果不是很全面和深入。
目前针对食品中糖含量测定的仪器分析方法主要有液相色谱-示差折光法[8]、液相色谱-蒸发光散射法[9]、液相色谱-质谱法[10,11]和离子色谱-脉冲安培法[12-14]等。糖类化合物具有弱酸性及亲水性,在比较强的碱性溶液中以阴离子形态存在,其还原性为直接进行安培检测提供了可能[15],近年来离子色谱-脉冲安培检测法已成为分析该类物质的主流方法[16-20]。本文在已有文献的基础上,建立了黄酒中主要单糖和低聚糖的离子色谱-脉冲安培检测法,对色谱条件和前处理方法进行了优化,并将所建立的方法用于不同含糖量的绍兴黄酒的检测。
指纹图谱是指经光谱或色谱测定得到的组分群体的特征图谱或图像,建立指纹图谱能较为全面地反映产品中所含的化学成分的种类与数量,进而对其质量进行整体描述和评价[21]。指纹图谱技术近年来也越来越多地运用于酒的检测中,主要集中在葡萄酒[22]和白酒[23,24]行业,该技术在黄酒检测中的应用报道较少。本文选取几家绍兴酒生产企业不同批次、不同年份的加饭酒进行检测,基于所得的检测结果,利用中位数法构建了标准指纹图谱,并采用夹角余弦法评价了各个样品与标准指纹图谱之间的相似度,初步分析了以相似度鉴别不同厂家酒的可行性。
1 实验部分
1.1 仪器与试剂
ICS-5000 型离子色谱仪(美国ThermoFisher Scientific 公司),配备ED5000 电化学检测器、Au工作电极、pH-Ag/AgCl 复合参比电极、Chromeleon6.8 色谱工作站、AS-AP 自动进样器。CarboPacTM10 保护柱(50 mm×4 mm),CarboPacTM10分析柱(250 mm×4 mm)。SYNERY 型超纯水发生器(美国Millipore 公司)。
D-葡 萄 糖(纯 度99.5%)、D-果 糖(纯 度99.5%)、D-麦芽糖(纯度99%)、麦芽三糖(纯度98.6%)购于德国Dr. Ehrenstorfer 公司,异麦芽糖(纯度>97%)、异麦芽三糖(纯度>97%)、潘糖(纯度>98%)购于东京化成工业株式会社;50% (质量分数)的氢氧化钠(NaOH)溶液、电化学分析用醋酸钠(NaOAc)购于美国ThermoFisher Scientific 公司;C18固相萃取柱:1 000 mg/6 mL(德国MN 公司);甲醇(色谱纯,美国Tedia 公司);实验用水均采用电阻率不低于18.2 MΩ·cm 的超纯水。
1.2 溶液的配制
1.2.1 标准溶液
分别称取各种糖100 mg,用超纯水溶解并定容至100 mL 容量瓶中,配成质量浓度为1 g/L 的标准储备液,于-18 ℃冷冻保存。使用前取出解冻,取等量同浓度级别的标准溶液混合后作为混合标准工作溶液。
1.2.2 淋洗液
250 mmol/L NaOH 溶液:取50% 的NaOH 溶液20 g,用水稀释定容至1 L,混匀后立即通氮气(55 000 Pa)保护。
200 mmol/L NaOAc 溶液:称取16.4 g 固体醋酸钠,用水溶解后稀释定容至1 L,混匀后立即通氮气(55 000 Pa)保护。
1.3 样品前处理
取C18固相萃取柱,依次用6 mL 甲醇、6 mL 超纯水活化,备用。取0.5 mL 黄酒样品,用超纯水稀释定容至100 mL,待净化。取2 mL 待净化液加到已活化好的小柱上,弃去流出液,再加2 mL 待净化液至小柱上,收集流出液,过0.22 μm 尼龙滤膜后供仪器检测。
1.4 色谱条件
色谱柱:CarboPacTM10 保护柱(50 mm×4 mm)和CarboPacTM10 分析柱(250 mm×4 mm),柱温为30 ℃。以超纯水(A)、250 mmol/L NaOH(B)和200 mmol/L NaOAc(C)为淋洗液进行洗脱,梯度洗脱程序为:0 ~2.0 min,82% A,18% B;2.0 ~11.0 min,82% A ~72% A,18% B,0 ~10% C;11.0 ~20.0 min,72% A ~62% A,18% B,10% C ~20% C;20.0 ~30.0 min,62% A ~52% A,18% B,20% C ~30% C;30.0 ~32.0 min,52% A ~32% A,18% B,30% C ~50% C;32.1 ~37.0 min,20% A,80% B;37.1 ~42.0 min,82% A,18% B。流速为1.0 mL/min,进样量为25 μL,检测方式为四电位脉冲安培检测。标准物质的色谱图见图1b。
2 结果与讨论
2.1 淋洗液浓度及淋洗梯度的优化
本实验对比了仅使用NaOH 作淋洗液(见图1a)和搭配使用NaOH、NaOAc 作淋洗液(见图1b)的分离效果。结果显示,仅使用NaOH 作淋洗液时,各物质色谱峰的对称性较差,后流出的物质出峰较晚,且展宽较严重;而同时加入NaOAc 并逐渐提高其洗脱浓度后,各物质峰形对称且出峰时间更合理,故本实验采用1.4 节的洗脱条件,在梯度洗脱中加入NaOAc 并逐渐提高浓度以提升其对后流出糖类的洗脱能力。
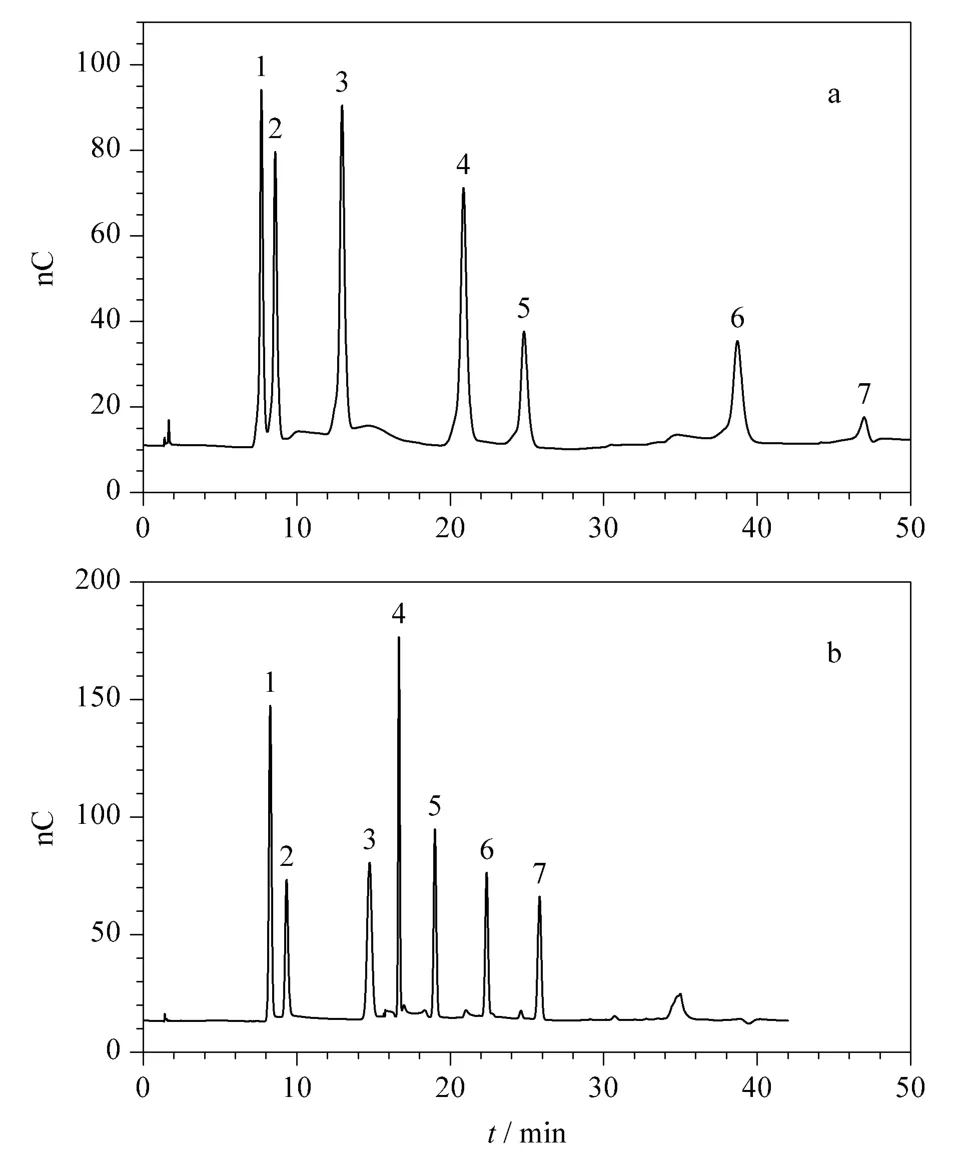
图1 不同淋洗液洗脱条件下糖标准溶液的色谱图Fig.1 Chromatograms of saccharide standard solution with different eluents
本实验还考察了不同比例的NaOH 以及NaOAc 加入时间对各种糖类洗脱效果的影响。结果显示,随着NaOH 淋洗浓度的加大及NaOAc 加入时间的提前,各物质出峰时间提前,峰形不同程度地变得尖锐,但是葡萄糖和果糖的分离度有所下降,当NaOH 淋洗浓度为125 mmol/L 时,两者未达到基线分离。当NaOH 淋洗浓度为75 mmol/L 时,标准溶液中葡萄糖和果糖刚达到基线分离;而在实际样品检测时还发现,样品中紧接着葡萄糖有一个杂质出峰,无法与果糖有效分离,而NaOH 淋洗浓度为45 mmol/L 时,果糖与该杂质能有效分离,故本方法最终选用1.4 节的洗脱条件(NaOH 淋洗浓度为45 mmol/L)作为最终的洗脱程序。
2.2 线性关系、定量限
准确配制含量分别为0.5、2、5、10、25、50 mg/L的混合标准溶液,按1.4 节的条件进行分析,以峰面积对质量浓度作图,结果显示:各种糖在0.5 ~50 mg/L 范围内线性关系良好,相关系数在0.998 0 ~0.999 2 之间。各物质的线性方程及相关系数(R2)见表1。
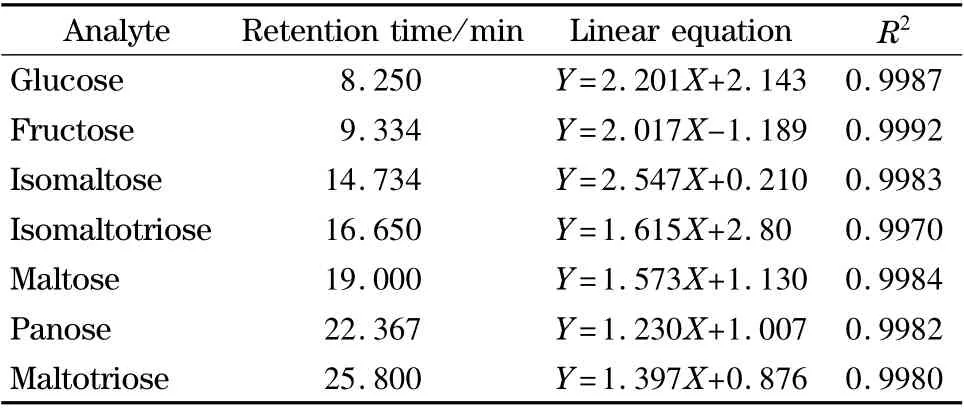
表1 各物质的保留时间、线性方程和相关系数Table 1 Retention times,linear equations and correlation coefficients (R2)of the analytes
本方法的定量限(LOQ)根据信噪比大于10 计算得出,以各标准物质在样品基体中的响应低限0.5 mg/L 计,乘以样品稀释倍数200 倍,得定量限为0.1 g/L。
2.3 加标回收率和精密度
选取一个糖本底含量较低的酒作加标回收率试验的样品,分别添加0.8、2.0、4.0 g/L 3 个水平的混合标准溶液,每个水平做6 个平行样品,计算平均回收率和相对标准偏差,考察方法的准确度和精密度。从表2 可见,回收率在76.5% ~108.4% 之间,相对标准偏差在3.02% ~8.23% 之间。
2.4 实际样品的测定
选取有代表性的总糖含量经检测符合GB/T 13662-2008 规定的不同含糖量的4 大类型绍兴黄酒元红酒(干型,总糖含量0 ~10 g/L)、加饭酒(半干型,又称花雕酒,总糖含量10 ~40 g/L)、善酿酒(半甜型,总糖含量40 ~100 g/L)、香雪酒(甜型,总糖含量>100 g/L)及QB/T 7545-2005(优级的总糖含量≥10 g/L,一级的总糖含量不作要求)中规定的烹饪黄酒各一个,按所建立的方法进行检测,检测结果见表3,典型的加饭酒样品谱图见图2。
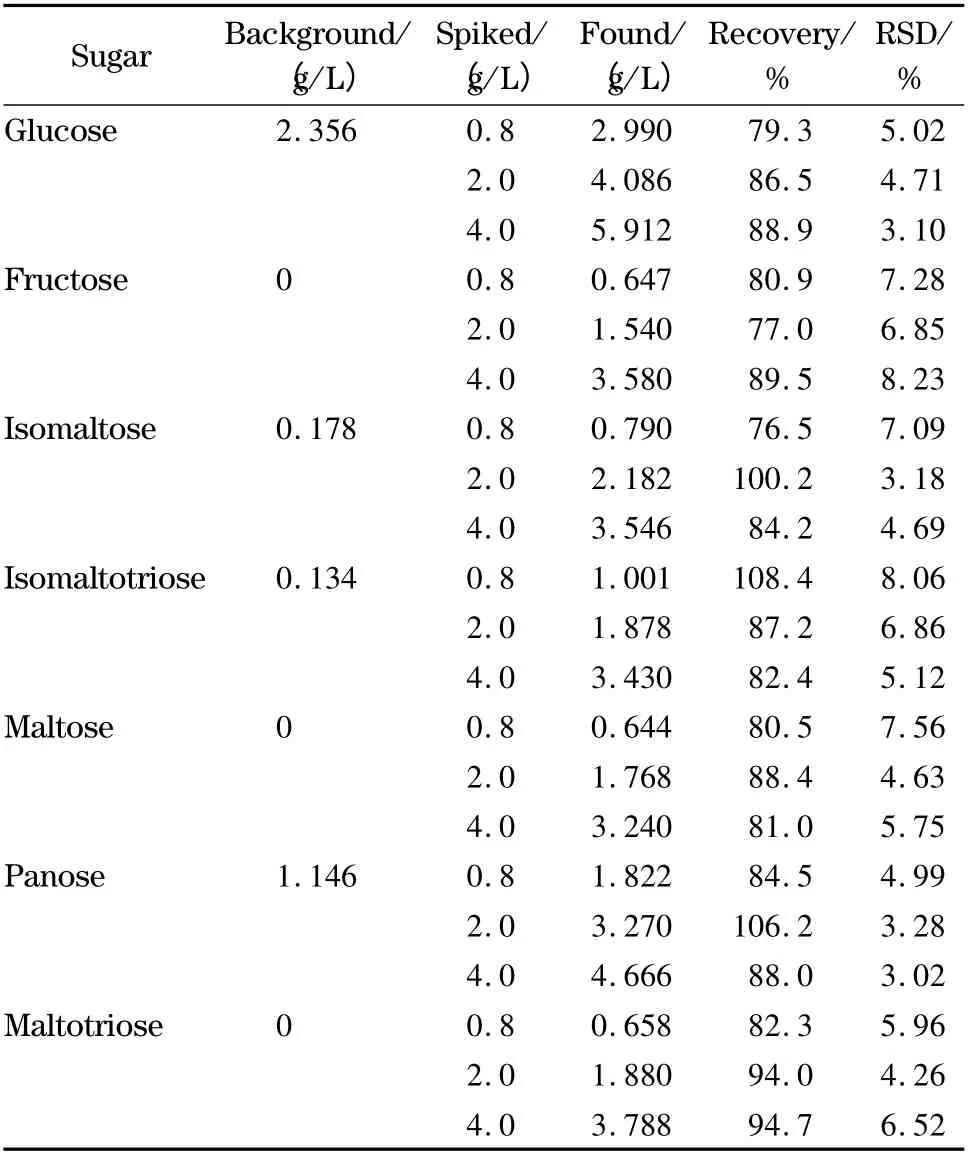
表2 目标物在样品中的加标回收率和相对标准偏差(n=6)Table 2 Recoveries and RSDs of the analytes spiked in a sample (n=6)
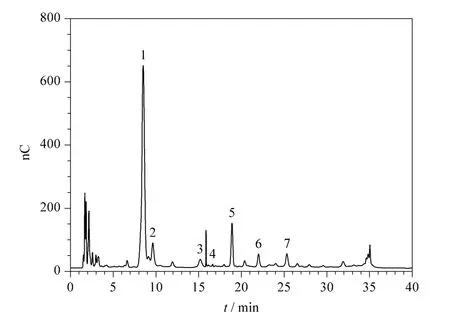
图2 含有7 种糖类的加饭酒样品谱图Fig.2 Chromatogram of a Jiafan rice wine sample containing seven sugars
由检测结果可见,葡萄糖是各种糖类中含量最高的,其次为潘糖、异麦芽糖和麦芽糖,异麦芽三糖含量较低,果糖在加饭、善酿和香雪酒中检出,麦芽三糖在个别样品中检出。5 种酒中,烹饪黄酒的含糖量最低,可能是该种酒不直接用于饮用,对口味要求较低,有可能经过勾兑稀释;元红酒发酵完全,含残糖少,属于干型酒,含糖种类以葡萄糖和潘糖为主,其余几种糖含量极低;加饭酒是绍兴黄酒中最著名、最普遍的一种,以元红酒为基础精制而成,在酿酒过程中增加糯米和麦麹的量,故各种糖含量较元红酒高;善酿酒是以贮存1 ~3 年的陈元红酒代水酿成的双套酒,即以酒制酒,糖分较高,属于半甜型酒,其中潘糖含量是4 大类酒中最高的;香雪酒是以糟烧白酒替代水,采用淋饭法酿制的一种双酿酒,属于甜型酒,其中的葡萄糖含量是4 大类酒中最高,除潘糖外,其余几种糖类含量也是4 大类酒中最高。文献[5]指出,葡萄糖和潘糖含量对黄酒口味评分起正面作用,善酿酒潘糖含量高、香雪酒葡萄糖含量高也可以在一定程度上解释这两种酒独特的口味。
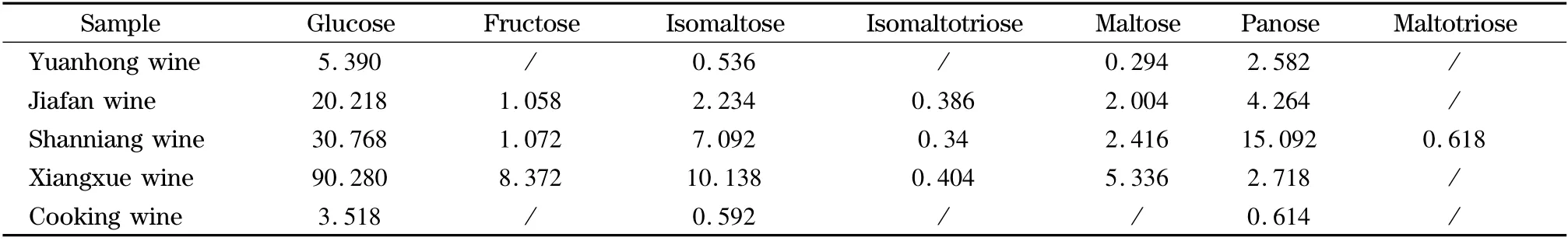
表3 酒类样品检测结果Table 3 Results of wine samples g/L
2.5 指纹图谱的建立及分析
对A、B、C 3 家酒厂每家生产的1 年、3 年、5年、8 年、10 年陈各5 个批次共75 个加饭酒样品进行检测并进行结果统计,建立指纹图谱并进行相似度分析。
2.5.1 标准指纹图谱的构建
3 家酒厂的加饭酒均检出的共有糖类有葡萄糖、潘糖、异麦芽糖和麦芽糖4 种,检测含量见附表1 (http://www. chrom-China. com/UserFiles/File/10. 3724SP. J. 1123. 2015. 02053-supplement.pdf)。本文参照文献[24]所述的方法,以每家所检样品4 种糖含量的中位值(见附表1)所组成的图谱视为该家酒厂加饭酒的标准指纹图谱。
2.5.2 相似度分析
指纹图谱的相似度计算首先是将一张指纹图谱视为一个n 维向量,组成这个向量的元素是色谱峰面积(本实验各物质的含量是由峰面积计算得到的,故计算时采用含量替代峰面积),两张指纹图谱之间的相似度是对2 个n 维向量运用公示计算而得。本文参照文献[24]的做法采用夹角余弦法计算相似度,计算公式如下:
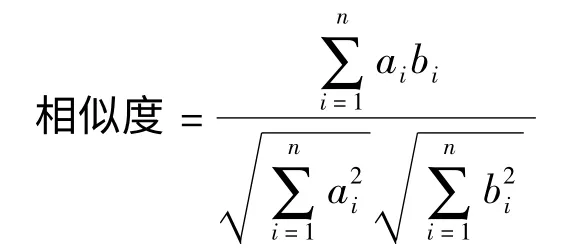
式中:ai为待测指纹图谱中第i 个物质峰的含量,bi为标准指纹图谱中第i 个物质峰的含量,n 为色谱峰的数目。计算过程可在Excel 软件中进行。
A、B、C 3 家酒厂各25 个酒样相对于A、B、C 标准谱图的相似度计算结果见附表2(http://www.chrom-China. com/UserFiles/File/10. 3724SP. J.1123.2015. 02053-supplement. pdf)。由附表2 可见,同一厂家生产的不同批次、不同年份的酒之间相似度较好,含糖量没有显著的差异,但与其余两家酒厂样品的标准谱图相比,相似度明显变差,如A、B与C 的相似度总体差异较显著,均小于0.9。这初步说明本方法建立的标准谱图可作为区分不同厂家绍兴加饭酒的依据之一。
3 结论
本文建立了高效阴离子交换色谱-积分脉冲安培检测法测定黄酒中葡萄糖等7 种单糖和低聚糖的方法,将所建立的方法用于不同糖含量的绍兴元红、加饭、善酿、香雪酒的检测。与已有相关文献相比,本文利用所建立的方法初步获得了4 种不同类型黄酒中7 种单糖和低聚糖的含量情况;对不同厂家不同年份和批次的加饭酒进行检测并建立指纹图谱进行相似度计算,结果显示指纹图谱相似度计算结果可为区别不同厂家加饭酒提供依据之一。
[1] Wang J L,Zhang Y,Yu Q F,et al. Liquor-Making Science &Technology (王家林,张颖,于秦峰,等. 酿酒科技),2011(7):47
[2] Ni L,Lü X C,Huang Z Q,et al. Journal of Chinese Institute and Food Science and Technology (倪莉,吕旭聪,黄志清,等. 中国食品学报),2012,12(3):1
[3] Li J S. Liquor-making Science &Technology (李家寿. 酿酒科技),2001(3):48
[4] GB/T 13662-2008
[5] Li B B,Liu X Q,Wu J,et al. China Brewing (李博斌,刘兴泉,吴坚,等. 中国酿造),2010(8):37
[6] Xie G F,Dai J,Zhao G A,et al. China Brewing (谢广发,戴军,赵光鳌,等. 中国酿造),2005(2):39
[7] Yu H,Ding Y S,Mou S F. Chromatographia,2003,57:721
[8] GB/T 22222-2008
[9] Ding H L,Li C,Jin P,et al. Chinese Journal of Chromatography (丁洪流,李灿,金萍,等. 色谱),2013,31(8):804
[10] Zhou H B,Xiong Z Y,Li P,et al. Chinese Journal of Chromatography (周洪斌,熊治渝,李平,等. 色谱),2013,31(11):1093
[11] Giancarlo V,Irene D,Alessandro C. Rapid Commun Mass Spectrom,2009(23):1607
[12] Geng L J,Huang J R,Feng F,et al. Chinese Journal of Chromatography (耿丽娟,黄峻榕,冯峰,等. 色谱),2014,32(12):1380
[13] Xu Y,Zang Y,Jiang T,et al. Chinese Journal of Chromatography (徐颖,臧颖,姜婷,等. 色谱),2014,32(12):1400
[14] Zhang R,Si X X,Yi A E,et al. Chinese Journal of Analysis Laboratory (张蓉,司晓喜,伊奥尔,等. 分析试验室),2014,33(8):963
[15] Mou S F,Yu H,Cai Y Q. Chinese Journal of Chromatography (牟世芬,于泓,蔡亚岐. 色谱),2009,27(5):667
[16] Martin R,Marco G,Gunther B,et al. J Chromatogr B,2015,988:106
[17] Xie J H,Shen M Y,Nie S P,et al. Carbohydr Polym,2013,98:976
[18] Xi L L,Wang F L,Zhu Z Y,et al. Talanta,2014,119:440
[19] Mercier G,Campargue C. J Chromatogr A,2012,1262:180
[20] Daniel R,Svein H K,Judit K,et al. Carbohydr Res,2012,358:56
[21] Manuel U C,Gonzalo C G,Irene L R,et al. J Math Chem,2006,40(1):15
[22] Zhang J X,Feng C G,Li H. Scientia Agricultura Sinica (张军翔,冯长根,李华. 中国农业科学),2006,39(7):1451
[23] Zhou W,Zhou X P,Zhao G H,et al. Chinese Journal of Analytical Chemistry (周围,周小平,赵国宏,等. 分析化学),2004,32(6):735
[24] Zhu C,Zhang S Y,Zhao J S,et al. China Brewing (祝成,张宿义,赵金松,等. 中国酿造),2011(9):157
