应用FRAP技术研究高蛋白中间水分食品体系中的分子迁移*
2015-12-25贾晓戈李娟陆乃彦张轩周鹏
贾晓戈,李娟,陆乃彦,张轩,周鹏
(江南大学食品科学与技术国家重点实验室;江南大学食品安全与营养协同创新中心,江苏无锡,214122)
高蛋白中间水分食品通常是指一类蛋白质含量在20% ~50%之间、水分含量在10% ~25%之间、水分活度在0.5~0.8之间的食品[1]。高蛋白中间水分食品以及丰富的营养和良好的功能性,被广泛应用于军事、航空、运动营养等食品领域。但是,这类食品在贮藏过程中极易出现质地硬化的现象,严重降低了产品的食用品质且缩短了产品的货架期。由于高蛋白中间水分食品富含蛋白质、碳水化合物和脂肪等物质,因此其在贮藏过程中发生质地硬化是一个涉及多种物理、化学变化的复杂过程,且在短期和长期贮藏过程中由不同因素所主导。近年来,一些研究者已经对引起高蛋白中间水分食品体系硬化的原因提出了多种假说,主要包括糖结晶[2-3]假说、蛋白质聚集[4-6]假说以及水分迁移[7-10]假说等。但是,这些假说存在一定的局限性和不确定性。
荧光漂白恢复技术(FRAP)是通过采用激光共聚焦扫描显微镜的高强度脉冲式激光照射生物体(如细胞)的某一区域,使得该区域的荧光分子淬灭。再利用低强度的激光进行扫描,来检测该区域周围非淬灭荧光分子向荧光漂白区域的扩散过程。该技术利用亲脂性或亲水性的荧光分子,如荧光素、绿色荧光蛋白等与蛋白或脂质耦联,用于检测所标记分子在活体细胞表面或细胞内部运动及其迁移速率,已成为一种研究诸如活细胞、生物膜和其它生物环境体系中分子动力学的重要技术。近几年来,FRAP技术结合激光共聚焦扫描显微镜(CLSM)逐渐被广泛应用于检测食品体系中溶质分子的运动及其迁移情况[11-12]。
本研究通过采用FRAP技术,对高蛋白中间水分食品模拟体系在贮藏初期分子迁移运动情况进行监测分析,进而从分子水平辅助揭示造成高蛋白中间水分食品质地硬化的内在机理原因。
1 实验材料与方法
1.1 实验材料
酪蛋白酸钠(NaCN,87%干基),新西兰恒天然集团;牛奶分离蛋白(MPC85,85%干基),新西兰恒天然集团;FITC荧光染料,美国Sigma公司;甘油、山梨醇、丙酮,国药集团化学试剂有限公司;玻底培养皿,杭州生友生物技术有限公司;封口膜,美国Plechiney Plastic Packaging公司;其他试剂:国药集团化学试剂有限公司。
1.2 实验仪器
LSM-780激光共聚焦显微镜,德国Zeiss公司;Hitachi SEM-3030电子扫描显微镜,日本Hitachi公司;水分活度仪,德国Novasina AG公司;SHP-250生化培养箱,上海森信实验仪器有限公司。
1.3 实验方法
1.3.1 高蛋白中间水分食品模型体系的制备
选取高蛋白营养棒(high-protein nutritional bar,一种典型的高蛋白食品体系)中常用的2种乳蛋白:酪蛋白酸钠和浓缩乳蛋白,并根据表1中的配方制备高蛋白中间水分食品模型体系。具体的实验步骤为:将2.5 g山梨醇溶解于1.25 g超纯水中,再加入1.75 g甘油进行搅拌。搅拌均匀后,使其混合物与4.6 g乳蛋白粉混合2 min,揉制成均匀的面团,并用封口膜密封,以防止水分蒸发,然后装进盛有Mg(NO3)2过饱和溶液的(aw=0.53)的密闭容器以待测定。将该密闭容器在室温下平衡0.5 h后,进行第0天的取样。取样结束后,重新封口并放入密闭容器中置于25℃下储藏。此后分别于第0、1、3、7天进行取样。
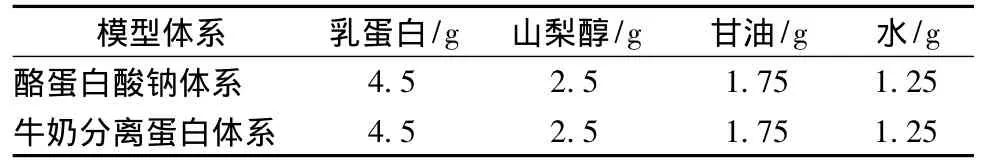
表1 含不同乳蛋白的高蛋白中间水分食品模型体系配方Table 1 The model of high protein-intermediate moisture food blended with different milk proteins
1.3.2 荧光漂白恢复测定
1.3.2.1 样品染色
具体实验操作步骤为:首先配制0.2 mg/mL的异硫氰酸荧光素(FITC)/丙酮染色液。染色时,滴加6 μL该染色液于0.5 g的样品中,混合均匀后,将0.3 g样品转移至玻底培养皿中,盖上盖玻片,并用AB胶封边,并置于25℃下避光储存0、1、3、7 d。
1.3.2.2 测定
观测样品的荧光漂白恢复时,将染色好的样品置于激光共聚焦扫描显微镜的载物台上,设定激发波长为488 nm,发射波长为510 nm,并在20倍目镜下观察样品。在观测视野区域内选择边长为18 μm的正方形区域作为漂白范围,激光强度为100%。选取与漂白区域相邻的与初始荧光值相等的区域用于背景校正。当视野FITC-蛋白体系被漂白瞬间,记录时间为t=0。再次监测漂白区域FITC-蛋白体系的荧光恢复情况,每隔一段时间记录荧光恢复情况图像并进行图像采集。
1.3.2.3 实验数据处理
根据FRAP实验结果,按公式1计算样品的荧光恢复率(Kt):

式中:Iu,相邻未漂白区域在t时间的荧光强度;Ib,漂白区域在t时间的荧光强度;Ib0,t=0时的荧光强度;Kt,在t时间样品的恢复率。
所得实验数据采用t检验法,当P<0.05为差异显著。
1.3.3 电子扫描显微镜(SEM)观察微观结构
量取20 mL 25%戊二醛溶液,并用pH=7.4的磷酸缓冲液(PBS)定容至200 mL,制成浓度为2.5%的戊二醛固定液。将模拟体系样品制成0.03~0.1 g的片状或条状,并立即投入到50 mL的戊二醛固定液中(保证固定液完全浸没样品)4℃下固定24 h。适当摇晃固定液瓶,防止样品粘着瓶底。固定完成后,从固定液中取出样品,用超纯水反复冲洗3次。随后将冲洗后的样品投入至体积分数50%的乙醇溶液(50 mL)中进行脱水。之后逐渐增加乙醇浓度,脱水梯度为50%-70%-80%-90%-100%-100%,每阶段脱水30 min。再将样品从无水乙醇中取出,自然晾干(3~6 h)。最后,将样品进行表面喷金后,在电压5 kV下进行100倍的电镜观察。
2 结果与讨论
2.1 酪蛋白酸钠模型体系荧光漂白恢复结果
图1为新鲜的酪蛋白酸钠模型体系(贮藏第0天)的FRAP结果图。
由图1可见,酪蛋白酸钠模型体系中大部分的酪蛋白酸钠已较好的水合,但仍有部分未水合充分的蛋白颗粒存在。这是由于高蛋白中间水分食品模型体系的制备是一个蛋白质分子与水及其他小分子不断相互作用的过程。图2~图4分别为酪蛋白酸钠模型体系在25℃下贮藏1、3、7 d的FRAP结果图。从图2~图4可以看出,新鲜制备的酪蛋白酸钠模型体系是一个非热力学稳定体系[13],随着贮藏时间的增长,水和其他小分子物质(甘油、山梨醇)从体相中向未充分水合的蛋白颗粒表面迁移,这些颗粒从体相中进一步吸水、溶胀,形成更大的、不规则的颗粒聚集体[14],并与颗粒空隙间的蛋白胶质进一步共同形成交联的网状结构。另外,图5显示了新鲜的酪蛋白酸钠模型体系分别放大100倍和500倍的电子扫描显微镜图。由图5可以看出,新鲜的酪蛋白酸钠模型体系呈现连续且伴有一些不溶性颗粒和气泡的结构状态。

图1 酪蛋白酸钠模拟体系贮藏第0天荧光漂白恢复Fig.1 The fluorescence recovery after photobleaching of sodium caseinate model stored at 0 day
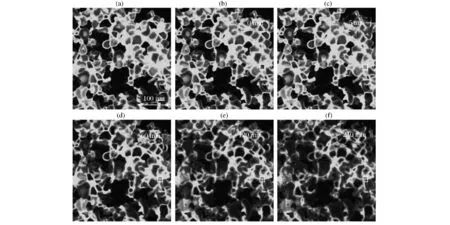
图2 酪蛋白酸钠模拟体系贮藏第1天荧光漂白恢复Fig.2 The fluorescence recovery after photobleaching of sodium caseinate model stored at 1st day
酪蛋白酸钠模型体系的荧光漂白区域的荧光强度随着贮藏时间的延长而逐渐恢复。起初,当酪蛋白酸钠模型体系(第0天)被激光漂白后,漂白区域内的荧光强度恢复迅速,当荧光恢复至5 min时,便可见明显胡荧光强度恢复;当荧光恢复至30 min时,整个漂白区域完成了荧光强度的恢复。而随着贮藏时间的延长,当酪蛋白酸钠模型体系分别贮藏至第1天和第3天时,漂白区域内的荧光恢复程度明显放缓。根据公式1对漂白区域的荧光强度恢复率进行计算。图6为酪蛋白酸钠模拟体系贮藏不同时间的荧光恢复率。其中,新鲜的酪蛋白酸钠模型体系的荧光恢复率为69.54%;在酪蛋白酸钠模型体系贮藏了1 d后,当荧光漂白恢复至240 min时,漂白区域的荧光恢复率为42.65%;而贮藏3 d后的酪蛋白酸钠模型体系,当荧光漂白恢复至240 min时,漂白区域的荧光恢复率降为35.14%;而贮藏了第7天后的酪蛋白酸钠模型体系,当荧光漂白恢复至240 min时,漂白区域的荧光恢复率只有12.63%。
通过酪蛋白酸钠模型体系的荧光漂白恢复实验和荧光强度恢复率的计算,实验结果表明,酪蛋白酸钠模型体系中的酪蛋白、以及水和甘油等小分子之间存在分子迁移的现象,且荧光强度恢复率越高、恢复时间越短,表明体系中分子迁移越迅速。而随着贮藏时间的延长,酪蛋白酸钠模型体系的荧光强度恢复率逐渐降低。这是由于酪蛋白酸钠模型体系在贮藏初期分子迁移迅速,随着小分子不断地向蛋白颗粒迁移并与蛋白质分子相作用,使得模型体系内的分子不断固化,制约了模型体系的整体流动性。
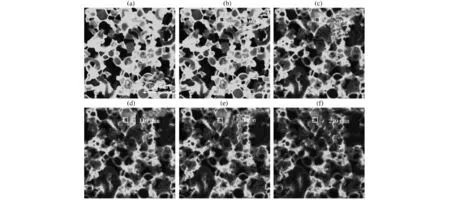
图3 酪蛋白酸钠模拟体系贮藏第3天荧光漂白恢复Fig.3 The fluorescence recovery after photobleaching of sodium caseinate model stored at 3rd day

图4 酪蛋白酸钠模拟体系贮藏第7天荧光漂白恢复结果图Fig.4 The fluorescence recovery after photobleaching of sodium caseinate model stored at 7th day

图5 酪蛋白酸钠模型体系电子扫描显微镜图Fig.5 The SEM of sodium caseinate model

图6 酪蛋白酸钠模拟体系贮藏不同天数的荧光恢复率Fig.6 The fluorescence recovery rate of sodium caseinate model stored at different days
2.2 浓缩乳蛋白模型体系荧光漂白恢复结果
图7为浓缩乳蛋白模拟体系贮藏第0天的FRAP结果图。新鲜的浓缩乳蛋白模型体系中存在有部分的未充分水合的蛋白颗粒,并有较多气泡存在。图8~图10分别为浓缩乳蛋白模拟体系贮藏第1、3、7天的FRAP的结果图。随着储藏时间的延长,体系中气泡的尺寸逐渐变小直至消失,说明体系内伴随着分子迁移。图11为新鲜浓缩乳蛋白模型体系分别放大100倍和500倍的电子扫描显微镜图,可见浓缩乳蛋白模型体系为较多不溶性颗粒聚集体和气泡构成的非连续状结构。
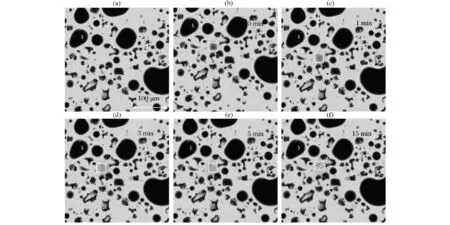
图7 浓缩乳蛋白模拟体系贮藏第0天荧光漂白恢复Fig.7 The fluorescence recovery after photobleaching of milk protein concentrate model stored at 0 day

图8 浓缩乳蛋白模拟体系贮藏第1天荧光漂白恢复Fig.8 The fluorescence recovery after photobleaching of milk protein concentrate model stored at 1st day
图12为浓缩乳蛋白模拟体系贮藏不同天数的荧光恢复图。新鲜制备的浓缩乳蛋白模型体系(第0 d)经荧光漂白后,漂白区域内的荧光强度迅速恢复,以致漂白区域的轮廓呈模糊状。当漂白区域恢复至15 min时,荧光强度则已恢复一半以上,荧光恢复率达53.33%。随着贮藏时间的延长,浓缩乳蛋白模型体系在分别贮藏1 d和3 d后,荧光强度同样恢复迅速。当荧光强度恢复至15 min时,漂白区域荧光强度恢复率分别达到47.44%和44.7%(图12)。而贮藏7 d后的浓缩乳蛋白模型体系荧光漂白恢复稍有减缓,在恢复60 min后,荧光强度恢复率为43.14%。
由此可见,浓缩乳蛋白模型体系的荧光漂白恢复无论从恢复时间上,还是荧光强度恢复率上相比,都较酪蛋白酸钠模型体系的荧光漂白恢复迅速,这可能是由于浓缩乳蛋白同时含有可溶性的乳清蛋白组分所致。且浓缩乳蛋白中含有酪蛋白组分,因此浓缩乳蛋白模型体系随着贮藏时间的延长呈现与酪蛋白酸钠模型体系相似的微观结构。
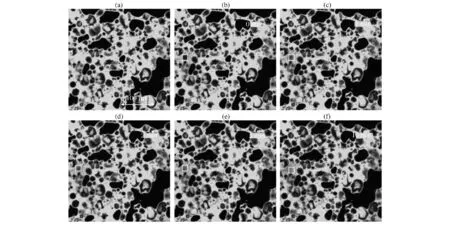
图9 浓缩乳蛋白模拟体系贮藏第3天荧光漂白恢复Fig.9 The fluorescence recovery after photobleaching of milk protein concentrate model stored at 3rd day
3 结论
本研究通过分别构建酪蛋白酸钠和浓缩乳蛋白这两种高蛋白中间水分食品模型体系,并采用荧光漂白恢复技术对模型体系在贮藏过程中微观结构的变化进行观察。通过计算模型体系的荧光恢复率值,表明高蛋白中间水分食品在贮藏初期存在着蛋白质及小分子等的迁移运动。
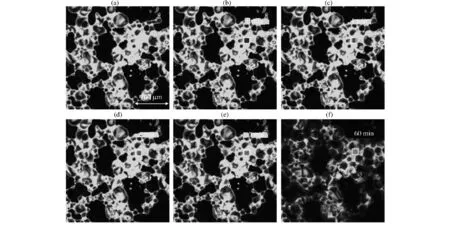
图10 浓缩乳蛋白模拟体系贮藏第7天荧光漂白恢复Fig.10 The fluorescence recovery after photobleaching of milk protein concentrate model stored at 7th day

图11 浓缩乳蛋白模型体系电子扫描显微镜图Fig.11 The SEM of milk protein concentrate model

图12 浓缩乳蛋白模拟体系贮藏不同天数的荧光恢复率结果图Fig.12 The fluorescence recovery rate of milk protein concentrate model stored at different days
[1] Pomeranz Y.Advances in Cereal Science and Technology[M].New York:AACC Press,1988:91-128.
[2] Belcourt L A,Labuza T P.Effect of raffinose on sucrose recrystallization and textural changes in soft cookies[J].Journal of Food Science,2007,72(1):65-71.
[3] LI T C,ZHOU P,Labuza T P.Effect of sucrose crystallization and moisture migration on the structural changes of a coated intermediate moisture food [J].Frontiers of Chemical Engineering in China,2009,3(4):346-350.
[4] ZHOU P,Labuza T P.Effect of water content on glass transition and protein aggregation of whey powders during short-term storage [J].Food Biophysics,2007,2(2/3):108-116.
[5] ZHOU P,LIU X M,Labuza T P.Moisture-induced aggregation of whey proteins in a protein/buffer model system[J].Journal of Agriculture and Food Chemistry,2008,(56):2 048-2 054.
[6] ZHOU P,LIU X M,Labuza T P.Effects of moisture-in-duced whey protein aggregation on protein conformation,the state of water molecules,and the microstructure and texture of high-protein containing matrix[J].Journal of Agriculture and Food Chemistry,2008,56(12):4 534-4 540.
[7] Simon M,Loveday J P,Hindmarsh L K,et al.Physicochemical changes in intermediate-moisture protein bars made with whey protein or calcium caseinate[J].Food Research Internatinal,2010,43(5):1 321-1 328.
[8] Labuza T P,Hyman C R.Moisture migration and control in multidomain foods[J].Trends in Food Science and Technology,1988(9):47-55.
[9] Liu W R,Langer R,Klibanov A M.Moisture-induced aggregation of lyophilized proteins in the solid state[J].Biotechnology and Bioengineering,1991,37(2):177-184.
[10] Loveday S M,Hindmarsh J P,Creamer L K.Physicochemical changes in model protein bars during storage[J].Food Research International,2009,42(7):798-806.
[11] Silva J V C,Peixoto P D S,Lortal S,et al.Transport phenomena in a model cheese:The influence of the charge and shape of solutes on diffusion[J].Journal of Dairy Science,2013,96(10):6 186-6 198.
[12] Perry P A,Fitzgerald M A,Gilbert R G.Fluorescence recovery after photobleaching as a probe of diffusion in starch systems[J].Biomacromolecules,2006(7):521-530.
[13] Burey P,Bhandari B R,Rutgers M L,et al.Confectionary gels:A review of formulation,rheological,and srructural aspects [J].International Journal of Food Properties,2009,12(1):176-210.
[14] Loveday S M,Hindmarsh J P,Creamer L K.Physicochemical changes in model protein bars during storage[J].Food Research International,2009,42(7):798-806.
